依达拉奉对大鼠脑缺血再灌注后VEGF及Flk-1表达的影响
季 玮,江艳芬,陈 颖,陈春叶,梁 静,朱爱萍
·基础研究·
依达拉奉对大鼠脑缺血再灌注后VEGF及Flk-1表达的影响
季 玮1,江艳芬1,陈 颖2,陈春叶1,梁 静1,朱爱萍1
(1.上海市中西医结合医院急诊科,上海 200082;2.上海市中西医结合医院药剂科,上海 200082)
目的 探讨依达拉奉对大鼠脑缺血再灌注后VEGF及Flk-1表达的影响。方法 将脑缺血再灌注模型制备成功的雄性SD大鼠64只随机分成模型组、依达拉奉组,每组32只。试验后第2天,模型组予尾静脉注射生理盐水10ml/kg,依达拉奉组予依达拉奉3mg/kg,每日1次。在试验后第3、7、14、28天,两组各处死8只大鼠,大鼠处死前进行神经功能缺损评分。RT-PCR法检测纹状体VEGF及其受体Flk-1mRNA表达水平,ELISA检测纹状体VEGF蛋白水平。结果 实验后第7、14、28天,依达拉奉组神经功能缺失评分较模型组均显著降低,VEGF mRNA相对表达量、Flk-1mRNA相对表达量、VEGF蛋白相对表达量较模型组均显著升高(均P<0.05)。依达拉奉组第7天神经功能缺失评分低于第3天,第14天低于第7天(均P<0.05)。依达拉奉组第7天VEGF mRNA相对表达量、Flk-1mRNA相对表达量、VEGF蛋白相对表达量高于第3天(均P<0.05)。结论 依达拉奉可改善脑缺血再灌注大鼠的运动神经功能,作用机制可能与促使纹状体VEGF及Flk-1表达,保护脑神经有关。
缺血再灌注;VEGF;Flk-1;依达拉奉
脑缺血再灌注损伤涵盖临床上许多疾病伴发的病理损害过程,它的进程对原发性疾病的预后起决定性作用。目前,对脑缺血的治疗研究主要集中在缺血半影区血供的改善及侧支循环的建立[1]。本研究采用大脑中动脉阻塞缺血再灌注的大鼠模型,观察依达拉奉对动物纹状体区VEGF及其受体Flk-1表达的动态变化情况,借以阐明依达拉奉促进脑缺血再灌注后运动神经功能改善的部分机制,为临床指导缺血性卒中的治疗提供新的思路和科学理论依据。
1 材料与方法
1.1 动物与试剂
雄性SD大鼠80只,购自上海斯莱克实验动物有限责任公司,体质量180~220g,饲养于上海中医药大学实验动物中心SPF级动物房;实验动物生产许可证编号:SCXK(沪)2007— 0005;实验动物使用许可证编号:SYXK(沪)2009— 0069。依达拉奉注射液购自南京先声东元制药有限公司;RNA抽提试剂盒购自QIAGEN公司;VEGF及其受体引物购自上海捷瑞生物工程有限公司;SYBR Green PCR mix购自Applied Biosystems公司;VEGF ELISA kit购自上海蓝基生物科技有限公司。
1.2 模型制备与分组
采用随机数字法,在80只SD大鼠中选取8只作为假手术组,其余72只为模型组。模型制备:取雄性SD大鼠,术前称重,24%水合氯醛(350mg/kg)麻醉后仰卧固定,沿颈正中作约2cm长皮肤切口,分离出右侧颈总动脉、颈外动脉。将一端加热成圆珠状(直径<0.3mm)的尼龙线沿颈外动脉、颈总动脉、颈内动脉向上插入前脑动脉(约2cm),再往回拉约2mm至大脑中动脉起始部(从颈内外动脉分叉处计算插入约1.7cm)。2h后,将线栓拔退至颈外动脉,恢复大脑中动脉的供血。假手术组仅切开皮肤、分离右侧颈总动脉后即缝合。造模术中死亡3只,存活69只,动物清醒后按相关文献[2]方法进行神经功能评分。0分:无神经缺损表现;1分:对侧前爪不能充分伸展;2分:向外侧转圈;3分:行走时向对侧倾倒;4分:不能行走,意识丧失。1至3分者作为模型成功标准,0分和4分者剔除。合计剔除5只,即造模成功的大鼠64只。
将造模成功后存活的大鼠按上述方法分为模型组、依达拉奉组,每组32只。术后第2天,模型组予尾静脉注射生理盐水10ml/kg,依达拉奉组予依达拉奉3mg/kg,每日1次。在第3、7、14、28天,两组各处死8只大鼠。动物末次给药后,处死前2h按前述方法进行神经功能评分。
1.3 RT-PCR法检测纹状体VEGF 及其受体Flk-1mRNA表达水平
按照试剂盒说明书提取总mRNA,然后以RT法合成cDNA后进行PCR扩增。参考PubMed中Gene bank检索VEGF及其受体 mRNA序列,根据软件Gene runner 3.0设计引物。PCR产物用1.5%琼脂糖凝胶电泳、染色、电泳凝胶成像扫描,Fluor Chen 2.0软件分析测定扩增条带吸光度值,与GAPDH的吸光度比值作为mRNA相对表达量。VEGF上游引物:5′-CTGTACCTCCACCATG-CCAAG-3′,下游引物:5′-ACAAGGCTCACAGTG-AACGC-3′,扩增片段469bp。VEGF受体(Flk-1)上游引物:5′-CCAATGAAGGGGAACTG-3′,下游引物:5′-TGACTGCTGGTGATGCT-3′,扩增片段535bp。GNPDH上游引物:5′-ACCACAGTCCAT-GCCATCAC-3′,下游引物:5′-TCCACCACCCTGT-TGCTGTA-3′,扩增片段452bp。
1.4 ELISA法检测纹状体VEGF水平
首先将纹状体置于40倍的缓冲溶液中匀浆提取蛋白,离心取上清液。根据ELISA kit说明书检测上清液VEGF含量,检测时上清液稀释2倍后检测。结果以相对表达量表示,相对表达量即为:以假手术组动物VEGF表达均值为1,其他组动物VEGF表达水平与其的比值。
1.5 统计学处理

2 结 果
2.1 依达拉奉对脑缺血大鼠神经功能缺损评分的影响
实验前,模型组、依达拉奉组神经功能评分相近,差异统计学意义(P>0.05)。实验后第7、14、28天,依达拉奉组神经功能缺失评分较模型组均显著降低,差异均有统计学意义(P值分别为0.022、0.000、0.000,均<0.05);依达拉奉组第7天神经功能缺失评分低于第3天,第14天低于第7天,差异均有统计学意义(P值分别0.007、0.042,均<0.05),见表1。
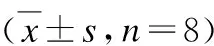
表1 两组大鼠不同时间点神经功能缺损评分Tab.1 Neural function defect scale at different time point in two groups
2.2 依达拉奉对脑缺血大鼠纹状体VEGF及其受体Flk-1mRNA表达的影响
实验后第7、14、28天,依达拉奉组VEGF mRNA相对表达量较模型组均显著升高,差异均有统计学意义(P值分别为0.030、0.000、0.021,均<0.05);依达拉奉组第7天高于第3天,差异有统计学意义(P=0.014<0.05),见表2。
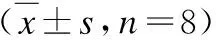
表2 两组大鼠纹状体VEGF mRNA相对表达量Tab.2 Relative expression of VEGF mRNA in two groups
实验后第7、14、28天,依达拉奉组Flk-1mRNA相对表达量较模型组均显著升高,差异均有统计学意义(P值分别为0.000、0.000、0.000,均<0.05);依达拉奉组第7天高于第3天,差异有统计学意义(P=0.000<0.05),见表3。
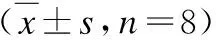
表3 两组大鼠纹状体Flk-1mRNA相对表达量Tab.3 Relative expression of Flk-1 mRNA in two groups
2.3 依达拉奉对脑缺血大鼠纹状体VEGF蛋白表达水平的影响
实验后第7、14、28天,依达拉奉组VEGF蛋白相对表达量较模型组均显著升高,差异均有统计学意义(P值分别为0.007、0.009、0.015,均<0.05);依达拉奉组第7天高于第3天,差异有统计学意义(P=0.004<0.05),见表4。
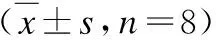
表4 两组大鼠纹状体VEGF蛋白相对表达量Tab.4 Relative expression of protein VEGF in two groups
3 讨 论
脑缺血再灌注大鼠模型制备有多种方法,选择性阻断大脑中动脉与大脑中动脉、后交通动脉、颈内动脉均具有良好的重复性,但选择性大脑中动脉阻塞模型在24h内梗死体积增加明显,造成单侧的包括基底节区、额叶、顶叶和颞叶皮层范围的缺血,能较好地模拟脑缺血再灌注疾病状况,是目前应用较为成熟的脑缺血模型,目前多用于神经保护药物的研究。本实验造模过程中存活率为95.8%,造模成功率为92.8%,符合实验要求。
本实验的神经功能缺损评分结果显示脑缺血再灌注的大鼠模型运动神经功能受到明显损伤,依达拉奉可以显著改善上述损伤,但干预效果在7d以上方能显现,且在7~28d内,干预时间越长,效果越显著。本实验中从第7天开始,依达拉奉组VEGF mRNA及VEGF蛋白相对表达量较模型组差异显著,且较本组的第3天数值明显上升,但第7、14、28天的数值之间差异不明显,可能与VEGF的表达超过一定阈浓度后,无须明显增加浓度,即可维持改善神经功能的作用有关。
VEGF主要通过抑制神经细胞凋亡与促血管再生起神经保护作用[3]。在神经细胞的应激状态下(如缺氧、葡萄糖缺失等),VEGF作为内源性神经保护因子可抑制神经细胞凋亡并刺激神经再生,并通过增强血脑屏障对葡萄糖的通透性以及抗氧化等作用间接产生神经保护作用[4]。VEGF mRNA表达调节细胞外基层内皮细胞的内部反应,对内皮细胞向基层细胞的分化具有关键作用,是内皮细胞有丝分裂和增殖的决定因素[4]。研究[5]发现,VEGF及其受体Flk-1可促进内皮细胞活化。FIk-1(VEGFR-2) 是VEGF的两种不同受体之一,属酪氨酸激酶受体家族第Ⅲ亚型,其生物效应是使细胞形态学改变,包括肌动蛋白的改组,细胞膜皱缩,趋化性和促有丝分裂能力显著改变[6]。正常大鼠脑中,VEGF的表达主要在星形胶质细胞,Flk-1主要在脉络丛上皮细胞表达,并且表达水平均很低[7];在缺氧情况下,大鼠脑内VEGF及受体的表达明显增强,VEGF主要在胶质细胞表达,Flk-1伴缺血后血管形成,在血管内皮细胞呈高表达[8]。
研究[9]发现,将外源性VEGF蛋白应用于短暂性脑缺血大鼠脑表面,24h梗死体积缩小,脑水肿及神经元损伤减轻,而内皮细胞通常在缺血后数天才开始增殖,说明在血管形成之前,VEGF对神经系统起着直接保护作用,这有助于延长细胞的存活时间,直到新血管形成。
本研究显示,模型组与假手术组的VEGF与Flk-1mRNA表达无明显差异,可能与模型组的纹状体样本在术后3d处理有关。国外有关局灶性脑缺血大鼠模型试验[10]发现,缺血再灌注4h时大脑皮层VEGF表达量显著上升,并在8h达到峰值。而在同样模型[11]下,缺血24h时与VEGF基因敲除大鼠相比,VEGF过表达大鼠大脑梗死体积减小20%,28d时减少33%。研究[12]显示,在未经药物或其他人为因素干预的情况下,VEGF的过表达发生在脑缺血后24h内,并在12h内可达峰值,24h后表达水平缓慢下降,其对缺血损伤的保护作用可延续24~48h。VEGF的促血管生成功能是恢复缺血坏死区血循环的关键,也是神经修复和再生的前提条件。脑血管闭塞后,缺血区毛细血管增生的范围与程度直接关系到缺血边缘区血流的改善,影响神经元生理功能的恢复,从而决定机体神经功能的改善程度[7]。VEGF及其受体的峰值在缺血缺氧后短时间出现,有利于VEGF诱导脑出血损伤区血管新生,从而重建血液循环,改善脑组织缺氧和营养的供应[8]。本实验未检测1~3d内VEGF与Flk-1mRNA,而第3d模型组与依达拉奉组的运动神经损伤情况无明显改善,可能与3d 内VEGF的表达不足以显著影响模型大鼠的运动神经功能有关。
依达拉奉相对分子质量为174.20,血脑屏障的通透率为60%[13],静脉给药后对于脑内具有高度细胞毒性的羟基基团清除效果良好[14]。 实验[15]表明,依达拉奉具有清除自由基抑制脂质过氧化作用,能明显抑制血管内皮细胞损伤,从而减轻脑缺血和脑缺血引起的脑水肿及组织损伤,改善缺血后引起的神经功能缺损,并且对迟发性神经细胞死亡也有抑制作用。依达拉奉可以通过直接抑制凋亡相关蛋白,下调缺血半暗带区脑组织Caspase-3蛋白的表达,减少凋亡前体物质的产生。进而减少细胞凋亡的发生,减轻脑损伤,起到良好的神经保护作用[16]。
目前,关于依达拉奉作用于VEGF及其受体的研究较少,本实验显示依达拉奉可显著干预大鼠模型的VEGF表达,且依达拉奉组的纹状体FlK-1均有高表达,与VEGF的变化趋势相一致,这提示VEGF的神经保护机制可能是通过FlK-1途径发挥作用的,与体外实验[17]的结果类似。
在起效时间上,依达拉奉组在干预7d后VEGF及其受体开始出现显著差异,与不同时间点神经功能缺损评分相符合,说明其对脑缺血再灌注损伤的保护作用可能与增加VEGF表达有关。同时,依达拉奉组的VEGF及其受体表达量却并未随时间的推移减少,28d治疗组VEGF仍高表达。这说明药物治疗可充分延长分泌时间,增加分泌量。从组内比较可知,干预7、14、28d的数据差异无统计学意义,可能与7d后依达拉奉的在体内的吸收分布与消除达到平衡,血药浓度处于稳定有关,可进一步进行药代动力学研究明确。
综上所述,依达拉奉可能促使纹状体VEGF及Flk-1表达,保护脑神经,改善脑缺血再灌注大鼠的运动神经功能。但前7d,其对VEGF和Flk-1作用效果并不明显,这可能与依达拉奉在恢复期发挥主要功效有关。本实验还存在运动神经评价方法单一、无纹状体病理学观察、样本量较少、用药时间不够长等缺点,应在进一步的研究中改善,从而明确依达拉奉的作用机制。
[1] 郑婵娟,廖维靖,杨万同,等.大鼠脑缺血再灌注损伤后VEGF、Flt-1、Flk-1mRNA的表达及意义[J].中华物理医学与康复杂志,2005,27(6):325-327.
[2] Bederson JB, Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke, 1986,17(3):472-476.
[3] Nagy Z, Simon L, Bori Z.Regulatory mechanisms in focal cerebral ischemia.New possibilities in neuroprotective therapy [J] Ideggyogy Sz, 2002,55(3-4):73-85.
[4] Beck H,Plate KH.Angiogenesis after cerebral ischemia[J].Acta Nenropathol, 2009,117(5):481-496.
[5] Hermann DM, Zechariah A.Implications of vascular endothelial growth factor for postischemic neurovas-cular remodeling [J].Cereb Blood Flow Metab, 2009,29(10):1620-1643.
[6] Robinson CJ, Stringer SE.The splice variants of vascular endothelial growth factor(vEGF)and their receptors[J].J Cell Sci, 2001,114:853-865.
[7] Chiba Y, Sasayama T, Miyake S,et al.Anti-VEGF receptor antagonist (VGA1155) reduces infarction in rat permanent focal brainischemia[J].Kobe J Med Sci, 2008,54(2):E136-146.
[8] Amemiya S, Kamiya T, Nito C,et a1.Anti-apoptotic and neuroprotective effects of aravone following transient focal ischemia in rats[J].Eur J Pharmaeol,2005,516(2):125-130.
[9] Hayashi T, Abe K,Itoyama Y.Reduction of ischemic damage by application of vascular endothelial growth factor in rat brain after transient ischemia[J].J Cereb Blood Flow Metab,18(8):887-895.
[10] Mu D, Jiang X, Sheldon RA, et al.Regulation of hypoxia-inducible factor 1alpha and induction of vascular endothelial growth factor in a rat neonatal stroke model[J].Neurobiol Dis, 2003,14(3):524-534.
[11] Wang Y, Jin K, Mao XO, et al.VEGF-overexpressing transgenic mice show enhanced post-ischemic neuroge-nesis and neuromigration[J].Neurosci Res, 2007,85(4):740-747.
[12] Laudenbach V, Fontaine RH, Medja F, et al.Neonatal hypoxic preconditioning involves vascular endothelial growth factor[J].Neurobiol Dis, 2007,26(1):243-252.
[13] Manoonkitiwongsa PS, Schultz RL, McCreery DB,et al.Neuroprotection of ischemic brain by vascular endo-thelial growth factor is critically dependent on proper dosage and may be compromised by angiogenesis[J].J Cereb Blood Flow Metab, 2004,24(6):693-702.
[14] Yamamoto T, Yuki S, Watanabe T, et al.Delayed neuronal death prevented by inhibition of increased hydroxyl radical formation in a transient cerebral ischemia [J].Brain Res, 1997,762(1-2):240-242.
[15] Yoshida H, Yanai H, Namiki Y, et al.Neuroprot-ective effects of edaravone:a novel free radical scavenger in cerebrovascular injury [J].CNS Drug Rev, 2006,12(1):9-20.
[16] 谢惠芳,徐如祥,魏继鹏,等.依达拉奉对大鼠局灶性脑缺血再灌注损伤后细胞凋亡及caspase-3蛋白表达的影响[J].中华神经医学杂志,2008,7(10):1009-1012.
[17] Yang JP, Liu XF, Liu HJ, et al.Extracellular signal-regulated kinase involved in NGF/VEGF-induced neuroprotective effect [J].Neurosci Lett, 2008,434(2):212-217.
Effect of edaravone on regeneration of neurons in rats after cerebral ischemia/reperfusion injury
JIWei1,JIANGYan-fen1,CHENYing2,CHENChun-ye1,LIANGJing1,ZHUAi-ping1
(1.Dept.of Emergency, Shanghai TCM-Integrated Hospital,Shanghai 200082, China; 2.Dept.of Pharmacy, Shanghai TCM-Integrated Hospital, Shanghai 200082, China)
Objective To investigate the effect of edaravone on regeneration of neurons in rats after cerebral ischemia/reperfusion injury.Methods Sixty-four male SD rats with cerebral ischemia/reperfusion injury were divided into edaravone group (n=32) and model group (n=32).On the 2ndday, rats in model group received intravenous injection of normal saline [10ml/(kg·d)] and rats in edaravone group received intravenous injection of edaravone [3mg/(kg·d)].At the 3rd, 7th, 14th, 28thdays, rats were sacrificed with 8 animals in each batch in both groups.Neural function defect scale was evaluated before sacrifice, and mRNA of VEGF and Flk-1 in corpus striatum was detected by RT-PCR, and VEGF protein was detected by ELISA.Results At the 7th, 14th, 28thday, neural function defect scale in edaravone group was significantly lower than that in model group.The expression of VEGF mRNA, Flk-1mRNA, and VEGF protein in corpus striatum of edaravone group was higher than that in model group.Neural function defect scale at d7 in edaravone group was lower than that at the 3rdand 14thdays, the expression of VEGF mRNA, Flk-1mRNA and VEGF protein in edaravone group at the 7thday was higher than that at the 3rdday.Conclusion Edaravone can improve function of motor nerve in rats after cerebral ischemia/reperfusion injury, which may be associated with the up-regulation of VEGF and Flk-1 expression in corpus striatum.
ischemia reperfusion; vascular endothelial growth factor; Flk-1; edaravone
10.16118/j.1008-0392.2015.05.010
2015-03-16
季 玮(1971—),女,副主任医师,学士.E-mail:jiweiqxz@163.com
江艳芬.E-mail:jiang_yanfen@126.com
R 743
A
1008-0392(2015)05-0047-05

