上腹部术后肺部感染病原菌分布特点及耐药性分析
韩志青, 袁海波, 徐晓雯, 罗艳蓉, 黄蓓洁
(1. 同济大学附属杨浦医院呼吸内科,上海 200090; 2. 吉林大学第一医院呼吸内科,长春 吉林 130021)
·临床研究·
上腹部术后肺部感染病原菌分布特点及耐药性分析
韩志青1, 袁海波2, 徐晓雯1, 罗艳蓉1, 黄蓓洁1
(1. 同济大学附属杨浦医院呼吸内科,上海 200090; 2. 吉林大学第一医院呼吸内科,长春 吉林 130021)
目的 分析上腹部术后患者合并肺部感染病原菌分布及耐药特点。方法 从外科系统入选上腹部手术后并发肺部感染及肺不张患者114例,该114例患者均不能自行咳痰,需通过纤维支气管镜吸痰及支气管肺泡灌洗来清除痰液。并将吸出的痰液或支气管肺泡灌洗液(BALF)标本送细菌培养及药敏试验。结果 灌洗液共分离出病原菌91株,检出率为79.8%。其中革兰阴性(G-)杆菌82株,以铜绿假单胞菌、鲍曼氏不动杆菌、肺炎克雷伯菌和奇异变形杆菌为主;革兰阳性(G+)球菌6株,以金黄色葡萄球菌为主。药敏结果显示,铜绿假单胞菌对多种抗菌药物耐药性增加,不动杆菌、肠杆菌科细菌对碳青霉烯类抗菌药物耐药率正在逐渐上升,G+球菌中金黄色葡萄球菌对利奈唑胺、万古霉素耐药率为0。结论 上腹部术后合并肺部感染患者,支气管肺泡灌洗液中检出率高,且感染菌株呈多药耐药,经验性合理选择抗菌药物时应针对上述特点,并减少诱导耐药菌株的产生,以期获得更好疗效。
上腹部手术后肺部感染; 病原菌分布; 耐药性
肺部感染是上腹部手术后出现的常见而又严重的并发症,重症肺部感染可导致患者多器官功能障碍,甚至死亡[1-3]。同济大学附属杨浦医院于2008年2月至2012年2月共收治外科上腹部手术后并发肺部感染及肺不张114例,该组患者均不能自主咳痰,以致痰液阻塞支气管引起肺不张,需通过纤维支气管镜吸痰及支气管肺泡灌洗来清除痰液。本研究对114例上腹部手术后并发肺部感染及肺不张患者行纤维支气管镜吸痰及支气管肺泡灌洗来清除痰液,将吸出的痰液或支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)标本送细菌培养及药敏试验,分析114例患者病原菌分布及耐药性特点。
1 资料与方法
1.1 一般资料
2008年2月至2012年2月同济大学附属杨浦医院外科收治上腹部手术后并发肺部感染患者共114例,其中男性69例,女性45例,该组患者均不能自主咳痰,需行纤维支气管镜吸痰或支气管肺泡灌洗,患者平均年龄(69±2)岁。79例患者有吸烟史,基础疾病有高血压病10例,糖尿病6例,冠心病7例,慢性支气管炎11例,支气管扩张6例,胃溃疡2例,其余无基础疾病。该组患者均无气管切开,24例行气管插管,患者均有痰多、痰液黏稠及脓性痰液不能咳出,以致痰液阻塞支气管引起肺不张。其中78例出现发热,114例患者胸片均有肺部浸润影及肺不张。该组患者均符合中华医学会呼吸病学分会制定的《医院获得性肺炎诊断和治疗指南》。
1.2 标本采集
使用一次性标本收集器,通过纤维支气管镜吸痰及支气管肺泡灌洗获得标本。
1.3 菌株鉴定及药敏试验
微生物鉴定系统及药物敏感技术采用VIT EK2型全自动细菌鉴定及药物分析仪,严格按《全国临床检验操作规程》操作。质控菌株: 大肠埃希菌ATCC 25922,金黄色葡萄球菌ATCC 29213,铜绿假单胞菌ATCC 27853,肺炎克雷伯菌ATCC 700603,均由卫生部临床检验中心提供。
1.4 统计学处理
采用SPSS 13.0软件进行数据处理,χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 临床表现
114例患者中,78例出现发热,70例患者有不同程度的咳嗽,咳痰,10例患者有轻度缺氧,其中5例为合并有支气管扩张患者,5例为合并有慢性支气管炎患者,79例患者有吸烟史,占总病例数的69.2%。
114例患者中,80例患者血常规中白细胞正常,中性粒细胞轻度升高或正常,100例患者均有C反应蛋白的升高。
114例患者中,胸部影像学中均可见肺部浸润影及肺不张。纤维支气管镜下90例患者可见患侧支气管充血水肿,并可见较多黏性分泌物溢出,其中有56例因痰痂阻塞支气管引起相应肺叶不张。有20例患者痰液黏稠吸不出,需生理盐水冲洗后才能被吸出。
2.2 病原菌的构成
患者共114例,送检吸取的痰液或支气管肺泡灌洗液进行培养+药敏检查,有3例在同一份送检标本中同时分离出≥2种病原菌,均为气管插管的患者。共检出病原菌91株,其中革兰阴性(G-)杆菌82株(87.2%)。革兰阳性(G+)球菌6株(6.4%),真菌3株(6.4%)。病原菌分布见表1。
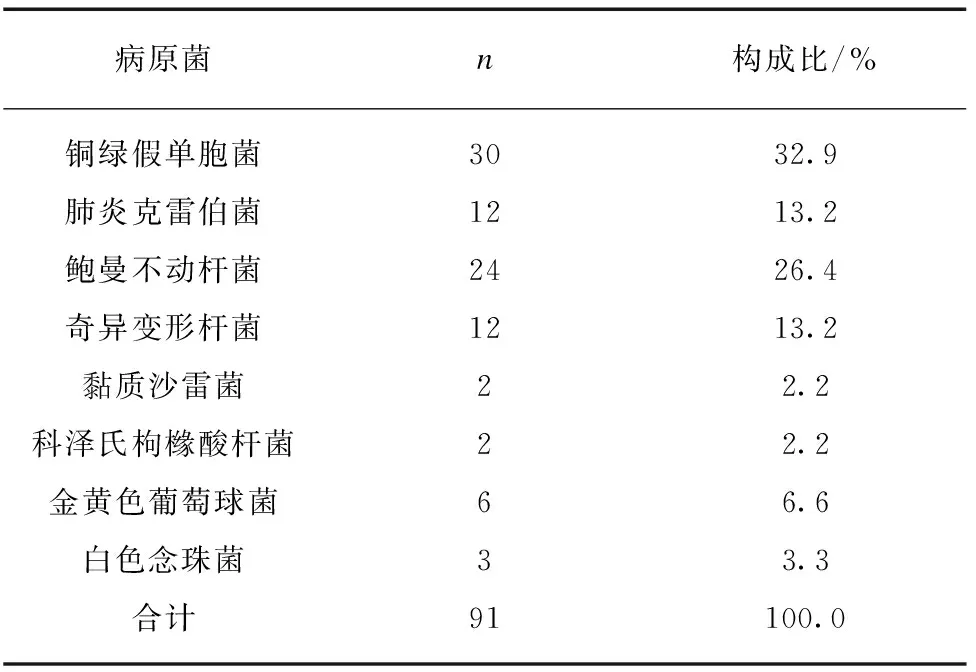
表1 病原菌构成比Tab.1 Distribution of pathogenic bacterial strains
2.3 病原菌的耐药性分析
30例铜绿假单胞菌患者中对美罗培南和亚胺培南及β内酰胺酶抑制剂抗菌药物耐药率稍低,见表2。
24例鲍曼氏不动杆菌对各类抗菌素的耐药率均较高,见表2。
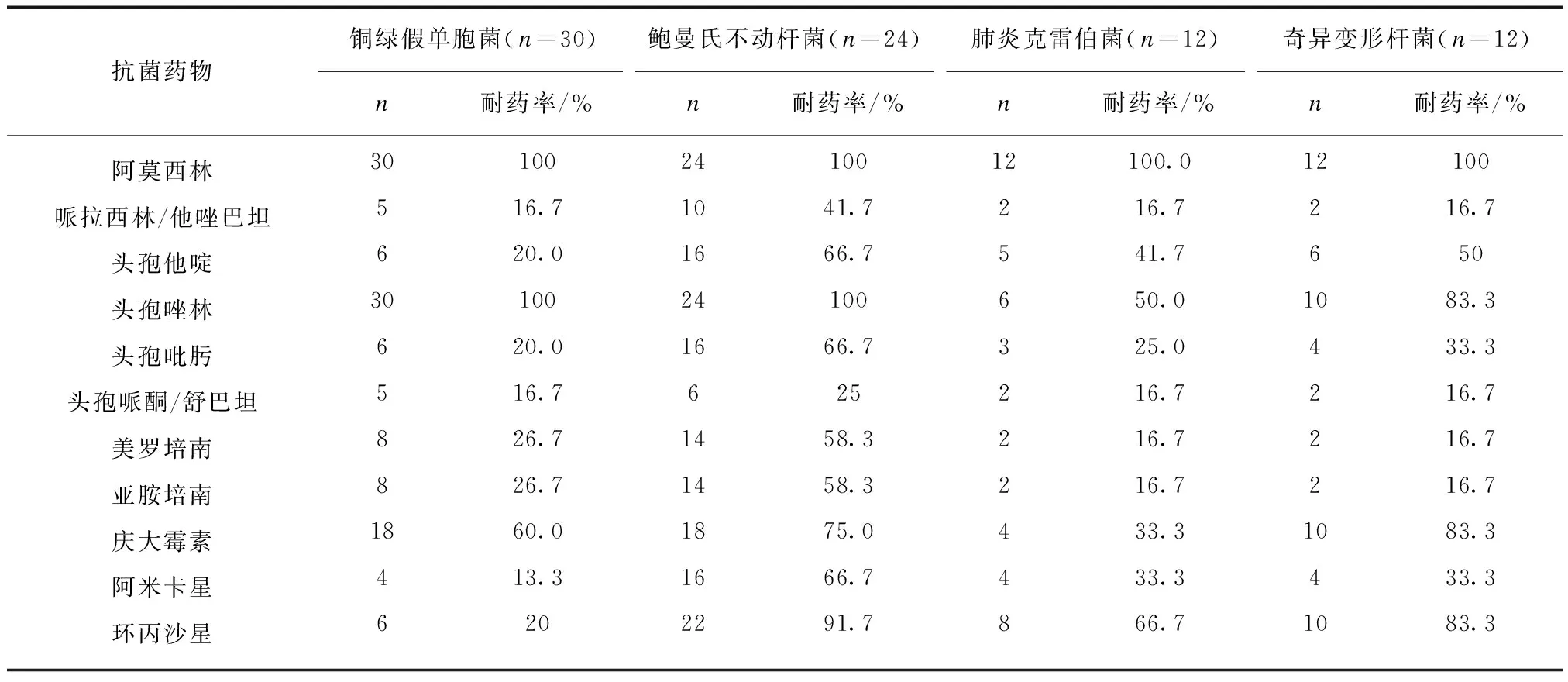
表2 上腹部术后合并肺部感染主要G-杆菌对抗菌药物的耐药率Tab.2 Drug resistance rate of isolated G-bacterial strains
12例肺炎克雷伯菌的耐药率详见表2。其中ESBLs阳性的肺炎克雷伯菌对三代-四代头孢菌素的耐药率达70%~80%,对β内酰胺酶抑制剂的耐药率为20%左右,对碳青霉烯类抗生素的耐药率与ESBLs阴性的肺炎克雷伯菌无很大区别。
6例金黄色葡萄球菌中无对万古霉素、利奈唑胺的耐药菌株。对青霉素和大环内酯类抗菌素耐药率达100%,见表3。
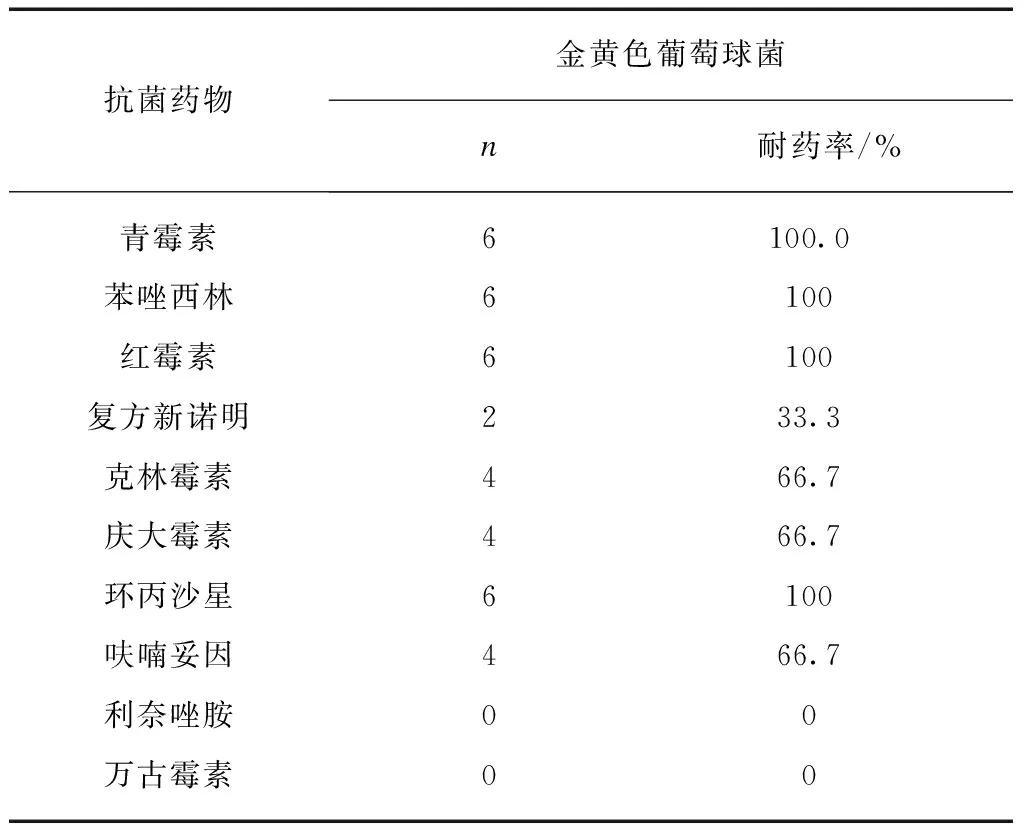
表3 上腹部术后合并肺部感染主要G+球菌 对抗菌药物的耐药率Tab.3 Drug resistance rate of isolated G+cocci strains
3 讨 论
上腹部手术后合并肺部感染是属于医院获得性感染,医院获得性肺炎的致病菌依次为金黄色葡萄球菌、铜绿假单胞菌、肠杆菌科细菌、克雷白菌属、大肠杆菌、黏质沙雷氏菌和变形杆菌属,其中最常见的致病菌是肺炎克雷白杆菌。本组资料显示G-杆菌是上腹部手术后合并肺部感染的主要病原菌,且以铜绿假单胞菌、鲍曼氏不动杆菌、肺炎克雷伯菌和奇异变形杆菌为主。G+球菌以金黄色葡萄球菌为主。分离病原菌中,G-杆菌占第1位的是铜绿假单胞菌。铜绿假单胞菌属于假单胞菌属,为需氧、有鞭毛、无芽孢及无荚膜的G-杆菌。近年来,铜绿假单胞菌的流行病学特点突出地表现在两个方面。(1) 院内感染。尤其是肺部感染的发病率不断增加,国内最具代表性的“中国CHINET细菌耐药性监测”资料显示,2012年综合性教学医院铜绿假单胞菌的分离率占所有分离菌的第5位,2005至2012年铜绿假单胞菌的分离率占G-的11.6%、14.1%、16.9%、16.4%、15.8%、14.8%、14.2%和14.0%,居第2~5位[4]。本组患者中铜绿假单胞菌的分离率占G-的32.9%,占第1位,这可能与该组患者中合并支气管扩张、慢性支气管炎的患者比例高有关。有资料显示铜绿假单胞菌感染的高发人群为结构性肺病变的患者,如支气管扩张、慢阻肺、肺囊性纤维化等,研究结果显示,3%~20%的稳定期慢阻肺患者下呼吸道痰标本和支气管镜吸引标本的铜绿假单胞菌培养阳性,而且定值的频率随着气流阻塞的加重而增加;采用经支气管镜保护性毛刷采集的标本,在避免了呼吸道污染的情况下,仍有3%~10%的慢阻肺急性加重患者的下呼吸道标本中分离到铜绿假单胞菌[5]。(2) 铜绿假单胞菌的耐药率居高不下。本组资料显示铜绿假单胞菌对阿莫西林、头孢唑林耐药率分别为100%,对庆大霉素、环丙沙星耐药率均>60%,对头孢他啶、头孢吡肟的耐药率均为20%,对美罗培南、亚胺培南耐药率均为13.3%,对头孢哌酮/舒巴坦、哌拉西林/他唑巴坦的耐药率为最低<10%,耐多药铜绿假单胞菌3例,占10%。有13家教学医院参与的中国医院院内获得性细菌耐药性分析(CARES)结果显示,2009年和2011年铜绿假单胞菌在所有分离细菌中居第4位,分离率分别为10.8%和12.6%,且MDR-PA的比例高达12.7%左右。这一点在呼吸系统感染更为突出[6]。铜绿假单胞菌的耐药率居高不下和它的耐药机制有很大的关系。铜绿假单胞菌的耐药机制涉及多个方面[7]: (1) 产生灭活酶: 铜绿假单胞菌可产生β-内酰胺酶、氨基糖苷类修饰酶、氯霉素乙酰转移酶等,其中β-内酰胺酶是耐药的主要机制,具有重要的,主要包括C类头孢菌素酶(AmpC)、超光谱-β-内酰胺酶(ESBL)、金属酶(MBL)和肺炎克雷伯菌产的碳青霉烯酶(KPC)等。(2) 膜通透性下降: 主动外排系统过度表达;膜孔蛋白丢失或表达下降。(3) 靶位改变: 拓扑异构酶突变,这与铜绿假单胞菌氟喹诺酮类抗菌药物的耐药有关;16s核糖体RNA甲基酶是对氨基糖苷类抗菌药物耐药的原因之一。(4) 细菌生物被膜形成。(5) 其他耐药机制: 整合子是存在于细菌质粒、染色体或转座子上的一种基因捕获和表达的遗传单位,可以通过接合、转化、转导和转座等方法在细菌间转移,成为细菌多重耐药迅速发展的重要原因。
肺炎克雷伯菌均为肠杆菌科,广泛存在于水和土壤等微生态环境中,易在住院患者的呼吸道和肠道定植,在机体免疫力低下的时,可引起呼吸道、泌尿道、消化道和皮肤软组织等多种部位感染,是导致医院内感染最常见致病菌之一。本组资料显示,其对碳青霉烯类、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦耐药率较低,为16.7%,由于这些药物含有的舒巴坦和他唑巴坦都是广谱、强效、不可逆竞争性酶抑制剂,且稳定性好,本身具有一定的抗菌活性,与头孢哌酮和哌拉西林结合后对许多G-杆菌有强大的协同作用。对阿米卡星耐药率为33.3%,对三、四代头孢菌素的耐药率25%~41%,产超广谱β内酰胺酶(ESBLs)阳性的肺炎克雷伯菌则更高,耐药率为70%~80%。这与临床上广泛使用三、四代头孢菌素诱导产生耐药菌增加有关,特别是三代头孢菌素是诱导产ESBLs菌株的重要因素,据报道35.7%的三代头孢菌素使用者诱发ESBLs耐药菌株[8]。本组检出肺炎克雷伯菌的患者中,ESBLs阳性占41.7%,可能与本院广泛使用三、四代头孢菌素有关。肺炎克雷伯菌对β-内酰胺类抗生素的重要耐药机制之一是产生质粒介导的ESBLs,ESBLs是丝氨酸蛋白衍生物,它能够水解青霉素、头孢菌素和单环β-内酰胺类抗生素的β-内酰胺酶,仅对头霉素、碳青霉烯类和酶抑制剂敏感,并可通过质粒在不同种属细菌之间水平传播而造成耐药性的广泛播散和流行。现今还存在对碳青霉烯类抗菌素耐药的肺炎克雷伯菌,主要归因于其产碳青霉烯酶[9]。肺炎克雷伯菌碳青霉烯酶最多见于美国,但相当大的疫情也发生在以色列和希腊[10-11]。它可引起多重耐药对β-内酰胺类、氟喹诺酮类、氨基糖甙类、碳青霉烯类抗生素敏感性明显降低[12],其可能的机制为外膜通透性损失、β-内酰胺酶的产生[13]和金属-β-内酰胺酶的产生。
鲍曼不动杆菌(Ab)属革兰阴性不发酵杆菌,存在于正常人体的皮肤、呼吸道和泌尿道,是一种条件致病菌,常引起医院获得性肺炎尤其是呼吸机相关性肺炎、菌血症、泌尿系感染、医源性伤口感染等。随着抗生素的广泛应用,鲍曼不动杆菌已经成为医院感染的重要病原菌。美国国家医院感染监测系统显示,鲍曼不动杆菌在医院感染病原菌中占第4位,成为仅次于铜绿假单胞菌的第2位常见不发酵杆菌[14]。鲍曼不动杆菌的感染率和耐药率明显升高,且有继续上升趋势[15]。由于该菌的特点是易在物体表面存活并在患者间传播,所以,加强病区卫生,对已感染者使用过的物品进行彻底的清洗和消毒、医护人员的手卫生是降低该菌感染发生的有效方法。本研究显示,对Ab耐药率最低的是头孢哌酮舒巴坦,为25%,其原因就像Levis等[16]报道的是由于舒巴坦除了可抑制β内酰胺酶以外,还可直接作用于细菌的青霉素结合蛋白(PBP2),显现了其对不动杆菌属独特的杀菌能力[16]。因此对于Ab感染的患者可以选用头孢哌酮舒巴坦治疗,以保证临床疗效的同时减少耐药细菌的产生。鲍曼氏不动杆菌的耐药机制相当复杂,熊薇等报道主要与细菌细胞膜结构的改变、外膜的通透性降低、β-内酞胺酶(如质粒介导的,TEM-1,TEM-2、染色体介导的AmpC型头孢菌素酶)等有关[17]。外膜蛋白OprD2是亚胺培南为代表的碳青酶烯抗生素进入菌体的特异性通道;故考虑外膜蛋白OprD2含量的减少甚至丢失是引起鲍曼氏不动杆菌等非发酵菌对亚胺培南耐药的主要原因[18]。临床上如已明确鲍曼氏不动杆菌感染者可避免使用碳青霉烯类抗菌素,以减少耐药性的产生。多黏菌素类抗菌素,作为最后手段用于治疗多重耐药鲍曼不动杆菌,近年来已引起广泛关注。然而不幸的是,耐多黏菌素鲍曼氏不动杆菌已经在世界各地有报道。最高的耐药率在亚洲,其次是欧洲。其耐药机制尚不清楚,但一些研究证实,它可能与脂多糖和/或在PmrAB双组分体系的损失。Moffatt[19-20]等和Henry等[21]发现脂质A生物合成基因-lpxA,lpxC或lpxD的失活致使在生产鲍曼不动杆菌是脂多糖完全丢失。为了迎合脂多糖丢失,鲍曼不动杆菌通过调细菌表面的组成和结构[21]来改变关键运输和生物合成系统中的表达。Park等[22]研究了PmrA和PrmB与鲍曼不动杆菌耐多粘菌素的相关性,研究结果显示PmrAB系统的增加的表达是鲍曼不动杆菌耐多粘菌素必不可少条件。
本组G+球菌中,以金黄色葡萄球菌为主,多为耐药菌株(MRSA),对青霉素类、红霉素及环丙沙星的耐药率为100%,对复方新诺明耐药率相对较低为33.3%,对利奈唑胺、万古霉素耐药率为0。MRSA的耐药决定因子为mec,其中mecA为结构基因,它大量表达这种特殊的编码PBP2a蛋白,从而导致了金黄色葡萄球菌耐药。mecA基因是金黄色葡萄球菌通过转座机制获得的外来基因,它不仅介导金黄色葡萄球菌对β-内酰胺类抗生素的耐药性,而且mecA基因所在的DNA片段SCCmec还能不断的获得积累其他的耐药基因,促进金黄色葡萄球菌多重耐药性的发展[23]。
该组病例中69.2%的患者有吸烟史,这些患者中检出铜绿假单胞菌、肺炎克雷伯菌、鲍曼氏不动杆菌和金黄色葡萄球菌分别占各菌株数的50%~75%不等,说明吸烟可以增加呼吸系统感染的发病风险。吸烟可通过降低吸烟者呼吸道的抗病能力,使病原微生物易于侵入和感染,增加呼吸系统感染的风险。2004年关于烟草问题的《美国卫生总监报告》通过对收集的大量证据分析后,认为有充分证据说明吸烟与急性呼吸系统感染存在因果关系。已戒烟者患呼吸系统感染的风险低于现在吸烟者,且戒烟时间越长,发病风险越低。
总之,通过分析上腹部术后合并肺部感染病原菌分布特点和耐药性,有助于临床医生经验性选择抗菌药物,提高治疗效果的同时,避免使用会诱导细菌耐药性产生的抗菌素,减少细菌耐药性的产生。作为临床医生,对于已感染耐药细菌的患者实施有效的消毒隔离,对医疗器械的严格消毒,减少侵袭性操作,提高患者抵抗力,劝患者戒烟,并加强医护人员手卫生的执行力度,才能有效控制耐药细菌在医院大范围的传播。
[1] 赵慧颖,吕晓颖.腹部术后肺部感染的原因分析及预防[J].中华医院感染学杂志,2007,17(3): 276-277.
[2] 杨雪英,陈华,郑惠琼,等.148例腹部手术切口感染调查及对策[J].中华医院感染学杂志,2005,15(8): 886-887.
[3] 李莹,黄存林,朱小琴,等.1878例外科腹部手术切口感染调查[J].中华医院感染学杂志,2006,16(4): 382-384.
[4] 汪复,朱德妹,胡付品,等.2012年中国CHINET细菌耐药性监测[J].中国感染与化学杂志,2013,1: 321-330.
[5] Parameswaran GI, Sethi S. Pseudomonas infection in chronic obstructive pulmonary disease [J]. Future Microbiol, 2012,7: 1129-1132.
[6] 陈宏斌,赵春江,王辉,等.2011年中国13家教学医院院内感染常见病原菌耐药性分析[J].中华内科杂志,2013,52: 203-212.
[7] Robert A, Bonomo RA, Szabo D. Mechanisms of multidrug resistance in Acinetobacter species and Pseudomonas aeruginosa [J]. Clin Infect Dis, 2006,43 Suppl 2: S49-56.
[8] 邱星安.肺炎克雷伯菌的耐药趋势及耐药机制的研究进展[J].中国现代药物应用,2011,5(5): 236.
[9] Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumoniae carbapenemase-producing bact-eria[J]. Lancet Infect Dis, 2009,9: 228-236.
[10] Leavitt A, Carmeli Y, Chmelnitsky I, et al. Molecular epidemiology, sequence types,and plasmid analyses of KPC-producing Klebsiella pneumoniae strains in Isreal[J]. Antimicrob Agents Chemother, 2010,54: 3002-3006.
[11] Souli M, Galani I, Antoniadou A, et al. An outbreak of infection due to β-Lactamase Klebsiella pneumoniae carbapenemase 2-producing K. pneumoniae in a Greek University Hospital: molecular characterization, epidemiology, and outcomes[J]. Clin Infect Dis, 2010,50: 364-373.
[12] Btatu S, Landman D, Haag R, et al. Rapid spread of carbapenem-resistant K. Pneumoniae in New York City: a new threat to our antibiotic armamentarium[J]. Arch Intern Med, 2005,165: 1430-1435.
[13] Bradford PA, Urban C, Mariano N, et al. Imipenem resistance in Klebsiella pneumoniae is associated with the combination of ACT-1, a plasmid-mediated AmpC β-lactamase, and the loss of an outer membrane protein[J]. Antimicrob Agents Chemother, 1997,41: 563-569.
[14] 王辉,孙宏莉,宁永忠,等.不动杆菌属多重耐药及泛耐药的分子机制研究[J].中华医学杂志,2006,86(1): 17-22.
[15] 李响新,周铁丽,朱丽青,等.鲍曼不动杆菌临床分布及耐药变迁[J].中国抗生素杂志,2007,32(12): 762-764.
[16] Levin AS, Levy CE, Manrique AE, et al. Severe nosocomial infection with imipenem-resistant Acinetobacter baumannii treated with ampicillin/sulbactam [J]. Int J Anti-microb Agents,2003,21(I): 58-62.
[17] 熊薇,张文池,陈如,等.头孢类抗生家对临床常见革兰氏阴性杆菌体外抗菌活性的比较研究[J].中华医院感染学杂志,2001,11: 251-253.
[18] Courvalion P. Plasmid mediated 4-quinolone resistance a real or apparent absenc[J]. Antimicrob Agents Chemother, 1990,34: 681-684.
[19] Moffatt JH, Harper M, Harrison P, et al. Colistin resistance in Acinetobacter baumannii is mediated by complete loss of lipopolysaccharide production[J]. Antimicrob Agents Chemother, 2010,54: 4971-4977.
[20] Moffatt JH, Harper M, Adler B, et al. Insertion sequence ISAba11 is involved in colistin resistance and loss of lipopolysaccharide in Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2011,55: 3022-3024.
[21] Henry R, Vithanage N, Harrison P, et al. Colistin-resistant, lipopolysaccharide-deficient Acinetobacter baumannii responds to lipopolysaccharide loss through increased expression of genes involved in the synthesis and transport of lipoproteins, phospholipids, and poly-B-1, 6-N-acetylglucosamine[J]. Antimicrob Agents Chemother, 2012,56: 59-69.
[22] Park YK, Choi JY, Shin D, et al. Correlation between overexpression and amino acid substitution of the PrmAB locus and colistin resistance in Acinetobacter baumannii[J]. Int J Antimicrob Agents, 2011,37: 525-530.
[23] 樊新,岳乔红,杨柳,等.耐甲氧西林金黄色葡萄球菌mecA基因的鉴定分析[J].现代检验医学杂志,2007,22(6): 66-67.
Distribution and drug resistance of pathogenic bacteria in abdominal surgery patients with pulmonary infection
HANZhi-qing1,YUANHai-bo2,XUXiao-wen1,LUOYan-rong1,HUANGBei-jie1
(1. Dept. of Respiratory, Yangpu Hospital, Tongji University, Shanghai 200090,China;2. Dept. of Respiratory, First Hospital of Jilin University, Changchun 130021, Jilin Province, China)
Objective To analyze the distribution and antibiotic resistance of pathogenic bacteria in abdominal surgery patients with pulmonary infection. Methods One hundred and fourteen patients with pulmonary infection and pulmonary atelectasis after abdominal surgery were enrolled in the study. Sputum and bronchoalveolar lavage fluid (BALF) specimens were collected for bacterial culture and antibiotic sensitivity test. Results Ninety one bacterial strains were isolated from BALF specimens with a detection rate of 79.8%. Gram-negative (G-) bacilli were 82 strains including,Pseudomonasaeruginosa,Acinetobacterbaumanii,KlebsiellapneumoniaeandProteusmirabilis; Gram-positive (G+)cocci were 6 strains, including Staphylococci aureus. Susceptibility results showed an increased drug resistance ofP.aeruginosaresistant to multiple antibiotics, ofAcinetobacter,Enterobacteriaceaeto vinyl carbapenem antibiotics; while none of G+cocci Staphylococcus aureus strains were resistant to linezolid and vancomycin. Conclusion The detective rate of pathogenic bacteria from BALF specimens is high in patients with pulmonary infection after abdominal surgery, and most of bacterial strains are multi-drug resistant, indicating that empiric antimicrobial agents are necessary for these patients.
lung infection after abdominal surgery; pathogen distribution; drug resistance
10.16118/j.1008-0392.2015.02.014
2014-06-12
韩志青(1969—),女,副主任医师,学士.E-mail: 13621679978@163.com
R 619+.3
A
1008-0392(2015)02-0059-06

