衰老及抗衰老药物的研究进展
宋朝春,魏冉磊,樊晓兰,李地艳,杨明耀
(四川农业大学 畜禽遗传资源发掘与创新利用四川省重点实验室,四川 成都 611130)
衰老及抗衰老药物的研究进展
宋朝春,魏冉磊,樊晓兰,李地艳,杨明耀Δ
(四川农业大学 畜禽遗传资源发掘与创新利用四川省重点实验室,四川 成都 611130)
衰老是生命过程的必然规律,是指机体各组织、器官功能随年龄增长而发生退行性变化的过程。关于衰老机制的研究以寻找高效的抗衰老药物已成为当前衰老研究领域中的热点问题。近年来在衰老及抗衰老药物的研究方面取得了很大的进展。本综述首先简述了衰老研究及影响衰老的因素,然后分析了模式生物中与衰老相关的信号通路和机制,并着重讨论了近年来一些潜在的抗衰老药物,最后展望了药物对衰老影响的未来研究。
衰老;抗衰老药物;信号通路;研究进展
衰老是机体各组织、器官功能随年龄增长而发生退行性变化的过程[1]。衰老可以降低机体面对环境胁迫维持动态平衡的能力,从而增加机体患病和死亡的可能性。衰老与高血压、2型糖尿病、动脉粥样硬化、老年痴呆等疾病密切相关。机体衰老与组织再生性细胞减少、脏腑虚损、机体内自由基增加、机体中毒、饮食无节律等相关,是体内外许多因素(环境污染、精神紧张、遗传等)共同作用的结果[2]。
衰老是生命过程的必然规律,是不可避免的,但是延缓衰老却是可能的。古今中外,人们一直在寻找各种延年益寿的方法和抗衰老药物以期能在遗传学上所界定的寿限内延迟衰老或提高生命质量。虽然躯体治疗衰老的方法不够理想,但是最近研究发现许多治疗其他疾病的天然产物和合成药物具有抗衰老作用,为促进人类健康和延缓衰老提供建议和思索[3]。采用自然衰老动物或者是人为因素导致衰老的动物为模型是人类研究衰老过程的有效手段。结合各类实验动物的自身特点以及生理特性,建立与临床衰老症状相似的动物模型,已成为研究衰老机制以及评价抗衰老药物的一个重要平台[4]。近50多年来,众多研究致力于探究衰老的特征、触发因素、信号通路、衰老的类型以及细胞衰老过程对于多种衰老相关性疾病的调控机制[2]。本文首先简述了衰老的特征和影响衰老的因素,然后重点介绍在衰老过程中遗传调控的重要信号通路以及近几年药物对抗衰老的最近研究进展。最后就药物对衰老影响未来的研究进行了展望。
1 衰老的研究进展
衰老通常是指人体在其生长发育达到成熟期以后,随着年龄的增长,在形态、结构和生理功能方面必然出现的一系列全身性、多方面的退行性变化,如皮肤萎缩、骨质丢失、动脉粥样硬化、老年性痴呆等[5]。衰老生物学(biology of senescence,BS)或老化生物学(biology of aging,BA)是研究生物衰老现象、过程与规律的科学。其任务是揭示衰老现象的特征,在不同水平(分子、细胞、组织、器官及整体水平)上的衰老变化,探讨导致衰老变化的原因和机制,以寻求延缓衰老的途径和方法。根本目的在于认识衰老的本质,增强老年健康意识,延长人的寿命,提高老年人的生命质量[6]。
随着全球人口老龄化趋势的加剧,各国研究者在长寿机制、表观遗传调节衰老和代谢与衰老等诸多方面取得了明显的进展。2013年国际著名的“细胞”杂志总结出了基因组不稳定、端粒损耗、表观遗传改变、丧失蛋白稳定性、对营养感受紊乱、线粒体功能紊乱、细胞衰老、干细胞耗竭和改变细胞间通信等衰老的细胞和分子特征,为衰老研究提供了指导性的见解[7]。
1.1 影响衰老的因素
1.1.1 衰老相关的分子:多种与衰老相关的分子,在生物体内起多种多样的作用,其功能缺失就会影响衰老的进程。抑癌基因p53是一个多功能的转录因子,在凋亡、衰老、抗氧化等方面起重要的作用。p53缺失的细胞丧失对丝氨酸缺乏的反应,抑制谷胱甘肽的合成,而降低细胞的成活率,抑制体内肿瘤的生长,从而延缓衰老[8]。叉头转录因子(forkhead transcription factor,FOXO)是一类调节抗氧化、代谢、免疫等作用的多种功能分子,其中,FOX03A与百岁老人的长寿遗传性密切相关,FOXO3A可以促进与衰老相关的基因的表达,从而延长寿命[9]。过氧化物歧化酶l(superoxide dismutase1,SODl)是细胞质内大量存在的抗氧化酶,过表达SOD1可提高活性氧的新陈代谢,延长机体的寿命[10]。
1.1.2 心脏衰老:最近证实成年的哺乳类动物中,心脏细胞是可以再生的,但这些细胞来源于何处仍然是个谜。通过多种同位素标记等方法,确认这些再生细胞来源于心脏中已经存在的心肌细胞,其再生能力在老年小鼠中明显下降[11]。使用年青小鼠与老年小鼠血液共循环的方法,确认影响心肌肥大的血液因素。发现生长分化因子11(growth differentiation factor,GDF11)是血液中逆转老年小鼠心肌肥大的重要蛋白。GDF11属于转化生长因子-13(transforming growth factor,TGF-13)超家族的成员,通过影响FOX03A等下游信号分子起作用,该因子的表达随着年龄增加而降低[12]。在衰老的心脏中,微小核糖核酸-34a(microRNA-34a,miRNA-34a)表达明显增加。降低其表达可以降低衰老引起的细胞死亡,分析miRNA-34a的靶蛋白,发现其有调节PUTNS作用[13]。
1.1.3 线粒体:线粒体与衰老、长寿具有密切的关系。对小鼠和线虫遗传学分析发现:线粒体核糖体蛋白(mitochondrial ribosomal proteins5,MRPs5)是代谢和长寿的调节分子。它在线粒体和细胞核之间的非平衡态,引起线粒体非折叠蛋白反应而延长寿命[14]。利用果蝇肌肉线粒体损伤模型,研究线粒体低毒兴奋效应(mitochondrial hormesis,mitohormesis)延长寿命的机制,发现中度的温度应激反应能明显地延长寿命。该机制与胰岛素信号通路以及仅限于肌肉的线粒体非折叠蛋白反应有关[15]。利用多种小鼠突变模型,证实了母体线粒体DNA突变明显影响子代的寿命,子代小鼠的衰老过程加快,随机性损伤脑功能[16]。低温引起线虫寿命的延长认为是降低了化学反应,研究发现发现把温度感受瞬时受体电位离子通道(transient receptor potential ion channels-1,TRPs-1)缺失,低温引起寿命延长的效应消失,原因是TRPA-1激活钙离子内流,激活钙依赖的蛋白激酶C(proteinkinase C,PKC),然后引起降解加速因子-16(decay acceleratingfactor-16,DAF-16)(FOX03A的同源物)表达是低温延长寿命的机制[17]。
1.1.4 端粒:端粒缩短导致人体的复制性衰老,端粒长度的维持机制与端粒酶及其相关结合蛋白的关系历来是研究的热点。老年人较青年人来说,其细胞端粒长度明显缩短,人体大多数组织平均每年端粒长度减少的变化范围为20~60 bp,当端粒缩短到一定界限,细胞停止分裂,细胞老化而死亡[18]。di Fagagna等[19]研究发现,端粒缩短引起DNA损伤反应,从而导致基因组不平衡而启动细胞衰老的过程;由此提出端粒的长度决定着细胞的寿命,被称为衰老的“端粒学说”或“细胞有限分裂学说”[20]。很早以前,Harley等[21]的人类端粒与衰老的研究中就发现,体细胞端粒DNA会随细胞分裂次数增加而不断缩短。近年Atzmon等[22]的研究也发现端粒长度与细胞分裂次数,以及与寿命极限有着密切关系。Unryn等[23]测定正常人体的外周血细胞中端粒长度随年龄变化情况(端粒长度在30~49岁时每年减少51.3 bp,40~80岁每年减少19.8 bp),提示随着细胞不断分裂,端粒长度逐渐缩短。由此可见,每一次的细胞分裂,染色体都会丢失一部分端粒DNA序列,当其缩短到一个临界长度,即末端限制性片段的长度时(Hayflick界限),细胞不再分裂,逐渐衰老直至死亡[24]。由于端粒还可能限制细胞的分裂次数,因此也有人将端粒的长度称为“生命时钟”[25]。端粒保护蛋白1(telomeric protection protein 1,TPP1)招募端粒酶到端粒上,延长DNA片断。通过突变体分析,发现TPP1上的TEL片断是招募端粒酶所必须的[26]。研究表明TPP1的磷酸化与端粒酶结合的周期依赖性相关,该蛋白S111位的磷酸化起关键作用;把该位点突变后端粒酶在复合体中的活性明显降低,引起端粒缩短[27]。
1.1.5 环境:环境参数包括饮食[28]、氧化应激和炎症可以显著地影响寿命[29-30]。饮食限制(营养摄入限制在动物的摄入大约65%)是最著名并且保守的延长寿命的措施[31]。在许多生物中,限食让大部分生理过程维持在一个明显年轻的状态,延缓与年龄有关的疾病的发生或进程[30,32]。虽然限食延长寿命的机制不明确,但有研究指出限食是作为一种干预措施,其中之一是通过干扰线粒体电子传递链从而延长寿命[33-34]。抑制TOR通路可以抑制蛋白质翻译过程或激活细胞自噬作用,从而延长机体的寿命[28]。在酵母,线虫,果蝇和人类的研究表明,限食可以作用于相应模式生物的胰岛素通路,从而延长寿命[35]。机体在压力环境下的抵抗能力被称作压力应激能力。压力状态下的应激能力与寿命之间存在很强的相关性。研究发现,许多长寿型突变体线虫都伴随着压力应激能力的提高[36]。氧化应激一直被认为是衰老的主要驱动力,在果蝇中的许多研究表明氧化损伤在衰老中有重要作用[37-38]。衰老与炎症是紧密联系的事件,已经有人建议把慢性炎症作为衰老的生物标志物[39]。研究发现下丘脑是小鼠整体炎症的主要部位,明显激活核因子抑制因子激酶-p(inhibitor of nuclear factor κ-B kinase,IKK-p)、核转录因子(nuclear transcription factor κB,NF-κB)等炎症关键分子,抑制促性腺素释放素(gon-adotropin-releasing hormone,GnRH)的产生[40]。神经系统的慢性炎症是多种神经退行性疾病常见的现象。研究发现星型胶质细胞多巴胺2受体(dopamine receptor D2,DRD2)通过晶状体蛋白介导固有免疫,缺失DRD2的小鼠明显活化位于黑色皮质中的星型胶质细胞。该结果有助于解释中老年人群中DRD2表达降低,容易发生神经退行性疾病的原因[41]。
2 影响衰老的主要信号通路
目前,通过遗传筛选和自然突变的方法,人们已经鉴定出数百个影响衰老或长寿的基因和相关信号传导通路,它们包括:胰岛素信号通路(insulin/IGF-1 signaling pathway,IIS),雷帕霉素标靶(target of rapamycin,TOR)信号通路,腺苷酸活化蛋白激酶(adenosine monophosphate - activated protein kinase,AMPK)信号通路,热激因子(heat-shock factors,HSFs),促分裂原激活蛋白激酶(mitogen activated protein kinases,MAPKs),沉默信息调控因子2样蛋白(silent information regulator 2 homolog 1,sirtuins)和线粒体相关信号通路等,这些信号传导通路在衰老的过程中发挥作用(见图1)。
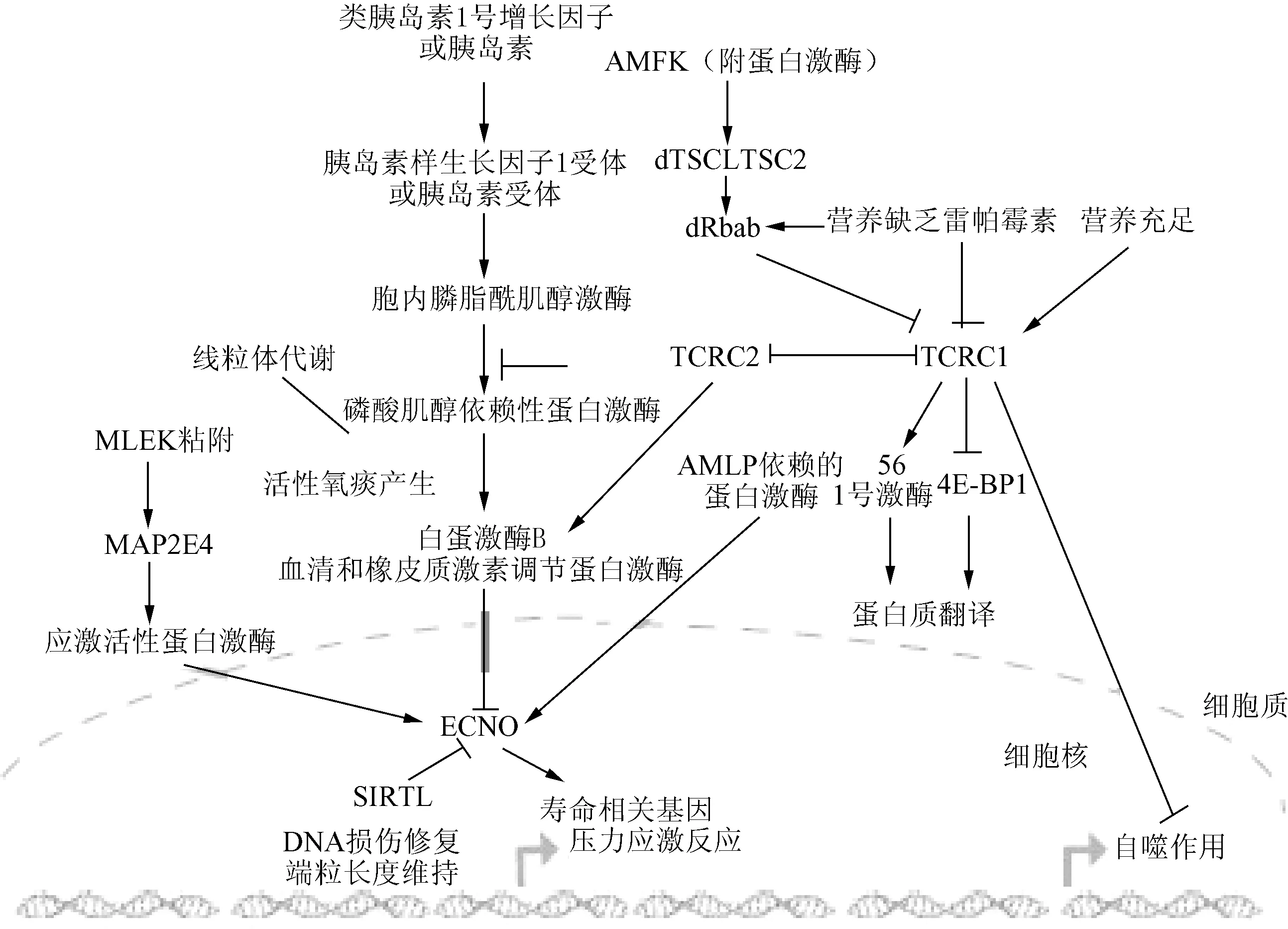
图1 与衰老相关的信号通路Fig.1 Signaling pathways associated with aging
2.1 胰岛素信号通路 胰岛素信号通路是已知调控生物体发育和衰老研究最多最重要的信号通路,在不同物种中具有高度的保守性[42-43]该信号通路包括胰岛素样受体(insulin-like growth factors,IGFs)/DAF-2[44],磷脂酰3羟基酶(phosphatidylinositol 3 kinase,PI3K)[45]以及蛋白激酶血清和糖皮质激素调节蛋白酶(serum and glucocorticoid induced kinase,SGK)和3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase1,PDK1)等激酶[36-46]这些激酶之间的级联反应,最终导致重要转录因子FOXO/DAF-16磷酸化[47],磷酸化的FOXO/DAF-16不能进核,从而阻止了抵抗应激和DNA损伤修复等抗衰老基因的转录启动[48-49]。不仅如此,受压力诱导所激活的JNK-1信号通路也可以直接磷酸化DAF-16 在线虫中,DAF-16主要在肠道和神经细胞中发挥对线虫衰老的调控作用[50]。此外,线虫在空间拥挤和食物匮乏的情况下,也会激活DAF-2进入一种静态滞育状态-dauer期,而在食物充足的情况下,线虫又会从dauer期直接发育为成虫,此时,DAF-2又发挥其对寿命的调控作用[51]。在研究果蝇脑组织和腹部脂肪中的FOXO时,Hwangbo等[52]发现胰岛素信号通路对整个果蝇的衰老调控呈现出细胞非自主性的特点。Holzenberger等[53]在小鼠的研究中发现,IGF1R在成年小鼠的脑组织和脂肪组织中发挥寿命调控作用。在针对不同人群的研究中,研究者也发现了许多与长寿相关的胰岛素信号通路基因的多态性改变,例如:胰岛素样生长因子(insulin-like growth factors1,IGF1)和FOXO3基因多态性,其中FOXO3A与人类的长寿关系密切[54]。胰岛素/1GF-1信号通路在酵母、线虫、果蝇、哺乳动物以及人类这些相似的特性,包括基因的组成以及对寿命和衰老的调节等。说明胰岛素ZIGF-1信号通路调节系统在生物进化中早期存在,并且从酵母到哺乳动物和人,调节衰老的基本机制可能是进化保守的。因此,胰岛素/IGF-1信号通路可以作为一新的靶标来进行药物研究和开发,以预防和治疗衰老相关性疾病。为衰老的机理研究以及预防和治疗衰老相关性疾病并延缓衰老提供了广阔的前景。
2.2 雷帕霉素信号通路 雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一个结构和功能高度保守的丝氨酸/苏氨酸激酶,是蛋白合成的关键调节器,并在细胞生长、增值、分化和凋亡等多种生物功能中发挥作用[55]。TOR是另一条高度保守的寿命调控信号通路,同时也是生物体感知营养和环境变化的关键途径。抑制TOR信号通路,可以增强生物体对抗环境压力的能力,延长从酵母到小鼠等许多物种的寿命[56]。已经证实,TOR信号通路在卡路里限制饮食所导致的寿命延长和细胞自噬反应过程中发挥作用并且,至少在线虫中的研究证明,TOR信号通路对寿命的调控独立于胰岛素信号通路,不依赖DAF-16/FOXO[57]。当营养充足时,TOR蛋白可以激活S6激酶(S6K1),抑制蛋白质翻译抑制因子4E-BP1,从而促进蛋白质翻译过程;而营养缺乏时,蛋白质的翻译过程也随之受到抑制。此外,营养缺乏也可以通过抑制TOR蛋白,激活细胞的自噬反应 TOR信号通路的抑制对细胞自噬反应的激活作用可能是间接的,受到基因表达调控的影响,在线虫中需要转录因子PHA-4/FOXA的参与[58]。TOR的小分子抑制剂雷帕霉素(rapamycin,RAPA)和限食作用类似,可以起到延长寿命和有益健康的作用[59]。
2.3 Sirtuin与衰老 从细菌到人类各种生物中,Sir2蛋白在进化上都相当保守,这些不同生物体中的Sir2蛋白被称作“sirtuin”[60]。依赖烟酰胺腺嘌呤二核苷酸(NAD)的组蛋白去乙酰化酶Sirtuins,是感知细胞代谢状态的重要效应因子Sirtuins的底物包括组蛋白p53和FOXO,过表达Sirtuins可以延长酵母、线虫和果蝇的寿命[61]。近年来有关Sirtuins影响衰老的分子机制还有待深入研究,在酵母中,Sir2并不能影响野生型酵母菌株的生命周期,但对于长生存突变,去除Sir2却能延长生存时间[62]。SIR-2.1延长线虫寿命是通过激活DAF-16实现的,在哺乳动物中,SIRT1通过去乙酰化作用直接作用于FOXO蛋白,从而促进抗压力基因的转录[63]。由于NAD和NADH是代谢反应的重要调节因子,所以Sirtuins蛋白在饮食限制影响寿命的过程中发挥了重要的调控作用[64-65]。在DNA损伤发生后,SIRT6对维持基因组的稳定性发挥了重要的作用[66]过量表达Sirtuins,可以部分减缓由于进食高脂肪含量食物引起的寿命缩短[67]。因此,sirtuin是一类特殊的蛋白质,影响着蛋白质乙酰化与代谢,并在联系NAD、代谢和衰老相互关系间发挥重要作用。对sirtuin为靶向药物继续研究,用以治疗老年疾病,甚至那些病态衰老将有一定作用。
2.4 AMP-Activated Protein Kinase(AMPK)与衰老 AMPK存在与所有真核生物中,是催化亚基、调节因子和亚基异源三聚体的复杂组成。AMP激酶(AMP-activated protein kinase,AMPK)是感知生物体内营养和能量的传感器,AMPK的激活取决于细胞内AMP/ATP的比值变化[68]在衰老的过程中,AMPK活性的改变可能与线粒体功能的退化有关[69-70]。过表达AMPK可以延长线虫的寿命,在胰岛素信号通路基因突变使线虫寿命延长的过程中,AMPK也发挥了不可或缺的重要作用[71]。降糖药二甲双胍可以激活AMPK,从而延长小鼠的寿命[72]。此外,饥饿也可以激活AMPK,从而直接增强DAF-16/FOXO的活性,延长线虫的寿命[73]。
3 抗衰老药物的研究现状
尽管还没有药政管理部门批准过抗衰老药物,但通过药物延缓衰老一直来引起很多人的兴趣。最近发现许类多化合物都可以延长模式生物的寿命,如沉默信息调节因子1(silent information regulator 1,SIRTl)激活剂,双胍类药物,雷帕霉素,抗氧化类药物,消炎类药物等。现列举一些重要的抗衰老化合物及其作用机理。
3.1 天然抗衰老药物 白藜芦醇是一种广泛存在于植物和红葡萄酒中的植物多酚,这种多酚可以启动长寿基因Sir2,抑制肿瘤基因p53,阻断细胞凋亡、延缓衰老和延长寿命[74-75]。雷帕霉素是一种新型大环内酯类免疫抑制剂。雷帕霉素通过不同的细胞因子受体阻断信号传导,阻断T淋巴细胞及其他细胞由G1期至S期的进程,从而发挥免疫抑制效应。雷帕霉素可以延长老鼠的寿命,即使在小鼠出生后第600天才开始提供雷帕霉素,都可以让小鼠生命延长[76]。最近发现黄芪多糖(黄芪)可调节衰老通路,黄芪不仅减少多聚谷氨酰胺(polyglutamine,PolyQ)蛋白聚集,同时也减轻了相关的神经毒性,延长野生型和PolyQ蛋白线虫的成虫寿命[77]。叶黄素是在大多数水果和蔬菜中的主要类胡萝卜素之一。0.1 mg/mL叶黄素的饮食可以通过上调内源性抗氧化酶延长果蝇的平均寿命[78]。β-胡萝卜素是类胡萝卜素之一,是一种抗氧化剂,具有防止衰老和预防衰老引起的多种退化性疾病作用[79]。硫辛酸是一种二硫化合物,作为线粒体中丙酮酸脱氢酶和α-酮戊二酸脱氢酶的辅酶,通过有效地改善三羧酸循环酶、呼吸链酶复合物的活性,降低线粒体DNA的氧化损伤以及线粒体膜脂酯过氧化水平。从而改善老年机体的线粒体功能障碍。进而发挥延缓衰老的作用[80]。多酚又称茶鞣或单宁,是形成茶叶色香味的主要成份之一,通过提高自由基的清除能力、激活细胞内的抗氧化防御系统,从而延缓衰老[81]。熊果酸(ursolic acid,UA)是一种存在于许多植物中的天然三萜类化合物,其生物活性主要应用于抗肿瘤、护肝、心血管、糖尿病、抗炎、抗病毒等多个领域,不良反应小。近期研究证明UA是一种较强的抗氧化剂,能强有力地抑制细胞中活性氧簇(reactive oxygen species,ROS)产生,还对H2O:诱导的DNA损伤具有保护效应。从而起到延缓衰老的作用[82-83]。α-酮戊二酸(α-ketoglutarate,α-KG)是三羧酸循环中的一个中心分子,可以刺激肌肉中蛋白质合成并抑制蛋白质降解,是氮清除剂和谷氨酰胺的来源,研究发现α-KG可以延长成年线虫的寿命,延缓与年龄有关的疾病,通过抑制三磷酸腺苷(adenosine triphosphate,ATP)合成酶和TOR信号通路[84]。
3.2 合成抗衰老药物 阿司匹林是一种历史悠久的解热、镇痛和抗炎药。阿司匹林可以延长线虫的平均寿命,增加健康寿命和压力阻力[3]。二甲双胍是广泛的规定治疗2型糖尿病和代谢综合征的药物,二甲双弧可以通过调节叶酸代谢和蛋氨酸代谢从而延长线虫的寿命,寿命是否增加与大肠杆菌对二甲双胍的敏感性和葡萄糖浓度相关,同时研究也发现二甲双胍可以作用于电子传递链,激活AMPK蛋白激酶,从而延长老鼠的寿命[84],但不能延长果蝇的寿命[85]。塞来昔布是非类固醇抗发炎药物,广泛用于治疗疼痛和炎症,塞来昔布可直接作用于胰岛素信号通路中的3磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase-1,PDPK1),从而增加寿命线虫[86]。异丙肌苷是一种免疫促进剂。它是2-羟丙基二胺和4-乙酰胺基苯甲酸生成的盐与肌苷按分子比3:1形成的复合物。该药能抑制病毒的增殖,临床用于治疗病毒感染或病毒感染相关的疾病。研究表明异丙肌苷也能增强老年人的免疫能力,从而延缓衰老[87]。吡拉西坦,是一种益智药,可能是通过增强血液流动起到防护大脑皮层缺氧作用,延缓脑衰老[88]。司来吉兰是一种选择性不可逆的单胺氧化酶B抑制剂。能够选择性和不可逆的抑制多巴胺降解从而提高脑内和中枢神经系统多巴胺水平。目前不仅作为帕金森病早期的一线治疗药物,而且作为帕金森病晚期的辅助治疗药物被广泛应用。司来吉兰同时显著的增量调节抗氧化酶活性,抑制黑质中的羟自由基的形成,具有良好的抗衰老作用[89]。拉莫三嗪是一种常用的抗痉挛的药物,用果蝇作为模式生物研究拉莫三嗪的死亡率、寿命、代谢速率和运动的影响之间的相互作用,发现,拉莫三嗪降低死亡率和增加寿命,是一种有益的抗衰老药物[90]。研究发现,成年线虫的淀粉样蛋白结合染料硫磺素-T能明显延长寿命、延缓衰老,还能抑制突变体蛋白的稳定性和人类β-淀粉样蛋白相关的毒性。这些有益的效果依赖于蛋白质稳态网络器HSFs,胁迫抗性和长寿的转录因子,分子伴侣,自噬和蛋白酶体功能。结果表明,药物维持的蛋白质稳态网络对老化的速率产生深远的影响,推动了治疗衰老和老年性疾病的新的措施的发展[91]。
3.3 其他抗衰老药物[92]除了上述的抗衰老物质外,还有许多具有不同化学结构的天然物质能通过各种机制发挥抗衰老作用,而且很多用于治疗各种疾病的合成药物也具有抗衰老作用。见表1。

表1 其他抗衰老药物
4 展望
在衰老与抗衰老的研究中,目前更多的研究集中在药物对衰老的影响,并且着重探究其作用机理。越来越多的化合物被研究证实可以延长模式生物的寿命,并且发现了许多延长寿命的信号通路及分子机制。
许多化学物质具有抗衰老作用。抗衰老药物的研究建立在对抗衰老机制不断认识的基础上。只有真正认识了衰老才能找到延缓衰老的特别方法。抗衰老药物研究将为药物研发打开一条新的通路,现在对抗衰老药物的研究还不够深入,大多局限于抗衰老保健品。但是这些保健品品种繁多,稂莠不齐。抗衰老药物较少,特别是具有抗衰老作用的复合制剂几乎没有。最近新发现治疗其他疾病的合成药物也具有预防或延缓衰老作用,因此这些药物的抗衰老作用有待于我们更深入地进行研究。而且药物抗衰老只是抗衰老方法的一种,应该在采取综合性保健措施的基础上合理选用抗衰老药物,以进一步增强老年人的体质,延长人类的平均预期寿命。
随着老年医学的发展,人们对衰老的研究越来越深入。而现代医学和分子生物学不断进步,研究手段的不断更新也给衰老研究带来了新的机遇和发展,但由于衰老是由多种因素引起的一个复杂的生物学过程,有多种机制参与,目前仍未完全阐明衰老机理,还有待于更深入的研究。
[1] Turnheim K.When drug therapy gets old:pharmacokinetics and pharmacodynamics in the elderly[J].Exp Gerontology,2003,38(8):843-853.
[2] Lopez-Otin C,Blasco MA,Partridge L,et al.The hallmarks of aging[J].Cell,2013,153(6):1194-1217.
[3] Ayyadevara S,Bharill P,Dandapat A,et al.Aspirin inhibits oxidant stress,reduces age-associated functional declines,and extends lifespan of caenorhabditis elegans[J].Antioxid Redox Signal,2013,18(5):481-490.
[4] Le Bourg E.Using Drosophila melanogaster to study the positive effects of mild stress on aging[J].Exp Gerontol,2011,46(5):345-348.
[5] Turnheim K.When drug therapy gets old:pharmacokinetics and pharmacodynamics in the elderly[J].Exp Gerontol,2003,38(8):843-853.
[6] Edward JM,Steven NA.Handbook of the Biology of Aging(Seventh Edition)[M].Elsevier,2012-11.
[7] López-Otín C,Blasco MA,Partridge L,et al.The hallmarks of aging[J].Cell,2013,153(6):1194-1217.
[8] Maddocks OD,Berkers CR,Mason SM,et al.Serine starvation induces stress and p53-dependent metabolic remodelling in cancer cells[J].Nature,2013,493(7433):542-546.
[9] Eisenstein M.Centenarians:Great expectations[J].Nature,2012,492:6-8.
[10] Reddi AR,Culotta VC.SOD1 integrates signals from oxygen and glucose to repress respiration[J].Cell,2013,152(1-2):224-235.
[11] Senyo SE,Steinhauser ML,Pizzimenti CL,et al.Mammalian heart renewal by pre-existing cardiomyocytes[J].Nature,2013,493(7432):433-436.
[12] Loffredo FS,Steinhauser ML,Jay SM,et al.Growth differentiation factor 11 is a circulating factor that reverses age-related cardiac hypertrophy[J].Cell,2013,153(4):828-839.
[13] Gurtan AM,Sharp PA.The role of miRNAs in regulating gene expression networks[J].J Molecular Biol,2013,425(19):3582-3600.
[14] Houtkooper RH,Mouchiroud L,Ryu D,et al.Mitonuclear protein imbalance as a conserved longevity mechanism[J].Nature,2013,497(7450):451-457.
[15] Owusu-Ansah E,Song W,Perrimon N.Muscle mitohormesis promotes longevity via systemic repression of insulin signaling[J].Cell,2013,155(3):699-712.
[16] Ross JM,Stewart JB,Hagström E,et al.Germline mitochondrial DNA mutations aggravate ageing and can impair brain development[J].Nature,2013,501(7467):412-415.
[17] Xiao R,Zhang B,Dong Y,et al.A Genetic Program Promotes C.elegans Longevity at Cold Temperatures via a Thermosensitive TRP Channel[J].Cell,2013,152(4):806-817.
[18] Takubo K,Aida J,Izumiyama-Shimomura N,et al.Changes of telomere length with aging[J].Geriatri Gerontolo Int,2010,10(suppl 1):197-206.
[19] di Fagagna FdA,Reaper PM,Clay-Farrace L,et al.A DNA damage checkpoint response in telomere-initiated senescence[J].Nature,2003,426(6963):194-198.
[20] Greider CW,Blackburn EH.The telomere terminal transferase of Tetrahymena is a ribonucleoprotein enzyme with two kinds of primer specificity[J].Cell,1987,51(6):887-898.
[21] Harley CB.Human ageing and telomeres[J].Ciba Found Symp,1997,211:129-139.
[22] Atzmon G,Cho M,Cawthon R,et al.Evolution in health and medicine Sackler colloquium:Genetic variation in human telomerase is associated with telomere length in Ashkenazi centenarians[J].P Natl Acad Sci USA,2010,107(suppl 1):1710-1717.
[23] Unryn BM,Cook LS,Riabowol KT.Paternal age is positively linked to telomere length of children[J].Aging Cell,2005,4(2):97-101.
[24] Hayflick L,Moorhead PS.The serial cultivation of human diploid cell strains[J].Exp cell Res,1961,25:585-621.
[25] Song Z,Wang J,Guachalla LM,et al.Alterations of the systemic environment are the primary cause of impaired B and T lymphopoiesis in telomere-dysfunctional mice[J].Blood,2010,115(8):1481-1489.
[26] Nandakumar J,Bell CF,Weidenfeld I,et al.The TEL patch of telomere protein TPP1 mediates telomerase recruitment and processivity[J].Nature,2012,492(7428):285-289.
[27] Zhang Y,Chen L-Y,Han X,et al.Phosphorylation of TPP1 regulates cell cycle-dependent telomerase recruitment[J].P Natl Acad Sci,2013,110(14):5457-5462.
[28] Katewa SD,Kapahi P.Dietary restriction and aging,2009[J].Aging Cell,2010,9(2):105-112.
[29] Libert S,Chao Y,Zwiener J,et al.Realized immune response is enhanced in long-lived puc and chico mutants but is unaffected by dietary restriction[J].MolImmunol,2008,45(3):810-817.
[30] Skorupa DA,Dervisefendic A,Zwiener J,et al.Dietary composition specifies consumption,obesity,and lifespan in Drosophila melanogaster[J].Aging Cell,2008,7(4):478-490.
[31] Clancy DJ,Gems D,Hafen E,et al.Dietary restriction in long-lived dwarf flies[J].Science,2002,296(5566):319.
[32] Mair W,McLeod CJ,Wang L,et al.Dietary restriction enhances germline stem cell maintenance[J].Aging Cell,2010,9(5):916-918.
[33] Copeland JM,Cho J,Lo Jr T,et al.Extension of Drosophila life span by RNAi of the mitochondrial respiratory chain[J].Curr Biol,2009,19(19):1591-1598.
[34] Zid BM,Rogers AN,Katewa SD,et al.4E-BP Extends Lifespan upon Dietary Restriction by Enhancing Mitochondrial Activity in Drosophila[J].Cell,2009,139(1):149-160.
[35] Fontana L,Partridge L,Longo VD.Extending healthy life span-from yeast to humans[J].Science,2010,328(5976):321-326.
[36] Hertweck M,Göbel C,Baumeister R.C.elegans SGK-1 Is the Critical Component in the Akt/PKB Kinase Complex to Control Stress Response and Life Span[J].Dev Cell,2004,6(4):577-588.
[37] Wang MC,Bohmann D,Jasper H.JNK Signaling Confers Tolerance to Oxidative Stress and Extends Lifespan in Drosophila[J].Dev Cell,2003,5(5):811-816.
[38] Curtis C,Landis GN,Folk D,et al.Transcriptional profiling of MnSOD-mediated lifespan extension in Drosophila reveals a species-general network of aging and metabolic genes[J].Genome Biol,2007,8(12):262.
[39] Singh T,Newman AB.Inflammatory markers in population studies of aging[J].Ageing Res Rev,2011,10(3):319-329.
[40] Zhang G,Li J,Purkayastha S,et al.Hypothalamic programming of systemic ageing involving IKK-[bgr],NF-[kgr]B and GnRH[J].Nature,2013,497(7448):211-216.
[41] Shao W,Zhang S-z,Tang M,et al.Suppression of neuroinflammation by astrocytic dopamine D2 receptors via alpha B-crystallin[J].Nature,2013,494(7435):90.
[42] Antebi A.Genetics of aging in Caenorhabditis elegans[J].PLoS Genetics,2007,3(9):1565-1571.
[43] Kenyon C.The plasticity of aging:insights from long-lived mutants[J].Cell,2005,120(4):449-460.
[44] Kimura KD,Tissenbaum HA,Liu Y,et al.daf-2,an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans[J].Science,1997,277(5328):942-946.
[45] Baker DJ,Wijshake T,Tchkonia T,et al.Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders[J].Nature,2011,479 (7372):232-236.
[46] Paradis S,Ailion M,Toker A,et al.A PDK1 homolog is necessary and sufficient to transduce AGE-1 PI3 kinase signals that regulate diapause in Caenorhabditis elegans[J].Genes Dev,1999,13(11):1438-1452.
[47] Lin K,Dorman JB,Rodan A,et al.daf-16:An HNF-3/forkhead family member that can function to double the life-span of Caenorhabditis elegans[J].Science,1997,278(5341):1319-1322.
[48] Lamitina ST,Strange K.Transcriptional targets of DAF-16 insulin signaling pathway protect C.elegans from extreme hypertonic stress[J].Am J Physiol Cell Physiol,2005,288(2):467-474.
[49] Jia K,Chen D,Riddle DL.The TOR pathway interacts with the insulin signaling pathway to regulate C.elegans larval development,metabolism and life span[J].Development,2004,131(16):3897-3906.
[50] Libina N,Berman JR,Kenyon C.Tissue-Specific Activities of C.elegans DAF-16 in the Regulation of Lifespan[J].Cell,2003,115(4):489-502.
[51] Dillin A,Crawford DK,Kenyon C.Timing requirements for insulin/IGF-1 signaling in C.elegans[J].Science,2002,298(5594):830-834.
[52] Hwangbo DS,Gersham B,Tu M-P,et al.Drosophila dFOXO controls lifespan and regulates insulin signalling in brain and fat body[J].Nature,2004,429(6991):562-566.
[53] Holzenberger M,Dupont J,Ducos B,et al.IGF-1 receptor regulates lifespan and resistance to oxidative stress in mice[J].Nature,2003,421(6919):182-187.
[54] Suh Y,Atzmon G,Cho M-O,et al.Functionally significant insulin-like growth factor I receptor mutations in centenarians[J].Proc Nati Acad Sci,2008,105(9):3438-3442.
[55] Hwang SK.Invited Mini Review:The functions of mTOR in ischemic diseases[J].BMB Repot,2011,44(8):506-511.
[56] Kapahi P,Zid BM,Harper T,et al.Regulation of Lifespan in Drosophila by Modulation of Genes in the TOR Signaling Pathway[J].Curr Biol,2004,14(10):885-890.
[57] Vellai T,Takacs-Vellai K,Zhang Y,et al.Influence of TOR kinase on lifespan in C.elegans[J].Nature,2003,426(6967):620.
[58] Hansen M,Chandra A,Mitic LL,et al.A role for autophagy in the extension of lifespan by dietary restriction in C.elegans[J].PLoS Genetics,2008,4(2):24.
[59] Kenyon CJ.The genetics of ageing[J].Nature,2010,464:504-512.
[60] Brachmann CB,Sherman JM,Devine SE,et al.The SIR2 gene family,conserved from bacteria to humans,functions in silencing,cell cycle progression,and chromosome stability[J].Genes Dev,1995,9(23):2888-2902.
[61] Houtkooper RH,Pirinen E,Auwerx J.Sirtuins as regulators of metabolism and healthspan[J].Nat Rev Mol Cell Biol,2012,13(4):225-238.
[62] Fabrizio P,Gattazzo C,Battistella L,et al.Sir2 blocks extreme life-span extension[J].Cell,2005,123(4):655-667.
[63] Berdichevsky A,Viswanathan M,Horvitz HR,et al.C.elegans SIR-2.1 Interacts with 14-3-3 Proteins to Activate DAF-16 and Extend Life Span[J].Cell,2006,125(6):1165-1177.
[64] Rogina B,Helfand SL.Sir2 mediates longevity in the fly through a pathway related to calorie restriction[J].Proc Nati Acad Sci USA,2004,101(45):15998-16003.
[65] Li Y,Xu W,McBurney MW,et al.SirT1 inhibition reduces IGF-I/IRS-2/Ras/ERK1/2 signaling and protects neurons[J].Cell Metab,2008,8(1):38-48.
[66] Mao Z,Hine C,Tian X,et al.SIRT6 promotes DNA repair under stress by activating PARP1[J].Science,2011,332(6036):1443-1446.
[67] Pearson KJ,Baur JA,Lewis KN,et al.Resveratrol delays age-related deterioration and mimics transcriptional aspects of dietary restriction without extending life span[J].Cell Metab,2008,8(2):157-168.
[68] Kahn BB,Alquier T,Carling D,et al.AMP-activated protein kinase:ancient energy gauge provides clues to modern understanding of metabolism[J].Cell Metab,2005,1(1):15-25.
[69] Reznick RM,Zong H,Li J,et al.Aging-associated reductions in AMP-activated protein kinase activity and mitochondrial biogenesis[J].Cell Metab,2007,5(2):151-156.
[70] Jäger S,Handschin C,Pierre JS,et al.AMP-activated protein kinase (AMPK) action in skeletal muscle via direct phosphorylation of PGC-1α[J].Proc Natl Acad Sci USA,2007,104(29):12017-12022.
[71] Apfeld J,O’Connor G,McDonagh T,et al.The AMP-activated protein kinase AAK-2 links energy levels and insulin-like signals to lifespan in C.elegans[J].Gene Dev,2004,18(24):3004-3009.
[72] Martin-Montalvo A,Mercken EM,Mitchell SJ,et al.Metformin improves healthspan and lifespan in mice[J].Nat Commun,2013,4(1):2192.
[73] Greer EL,Dowlatshahi D,Banko MR,et al.An AMPK-FOXO Pathway Mediates Longevity Induced by a Novel Method of Dietary Restriction in C.elegans[J].Curr Biol,2007,17(19):1646-1656.
[74] Alarcón de la Lastra C,Villegas I.Resveratrol as an anti-inflammatory and anti-aging agent:Mechanisms and clinical implications[J].Mol Nutr Food Res,2005,49(5):405-430.
[75] Baur JA,Sinclair DA.Therapeutic potential of resveratrol:the in vivo evidence[J].Nat Rev Drug Discov,2006,5(6):493-506.
[76] Harrison DE,Strong R,Sharp ZD,et al.Rapamycin fed late in life extends lifespan in genetically heterogeneous mice[J].Nature,2009,460(7253):392-395.
[77] Zhang H, Pan N, Xiong S,et al.Inhibition of polyglutamine-mediated proteotoxicity by Astragalus membranaceus polysaccharide through the DAF-16/FOXO transcription factor in Caenorhabditis elegans[J].Biochem J,2012,441(1):417-424.
[78] Berendschot TT,Goldbohm RA,Klöpping WA,et al.Influence of lutein supplementation on macular pigment,assessed with two objective techniques[J].Invest Ophthalmol Vis Sci,2000,41(11):3322-3326.
[79] Engler MM,Engler MB,Malloy MJ,et al.Antioxidant vitamins C and E improve endothelial function in children with hyperlipidemia endothelial assessment of risk from lipids in youth (EARLY) Trial[J].Circulation,2003,108(9):1059-1063.
[80] Moini H,Packer L,Saris N-EL.Antioxidant and prooxidant activities of α-lipoic acid and dihydrolipoic acid[J].Toxicol Appl Pharmacol,2002,182(1):84-90.
[81] Mukhtar H,Ahmad N.Tea polyphenols:prevention of cancer and optimizing health[J].Am J Clini Nutr,2000,71(6 suppl):1698-1702.
[82] Ramos AA,Pereira-Wilson C,Collins AR.Protective effects of ursolic acid and luteolin against oxidative DNA damage include enhancement of DNA repair in Caco-2 cells[J].Mutat Res,2010,692(1-2):6-11.
[83] Ali MS,Ibrahim SA,Jalil S,et al.Ursolic acid:a potent inhibitor of superoxides produced in the cellular system[J].Phytother Res,2007,21(6):558-561.
[84] Lucanic,Randall M Chin,Xudong Fu,Melody Y Pai,et al.The metabolite a-ketoglutarate extends lifespan by inhibiting ATP synthase and TOR[J].Nature,2014, 510(7505):397-401.
[85] Slack C,Foley A,Partridge L.Activation of AMPK by the putative dietary restriction mimetic metformin is insufficient to extend lifespan in Drosophila[J].PLoS One,2012,7(10):47699.
[86] Ching TT,Chiang WC,Chen CS,et al.Celecoxib extends C.elegans lifespan via inhibition of insulin-like signaling but not cyclooxygenase-2 activity[J].Aging Cell,2011,10(3):506-519.
[87] Tsang KY,Pan JF,Swanger D,et al.In vitro restoration of immune responses in aging humans by isoprinosine[J].Int Immunopharmacol,1985,7(2):199-206.
[88] Müller WE,Koch S,Scheuer K,et al.Effects of piracetam on membrane fluidity in the aged mouse,rat,and human brain[J].Biochem Pharmacol,1997,53(2):135-140.
[89] Borst SE,MILLARS W,Lowenthal DT.Growth hormone,exercise,and aging:the future of therapy for the frail elderly[J].J Am Geriatr Soc,1994,42(5):528-535.
[90] Avanesian A,Khodayari B,Felgner JS,et al.Lamotrigine extends lifespan but compromises health span in Drosophila melanogaster[J].Biogerontology,2010,11(1):45-52.
[91] Alavez S,Vantipalli MC,Zucker DJ,et al.Amyloid-binding compounds maintain protein homeostasis during ageing and extend lifespan[J].Nature,2011,472(7342):226-229.
[92] Lucanic M,Lithgow GJ,Alavez S.Pharmacological lifespan extension of invertebrates[J].Ageing Res Rev,2013,12(1):445-458.
[93] Harrington LA,Harley CB.Effect of vitamin E on lifespan and reproduction in Caenorhabditis elegans[J].Mech Ageing Dev,1988,43(1):71-78.
[94] Adachi C,Baldo MA,Forrest SR,et al.High-efficiency organic electrophosphorescent devices with tris(2-phenylpyridine) iridium doped into electron-transporting materials[J].Appl Phys Lett,2000,77(6):904-906.
[95] Wu Z,Smith JV,Paramasivam V,et al.Ginkgo biloba extract EGb 761 increases stress resistance and extends life span of Caenorhabditis elegans[J].Cell Mol Biol(Noisy-le-Grand,France),2002,48(6):7257-7231.
[96] Zuo Y,Peng C,Liang Y,et al.Sesamin extends the mean lifespan of fruit flies[J].Biogerontology,2013,14(2):107-119.
[97] Bahadorani S,Hilliker AJ.Cocoa confers life span extension in[J].Nutr Res,2008,28(6):377-382.
[98] Enck P,Benedetti F,Schedlowski M.New insights into the placebo and nocebo responses[J].Neuron,2008,59(2):195-206.
[99] Srivastava D,Arya U,SoundaraRajan T,et al.Reserpine can confer stress tolerance and lifespan extension in the nematode C.elegans[J].Biogerontology,2008,9(5):309-316.
[100] Weller M,Felsberg J,Hartmann C,et al.Molecular predictors of progression-free and overall survival in patients with newly diagnosed glioblastoma:a prospective translational study of the German Glioma Network[J].J Clin Oncol,2009,27(34):5743-5750.
[101] Saul N,Pietsch K,Menzel R,et al.Catechin induced longevity in C.elegans:from key regulator genes to disposable soma[J].Mech Ageing Dev,2009,130(8):477-486.
[102] Eisenberg BL,Harris J,Blanke CD,et al.Phase II trial of neoadjuvant/adjuvant imatinib mesylate(IM) for advanced primary and metastatic/recurrent operable gastrointestinal stromal tumor(GIST):early results of RTOG 0132/ACRIN 6665[J].J Surg Oncol,2009,99(1):42-47.
[103] Honda M,Sakai A,Yamashita T,et al.Hepatic ISG expression is associated with genetic variation in interleukin 28B and the outcome of IFN therapy for chronic hepatitis C[J].Gastroenterol,2010,139(2):499-509.
[104] Pavel CI,MrghitaLA,Dezmirean DS,et al.Comparison between local and commercial royal jelly-use of antioxidant activity and 10-hydroxy-2-decenoic acid as quality parameter[J].J Apicult Res,2014,53(1):116-123.
[105] Sayed AA.Ferulsinaic acid attenuation of advanced glycation end products extends the lifespan of Caenorhabditis elegans[J].J Pharm Pharmacol,2011,63(3):423-428.
[106] Collins JJ,Evason K,Kornfeld K.Pharmacology of delayed aging and extended lifespan ofCaenorhabditis elegans[J].Exp Gerontol,2006,41(10):1032-1039.
[107] Benedetti MG,Foster AL,Vantipalli MC,et al.Compounds that confer thermal stress resistance and extended lifespan[J].Exp Gerontol,2008,43(10):882-891.
[108] Petrascheck M,Ye X,Buck LB.An antidepressant that extends lifespan in adult Caenorhabditis elegans[J].Nature,2007,450(7169):553-556.
[109] Williams DS,Cash A,Hamadani L,et al.Oxaloacetate supplementation increases lifespan in Caenorhabditis elegans through an AMPK/FOXO-dependent pathway[J].Aging Cell,2009,8(6):765-768.
[110] Onken B,Driscoll M.Metformin induces a dietary restriction-like state and the oxidative stress response to extend C.elegans healthspan via AMPK,LKB1,and SKN-1[J].PloS One,2010,5(1):8758.
[111] Avanesian A,Khodayari B,Felgner JS,et al.Lamotrigine extends lifespan but compromises health span in Drosophila melanogaster[J].Biogerontol,2010,11(1):45-52.
[112] Alavez S,Vantipalli MC,Zucker DJ,et al.Amyloid-binding compounds maintain protein homeostasis during ageing and extend lifespan[J].Nature,2011,472(7342):226-229.
[113] Ching TT,Chiang WC,Chen CS,et al.Celecoxib extends C.elegans lifespan via inhibition of insulin-like signaling but not cyclooxygenase-2 activity[J].Aging Cell,2011,10(3):506-519.
(编校:王冬梅)
Advances in the study of aging and anti-aging drugs
SONG Chao-chun,WEI Ran-lei,FAN Xiao-lan,LI Di-yan,YANG Ming-yaoΔ
(Animal Genetic Resources Exploration and Innovation Key Laboratory of Sichuan Province,Sichuan Agricultural University, Chengdu 611130, China)
Aging is an inevitable law of life process.It is a cascade of degenerative changes of tissues and organ functions with growing age.The potential anti-aging medicine based on the underlying aging mechanism has become the current hot issue in the gerontology.Research programs focusing of aging and anti-aging medicine have made great progress in recent years.This review first describes the recent advances in the aging research,followed by the factors influencing aging and then summary of the signaling pathways and their corresponding mechanisms in model organisms.After that,some potential anti-aging drugs discovered in recent years were discussed and pointed out the influence of drugs on future aging research.It will provide a reference for improving health and the quality of life in elderly people.
aging; anti-aging drugs; signaling pathway; research advances
四川省教育厅“科研创新团队”项目;“四川省千人计划”项目;国家自然科学基金(31471998)
宋朝春,男,硕士研究生,研究方向:衰老与抗衰老,E-mail:594342280@qq.com;杨明耀,通讯作者,男,教授,博士生导师,研究方向:衰老与抗衰老,E-mail:yangmingyao@sicau.edu.cn。
R917
A
1005-1678(2015)01-0163-08

