体外膜肺氧合辅助下危重急性心肌梗死紧急介入治疗的临床疗效分析
刘迎午 李彤 王赟赟 段大为 王禹 刘博江 彭文近 李鑫 吴鹏
急性心肌梗死(acute myocardial infarction,AMI)表现为冠状动脉急性闭塞造成心肌细胞坏死,未得到及时救治的患者会出现心原性休克,甚至死亡。建立有效的循环支持非常重要,及时有效地开通梗死相关血管、实施再灌注治疗是最重要的治疗手段之一。循环支持的设备很多,如主动脉内球囊反搏(intra-aortic balloon counterpulsation,IABP)、体外膜肺氧合(extra-corporeal membrane oxygenation,ECMO)和左心辅助装置(如Impella)等,其中IABP和ECMO 较为常用。在患者已经出现心脏骤停或严重心功能不全时,ECMO 的作用远远优于IABP[1]。天津市第三中心医院心脏中心自2009 年4 月至2014 年11 月,共应用ECMO 治疗危重AMI患者19 例,存活8 例,现报告如下。
1 对象与方法
1.1 研究对象
2009 年4 月至2014 年11 月,因急性ST 段抬高心肌梗死(ST-segment elevation myocardial infarction,STEMI)于天津市第三中心医院就诊,并出现心原性猝死或心原性休克[2]的患者中,实施ECMO 治疗者共19 例,男16 例,女3 例,平均年龄60. 1 岁;5 例有糖尿病史,12 例有高血压病史,4 例既往心肌梗死史,14 例有吸烟史;心原性休克9 例,心原性猝死10 例,猝死的患者一直行心外按压,直至ECMO 置入。因循环功能不稳定,这19 例患者首先置入ECMO,均采用V-A 模式,循环趋于稳定后,按照常规方法行冠状动脉造影及介入治疗。ECMO 置入距离发生心原性猝死或心原性休克的平均时间为59. 2 min。根据患者是否存活出院,分为死亡组和存活组。
1.2 方法
术前胃管内注入水溶性阿司匹林或研碎的肠溶阿司匹林片300 mg,胃管内注入硫酸氢氯吡格雷300 ~600 mg,之后按常规方法行冠状动脉造影,根据心电图表现及冠状动脉造影结果判断梗死相关血管,由术者决定治疗策略:导丝通过后,根据影像结果判断血栓负荷,若血栓负荷重,则先行血栓抽吸;否则,先行经皮冠状动脉腔内成形术(percutaneous transluminal coronary angioplasty,PTCA),根据情况置入支架,必要时行支架内后扩张;术中出现无复流时可以选择应用糖蛋白Ⅱb/Ⅲa 抑制剂,术后在冠心病监护病房(CCU)监护治疗。
1.3 资料收集
记录患者的一般情况,既往病史,本次发生循环衰竭的表现,冠状动脉病变及介入治疗情况:包括冠状动脉病变血管支数、梗死相关血管、冠状动脉病变SYNTAX 积分、介入治疗是否成功、是否进行了完全血运重建、是否IABP 辅助、ECMO 置入前的时间延误、置入地点、初始辅助流量、ECMO 辅助时间等。
1.4 统计学分析
2 结果
2.1 两组患者的一般资料比较
19 例患者在ECMO 辅助下行冠状动脉造影检查,均行介入治疗,手术成功率100%;其中死亡11例,存活8 例,存活率为42.1%。11 例死亡患者的死因均为多脏器功能衰竭,其中1 例并发脑出血,1 例为院外心脏骤停造成外伤性脑出血,1 例并发下肢缺血被迫撤除ECMO。死亡组和存活组患者的性别、年龄,既往糖尿病、高血压病、心肌梗死病史及吸烟史等比较,差异均无统计学意义(均P >0.05,表1)。
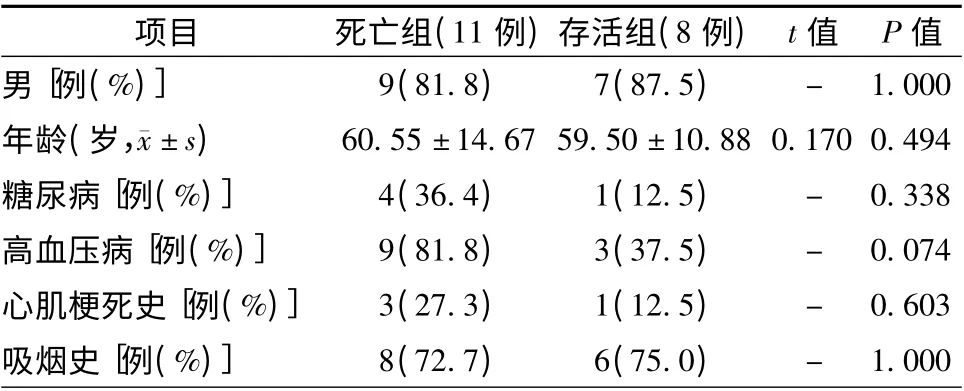
表1 两组患者的一般资料比较
2.2 两组患者冠状动脉病变介入治疗相关资料比较
两组患者的冠状动脉病变血管支数、SYNTAX 评分、介入治疗成功率、IABP 置入比例,支架置入和(或)单纯PTCA、发生心原性休克或心原性猝死至ECMO 置入时间,ECMO 初始辅助流量、ECMO 辅助时间等比较,差异均无统计学意义(均P >0.05,表2)。
2.3 两组患者梗死相关血管比较
死亡组梗死相关血管为左主干2 例,左前降支8 例,右冠状动脉1 例;存活组梗死相关血管为左主干2例,左前降支1例,左回旋支1例,右冠状动脉4 例;两组梗死相关血管分布情况比较,差异有统计学意义(P=0.047)。进一步分组分析,相对于右冠状动脉、左回旋支、左主干(即非左前降支),当梗死相关血管为左前降支时,死亡率更高[88.9%(8/9)比30.0%(3/10),P=0.020]。

表2 两组患者冠状动脉病变及介入相关资料比较
2.4 两组患者置入ECMO 的原因和地点比较
死亡组置入ECMO 原因为心原性休克6 例,心原性猝死5 例;存活组置入ECMO 原因为心原性休克3 例,心原性猝死5 例;两组比较,差异无统计学意义(P=0.650)。死亡组置入ECMO 地点为急诊室4 例,CCU 6 例,导管室1 例;存活组置入ECMO地点为急诊室4 例,CCU 3 例,导管室1 例;两组比较,差异无统计学意义(P=0.763)。
3 讨论
AMI 是严重威胁生命的疾病,在疾病的早期及时开通梗死相关血管是治疗中至关重要的一步。尽早实施介入治疗可以使STEMI 的死亡率至少下降25%以上[3]。但是,对于已经出现心原性休克的患者,此时身体内环境不稳定,酸碱失衡,紧急介入治疗的风险会更大。有研究报道,ECMO 在重症心肌炎、AMI、心原性休克等抢救治疗中有明确的疗效[1,4-5]。在临床介入治疗手术期间行V-A ECMO辅助,可以很快使患者的内环境得到改善,纠正酸中毒,为进一步的治疗赢得时间,保证了介入手术的成功率。
本研究中,19 例患者行冠状动脉造影检查,均行介入治疗[包括血栓抽吸、PTCA 和(或)支架置入术],手术成功率100%,其中8 例存活出院,存活率42.1%,提示在AMI 合并心原性休克或猝死时紧急置入ECMO 后行介入治疗是可行的,术后患者存活率也明显高于常规治疗。术后出现1 例自发性出血,1 例下肢缺血事件。虽然患者应用肝素抗凝的剂量和普通患者一样,但测出的出凝血指标却明显低凝,根据活化凝血时间(activated clotting time,ACT)下调肝素的剂量,但仍然发生了出血并发症,考虑可能与心肺复苏术后循环不好或者身体存在微血管血栓有关。下肢缺血患者开始时考虑存在血管动脉硬化(糖尿病),但由于患者的D-二聚体是升高的,最终考虑体内有微血栓形成。这提示,对此类患者的抗凝治疗还需进一步探讨。
理论上,ECMO 置入后将股静脉的血流经过转流泵和膜肺(不再经过心脏、肺)直接泵入降主动脉,保证了外周循环,所以ECMO 在减少心脏负荷、减少心脏做功的同时,也减少了心脏血流。考虑置入IABP 可能通过气囊反搏,增加冠状动脉灌注,对生存率会有一定的帮助。但本研究中未见到明显的统计学差异,原因可能有:(1)本研究中例数较少;(2)这部分患者置入IABP 时,并非是为了改善ECMO 置入后的冠状动脉灌注,而是因为患者先出现的低血压休克状态,试图应用IABP 辅助,但IABP下循环功能不能维持,有的反复心室颤动,此时,再置入ECMO 予以辅助,一定程度上影响了IABP 的效果。这方面内容还需要今后通过大样本预设终点研究来证实。
将患者按梗死相关血管是否为左前降支分组后进行分析发现,当梗死相关血管为左前降支合并心原性休克或猝死时,在ECMO 辅助下行介入治疗后,死亡率明显高于梗死相关血管为非左前降支的患者[88.9%(8/9)比30.0%(3/10),P =0.020]。这可能与左前降支闭塞后,心肌坏死面积大,对心功能影响大,容易造成心电活动不稳定而出现恶性心律失常有关。本研究中未能发现其他因素对患者存活有明显影响,可能与样本量小有关。
死亡组和存活组发生心原性休克或心原性猝死至ECMO 置入的平均时间分别为(72.64 ±18.07)min和(40.63 ±14.74)min,长时间的延误可能与术后的多脏器衰竭有关。国外也有研究提示,要特别关注ECMO 置入的时机,这对预后有很大的影响[6]。因此,若能优化术前流程,包括告知、术前准备工作,提高术前基础生命支持的质量等可能进一步改善临床预后。
综上所述,AMI 合并心原性休克或心原性猝死时,在ECMO 辅助下行介入治疗是可行的。梗死相关血管为非左前降支时生存率可能更高,提示对此类患者应实施更积极的治疗措施。其他因素对死亡率的影响还需要更多的样本量来证实。此类患者的抗凝治疗仍需要进一步探讨。若能优化流程,把握ECMO 置入时机,提高ECMO 置入前基础生命支持的质量,可能对改善预后有更大的益处。
[1]Esper SA,Bermudez C,Dueweke EJ,et al. Extracorporeal membrane oxygenation support in acute coronary syndromes complicated by cardiogenic shock. Catheter Cardiovasc Interv,2015,86:S45-50.
[2]中华医学会心血管病学分会.急性ST 段抬高型心肌梗死诊断和治疗指南. 中华心血管病杂志,2015,43:380-393.
[3]杨士伟,周玉杰. 体外膜肺氧合在成人心血管疾病中的应用.中华心血管病杂志,2009,37:766-768.
[4]袁勇,张励庭,冯力,等. 体外膜肺氧合在抢救急性心肌梗死并发心脏骤停中的应用.临床心血管病杂志,2008,24:72-73.
[5]潘绪,李田昌,汤楚中. 体外膜肺氧合用于危重经皮冠状动脉介入治疗. 中国介入心脏病学杂志,2013,21:346-349.
[6]Haile DT,Schears GJ. Optimal time for initiating extracorporeal membrane oxygenation. Semin Cardiothorac Vasc Anesth,2009,13:146-153.
——兼与亚当·斯密《道德情操论》比较

