猪群中牛病毒性腹泻病毒所致的类似猪瘟及检测方法
邱美珍,杨 俊,杜丽飞,王 慧,周望平,王红兵
(湖南省畜牧兽医研究所,湖南 长沙410131)
牛腹泻病毒(bovine viral diarrhea virus,BVDV)是黄病毒科瘟病毒属的成员,是引起牛病毒腹泻病的主要病原,能在牛肾细胞、牛睾丸细胞、牛鼻甲骨细胞等生长繁殖。根据其在细胞培养中的病变程度将其分为2 种生物型:致细胞病变型BVDV(CP 型BVDV)和非致细胞病变型BVDV(NCP 型BVDV);根据基因型可将此病毒分为Ⅰ型和Ⅱ型。其感染的动物不仅仅只限定于牛,而是发生于各种各样的偶蹄类动物如猪、绵羊、鹿等[1]。 BVDV 呈世界性分布,广泛存在于欧美等许多养牛发达国家。 1980年以来,我国从德国、丹麦、美国等十多个国家引进奶牛和种牛, 将本病带入我国, 并分离鉴定出了病毒。BVDV 的普遍存在还常影响猪瘟疫苗的质量和免疫效果,猪BVDV 感染表现出类似温和猪瘟的临床症状和剖检症状, 很难与猪瘟区分。 下面就猪BVDV 与温和猪瘟比较,危害,实验室检测方法进行综述。
1 猪牛病毒性腹泻与猪瘟比较

表1 猪牛病毒性腹泻与温和猪瘟,急性猪瘟的比较
1976年曾有报道称BVDV 经胎盘感染猪,这案例被认为是猪首次自然感染牛病毒性腹泻病毒,但据事实分析猪BVDV 可能早就存在,只是没有被发现,这可能与猪BVDV 感染无论是临床症状还是病历变化上都难以与慢性猪瘟(swine fever,SF)区分相关[1-2]。自1976 以来,猪自然感染BVDV 病例在多个国家临床得到证实,实验诱导猪、羊BVDV 病例在多个国家实验室得到了印证[3-4]。尽管一度认为牛是BVDV 唯一的自然感染宿主, 持续感染牛是BVDV 的主要传染源,但目前自然感染和持续感染同样发生在异种宿主如猪、绵羊和鹿等。
猪瘟病毒(classical swine fever virus,CSFV)、牛病毒性腹泻病病毒(BVDV)和羊边界病毒(BDV)同源性较高,抗原性上有交叉。 基因测序显示BVDV株和CSFV 株核苷酸序列同源性约66%,氨基酸同源性约85%。 尽管自然感染有明显的宿主特异性,实验感染可将猪瘟病毒感染牛,也可将BVDV 感染猪,绵羊及其他反刍动物。 最近发现BVDV 的变异株引致成年牛严重的血小板减小及出血综合征,与猪瘟病毒有相似的致病特点。 近年来,在欧美一些国家猪的BVDV 感染率很高, 一般不表现临诊症状,呈亚临诊症状。 猪感染BVDV 所致的疾病特征与猪瘟类似。 下面将猪的牛病毒性腹泻与温和猪瘟、急性猪瘟比较如表1。
2 猪群中BVDV普遍存在的危害
猪瘟病毒与牛病毒性腹泻病毒(BVDV)的抗原性和血清学密切相关,两者同源性很高,能互相诱导一定程度的同源病毒抗体。目前猪瘟疫苗主要通过细胞培养,如果细胞或培养液中存在牛病毒性腹泻病毒(BVDV)及其抗体,可与猪瘟病毒发生中和反应,造成疫苗抗体效价下降或生产失败。范仲鑫[5]等的研究表明应用RT-PCR 方法对湖南省内销售的10 个厂家48 个批次的猪瘟细胞苗进行BVDV 病毒核酸检测。 结果表明10 个厂家的猪瘟细胞苗中有5 个厂家检出BVDV 核酸阳性,48 个批次中有9批次榆出BVDV 核酸阳性,阳性率为18.75%。调查表明当前猪瘟细胞苗BVDV 污染较严重,BVDV 从而普遍存在猪场,成为传染源。 Terpstra C 等[1]有研究数据显示,从猪产后分离到BVDV 的几乎都是隐性感染猪。 根据屠宰母猪和公猪的血清学调查表明,20%的猪牛病毒性腹泻病毒抗体阳性。 其血清学阳性率在有牛存在的农场还会更高,并随着年龄的增加,无论是否有饲养牛,猪BVDV 抗体阳性率都会增加。 羊和人也能传播BVDV 给猪,多种动物的BVDV 相互传播造成猪BVDV 的普遍存在,这还可能会引起该病毒的不断循环和漂移。
猪群中BVDV 的存在还干扰疫苗的免疫效果。张慧英[6]研究从368 份猪瘟免疫血清样本中检测到BVDV 抗原,其中7 份呈阳性,阳性率1.90%。 对7份BVDV 阳性血清采用ELISA 和IHA 两种方法检测猪瘟(CSFV)抗体水平,抗体合格率偏低,两者的结果符合率为71%。结果提示BVDV 在一定程度上干扰了猪瘟疫苗的免疫效果,影响抗体水平。
3 实验室猪BVDV诊断方法的比较
根据临床症状和病理病变很难区分猪BVDV和温和猪瘟, 目前已建立了多种对BVDV 抗原、抗体及病毒组分(抗原和核酸)的检测方法,每种方法都各有其优缺点和适用性。与以RT-PCR 为代表的分子生物学检测技术相比,病毒分离鉴定、免疫荧光及血清中和试验等方法非常耗时,不利于临床快速诊断; 此外,RT-PCR 检测不受血清样品中抗体的干扰, 在样品中有高水平抗体时, 病毒分离和ELISA 检测都不可靠, 但是RT-PCR 并不受干扰,且对检测样品的储藏条件限制少,石蜡切片、沾有血液或血清样品的滤纸均可用于检测。目前实验室常采用抗原捕获ELISA、RT-PCR 和荧光RT-PCR进行检测。 郭锐等[7]以实时荧光定量PCR 方法检测牛病毒性腹泻病毒,该方法检测灵敏度比RT-PCR高10~100 倍,并且避免了常规PCR 电泳检测所带来的高污染率,该方法具有快速、灵敏、特异性、重复性好和能定量检测等优点。 季新成[8]等利用抗原捕获ELISA 试剂盒对新疆部分地区160 份牛血清进行了牛病毒性腹泻病毒抗原检测,结果有6 份样品为阳性,对该6 份血清用BVDV 阴性血清进行了系列稀释后, 分别用抗原捕获ELISA、RT-PCR 和荧光RT-PCR 进行检测, 发现RT-PCR 方法比ELISA 检测灵敏度高10~100 倍,荧光RT-PCR 比RT-PCR 灵敏度高约10~100 倍。 下面就三种检测方法做一比较见表2。
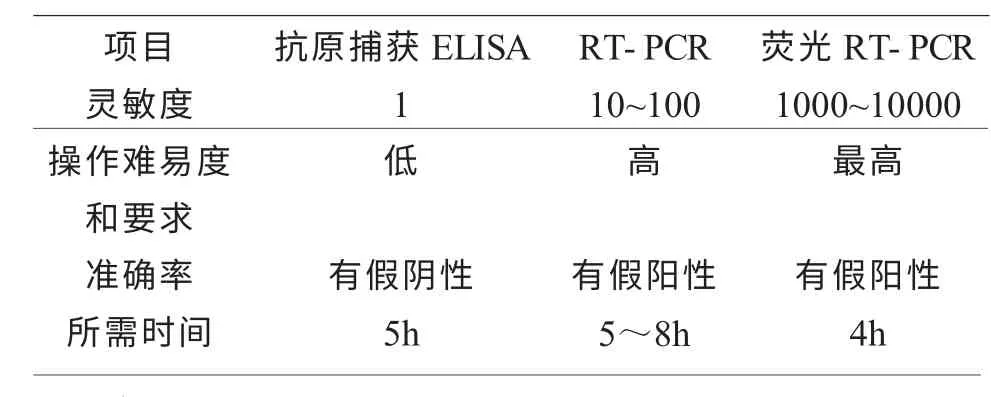
表2 猪BVDV检测方法的比较
4 展望
随着分子病毒学及其检测技术的发展,病毒的致病机理、病理和跨种属传播机制等方面的研究已成为人们关注的热点和焦点。应用分子诊断技术结合国内外猪病、牛病、羊病的日益复杂,大规模开展猪新出现疫病的收集、挖掘和整理。在病原诊断、分离、回归的基础上,从多个层次、多个角度深入、系统地开展BVDV 研究,阐明其分子机理和跨种属传播机制,结合临床指标进行预防,必将大幅度降低该疫病的危害,加快动物疫病防治的进程。
[1]Terpstra C,Wensvoort G.Natural infections of pigs with bovine viral diarrhoea virus associated with signs resembling swine fever[J].Vet Q.1997,19(3):97-101.
[2]Terpstra C,Wensvoort G.Bovine virus diarrhea virus infections in swine[J].Res Vet Sci.1988,45(2):137-42.
[3]Walz PH,Baker JC,Mullaney TP,Maes RK. Experimental inoculation of pregnant swine with type 1 bovine viral diarrhoea virus[J].Journal of Veterinary Medicine,2004,51(4):191-193.
[4]Passler T, Riddell KP, Edmondson MA,et al.Experimental infection of pregnant goats with bovine viral diarrhea virus(BVDV) 1 or 2.Vet Res. 2014,45:38.
[5]范仲鑫,张朝阳,刘道新,等,猪瘟细胞苗污染牛病毒性腹泻病毒情况调查[J].畜牧与兽医,2011,43(7):84-87.
[6]张慧英.牛病毒性腹泻病毒感染对猪瘟免疫的影响[J].四川畜牧兽医,2010,(10):28-31.
[7]郭 锐,陈 平,田永祥,等.快速检测牛病毒性腹泻病毒实时荧光定量PCR 技术建立及应用[J]. 湖北农业科学,2011,50(8):1640-1645.
[8]季新成,曾新强,员丽娟,等。 牛病毒性腹泻病毒不同检测方法的比较研究[J].中国动物检疫,2009,(7):56-60.

