经典毒株PRRSV弱毒疫苗对高致病性PRRSV的临床控制报告
祖海涛 苏良科 朱连德
(勃林格殷格翰国际贸易(上海)有限公司动物保健部,北京100010)
经典毒株PRRSV弱毒疫苗
对高致病性PRRSV的临床控制报告
祖海涛苏良科朱连德
(勃林格殷格翰国际贸易(上海)有限公司动物保健部,北京100010)
摘要:本文介绍了某确诊为HP-PRRS的规模猪场猪只的临床症状,鉴别诊断,实验室血清、分子生物学和基因测序的检测,发现发病的主要原因是HP-PRRS的感染并伴有PCV2感染。猪场通过更换疫苗和改变措施,防控效果有所改善。通过分析后发现,针对中国目前的蓝耳病毒株,“经典株”PRRS疫苗对高致病性PRRSV变异蓝耳病也具有良好的免疫保护效果。总之,在合理使用弱毒疫苗的同时,科学的猪场管理和严格的生物安全对于蓝耳病的防控也是至关重要的。
关键词:蓝耳病;发病情况;检测;防控
蓝耳病即猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome, PRRS),是目前危害全球养猪业的主要传染病之一,在全球大部分地区流行[1]。该病在我国普遍存在,特别是2006—2007年高致病性蓝耳病(HP-PRRS)暴发后,给我国养猪生产造成巨大损失[2-4]。
2007年至今,我国相继问世NVDC-JXA1株高致病性蓝耳病灭活疫苗,CH-1R株、R98株、JXA1-R株、HuN4F112株、TJMF92株等经典和高致病性蓝耳病弱毒活疫苗,以及较早的CH-1a株经典蓝耳病灭活疫苗和进口的Ingelvac PRRS MLV VR2332株减毒活疫苗,这些疫苗的推广和应用对控制和减缓疫情蔓延起到了积极的作用[5,6]。但是近年来,由于养猪场对高致病性蓝耳病病原认识不清,加之兽医人员对蓝耳病弱毒活疫苗特性了解不足,滥用疫苗现象普遍,再加上各猪场猪群的疾病背景不同,免疫程序更是千差万别,临床上暴发高致病性蓝耳病猪场病例有抬头趋势[7]。许多猪场出现过免疫HPPRRS疫苗但还是发生HP-PRRS的现象,导致很多猪场对是否要进行蓝耳病疫苗免疫处在观望或迷茫状态。
1 猪场背景
湖北某规模化商品猪场,现存栏经产母猪500头。母猪品种为长大二元,公猪品种为杜洛克,生产杜长大三元杂交商品猪。单点式饲养管理模式,自繁自养,全进全出。仔猪在21日龄断奶,断奶当天转入保育舍,70日龄从保育舍转入育肥舍。
猪场主要疫苗的免疫程序如下。
母猪:高致病性蓝耳病疫苗(TJM-F92株)普免4次/年;猪瘟高效细胞疫苗普免3次/年;伪狂犬疫苗普免4次/年;
仔猪:仔猪出生后3日龄内滴鼻伪狂犬疫苗、55日龄二免(肌肉注射);15日龄免疫高致病性蓝耳病疫苗(TJM-F92株)活疫苗和全病毒灭活圆环病毒疫苗各1头份;猪瘟高效细胞疫苗35日龄首免,65日龄二免。
猪场远离养殖高密度区,自然防疫条件较好。在蓝耳病的防控方面,后备种猪一直是定点引种,引入时采取严格隔离,生产成绩一直很好而且稳定。
2 猪场发病情况
自2014年4月开始,产房存活率下降,仔猪转入保育舍后10天左右(即在30日龄)陆续出现发病症状,主要表现为慢性消瘦、厌食、精神沉郁、打喷嚏、流鼻涕,部分猪发高烧。急性死亡猪皮肤发绀,慢性经过猪表现被毛粗乱,贫血、皮肤苍白、衰竭无力,后腿关节肿大。到55日龄进入发病高峰,猪呼吸道病症状较严重,进入圈舍明显听到育成猪咳嗽、打喷嚏;20%左右育成猪被毛长,脊椎骨突出,消瘦,死淘率可达10%,经济损失巨大。发病猪只的临床表现为体温41℃以上,腹式呼吸,采食量下降,腹泻。
在发病猪群,猪场加强了栏舍消毒、病猪隔离等生物安全措施,并在饲料和饮水中加入阿莫西林、氟苯尼考等多种抗生素和中药制剂进行治疗,但效果不佳。
病死保育猪解剖后主要以肺脏病变为主,肺脏充血、出血、肺小叶间质增宽,局灶性肺实变,肺脏肉变,肺门淋巴结水肿呈棕黄色;腹股沟淋巴结水肿,切面多汁。个别猪心包积液并有纤维渗出物,心肌表面呈“绒毛心”。
母猪群的健康一直没有受到影响,产后配种率、分娩率都维持在原来正常水平。
2014年7月猪场采集了日龄都在60左右的发病猪及健康猪的血样各10份,送正大集团实验室做抗体检测,同时采集3份病料送到华中农业大学进行病原学检查。
3 实验室检测
3.1血清抗体检测
将采集的血液样品分别进行蓝耳病抗体和猪瘟抗体的检测。
PRRSV抗体监测试剂盒使用美国爱德士(IDEXX)公司产品,生产批号为40959-V931。操作方法按照说明书进行,PRRSV抗体检测成立条件是阳性对照OD值-阴性对照OD值≥0.15;阴性对照OD值≤0.15。阳性判断标准是S/P值≥0.40;阴性判断标准是S/P值<0.40。
CSFV抗体检测试剂盒也是美国爱德士(IDEXX)公司产品,生产批号A651。操作方法按照说明书进行,CSFV抗体检测成立条件是阴性对照OD值>0.500,阳性对照的阻断率>50%。阳性判断标准是阻断率≥40%;阴性判断标准是阻断率≤30%;阻断率在30%~40%之间为可疑。
3.2分子生物学检测
猪场同时采集3份病料送往华中农业大学应用RT-PCR、PCR等方法进行高致病性和/或经典的PRRSV抗原、圆环病毒2型(PCV2)、伪狂犬病病毒(PRV)、猪瘟(CSF)的抗原检测。
3.3PRRSV的ORF5基因测序
对RT-PCR所检测到的蓝耳病毒株,扩增ORF5基因片段、测序,并与当前流行毒株和目前常用的疫苗毒株进行比对分析。
4 实验室检测结果
4.1抗体检测结果
猪瘟抗体检测结果显示:健康猪抗体阳性率为10%,平均阻断率为26%;发病猪抗体阳性率为40%,平均阻断率为32%,每头猪的阻断率见图1。
蓝耳病抗体的检测结果显示:健康猪抗体阳性率为20%,离散度为65%,S/P值为0.48;发病猪抗体阳性率为40%,离散度为72%,S/P值为1.5,其中S/P>2的30%,S/P>3的10%,见图2。

图1 CFSV抗体阻断率分析图
4.2病毒检测结果
PRRSV抗原检测的引物是根据高致病性蓝耳病病毒核酸NSP2基因进行设计,扩增的产物经过凝胶电泳后如果仅有508 bp的片段,说明只有经典毒株的PRRSV感染;如果仅有418 bp的片段,说明只有高致病性PRRSV毒株感染;如果同时能扩增出这两个片段,说明样品同时存在经典和高致病毒株。送检的3份病料都是只有418 bp左右的片段,说明高致病性PRRSV核酸呈阳性,而没有检测出经典的PRRSV(图3);圆环病毒2型的各样品的PCR产品电泳后出现496 bp的特异性条带,因此判断为阳性(图4);猪瘟抗原(图5)和伪狂犬野毒(图6)都是阴性。详细结果见表1。

图2 PRRSV抗体S/P值分析图

图3 病料的RT-PCR结果

图4 病料的圆环ORF2基因PCR检测

图5 病料的猪瘟E2基因的RT-PCR结果
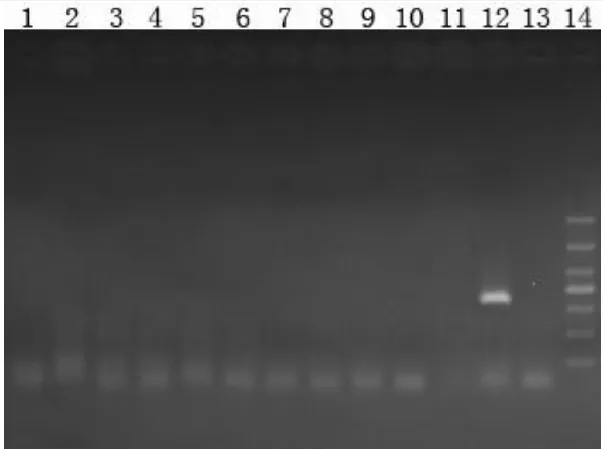
图6 病料的伪狂犬gE基因的PCR结果

表1 3份病料的抗原检测结果
样品中RT-PCR扩增出的PRRSV阳性条带的阳性毒株,扩增ORF5基因序列,并对其测序,将核酸序列在NCBI上经Blast搜索,并与当前流行毒株和目前常用的疫苗毒株进行比对分析,表明该猪场的毒株与高致病性蓝耳病疫苗毒株最为接近,与HuN4-F112株、TJM -F92株、JXA1-R株的同源性分别为98.83%、98.50%、98.17%。而与经典的PRRS疫苗株VR2332、R98株的同源性分别是88.17%和88.00%。测序结果表明猪场感染的是高致病性蓝耳病。详细结果见表2。

表2 蓝耳病病毒主要抗原基因ORF5测序同源性比较结果((%%))
5 猪场的防控措施和效果
5.1防控措施
根据猪场的临床症状和实验室的检测结果,判定该猪场发病的主要原因是HP-PRRS的感染并伴有PCV2的感染,而没有经典PRRSV、猪瘟、伪狂犬野毒的感染。但该场一直使用高致病性蓝耳(TJM-F92株)疫苗,经与猪场详细沟通后,决定从2014年8月1日开始全场使用进口经典毒株PRRSV疫苗,使用方法如下。
⑴母猪群在使用疫苗前1周,饲料中添加适当药物进行保健,主要的药物是20%替米考星1 kg/吨料+ 20%磺胺间甲氧嘧啶1 kg/吨料,在饲料中再添加适当的电解多维。
⑵母猪群首次普免进口经典毒株PRRSV疫苗时,产前一个月的母猪暂时不免,待产完仔猪后,在产房和仔猪一同免疫。
⑶母猪群首次免疫后,一个月加强免疫一次,以后4次/年。
⑷将公猪分为2个群体,分开免疫(间隔3周),免疫后的公猪,3周内不要使用其精液。
⑸现有产房中的所有14日龄及以上仔猪免疫进口经典毒株PRRSV疫苗1头份。以后出生的仔猪在14日龄免疫。
同时加强病猪的隔离淘汰、环境卫生管理工作,严格做好全进全出。
5.2防控效果
在猪场免疫经典毒株PRRSV疫苗后3个月,猪场比较了更换疫苗前后各2个月的断奶仔猪数和保育舍的存活率。更换疫苗前由于保育猪发病,6~7月的生产成绩不高,在8月初更换蓝耳病疫苗后,猪场的生产成绩有很大提升(表3)。到目前为止,猪场生产成绩一直稳定,保育猪成活率达到97%左右。

表3 猪场更换PRRSV疫苗前后生产成绩的比较
6 分析与讨论
对PRRS患病猪群进行活疫苗免疫,是有效控制PRRS危害的重要措施之一,这在全世界范围内都有大量成功的报道[8,9]。从PRRS美洲株弱毒苗的临床使用效果可以看出,免疫能够减轻临床症状,提高生产成绩,对同基因型变异株和异源毒株有保护力[10-12]。
在养猪的生产实际中,当怀疑猪群受到蓝耳病感染时,首先应尽快检测确诊,然后使用疫苗进行免疫。但养殖户在选择使用哪种疫苗或哪个厂家的蓝耳病疫苗上,往往无所适从,因为市场上既有“高致病性”蓝耳病疫苗又有“经典”蓝耳病疫苗。当前流行一种观点,即对猪场的PRRS毒株进行测序,根据测序结果来确定选择使用高致病性变异株疫苗还是使用经典毒株疫苗[6]。在PRRSV的基因组中,非结构蛋白Nsp2和结构蛋白ORF5基因由于变异大,是进行PRRSV分子流行病学研究和病毒遗传变异分析的重要的2个靶基因。当前大部分实验室对PRRSV进行基因序列相似性比对并区分所谓的“高致病性”或“经典”毒株,依靠的正是这两个基因。如果检测出的毒株在NSP2具有非连续性的30个氨基酸的缺失,便属于是“高致病性”PRRSV毒株,若相对应部位未出现缺失的就是“经典”PRRSV毒株。猪场内流行的PRRS毒株基因与PRRS疫苗毒株的基因序列相似性越高,并不一定意味着它们之间的交叉保护越好。Tanja等研究发现PRRS疫苗毒株和野毒株之间ORF5基因序列的相似性,与疫苗的交叉保护力没有直接关系[13]。如果存在PRRS的基因相似性越高保护性越好,那么理论上讲,用本猪场分离的PRRSV毒株来免疫本场猪群,效果应当是最好的。但是美国Daniel等试验发现,使用本场的PRRSV毒株(LVI)给本场的猪群进行免疫驯化,虽然猪群PRRSV转阴的时间要比使用商品化的PRRS MLV疫苗快,但是使用PRRS疫苗的经济效益要好于本场PRRSV(LVI)的免疫[14]。
本文所报道的猪场,病料中扩增出的PRRSV ORF5基因核苷酸序列与我国分离的高致病性毒株HuN4-F112株、TJM-F92株和JX A1-R株的同源性都在98%以上。在发病之前一直使用的是高致病性的蓝耳病疫苗TJM-F92株,但还是在保育猪群中发生高致病性蓝耳病,可见即便使用同基因型的蓝耳病疫苗,也不能做到对猪群的全部保护,其原因在于PRRS的防控非常复杂,疫苗只是控制蓝耳病的措施之一,需要的是综合防控。该猪场虽然自然防疫条件较好,也非常注重蓝耳病的控制,定点引种并在引入时进行隔离,但还是发生了蓝耳病,而且历经3、4个月都没有得到理想的控制。分析发病的原因主要有两方面:其一还是引种出了问题,因为在发病的前2个月(即2014年2月)猪场引进了一批后备母猪,这批后备母猪引入时临床表现很健康,因条件限制引种时并没有对这些后备猪进行检测,它们可能带毒或处于排毒期。其二是猪场虽然自繁自养,全进全出,但因为场地限制一直使用的是单点式饲养管理模式,所以发生蓝耳病时无法切断病毒在场内的反复循环感染,导致猪场发病的持续时间较长。
本文报告的猪场在受到高致病性蓝耳病病毒感染后,应用进口经典毒株PRRSV疫苗有效控制了猪场高致病性蓝耳病的野毒攻击,降低了保育阶段的损失,显著改善了生产成绩。由此案例可看出,“经典株”PRRS疫苗对高致病性PRRSV变异蓝耳病,也具有良好的免疫保护效果。“高致病性”PRRSV毒株的特征是在PRRSV的NSP2基因存在30个氨基酸缺失,缺失的基因在整个PRRSV基因序列的占比不到0.6%,其本质还是北美株PRRSV,可以使用所有的北美株PRRS疫苗。国内外多个试验也证明IngelvacPRRS MLV疫苗对多种常见异源PRRSV都是有效的[15-17]。因此当猪场发生检测测序为“高致病性”PRRSV时既可以使用“经典株”PRRS疫苗,也可以使用安全稳定的“高致病性”PRRS疫苗。另外,此案例说明管理在蓝耳病的控制上也起到重要作用。因为猪场从2014 年4月发病开始一直到同年10月,都没有再引进后备猪,这在蓝耳病的控制策略上相当于是对该猪场进行了封群。在8月开始对全场母猪
中国目前流行的蓝耳病毒株,无论是经典的美洲型PRRSV,还是“高热病”的变异PRRSV,都属于PRRSV美洲型。进口猪蓝耳病活疫苗能够对不同毒株和同种毒株的攻毒提供交叉保护。但蓝耳病的防控非常复杂,合理的使用弱毒疫苗,科学的猪场管理和严格的生物安全依然很重要[9,18]。
参考文献
[1]斯特劳,阿莱尔,蒙加林,等.猪病学[M].赵德明,张仲秋,沈建忠译.第8版.北京:中国农业大学出版社, 2000:214-216.
[2] Tong GZ, Zhou YJ, Hao XF, et a1. Highly virulent porcine reproductive and respiratory syndrome virus emerged in China [J]. Transboundary and Emerging Diseases, 2008, 55(3-4): 52-164.
[3]文利新,丁小波,罗维.猪高致病性蓝耳病的发病特点及其防治技术[J].湖南农业科学, 2008(4):153-154.
[4] Li YF, Wang XL, Bo KT, et al. E-mergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China [J]. Veterinary Journal, 2007, 174 (3): 577-584.
[5]周波,苏小齐.商品化蓝耳病疫苗的市场概况[J].猪病防控, 2013(8):50-52.
[6]夏伟,袁远,张宇辉.高致病性蓝耳病临床案例分析与防治策略[J].养猪, 2014 (4): 89-91.
[7]杨汉春.中国猪繁殖与呼吸综合征的过去、现在和未来[R].北京: 2013国际猪繁殖与呼吸综合征学术研讨会, 2013.
[8]朱汉守.蓝耳病的最新研究进展及其启示[J].今日养猪业, 2009(6):28-30.
[9]朱连德,王爱国,王冬.进口猪蓝耳病活疫苗在中国猪场免疫预防效果研究[J].猪业科学, 2010(6):83-85.
[10]吴良波,方树河,朱连德.在中国武汉用PRRS改良活疫苗大规模接种商品化猪群以抵抗PRRS感染的功效[C].亚洲猪病学会第3届学术会议论文集:中文版, 2007:82-83.
[11] Yao JC, Wei GQ, Fang SH,等.在中国福建用PRRS改良活疫苗大规模接种商品化猪群以抵抗PRRS感染的功效[C].亚洲猪病学会第3届学术会议论文集:中文版, 2007:84.
[12]姚龙涛.对部分新出现和再出现的重要猪病的一些认识[J].今日养猪业, 2004 (3):17-20.
[13] Tanja, Francisco JP, Dachrit N, et al. Genomic homology of ORF 5 gene sequence between modified live vaccine virus and porcine reproductive and respiratory syndrome virus challenge isolates is not predictive of vaccine efficacy [J]. Journal of Swine Health and Production, 2005, 13(5):246-253.
[14] Daniel L, Montserrat T, Robert M. What have we learned using load close expose to produce PRRSv-negative pigs from positive breeding herds? [C]. Leman Swine Conference, 2013:57-58.
[15] Patterson A, Victoria J, Jordan D, et al. Modified live PRRSV vaccination is efficacious following challenge with eight genetically diverse PRRSV isolates [C]. Leman Swine Conference, 2013:194.
[16] Zuzhang W, Jianwu Zh, Jinshan Zh, et al. Immunization of pigs with a type 2 modified live PRRSV vaccine prevents the development of a deadly long lasting hyperpyrexia in a challenge study with highly pathogenic PRRSV JX143 [J]. Vaccine, 2013(31): 2062-2066.
[17] Lager KM, Schlink SN, Brockmeier SL, et al. Efficacy of Type 2 PRRSV vaccine against Chinese and Vietnamese HP-PRRSV challenge in pigs[J]. Vaccine, 2014, 32(48):6457-6462.
[18]童光志.聚焦亚洲峰会透析中国猪病——亚洲猪病学会第3届学术会议专访[J].规模e猪, 2007(5):4-5.
中图分类号:S852.65
文献标识码:B
文章编号:1673-4645(2015)04-0028-06
收稿日期:2015-01-21

