川芎嗪注射液联合化疗对晚期肝癌患者 IL-1、IL-4及TGF-β的影响
徐嫣苓,李卓栋,唐凤艳,田义洲,陈文斌
(1.舟山医院 检验科,浙江 舟山 316000;2.舟山医院中医骨伤院区 肝胆科,浙江 舟山 316000;3.浙江省第一医院 肛肠外科,浙江 杭州 310003)
川芎嗪注射液联合化疗对晚期肝癌患者 IL-1、IL-4及TGF-β的影响
徐嫣苓1Δ,李卓栋1,唐凤艳1,田义洲2,陈文斌3
(1.舟山医院 检验科,浙江 舟山 316000;2.舟山医院中医骨伤院区 肝胆科,浙江 舟山 316000;3.浙江省第一医院 肛肠外科,浙江 杭州 310003)
目的 观察研究川芎嗪注射液联合化疗对晚期肝癌患者常见免疫指标的影响。方法 选取2013年1月~2015年1月舟山医院肝胆科收诊疗的肝癌晚期患者80例,按随机数字表法分为观察组及对照组各40例,对照组患者仅给予化疗常规治疗,观察组在对照组常规治疗基础上加用川芎嗪注射液治疗,记录并分析治疗前后2组患者白细胞介素-1(interleukin-1,IL-1)、IL-4及转化生长因子-β(transforming growth factor beta,TGF-β)变化。结果 治疗前2组患者IL-1、IL-4、TGF-β水平差异无统计学意义,治疗后观察组患者IL-1、IL-4、TGF-β水平显著低于对照组[分别为(41.4±11.8)vs (76.0±12.2)ng/L、(118.5±39.9)vs(223.0±47.3)ng/L、(6.7±3.2)vs(11.7±2.6)ng/mL,均P<0.05]。结论 川芎嗪注射液联合化疗在改善晚期肝癌相关免疫学指标上效果肯定、确切,未明显增加患者副作用。
川芎嗪注射液;肝癌晚期;联合化疗;免疫学指标
肝癌即肝脏恶性肿瘤,该疾病在我国发病率及致死率均较高,属高发高危恶性肿瘤[1]。肝癌早期症状不明显,甚至多数患者无明显临床症状,因此大部分患者确诊时已属晚期[2]。晚期肝癌已失去手术切除机会,治疗主要集中在放化疗领域,而介入局部化疗为晚期肝癌的首选治疗方案,但晚肝癌患者血管介入栓塞化疗受到多重因素的影响,且副作用十分明显[3]。中医疗法对多种晚期癌症具有一定疗效,且中药治疗副作用较小,可以作为晚期肝癌的一个辅助治疗方案[4]。文献报道[5]川芎嗪对肝癌患者有一定治疗作用,在本次研究中采用川芎嗪注射联合化疗对晚期肝癌患者进行治疗,并观察患者白细胞介素-1(interleukin-1,IL-1)、IL-4及转化生长因子-β(transforming growth factor beta,TGF-β)变化状况,现报道如下。
1 资料与方法
1.1 一般资料 选取2013年1月~2015年1月舟山医院肝胆科收治的诊断为肝癌晚期的患者80例,按随机数字表法(1:1)分为观察组及对照组各40例。观察组:男性27例,女性13例,年龄49~65岁,平均(56.8±4.4)岁。对照组:男性28例,女性12例,年龄48~66岁,平均(56.1±4.5)岁。2组患者性别、年龄等基线资料差异无统计学意义。诊断标准:参考2011版《原发性肝癌诊疗规范》[6]诊断为晚期肝癌。纳入标准:①西医诊断为晚期肝癌;②卡氏评分(KPS)≥60分以上;③签署治疗知情同意书且配合治疗。排除标准:①不符合诊断者;②最近1月内有放疗、介入、化疗或手术史者;③合并有心、肾功能不全等严重疾病;④合并精神疾病者。本次研究患者均签署知情同意书并经舟山医院伦理委员会批准。
1.2 方法
1.2.1 分类与治疗:2组患者均给予基础对症治疗。对照组行介入化疗,经股动脉穿刺插管于肝固有动脉或肝右、左动脉支给予灌注化疗丝裂霉素(浙江海正药业股份有限公司,国药准字H33020786)+卡铂(齐鲁制药有限公司,国药准字H10920028)+吡柔比星(深圳万乐药业有限公司,国药准字H10930105),4周后重复1次,共化疗2次。观察组患者在对照组的基础上应用川芎嗪注射液(国药准字H20059447,2 mL:40 mg),每次40 mg,1次/天,10 d为1个疗程,疗程之间间隔3 d,共3个疗程。
1.2.2 实验室检查:分别于治疗前后采集患者静脉血,血清IL-1、IL-4、血浆转化生长因子-β(transforming growth factor beta,TGF-β)浓度采用酶联免疫法检测(仪器采用瑞士罗氏公司生产的E170全自动免疫分析仪,试剂盒均由上海真奥生物公司提供。

2 结果
2.1 2组患者治疗前后IL-1、IL-4浓度变化分析 治疗前2组患者IL-1、IL-4水平差异无统计学意义,治疗后观察组患者IL-1、IL-4水平显著低于对照组(P<0.05)。见表1。


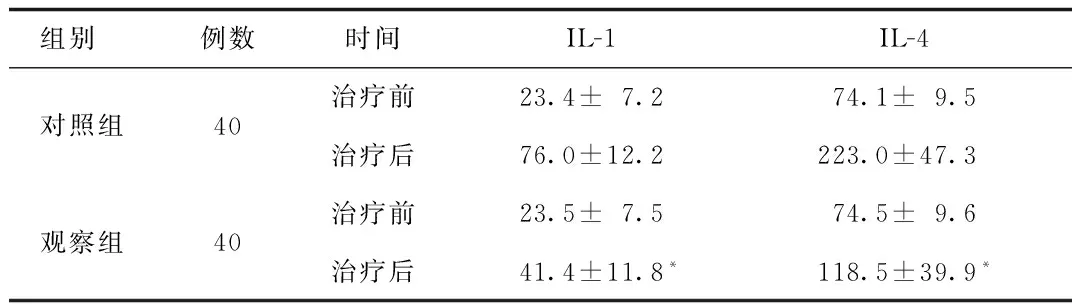
组别 例数时间IL-1IL-4对照组40治疗前23.4±7.274.1±9.5治疗后76.0±12.2223.0±47.3观察组40治疗前23.5±7.574.5±9.6治疗后41.4±11.8*118.5±39.9*
*P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.2 2组患者治疗前后TGF-β浓度变化分析 治疗前2组患者TGF-β水平差异无统计学意义,治疗后观察组患者TGF-β水平显著低于对照组(P<0.05)。见表2。

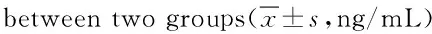

组别 例数时间TGF-β对照组40治疗前4.5±1.1治疗后11.7±2.6观察组40治疗前4.6±1.0治疗后6.7±3.2*
*P<0.05,与对照组治疗后比较,compared with control group post-treatment
3 讨论
原发性肝癌是临床多发恶性肿瘤之一,其发病率及死亡率均居高不下。在我国,原发性肝癌的最主要病因为慢性乙型肝炎后肝硬化[7]。目前原发性肝癌的治疗手段主要分为三大类[8]:手术治疗、化疗及放疗,然而整体治疗效果不佳。近年来,炎症与肝癌的关系逐渐成为研究热点。炎症反应是机体的一种防御性反应,针对组织损伤,通过调节机体内环境多种炎症因子的相互作用,影响机体内环境平衡。然而,某些情况下因持续刺激的作用可导致机体炎症过度反应,这些过度炎症反应在原发性肝癌的发生发展中扮演着重要的角色[9]。目前对炎症与肝癌的具体关系尚未完全清楚阐明,但肝癌相关性炎症也因此可以看作是肝癌发生发展的一个影响因素。文献报道[10],肝癌患者血清中 IL-1、IL-4及TGF-β明显升高,在肝癌的治疗过程中检测IL-1、IL-4及TGF-β含量将有助于疗效判断。
因肝癌早期症状不典型或无明显临床症状,导致大部分患者确诊时已属晚期,此时患者已失去手术切除机会。晚期肝癌患者介入局部化疗为晚期肝癌的首选治疗方案,但晚期肝癌患者血管介入栓塞化疗副作用十分明显。而中医可以发挥调理优势,能够较好地辅助晚期肝癌患者的化疗。川芎嗪为近年研究较多的能够对肿瘤细胞起到一定抑制作用的中药制剂,该中药的有效成分为川芎生物碱[11]。现代药理研究[12]表明,该药物能够抑制血管内皮细胞生长增殖、诱导血管内皮细胞、肿瘤细胞凋亡,还能够抑制肿瘤细胞血管内皮生长因子表达,从多个方面发挥抗癌作用。
本文结果发现,观察组患者使用川芎嗪治疗后血液中炎症因子指标IL-1、IL-4、TGF-β均显著低于西药对照组(P<0.05),这提示川芎嗪抗肝癌引起的炎症反应的效果是显著的。在实际治疗过程中发现患者在接受化疗时合用川芎嗪注射液并未加重患者药物副作用,这提示对晚期肝癌化疗患者应用川芎嗪注射液具有较高的安全性。但本研究仅观察川芎嗪注射液对晚期肝癌化疗患者的近期治疗作用,其远期疗效仍有待进一步研究。
综上所述,对晚期肝癌化疗患者规律应用川芎嗪,改善患者放射治疗后的机体免疫状态,有利于患者术后的恢复,值得临床进一步研究和应用。
[1] 王志伟,刘志平.肝脏肿瘤外科治疗的研究与进展[J].肝胆外科杂志,2011,19(1):112.
[2] 刘允怡,赖俊雄,梁惠棠.全身免疫化疗治疗肝癌的效果[J].中国普外基础与临床杂志,2006,13(2):129-131.
[3] 黄优华,徐强,沈涛,等.肝动脉化疗栓塞联合射频消融治疗中晚期肝癌的疗效评价[J].海南医学,2014,24(24):3630-3632.
[4] 章巧琪,万冬桂.晚期癌症常见症状的中医药治疗[J].中国全科医学:医生读者版,2011,17(6):46-47.
[5] 徐世英,曾敬怀,蒋英蓝,等.川芎嗪联合化疗治疗中晚期肝癌的疗效及对患者BDNF水平的影响研究[J].中国生化药物杂志,2015,9(33):133-135..
[6] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肝胆病杂志,2011,13(11):1141-1159.
[7] 陈萍,李江,苏菲,等.乙型肝炎肝硬化并发原发性肝癌的危险因素评估[J].安徽医科大学学报,2012,47(10):1218-1221.
[8] 刘楠,王小虎.放射治疗在原发性肝癌中的应用[J].中国医学创新,2011,8(26):181-182.
[9] 乔欣,李华.Hippo信号通路与肿瘤、炎症关系的研究进展[J].器官移植,2014,11(6):389-391.
[10] 沈国定,姜润秋,孙倍成.炎症相关因子IL-1β,TGF-β及MCP-1在肝细胞肝癌的表达[J].江苏医药,2011,9(7):797-799.
[11] 谈博,张奉学,刘妮,等.川芎嗪和苦参碱对HSC-T6细胞增殖的抑制作用[J].热带医学杂志,2004,7(6):678-681.
[12] 侯常,潘雪珂,陈朝,等.川芎嗪对人宫颈癌HeLa细胞增殖的影响及其分子机制[J].新医学,2013,44(1):61-64.
(编校:王俨俨)
Effect of ligustrazine injection combined with chemotherapy on IL-1, IL-4 and TGF-β in patients with advanced hepatocellular carcinoma
XU Yan-ling1Δ, LI Zhuo-dong1, TANG Feng-yan1, Tian Yi-zhou2, CHEN Wen-bin3
(1. Clinical Laboratory, Zhou Shan Hospital, Zhoushan 316000, China; 2. Department of Hepatology, Orthopedics and Traumatology Branch of TCM in Zhoushan Hospital, Zhoushan 316000, China; 3.Department of AnoRectal Surgery, The First Hosptal of Zhejiang Province, Hangzhou 310003, China)
ObjectiveTo observe the effect of ligustrazine injection combined with chemotherapy on common immunological parameters in patients with advanced hepatocellular carcinoma.MethodsEighty cases diagnosed with advanced hepatocellular carcinoma from January 2013 to January 2015 in the hospital were randomly divided into observation group and control group, 40 patients in each group. The control group received only conventional treatment of chemotherapy and observation group received ligustrazine injection on the basis of control group. The levels of interleukin-1 (IL-1), IL-4 and transforming growth factor beta (TGF-β) wwere compared based on the record between two groups pre-and post-treatment.ResultsThere were no significant differences between two groups in IL-1,IL-4 and TGF-β levels pre-treatment. After treatment, the IL-1, IL-4 and TGF-β levels in observation group were lower than those in control group [(41.4±11.8)vs (76.0±12.2)ng/L,(118.5±39.9)vs(223.0±47.3)ng/L,(6.7±3.2)vs(11.7±2.6)ng/mL, respectively, allP<0.05].ConclusionLigustrazine injection combined with chemotherapy has an exact effect on improving the immunological parameters associated with advanced hepatocellular carcinoma without significantly increasing side effects, it is worthy of further research and application.
ligustrazine injection; advanced hepatocellular carcinomar; combined chemotherapy; immunological parameters
国家自然科学基金青年科学基金(30600596)
徐嫣苓,通信作者,女,本科,主治医师,研究方向:生物化学,E-mail:xuy689@sina.com。
R735.7
A
1005-1678(2015)12-0153-03

