胸腺肽对哮喘大鼠的调节及机制的研究
闫超,许珂玉
(辽宁医学院 生物化学与分子生物学教研室,辽宁 锦州 121000)
胸腺肽对哮喘大鼠的调节及机制的研究
闫超,许珂玉Δ
(辽宁医学院 生物化学与分子生物学教研室,辽宁 锦州 121000)
目的 观察胸腺肽对哮喘大鼠Th1/Th2的调节作用,研究胸腺肽对T-bet和GATA-3表达的影响。方法 将60只SPF级6~8周龄的雄性大鼠分为正常组、哮喘组、地塞米松组(0.5 mg/kg)、胸腺肽高剂量组(5 mg/kg)、胸腺肽中剂量组(2.5 mg/kg)、胸腺肽低剂量组(1.25 mg/kg)。用卵清蛋白致敏法建立大鼠哮喘模型。正常组及哮喘组腹腔注射生理盐水,其他组注射相应药物。用酶联免疫吸附试验(ELISA)法检测各组大鼠血清中IL-4、IFN-γ的含量。免疫组化法检测各组的肺组织中GATA-3和T-bet因子蛋白表达情况。结果 哮喘组血清中IL-4含量比其他组浓度均高(P<0.05),哮喘组血清中IFN-γ含量比其他组浓度均低(P<0.05)。哮喘组GATA-3蛋白的表达比其他组浓度均高(P<0.05)。各组中T-bet的表达,哮喘组Fbet的表达比其他组浓度均低(P<0.05)。结论 胸腺肽通过上调T-bet和下调GATA-3实现上调IFN-γ和抑制IL-4的调节,对哮喘大鼠有治疗作用。
支气管哮喘;胸腺肽;GATA-3;T-bet
支气管哮喘是一种以T淋巴细胞、肥大细胞、嗜酸性粒细胞浸润,以气道炎症、气道可逆性阻塞和高反应性为主要病理特征,由一系列炎性介质和细胞因子参与的变态反应性慢性疾病[1]。近年来研究发现,Th1/Th2细胞在数量和功能方面失衡,将会导致哮喘疾病的发生,并且发现GATA-3和T-bet作为Th0的上游直接转录因子,参与并调控着它向Th1和Th2的分化[2]。含有转录因子特征的GATA-3,只表达在Th2细胞中,促进Th2细胞因子的表达。GATA-3含有锌指结构域,对Th0细胞分化成Th2细胞具有促进作用,并且对Th0细胞分化成Th1细胞具有抑制作用。含有Th1细胞特异性转录因子特征的T- bet蛋白,只在Th1细胞中表达,对Th0细胞分化成Th1细胞具有促进作用,对GATA-3基因表达具有抑制作用,所以也对Th2因子的合成具有抑制的作用[3]。所以在Th1/Th2免疫调节机制中,GATA-3和T-bet处于核心地位。胸腺分泌的多肽混合物胸腺肽,具有生物活性,并且具有调节和增强人体免疫的作用[4]。胸腺肽能够调节和控制T淋巴细胞的分化、成熟及其功能的表达,从而调节Thl/Th2平衡[5]。临床上使用胸腺肽治疗哮喘已有较显著的疗效,但是具体的治疗机制尚不明确[6]。据此,本研究以卵清蛋白致敏大鼠建立哮喘模型,以探讨胸腺肽治疗哮喘的分子机制,为胸腺肽治疗哮喘的机制提供实验性的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:60只6-8周龄SPF级健康雄性大鼠,体质量180~220 g,购于辽宁医学院实验动物中心,饲养于辽宁医学院实验动物中心SPF级实验室,饲养温度25 ℃,相对湿度70%,昼夜照明12 h/12 h。
1.1.2 主要试剂及仪器:鸡卵白蛋白购自美国Sigma公司,灭活百日咳杆菌菌苗,α-SMA免疫组化试剂盒购自北京鼎国昌盛生物技术有限责任公司,地塞米松注射液购自上海通用药业股份有限公司,兔抗大鼠T-bet单克隆抗体,兔抗大鼠GATA-3单克隆抗体,辣根过氧化酶(HRP)标记山羊抗兔IgG购自SantaCruz,ELISA试剂盒购自深圳晶美生物工程进口分装产品,雾化器购自北京中西远大科技有限公司,呼吸流量换能器购自北京新航兴业科贸有限公司。
1.2 方法
1.2.1 哮喘大鼠模型的建立:按照随机数字表将60只大鼠分为6组,每组10只。即:A组:正常组,B组:哮喘组,C组:地塞米松治疗组,D组:胸腺肽低剂量治疗组,E组:胸腺肽中剂量治疗组,F组:胸腺肽高剂量治疗组。适应性饲养于辽宁医学院实验中心1周后,B、C、D、E、F组大鼠在第一天和第八天每只腹腔注射1 mL抗原液(含卵蛋白100 mg,灭活百日咳杆菌5×109个和氢氧化铝100 mg)致敏,两周后给予大鼠每天雾化吸入5%卵蛋白持续30分钟,连续14天;B组在每次雾化吸入前半小时给予每只大鼠腹腔注射生理盐水1 mL;C组在每次雾化吸入前半小时予每只大鼠腹腔注射0.5 mg/kg地塞米松;D组在每次雾化吸入前半小时给予每只大鼠腹腔注射1.25 mg/kg胸腺肽;E组在每次雾化吸入前半小时给予每只大鼠腹腔注射2.5 mg/kg胸腺肽;F组在每次雾化吸入前半小时给予每只大鼠腹腔注射5 mg/kg胸腺肽。A组为正常对照组,用生理盐水代替卵蛋白致敏和激发大鼠。
1.2.2 肺通气功能:末次给药24 h后进行指标测定,测定各组大鼠的潮气量、呼吸频率,计算每分钟通气量。
1.2.3 ELISA测量IL-4、IFN-γ的表达:末次给药24 h后取大鼠外周血2~4 mL,离心后取血清然后按照ELISA试剂盒的步骤操作,等密封装平衡至室温,从中取出所需的板条,其余密封放回4 ℃。加样:分别将100 μL不同浓度的待测液加入相应孔中,然后用封板膜封住反应孔,空白孔除外。温育:37 ℃共同温育30分钟,洗板4次。,然后除空白孔外,每孔加入100 μL检测剂工作液。封住板孔,室温(20~25 ℃)孵育60分钟后洗板4次。显色:每孔加入一滴显色剂A和一滴显色剂B,室温避光显色20分钟。终止:每孔加入一滴终止液混匀。测定:以空白孔调零,450 nm波长测量OD450值,测定应在加终止液后10分钟以内进行。
1.2.4 免疫组化法测量肺组织中GATA-3和T-bet的表达:石蜡组织切片常规脱蜡至水,按顺序浸入100%二甲苯Ⅰ和二甲苯Ⅱ中各10 min,无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、90%乙醇、80%乙醇、蒸馏水中各1次,每次5 min;灭活内源性过氧化酶:用新配置的3%H2O2,室温孵育15 min,然后双蒸水水洗3次,每次5 min;抗原修复:采用高压修复抗原方法,待修复液中的切片自然冷却至室温后,PBS洗3次,每次5 min;封闭:用10%的正常山羊血清封闭,室温孵育30 min;抗原抗体反应:滴加适当比例的一抗,4 ℃湿盒内孵育20 h,然后滴加二抗,37 ℃条件下孵育30 min,PBS洗3次,每次5 min;滴加辣根酶标记链霉菌卵白素工作液,37 ℃条件下孵育30 min,PBS洗3次,每次5 min;DAB显色,梯度酒精、二甲苯脱水并透明,然后中性树胶封片,最后显微镜观察并拍照。使用医学图像分析管理系统进行免疫组化的半定量,最后计算求得染色指数。

2 结果
2.1 卵清蛋白激发后各组大鼠的体征 出现动作烦躁不安、直立呼吸且呼吸比较急促,连续激发后体重减轻,经胸腺肽和地塞米松治疗后上述症状明显减轻。
2.2 肺通气功能指标 哮喘模型组潮气量和肺通气量低于正常对照组,呼吸频率高于正常对照组,差异显著(P<0.05),说明造模成功。哮喘组呼吸频率均高于胸腺肽各剂量组和地塞米松组(P<0.05)。哮喘组潮气量低于胸腺肽高、中剂量组和地塞米松组(P<0.05),并且胸腺肽高剂量组和地塞米松组潮气量较高。胸腺肽高、中剂量组和地塞米松组肺每分钟通气量与正常组接近,并且高于哮喘模型组(P<0.05),见表1。
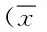
表1 各组大鼠的肺通气功能比较±s)Tab.1 Comparison of pulmonary ventilation function in rats of each ±s)
*P<0.05,与正常组比较,compared with the normal group;#P<0.05,与哮喘组比较,compared with asthma group,ΔP<0.05,与地塞米松组比较,compared with dexamethasone group
2.3 血清中IL-4和IFN-γ的含量 哮喘组外周血血清中IL-4的浓度明显高于正常对照组、地塞米松组和胸腺肽高、中剂量组,差异显著(P<0.05)。正常对照组、地塞米松组和胸腺肽高、中剂量组之间相比差异无统计学意义。哮喘组外周血血清中IFN-γ的浓度明显低于正常对照组、地塞米松组和胸腺肽高、中剂量组,差异显著(P<0.05)。正常对照组、地塞米松组和胸腺肽高、中剂量组之间相比差异无统计学意义,见表2。

表2 各组大鼠血清IFN-γ、IL-4的浓度
*P<0.05,与正常组比较,compared with the normal group;#P<0.05,与哮喘组比较,compared with asthma group,ΔP<0.05,与地塞米松组比较,compared with dexamethasone group
2.4 肺组织中GATA-3和T-bet的表达 免疫组化染色结果可以看出阳性结果为棕色颗粒,阴性结果为蓝色颗粒。哮喘组与对照组比较GATA-3的表达明显增高,被染成一周的棕色颗粒,经胸腺肽和地塞米松治疗后治疗后阳性颗粒明显减少,说明GATA-3的表达降低。哮喘组T-bet的表达明显低于对照组,经胸腺肽和地塞米松治疗后治疗后均能明显上调T-bet的表达,阳性颗粒明显增多(见图1、3)。半定量法统计目标蛋白的表达量(染色指数)见图2和图4。哮喘组和胸腺肽低剂量组GATA-3表达水平明显高于正常组(P<0.05),地塞米松组和胸腺肽高、中剂量组明显低于哮喘组(P<0.05)。各组T-bet表达水平,哮喘组和胸腺肽低剂量组明显低于正常组(P<0.05),地塞米松组和胸腺肽高、中剂量组明显高于哮喘组(P<0.05)。

图1 各组大鼠肺组织中GATA-3蛋白表达情况Fig.1 Expression of GATA-3 protein in lung tissue of rats in each group

图2 各组大鼠肺组织中GATA-3蛋白表达量比较±s)Fig.2 Tab.2 Comparison of IL-4, IFN-γ in rats of each group
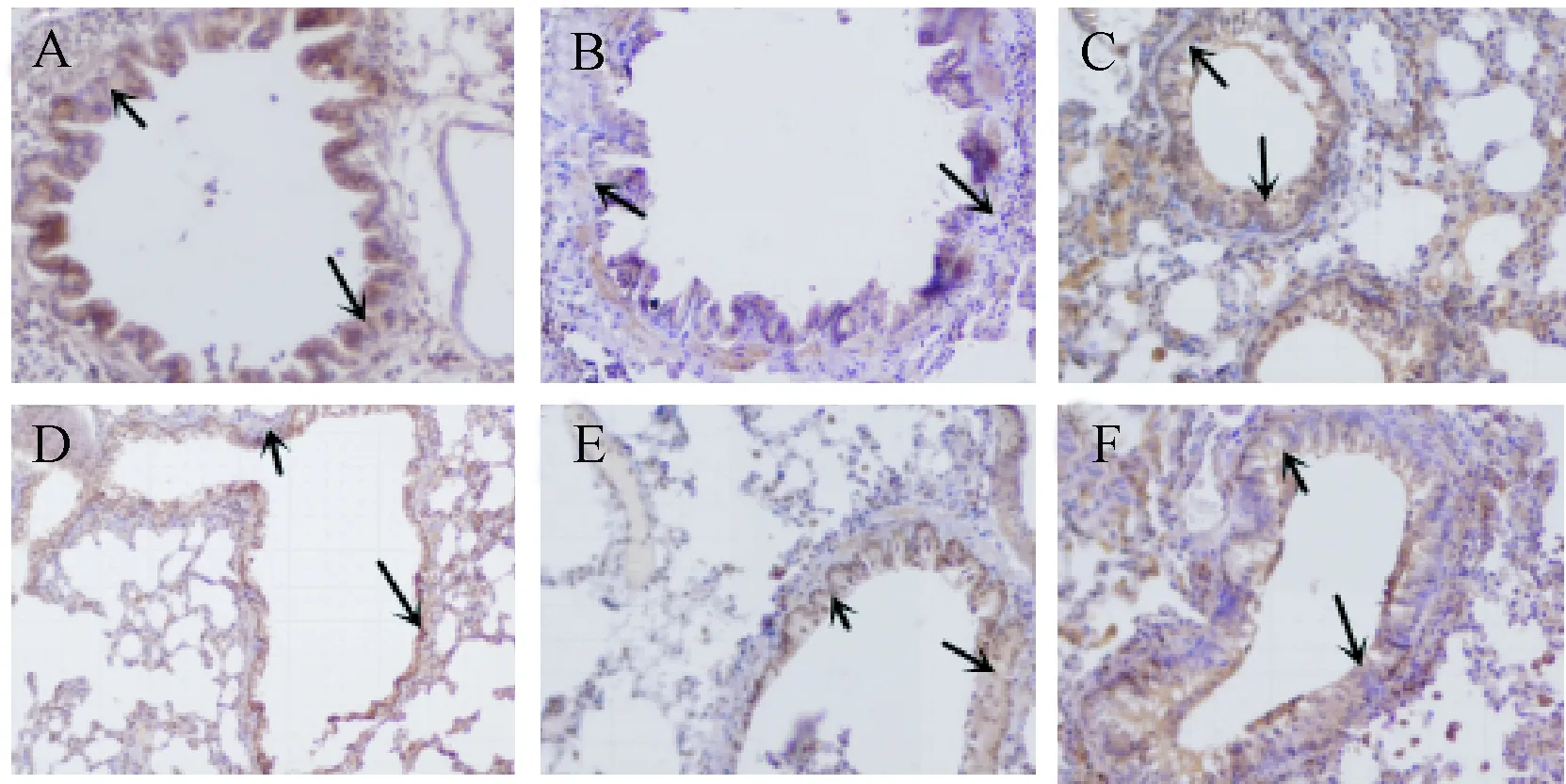
图3 各组大鼠肺组织中T-bet蛋白表达情况Fig.3 Expression of T-bet protein in lung tissue of rats in each group

图4 各组大鼠肺组织中T-bet蛋白表达量比较(n=10)Fig.4 Expression of T-bet protein in lung tissue of rats in each group(n=10)
3 讨论
哮喘属于Ⅰ型变态反应性疾病,在特定的细胞因子环境下,变态原经相应递呈细胞呈给CD4+细胞,CD4+细胞向Th2细胞过度增殖,而在哮喘炎症发生发展的过程中起着关键作用的是过量活化的Th2细胞[7]。当Th2细胞大量增殖,Th1/Th2就会失衡,而哮喘发病的关键环节是Th1/Th2失衡,并且这个比例贯穿于哮喘的各个阶段[8]。因此,药物干预治疗的首选靶点是调节Th1/Th2平衡,对治疗哮喘具有重要意义[9]。IFN-γ是Th1细胞分泌的主要细胞因子,对哮喘具有保护作用[10]。IL-4是Th2细胞分泌的主要细胞因子,对哮喘具有伤害作用[11]。IFN-γ/IL-4比例变化可以反映Th1/Th2比例变化,生理状态下二者互相制约达到动态平衡,但是一旦平衡被打破将会导致疾病的发生[12]。本实验研究结果表明胸腺肽治疗组与哮喘组比较明显改善(P<0.05),ELISA结果显示胸腺肽能够调节血清IL-4与IFN-γ的比例,具有调节Th1/Th2失衡的作用。
体内外大量实验研究表明GATA-3和T-bet是控制Th1和Th2分化的关键性转录因子,在Th1/Th2的转换中起着调节作用[13]。免疫组化结果显示,胸腺肽能胸腺肽在抑制GATA-3的表达,上调T-bet的表达。
胸腺肽能够调节和控制T淋巴细胞的分化、成熟及其功能的表达,调节Thl/Th2平衡[14]。糖皮质激素被公认为最有效的消除气道炎症的药物,但糖皮质激素多用于哮喘的终末阶段、慢性气道炎症,且其全身用药副作用较大,即使是吸入激素长期使用后,亦可产生对下丘脑—垂体—肾上腺轴的抑制作用,并可以抑制生长激素的分泌,影响儿童的生长发育[15]。近年来,随着对哮喘发病机制和病理生理认识的不断深入,治疗的目标亦更趋于哮喘发病的起始阶段。本实验试图探讨胸腺肽治疗机制,通过实验研究发现,经过胸腺肽治疗的哮喘,GATA-3和IL-4的表达降低(P<0.05),而T-bet和IFN-γ的表达增加(P<0.05)。
综上所述,胸腺肽对Th1/Th2失衡的调节作用可能通过抑制GATA-3表达的同时,进一步抑制IL-4的表达,通过上调 T-bet的表达,促进IFN-γ的表达,进而促进Th0向Th1分化,因此对Th1/Th2失衡具有调节作用。
[1] Damiá ADD, Gimeno JC, Ferrer MJS, et al. A study of the effect of proinflammatory cytokines on the epithelial cells of smokers, with or without COPD[J]. Arch Bronconeumol, 2011, 47(9): 447-453.
[2] Kim Y, Lee S, Kim Y S, et al. Regulation of Th1/Th2 cells in asthma development: a mathematical model[J]. Math Biosci Eng, 2013, 10(4): 1095-133.
[3] 许珂玉. 补脾益气方药对哮喘大鼠治疗机制的研究[D]. 沈阳:辽宁中医药大学, 2012.
[4] ZHU W, ZHANG J, LI J, et al. Effect of thymosin β_4 on airway inflammation in asthmatic mouse[J].Br Med J., 2012, 4: 017.
[5] Yang X, Qian F, He H Y, et al. Effect of thymosin alpha-1 on subpopulations of Th1, Th2, Th17, and regulatory T cells (Tregs) in vitro[J].Braz J Med Biol Res, 2012, 45(1): 25-32.
[6] JI R, NI Y, ZHANG J, et al. Prevention and cure effect of thymosin on postoperative infectious complications of malignant obstructive jaundice[J]. J Clin Med, 2011, 3: 014.
[7] Liu B, Lee J B, Chen C Y, et al. Type-2 innate lymphoid cells facilitate antigen-induced CD4+ TH2 cell immune response that exacerbates chronic allergic asthma (HYP7P. 291)[J]. J J Immunol, 2014, 192(1 Supplement): 119.
[8] Shi Y H, Shi G C, Wan H Y, et al. Coexistence of Th1/Th2 and Th17/Treg imbalances in patients with allergic asthma[J]. Chin Med J, 2011, 124(13): 1951-1956.
[9] Grünig G, Corry D B, Reibman J, et al. Interleukin 13 and the evolution of asthma therapy[J].Am J Clin Exp Immunol, 2012, 1(1): 20.
[10] Chen Y, Chauhan S K, Sadrai Z, et al. Th17-derived IFN-γ+ IL-17+ effectors exacerbate dry eye disease[J]. Invest Ophthalmol Vis Sci, 2014, 55(13): 4604-4604.
[11] Connor L M, Tang S C, Camberis M, et al. Helminth-conditioned dendritic cells prime CD4+ T cells to IL-4 production in vivo[J]. J Immunol, 2014, 193(6): 2709-2717.
[12] Huang H R, Zhong Y Q, Wu J F. The association between IFN-γ and IL-4 genetic polymorphisms and childhood susceptibility to bronchial asthma[J]. Gene, 2012, 494(1): 96-101.
[13] 陈棱丽, 吕剑, 成霖霞, 等. 丹参协同地塞米松对哮喘大鼠 T-bet/GATA-3 及 Th 失衡的调控研究[J]. 实用预防医学, 2015, 22(7): 783-787.
[14] 李炜晔, 陆惠敏, 郭强, 等. 胸腺肽 α1 对小鼠机体免疫系统的影响[J]. 四川大学学报 (医学版), 2014, 3: 011.
[15] 申昆玲, 邓力, 李云珠, 等. 糖皮质激素雾化吸入疗法在儿科应用的专家共识[J]. 临床儿科杂志, 2014, 32(6): 504-511.
(编校:谭玲)
Research of thymosin on adjustment and mechanism in asthmatic mouse
YAN Chao, XU Ke-yuΔ
(1.Department of Biochemistry and Molecular Biology, School of Basic Medical Sciences, Liaoning Medical University, Jinzhou 121000, China)
ObjectiveTo explore the regulation role and expression level of thymosin for Th1/Th2 and T-bet ,GATA-3 in asthma model rats respectively.Methods60 SPF grade male rats (6-8w) were randomly divided into six groups:control group, asthma model group, dexamethasone (0.5 mg/kg) group, thymosin high dose group (5 mg/kg), thymosin middle dose group(2.5 mg/kg), thymosin low dose group (1.25 mg/kg). The asthma model was constructed with ovalbumin. The rat in the control group and asthma model group were injected with normal saline by intraperitoneal, while other rats were injected with corresponding drugs.Then the concentration of IL-4 and IFN-γ in the serum of rats were tested by the method of enzyme linked immunosorbent assay(ELISA) and the protein expression level of GATA-3 and T-bet factor in the lung tissue were tested by immunohistochemistry in each group.ResultsThe concentration of IL-4 in the serum was higher and IFN-γ was lower in the asthma model group than the other groups, while the protein expression level of GATA-3 was higher and T-bet was lower in the asthma model group than the other groups(allP<0.05).ConclusionThymosin upregulation of IFN-γ and inhibition of IL-4 may be achieved by upregulating T-bet and downregulating GATA-3, and thymosin has therapeutic effect on asthma rats.
bronchial asthma; thymosin; GATA-3; T-bet
辽宁省教育厅基金资助项目(2009A469)
闫超,女,硕士在读,研究方向:天然药物与肿瘤治疗,E-mail:836842135@qq.com;许珂玉,通信作者,女,博士,教授,研究方向:天然药物与肿瘤治疗,E-mail:1194003345@qq.com。
R562.25
A
1005-1678(2015)12-0032-04

