八正胶囊的质量标准研究
陈勇
(贵州省黔东南州食品药品检验所,贵州 凯里 556003)
八正胶囊的质量标准研究
陈勇
(贵州省黔东南州食品药品检验所,贵州 凯里 556003)
目的 建立八正胶囊的质量标准。方法 用薄层色谱法鉴别大黄素和大黄酚,并用高效液相色谱法测定样品中大黄素、大黄酚的含量测定。结果 薄层色谱斑点清晰,且空白无干扰;大黄素结果表明,大黄素进样量在0.0267~0. 4272 μg范围内呈良好的线性关系,Y=1425.7X+2.1521(r=0.9998);大黄酚进样量在0.0417~0.6677 μg,Y=5×106X-8566.2(r=0.9999)范围内呈现良好的线性关系。加样平均回收率分别为97.35%、98.39%;RSD分别为1.7%、0.4%。结论 建立的方法简便,重复性好,可用于八正胶囊的质量标准。
八正胶囊;大黄素;大黄酚;薄层鉴别;含量测定
八正胶囊源于宋朝《太平惠民和剂局方》中的八正散,由扁蓄、滑石、瞿麦、栀子、车前子、大黄、川木通、甘草八味中药经现代制药技术加工而成,具有清热、通淋和利尿功效。临床上用于治疗泌尿系统感染性疾病[1]。其原质量标准中大黄以及栀子的薄层鉴别均较复杂,且含量测定项只有栀子[2],为了更好地控制该制剂的质量,确保临床疗效。本实验对栀子薄层方法的改进,增加了大黄的含量测定,从而进一步完善八正胶囊的质量标准。
1 材料与方法
1.1 仪器 Waters2695高效液相色谱仪(美国Waters公司)、Agillent 1100高效液相色谱仪(美国Agillent公司);色谱柱:菲罗门 C18(4.6×250 mm,5 μm), 迪马C18(4.6×250 mm,5 μm);梅特勒BP210S百万分之一电子天平(美国梅特勒-托利多仪器有限公司);硅胶G、H薄层板(青岛海洋化工厂)。
1.2 药品与试剂 栀子苷(批号:110749-201405,供含量测定用);大黄素(批号:110756-201410),大黄酚(批号:110757-201407),对照品及对照药材均购于中国药品生物制品检定研究所。八正胶囊由某制药公司生产,批号:091109、1002006、1005012。甲醇(购自上海振兴化工一厂,色谱纯),乙腈(购自山东禹王有限公司化工分公司,色谱纯),水为纯化水,其他试剂均为分析纯。
1.3 薄层鉴别
1.3.1 大黄:取样品0.5 g内容物+10 mL水+1 mL盐酸,置水浴上通过15 mL乙醚回流提取30 min,共2次,合并乙醚液(酸液备用),并蒸干,加1 mL三氯甲烷使残渣溶解,滤液作为供试品溶液。另精密称取1 g大黄对照药材,加水煎煮30 min,滤过,滤液浓缩至10 mL,同法制成大黄对照药材溶液。参照薄层色谱法(中国药典2010年版一部附录Ⅵ B)试验:分别取5 μL上述2种溶液点于同一以羧甲基纤维素钠为黏合剂的硅胶H薄层板上,通过石油醚(30~60 ℃)-甲酸乙酯-甲酸(15︰5︰1)的上层溶液进行展开,取出后晾干,并于紫外光灯(365 nm)下检视。
1.3.2 栀子:取1 g本品内容物,经研细后加30 mL乙酸乙酯,通过超声处理20 min,并进行滤过,滤液蒸干,加1 mL三氯甲烷使残渣溶解,滤液作为供试品溶液。依据处方制成缺栀子阴性供试品溶液,取栀子苷对照品和甲醇制成每1 mL含1 mg的溶液,作为栀子对照品溶液。参照薄层色谱法(中国药典2010年版一部附录Ⅵ B)试验,分别取5~10 μL上述3种溶液点于同一硅胶G薄层板上,通过乙酸乙酯-丙酮-甲酸-水(6︰4︰0.5︰0.5)展开[3],取出后晾干,喷加10%硫酸乙醇溶液,并加热至斑点显色清晰。
1.4 含量测定
1.4.1 色谱条件:检测波长和流动相的选择:经紫外-可见分光光度计扫描大黄素和大黄酚在256 nm处均有较大吸收,且药典2010年版中药材大黄的含量测定波长为254 nm[4],为了尽量接近药典标准,因此本实验以254 nm作为检测波长。流动相参照2010年版药典中(新清宁片)中大黄含量测定流动相,对供试品及对照品的分离度均较好,因此最终确定为乙腈-甲醇-0.1%磷酸(42︰23︰35)。
1.4.2 对照品溶液的制备:精密称取大黄素和大黄酚对照品适量,加甲醇混合并分别制成溶液,每份分别为含大黄素10 μg/mL和大黄酚16 μg/mL的溶液,即得。
1.4.3 供试品溶液的制备
① 精密称取装量差异项下的本品(约0.5 g),经研细后置具塞锥形瓶中,加甲醇-盐酸(10︰1)[5]的混合溶液25 mL,称定重量,置80 ℃水浴中加热回流30 min,若瓶壁有黏附物,须超声处理去除,再称定重量,补加甲醇至原有重量,并摇匀滤过。精密量取续滤液2 mL,置5 mL量瓶中,加2%的氢氧化钠溶液 1 mL, 加甲醇至刻度,摇匀,滤过,取续滤液,用于测定总大黄酚和总大黄素的含量。
② 精密称取装量差异项下的本品(约0.5 g),经研细后置具塞锥形瓶中,加甲醇25 mL,称定重量,超声处理去除30 min,冷却后称定重量,补加甲醇至原有重量,并摇匀滤过,取续滤液,用于测定游离大黄酚和游离大黄素的含量。
1.5 方法
1.5.1 专属性考察:取缺大黄阴性对照,照1.4.2项下制备方法制成阴性对照溶液,进样分析。
1.5.2 线性关系考察:精密称取大黄素对照品0.01068 g,放入100 mL量瓶中,并加甲醇溶解稀释至刻度,摇匀,逐级稀释,分别配制成浓度为0.00267、0.00534、0.01068、0.02136、0.04272 mg/mL的溶液,分别进样10 μL, 测定。
精密称取大黄酚对照品0.01676 g(含量按99.6%计算),置100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,逐级稀释,分别配制成浓度为0.00417、0.00835、0.01669、0.03339、0.06677 mg/mL的溶液,分别进样10 μL, 测定。
1.5.3 精密度试验:以大黄素、大黄酚混合对照品溶液(0.01068、0.01669 mg/mL)连续进样5次,每次20 μL,测定峰面积。
1.5.4 重复性试验:取上述同一批样品(批号110101),按1.4.3项下①的方法进行制备,共6份,分别测定其总大黄素和总大黄酚总量。
1.5.5 稳定性试验:按前文所述方法制备供试品溶液,精密进样10 μL,测定大黄素、大黄酚峰面积,在0、2、4、8 h测定1次。
1.5.6 加样回收率试验:分别精密量取大黄素、大黄酚对照品甲醇溶液(浓度为0.1068、0.1669 mg/mL)1.0及1.2 mL置6个具塞锥形瓶中,挥干溶剂,再精密量取已测定含量的样品(同重复性试验样品,其中大黄素、大黄酚含量为0.58、0.79 mg/g) 6份, 分别加入上述具塞锥形瓶中,按标准正文拟订的大黄HPLC含量测定供试品制备方法①方法操作,测定大黄素、大黄酚含量,并按下式计算加样回收率。
分别精密量取大黄素、大黄酚对照品甲醇溶液(浓度为0.1068、0.1669 mg/mL)1.0及0.5 mL置6个具塞锥形瓶中,挥干溶剂,再精密量取已测定含量的样品(同重复性试验样品,其中大黄素、大黄酚含量为0.36、0.37 mg/g) 6份,分别加入上述具塞锥形瓶中,按标准正文拟订的大黄HPLC含量测定供试品制备方法②方法操作,测定大黄素、大黄酚含量,并按下式计算加样回收率。

1.5.7 方法耐用性考察:采用不同牌号仪器,不同牌号、规格的色谱柱,按标准正文拟订的方法,分别测定样品中总的以及游离大黄素和大黄酚的含量。
1.5.8 样品含量测定:按前文拟订的方法,测定收集到的八正胶囊样品中总大黄素和总大黄酚总量以及游离大黄素和游离大黄酚总量。
2 结果
2.1 薄层鉴别 在供试品色谱中,与对照药材色谱位置相对应,显相同颜色的荧光斑点;色谱斑点清晰、分离度良好,阴性对照无干扰,见图1;在供试品色谱中,与对照药材色谱位置相对应,显相同颜色的斑点。色谱斑点清晰、分离度良好,阴性对照无干扰。见图2。

图1 八正胶囊中大黄的TLC图1.阴性对照(缺大黄) 2.八正胶囊(批号0911009) 3.八正胶囊(批号1002006) 4.八正胶囊(批号1005012) 5.大黄对照药材Fig.1 Thin layer chromatography of rhubarb in bazheng capsule

新方法操作的薄层板 为按原标准操作的薄层板图2 八正胶囊中栀子的TLC图1.阴性对照(缺栀子) 2.八正胶囊(批号1002006) 3.八正胶囊(批号0911009) 4.八正胶囊(批号1005012) 5.栀子苷对照品Fig.2 Thin layer chromatography of gardenia in bazheng capsule
2.2 专属性考察 结果阴性对照色谱中,在大黄素、大黄酚对照品相同保留时间处无色谱峰,阴性对照无干扰。见图3,图4。
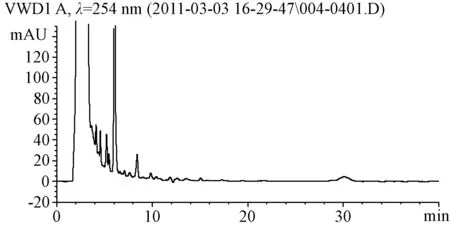
图3 八正胶囊阴性对照溶液的HPLC图Fig.3 High performance liquid chromatogram of negayive control solution of bazheng capsule
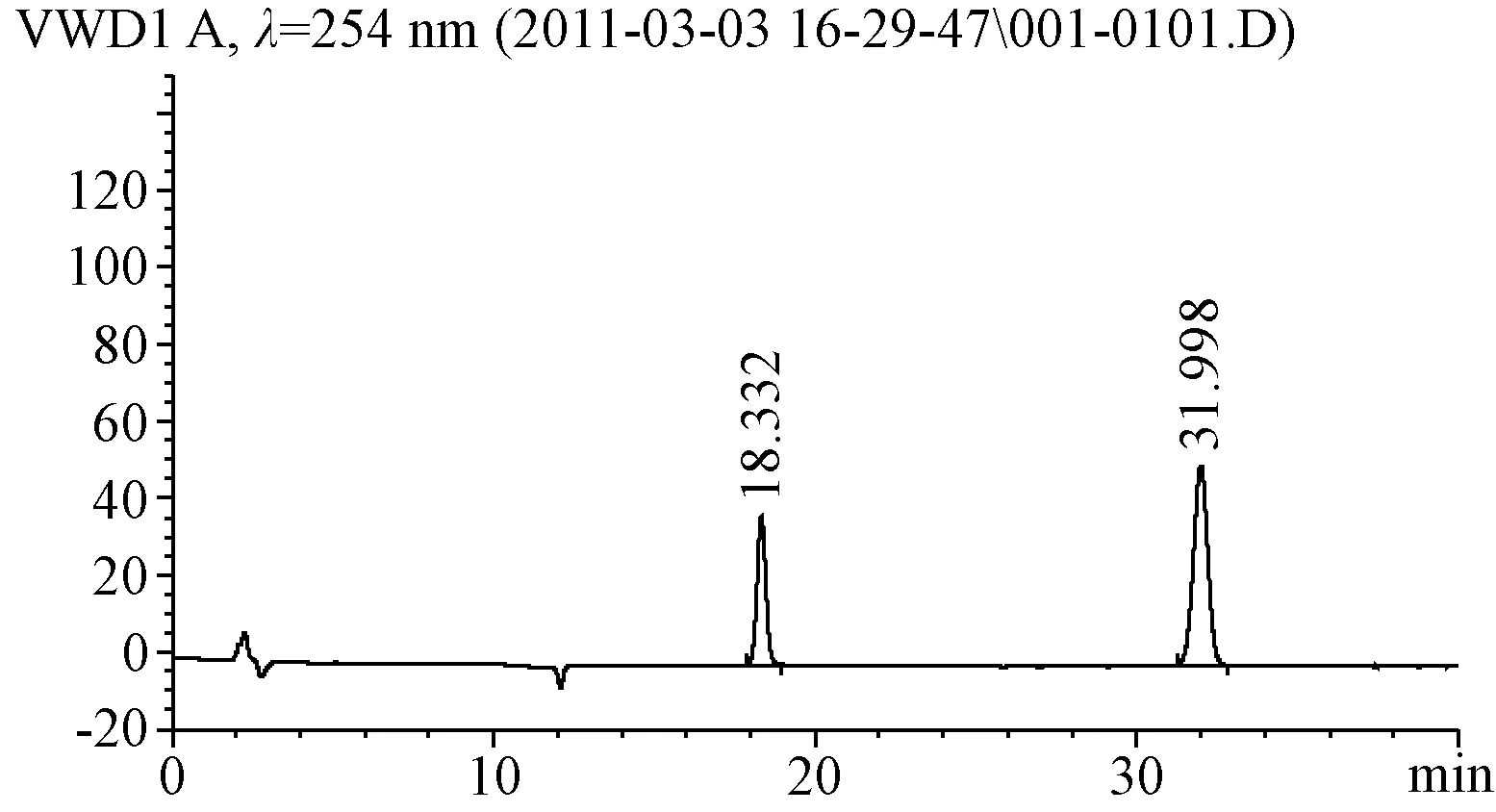
图4 大黄素、大黄酚对照品的HPLC图Fig.4 High performance liquid chromatogram of emodin and chrysophanol

图5 八正胶囊样品(总大黄素、总大黄酚)的HPLC图Fig.5 High performance liquid chromatogram of total emodin and chrysophanol in bazheng capsule
2.3 线性关系考察 以进样量为横坐标,大黄素峰面积为纵坐标,绘制标准曲线,并按最小二乘法计算直线回归方程,得Y=1425.7X+2.1521(r=0.9998)。结果表明,大黄素进样量在0.0267~0. 4272 μg范围内,与峰面积呈良好的线性关系。见图6。
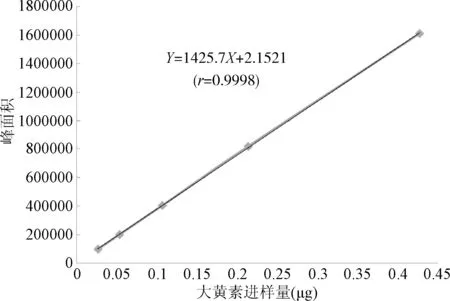
图6 大黄素标准曲线Fig.6 The standard curve of emodin
以进样量为横坐标,大黄酚峰面积为纵坐标,绘制标准曲线,并按最小二乘法计算直线回归方程,得Y=5×106X-8566.2(r=0.9999)。结果表明,大黄酚进样量在0.0417~0.6677 μg范围内,与峰面积呈良好的线性关系。见图7。
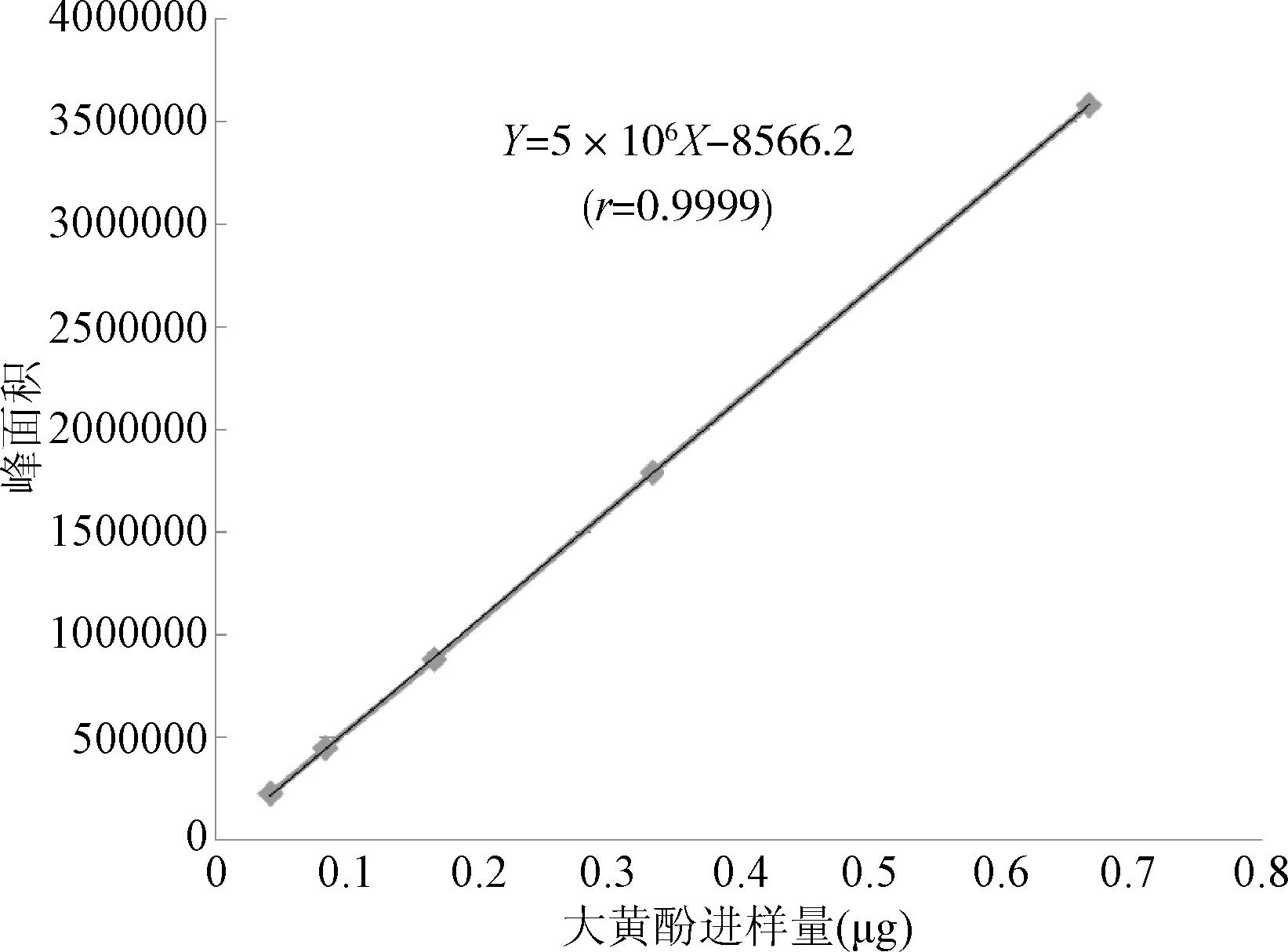
图7 大黄酚的标准曲线Fig.7 The standard curve of chrysophanol
2.4 精密度试验 精密度试验结果表明:大黄素峰面积平均值为747562,RSD为0.35%;大黄酚峰面积平均值1716662,RSD为0.28%,表明仪器精密度良好。
2.5 重复性试验 重复性试验结果表明:6次重复测定总大黄素和总大黄酚总含量为0.53 mg/粒,RSD为1.0%;游离大黄素和游离大黄酚总含量为0.24 mg/粒,RSD为1.4%,表明该方法重复性较好。
2.6 稳定性试验 稳定性试验结果表明:总大黄素峰面积平均值为356.98,RSD为1.7%;总大黄酚峰面积平均值为862.83,RSD为0.2%;游离大黄素峰面积平均值为484284,RSD为0.45%,游离大黄酚峰面积平均值为699077,RSD为0.62%,表明供试品溶液至少在8 h内稳定。
2.7 加样回收率试验 加样回收率试验结果表明:本方法回收率良好。见表1,表2。
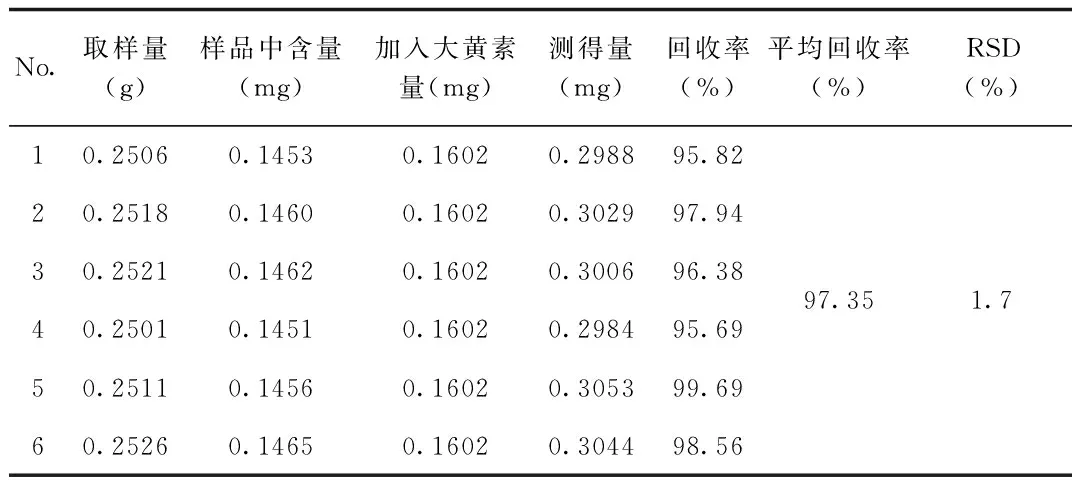
表1 大黄素回收率试验结果Tab.1 Recovery test of emodin

表2 大黄酚回收率试验结果Tab.2 Recovery test of chrysophanol
2.8 方法耐用性考察结果 方法耐用性试验结果表明:该方法耐用性良好。见表3。

表3 方法耐用性试验结果Tab.3 Results of durability test
2.9 样品含量测定 以生产的实际情况及原料药材含量的波动,暂订:本品每粒含大黄以总大黄酚(C15H10O4)和总大黄素(C15H10O5)的总量计,不得少于0.35 mg;以游离大黄酚(C15H10O4)和游离大黄素(C15H10O5)的总量计,不得少于0.15 mg。见表4。

表4 八正胶囊样品含量测定结果Tab.4 Results of content determination of bazheng capsule samples
3 讨论
在实验过程中做过车前子以及甘草等的薄层鉴别研究,但是车前子薄层中栀子对其干扰较明显,阴性供试品与对照品相应位置有栀子的斑点。甘草的薄层鉴别中阴性有干扰。这2种薄层鉴别条件有待进一步研究。大黄的薄层新方法与原标准相比薄层图效果相当,但提取方法更简单,因此采用新方法。
大黄素和大黄酚几乎不溶于水,溶于或微溶于甲醇、乙醇[6],参考相关文献[7],经试验摸索,供试品以甲醇-盐酸(10:1)提取大黄素及大黄酚溶出率较大,因此确定了提取方法。
[1] 杨丽娟,刘如意,任慧勋,等.八正合剂药理作用的研究实验[J].河南中医学院学报,2005,20(6):16.
[2] 国家食品药品监督管理局.国家药品标准[S].73-100.
[3] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010:832.
[4] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010:536.
[5] 李耿,温良明,候少贞,等. RP-HPLC测定八正颗粒中大黄素、大黄酚的含量[J].中成药,2007,29(9):附11-13.
[6] 常新全,丁丽霞.中药活性成分分析手册[M].北京:学苑出版社,2002:45-14.
[7] 彭邵忠,李耿,蔡大可,等.八正丸的质量标准研究[J].中药新药与临床药理,2008,19(2):140-145.
(编校:王冬梅)
Study on quality specification of bazheng capsule
CHEN Yong
(Institute for Food and Drug Control of Guizhou Provincial Qiandongnan, Kaili 556003, China)
ObjectiveTo improve the quality of the standard bazheng capsule.MethodsTLC was used for identification of emodin and chrysophanol content determination, and determination of samples by high performance liquid chromatography.ResultsTLC spots were clear,and the blank without interference. Emodin showed a good linear relationship at range of 0.0267~0.4272 μg,Y=1425.7X+2.1521(r=0.9998);chrysophanol showed a good linear relationship at range of 0.0417~0.6677 μg,Y=5×106X-8566.2(r=0.9999).The recovery was 97.35%,98.39%,and RSD was 1.7%,0.4%.ConclusionThe established methods are simple and with good repeatability, and can be used for the quality control of bazheng capluse.
bazheng capsules; emodin; chrysophanol;TLC; content determination
陈勇,男,学士,研究员,研究方向:肝病,E-mail:chengyong1232@163.com。
R284.1
A
1005-1678(2015)03-0179-04

