曲古抑菌素对骨髓间充质干细胞特化干预的体外研究
袁志峰,许国华,任莉
(1.景德镇市第一人民医院 骨科,江西 景德镇 333000;2.上海长征医院 脊柱外科,上海 200003;3.浙江省立同德医院 骨科,浙江 杭州 310012)
曲古抑菌素对骨髓间充质干细胞特化干预的体外研究
袁志峰1,许国华2,任莉3
(1.景德镇市第一人民医院 骨科,江西 景德镇 333000;2.上海长征医院 脊柱外科,上海 200003;3.浙江省立同德医院 骨科,浙江 杭州 310012)
目的 探讨曲古抑菌素(trichostatin A,TSA)对大鼠骨髓间充质干细胞(marrow mesenchymal stem cells,MSCs)特化为成骨细胞的影响。方法 采用全骨髓贴壁法体外分离、培养、纯化大鼠MSCs,进行形态学观察;选择第3代MSCs定向诱导分化为成骨细胞,根据给药浓度不同分为TSA低剂量组(0.1 μmol/L)、中剂量组(1 μmol/L)、高剂量组(10 μmol/L),同时设立空白对照组。MTT法观察各组对MSCs的增殖作用并绘制细胞生长曲线,检测TSA对MSCs诱导分化为成骨细胞过程中碱性磷酸酶(alkaliphosphatase,ALP)活性的影响;RT-PCR法检测TSA对核心结合因子α-1(corebinding factor α1,Cbfα1)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1)mRNA表达水平的影响。结果 MSCs生长曲线的测定结果显示,各组细胞生长曲线趋势相似,与对照组相比,TSA低剂量组的生长曲线没有显著性变化,TSA中剂量及高剂量均显著促进MSCs增殖(P<0.05)。与对照组相比,TSA低剂量组、中剂量组、高剂量组对MSCs诱导分化为成骨细胞过程中的第4、5、6 E均可显著提高ALP活性(P<0.05)。与空白组相比,TSA各剂量组可以显著提高Cbfα1、bFGF、IGF-1mRNA表达水平(P<0.05)。结论 TSA可显著促进大鼠骨髓间充质干细胞特化为成骨细胞,可能是通过上调Cbfα1、bFGF、IGF-1基因的表达水平实现。
曲古抑菌素;骨髓间充质干细胞;核心结合因子α-1;碱性成纤维细胞生长因子;胰岛素样生长因子-1
间充质干细胞(marrow mesenchymal stem cells,MSCs)为具有多向分化潜能的干细胞,在特定的诱导条件下,具有向成骨细胞、心肌细胞以及脂肪细胞等分化的能力,对多种疾病具有治疗潜能,如骨质疏松症、心肌梗死、神经性疾病等[1-2]。最新研究发现,曲古抑菌素(trichostatin A,TSA)是一种有效的特异性组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂,参与调节多种细胞活动,如细胞分化及增殖过程中[3-4]。本研究拟在采用RT-PCR法检测TSA对核心结合因子α-1(corebinding factor α1,Cbfα1)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、胰岛素样生长因子-1(insulin-Like growth factor-1,IGF-1)mRNA表达水平,观察TSA对MSCs特化的成骨细胞分化的影响。
1 材料与方法
1.1 实验动物 SPF级SD大鼠20只,5周龄,体质量100~120 g,动物室温度(25±2) ℃,相对湿度(45±5)%,实验期间大鼠自由饮水和进食,雌雄不限。由广西医科大学动物实验中心提供,合格证号为:SCXK(桂)2009-0002。
1.2 试剂及仪器 L-DMEM培养基(Gibco);胎牛血清(Hyclone公司);地塞米松、β-甘油磷酸钠、抗血酸、TSA、链霉素青霉素、胰蛋白酶、二甲基亚砜(均购自Sigma);PNPP显色剂、碱性磷酸酶(ALP)试剂盒(均购自Wako公司);聚合酶链引物设计、逆转录聚合酶链反应试剂盒(均购自TaKaRa公司)。实时荧光定量PCR仪(购自ABI公司);CO2培养箱(购自Shellab公司);倒置相差显微镜(购自Olympus公司)。
1.3 方法
1.3.1 MSCs的原代分离、培养、传代:取5周龄SD大鼠,脱颈椎处死动物,75%的酒精浸泡10 min消毒,于超净工作台中分离胫骨及股骨,PBS反复冲洗3次。切取骨两端,露出骨髓腔,用含有青霉素及链霉素的L-DMEM培养基冲出骨髓,反复吹打,得到骨髓单细胞混悬液,1000 r/min低温快速离心5 min,弃上清。用含有青霉素及链霉素的L-DMEM培养基重悬沉淀细胞,以细胞浓度为1×109个/L接种于25 cm2培养瓶中,置于37 ℃、5%CO2培养箱中培养。原代培养的第3天首次换液,以后每3 d换液1次。当细胞铺满培养瓶底至细胞融合为单层细胞,密度约为80%左右时,用0.25%胰酶进行消化,按照1:2的比例进行传代培养[5]。
1.3.2 MSCs形态学观察:细胞培养的每日用倒置相差显微镜观察细胞形态变化及生长状况并拍照保存。
1.3.3 药物处理及实验分组:TSA溶于磷酸盐缓冲液(pH7.4)和二甲基亚砜中,置于-20 ℃冰箱保存。实验共分为4组:TSA低剂量组(0.1 μmol/L)、中剂量组(1 μmol/L)、高剂量组(10 μmol/L),同时设立空白对照组(仅含磷酸盐缓冲液和二甲基亚砜)。
1.3.4 MSCs生长曲线的测定:将生长状态良好的第2代MSCs以密度为5×103个接种于96孔培养板中,置于37 ℃、CO2饱和湿度的5%CO2培养箱中培养,按上述TSA剂量分别加入各组中每天取1板进行MTT检测,连续1周。MTT检测时应用酶联免疫检测仪检测各孔吸光度值,选择波长为492 nm。按照检测结果,以光吸收值为纵坐标,以细胞生长天数为横坐标,绘制细胞生长曲线。
1.3.5 MSCs体外定向诱导分化为成骨细胞:MSCs培养到第3代,以1×109个/L的浓度接种于6孔培养板上,待细胞贴壁生长至密度为80%左右时,各孔加入成骨细胞诱导剂:1 mmol/L地塞米松、1 mmol/L β-甘油磷酸钠、50 mmol/L抗血酸,置于37 ℃、5%CO2培养箱中培养。加入诱导液后每3 d换液1次,并设不加诱导剂的MSCs孔作为对照组,每组设8个复孔。
1.3.6 成骨细胞内碱性磷酸酶(ALP)活性测定:在各组MSCs诱导分化给药过程的第4、5、6天时,用PBS洗涤细胞2次,用0.04 g/L的蛋白酶E进行消化,并收集细胞。进行细胞内ALP活性的测定,测定时用的9×10-2mol/L PNPP,其中反应液的pH值为10.3,置于37 ℃反应30 min,加0.1mol/L NaOH终止液终止反应,于400 nm处测定吸光度,同时用考马斯亮蓝法检测细胞蛋白质含量。
1.3.7 RT-PCR法检测TSA对成骨细胞Cbfα1、bFGF、IGF-1mRNA表达水平的影响:MSCs体外定向诱导分化为成骨细胞后,按上述TSA剂量分组给药,给药后共培养5 d进行RT-PCR检测试验。具体步骤:①细胞中总RNA提取,采用Trizol一步法提取总RNA,紫外分光光度法测定总RNA浓度,选择A260/A280在1.8~2.0间的样;②反转录为cDNA,所有样的总RNA的浓度调整至500 mg/L,取2 μL进行逆转录。所有操作严格按照逆转录聚合酶链反应试剂盒步骤进行,将逆转录所得的cDNA置于-20 ℃保存备用;③PCR反应扩增反应,体系为20 μL,包括:SYBR Premix Ex TaqTMⅡ(2×)10 μL;正向引物(10 μmol/L) 0.8 μL;反向引物(10 μmol/L) 0.8 μL;ROX 参比染料(50×) 0.4 μL;cDNA模版2 μL;dH2O 6 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火31 s,进行40个循环。每个循环的延伸末收集荧光信号软件自动计算出待测样本中管家基因和目的基因的准确含量,采用2-△△Ct计算相对表达量。所有引物由上海生工公司设计合成,见表1。

表1 各引物序列Tab.1 The primer sequence

2 结果
2.1 MSCs细胞形态观察 倒置相差显微镜下可见MSCs为圆形,大小不一,培养24 h后,开始贴壁,呈圆形,梭形,或多角形;5 d后,可见放射状排列的细胞群,多为梭形,胞浆丰富,胞核大,核仁清晰。见图1。

图1 MSCs细胞形态观察图(×1000)Fig.1 MSCs cell morphological observation(×1000)
2.2 MSCs生长曲线的测定 各组细胞生长曲线趋势相似,在MSCs接种给药第1、2天为细胞潜伏适应期,而3~6 d曲线呈直线上升,则为MSCs的对数生长期。第7天后曲线上升趋势逐渐变得平缓,MSCs增殖速度明显减慢,进入平台期。与对照组相比,TSA低剂量组的生长曲线没有显著性变化,TSA中剂量及高剂量均有显著升高MSCs生长曲线的趋势,有效增强了MSCs的扩增能力(P<0.05)。见图2。
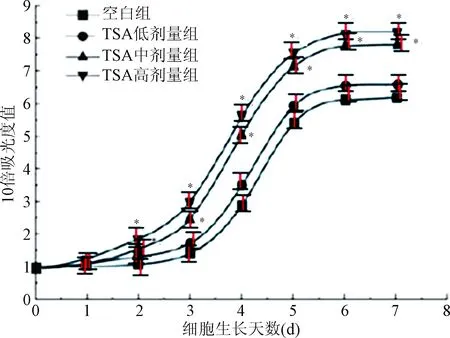
图2 不同组的MSCs生长曲线*P<0.05,与空白对照组比较Fig.2 Comparison of growth curve of MSCs in each group*P<0.05,compared with control group
2.3 成骨细胞内碱性磷酸酶(ALP)测定细胞活性 与对照组相比,TSA低剂量组(0.1 μmol/L)、中剂量组(1 μmol/L)、高剂量组(10 μmol/L)对MSCs诱导分化为成骨细胞过程中的第4、5、6天均可显著提高ALP活性(P<0.05)。见表2。
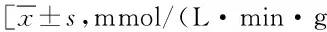
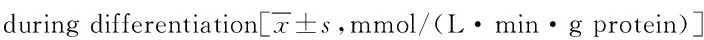

组别TSA浓度4d5d6d空白组—2.218±0.3213.076±0.2223.339±0.105TSA低剂量组0.1μmol/L2.552±0.255*3.181±0.128*3.588±0.133*TSA中剂量组1μmol/L2.887±0.312**3.322±0.125**3.712±0.128**TSA高剂量组10μmol/L3.081±0.343**3.574±0.211**3.978±0.213**
*P<0.05,**P<0.01,与空白对照组比较,compared with control group
2.4 RT-PCR法检测TSA对成骨细胞Cbfα1、bFGF、IGF-1mRNA表达水平的影响 RT-PCR法检测TSA对成骨细胞影响,结果表明,与空白组相比,TSA各剂量组可以显著提高Cbfα1、bFGF、IGF-1mRNA表达水平,差异具有统计学意义(P<0.05)。见表3。


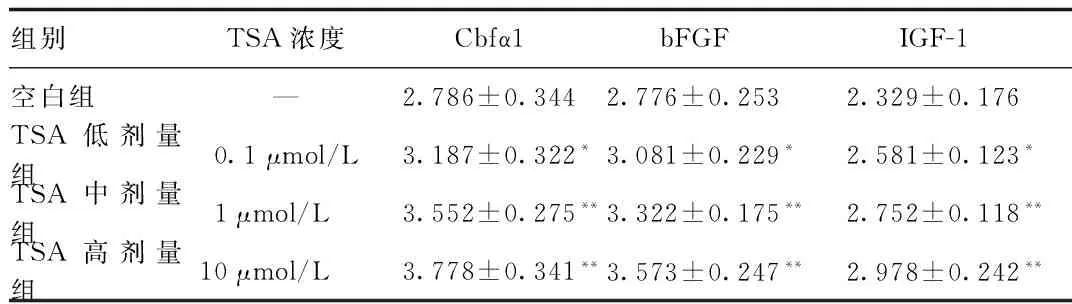
组别TSA浓度Cbfα1bFGFIGF-1空白组—2.786±0.3442.776±0.2532.329±0.176TSA低剂量组0.1μmol/L3.187±0.322*3.081±0.229*2.581±0.123*TSA中剂量组1μmol/L3.552±0.275**3.322±0.175**2.752±0.118**TSA高剂量组10μmol/L3.778±0.341**3.573±0.247**2.978±0.242**
*P<0.05,**P<0.01,与空白对照组比较,compared with control group
3 讨论
MSCs作为成骨细胞的祖细胞,其分化成为成骨细胞的能力直接影响着骨质疏松或者骨折的愈合能力,因此近年来关于促进其分化为成骨细胞的药物得到了医药界的广泛关注,也是骨科领域的研究热点。TSA最初作为抗真菌药物被人们所认识,并很快得到了广泛的应用[6]。但最近研究还发现TSA是一种有效的、并特异性作用于组蛋白去乙酰化酶,它选择性抑制Ⅰ类和Ⅱ类组蛋白去乙酰化酶,但对Ⅲ类组蛋白去乙酰化酶并无抑制作用[7-8]。TSA作为组蛋白去乙酰化酶的抑制剂,是通过阻断组蛋白去乙酰化酶的作用通路,发挥其对去乙酰化的抑制功能,从而起到调节转录激活过程的乙酰化与去乙酰化动态平衡作用[9-10],目前较多研究将其用于各种肿瘤疾病的治疗过程中。近期研究发现TSA参与到调节多种不同的细胞活动中,如细胞分化和细胞增殖[11]。
本研究结果表明,与对照组相比,TSA显著提高成骨细胞碱性磷酸酶活性,RT-PCR法检测结果显示,TSA各剂量可以显著提高成骨细胞中Cbfα1、bFGF及IGF-1mRNA的表达水平,而这些细胞因子与成骨细胞分化有着密切的联系。Cbfα1为脊椎动物成骨细胞分化的关键调节因子,通过与成骨细胞上的特异顺式作用元件结合从而激活骨钙素的表达水平,调节着大多数关键成骨细胞基因的表达水平,控制分化成骨细胞的成骨速率以及调节骨钙素基因(EK5)表达,从而在成骨细胞分化过程中起到至关重要的作用[12-13]。bFGF通过多种信号通路调控成骨细胞的数量及其活动,对骨代谢具有重要的调节作用[14]。IGF-1是评价治疗骨质疏松症药物的重要指标,它可促进成骨细胞的增殖和骨基质的合成,是骨中含量丰富的细胞因子。
综上所述,本研究结果表明,与对照组相比,TSA可显著促进大鼠骨髓间充质干细胞特化为成骨细胞,可能是通过上调Cbfα1、bFGF、IGF-1基因的表达水平而实现的,提示TSA可开发为治疗骨质疏松症以及促进骨愈合的新药,但其具体作用机制还有待进一步研究。
[1] Svechnikova I,Almqvist PM,Ekström TJ.HDAC inhibitors effectively induce cell type-specific differentiation in human glioblastoma cell lines of different origin[J].Int J Oncol,2008,32(4):821-827.
[2] Wu Y,Zhao RC,Tredget EE.Concise review:bone marrow-derived stem progenitor cells in cutaneous repair and regeneration[J].Stem Cells,2010.28(5):905-915.
参考文献
[3] Noer A,Lindeman LC,Collas P.Histone H3 modifications associated with differentiation and long-term culture of mesenchymal adipose stem cells[J].Stem Cells Dev,2009.18(5):725-736.
[4] Marsoni SG,Damia G,Camboni G.A work in progress:the clinical development of histone deacetylase inhibitors[J].Epigenetics,2008.3(3):164-171.
[5] 李晓峰,赵劲民,苏伟,等.大鼠骨髓间充质干细胞的培养与鉴定[J].中国组织工程研究与临床康复,2011,15(10):1721-1725.
[6] 李方方,郑改焕,徐酉华,等.靶向血管内皮生长因子siRNA对K562细胞凋亡及survivin表达的影响[J].中华血液学杂志,2009,30(12):825-828.
[7] Philippe B,Luc S,Valérie PB,et al.Culture and Use of Mesenchymal Stromal Cells in Phase I and Ⅱ Clinical Trials[J].Stem Cells Int,2010,20(10):503-593.
[8] Li Z,Liu C,Xie Z,et al.Epigenetic dysregulation in mesenchymal stem cell aging and spontaneous differentiation[J].PLoS One,2011,6(6):e20526.
[9] Chen CQ,Chen CS,Chen JJ,et al.Histone deacetylases inhibitor trichostatin A increases the expression of Dleu2/miR-15a/l6-1 via HDAC3 in non-small cell lung cancer[J].Mol Cell Biochem,2013,383(1-2):137-148.
[10] Wang H,Li Q,Chen H.Genistein affects histone modifications on Dickkopf-related protein 1 (DKKl) gene in SW480 human colon cancer cell line[J].PLoS One,2012,7(7):e40955.
[11] Kawano T,Akiyama M,Agawa-Ohta M.et al.Histonedeacetylase inhibitors valproic acid and depsipeptidesenstitize retinoblastoma cells to radiotherapy by increasing H2AX phosphorylation and p53 a-cetylation-phosphorylation[J].Int J Oncol,2010,37(4):787-795.
[12] Gevorgyan A,Sukhu B,Alman BA,et al.Radiation effects and radioprotection in MC3T3-E1 mouse calvarialosteoblasticcells[J].PlastReconstr Surg,2008,122(4):1025-1035.
[13] Hofmann A,Ritz U,Hessmann MH,et al.Cell viability,osteoblast differentiation,and gene expression are altered in human osteoblasts from hypertrophic fracture non-unions[J].Bone,2008,42(29):894-906.
[14] Komaki H,Tanaka T,Chazono M,et al.Repair of segmental bone defects in rabbit tibiae using a complex of beta-tricalciumphosphate,type I collagen,and fibroblast growth factor-2 [J].Biomaterials,2006,27(29): 5118-5126.
(编校:吴茜 王俨俨)
Intervention effects of trichostatin A on specilization of bone marrow mesenchymal stem cells in vitro
YUAN Zhi-feng1,XU Guo-hua2,REN Li3
(1.Department of Orthopedics, The First People’s Hospital of Jingdezhen City, Jingdezhen 333000, China;2 .Department of Spine Surgery, Shanghai Changzheng Hospital, Shanghai 200003, China; 3. Department of Orthopedics, Tongde Hospital of Zhejiang Province, Hangzhou 310012, China)
ObjectiveTo explore the intervention effects of trichostatin A (TSA) on specialization of rat bone marrow mesenchymal stem cells (MSCs).MethodsThe rat MSCs were isolated,cultured and purified by the whole bone marrow adherent method in vitro, with morphological observation. The third generation of MSCs were selected, directional induced to osteoblasts, and divided into the TSA low dose group (0.1 μmol/L), middle dose group (1 μmol/L), the high dose group (10 μmol/L) according to different drug concentrations, seting up blank control group at the same time. MSCs proliferation and cell growth curve of each group were drawn by MMT, the activity of alkaliphosphatase (ALP) was detected, and the levels of corebinding factor α1 (Cbfα1), basic fibroblast growth factor (bFGF) and insulin-like growth factors-1 (IGF-1) mRNA were detected by RT-PCR. Results The trend of MSCs growth curves in each groups were similar, compared with control group, the growth curve of TSA low dose group had no significant change, the TSA middle dose and high dose significantly promoted the proliferation of MSCs (P<0.05). Compared with control group, ALP activity of TSA low-, middle- and high-dose group were significantly higher at 4th,5th,6th(P<0.05). The expression levels of Cbfα1, bFGF and IGF-1mRNA were significantly higher than those of control group, respectively (P<0.05).ConclusionTSA can significantly promote the rat bone marrow mesenchymal stem cells to differentiate into osteoblast, which is possibly associated with up-regulation of Cbfα1, bFGF and IGF-1mRNA level.
trichostatin A;MSCs;corebinding factor α1;basic fibroblast growth factor;insulin-like growth factor-1
2011年浙江省卫生科技计划项目(2011KYA030)
袁志峰,男,主任医师,学士,研究方向:骨科临床及基础,E-mail:gzf13979850246@163.com。
R34
A
1005-1678(2015)03-0039-03

