异基因造血干细胞移植治疗骨髓增生异常综合征合并坏疽性脓皮病一例
吴婷婷 王晓燕 吴迪炯 俞庆宏 邵科钉 沈一平 周郁鸿 叶宝东
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是一组异质性克隆性造血干细胞疾病,其病因尚未确定。异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是目前治疗MDS 的有效方法,尤其是对于青年患者而言[1]。坏疽性脓皮病(pyoderma gangrenosum,PG)是一种以皮肤破坏性溃疡为特征的反应性炎症性皮肤病,较为少见,目前认为可能是一种免疫介导性疾病,临床上可能伴发炎症性肠病、MDS 等。目前临床上主要应用糖皮质激素和免疫抑制剂治疗PG[2]。关于allo-HSCT 治疗MDS 合并PG 的报道较少见,浙江中医药大学附属第一医院血液科应用allo-HSCT 治愈了1 例MDS 合并PG 患者,现报道如下。
1 临床资料
患者男性,19 岁,既往体健。2009 年10 月因“头晕、面黄、乏力伴发热4 d”到当地医院就诊,查血常规:白细胞1.2 ×109/L,血红蛋白117 g/L,血小板52 ×109/L;当时未进一步检查明确诊断,给予中成药、雄激素口服,效果欠佳。2009 年12 月到我院就诊收治入院,患者否认工作粉尘、毒物、放射性物质接触史;家中父母及姐妹均体健,否认家族遗传病史。查血常规示:白细胞2.0 ×109/L,血红蛋白71 g/L,血小板96 × 109/L;网织红细胞计数1.87%。铁蛋白238.1 ng/mL,叶酸47 nmol/L,维生素B12 723 pmol/L。骨髓涂片检查示:骨髓小粒可见,骨髓增生活跃,其中粒系增生活跃,占32.5%,各阶段粒细胞比例、形态大致正常;红系增生活跃,占45.5%,各阶段红细胞比例大致正常,可见部分红系细胞类巨幼样变,核浆成熟失衡,红细胞呈卵圆形;淋巴细胞占20%,形态大致正常,全片见巨核细胞78 个,可见小巨核细胞,提示MDS-难治性贫血(refractory anemia,RA)型。骨髓活检:骨髓部分区域增生极度低下,部分区域增生较活跃,粒红比例减小,粒红系细胞以偏成熟为主,可见幼稚前体细胞异常定位现象,Gomori 网状纤维染色(-)。染色体检查示:46XY,正常核型。腹部B 超示脾脏形态、大小正常,厚3.4 cm。临床诊断为MDS-RA,国际预后积分为中危-1。给予十一酸睾酮、沙利度胺、曲安西龙口服,注射氨磷汀以及输注血制品等对症治疗,患者病情反复,期间多次发生皮肤淤点淤斑、感染,予卡络磺钠止血、抗炎治疗后好转出院。
2010 年7 月,患者无明显诱因出现右下肢近膝端红肿、疼痛,逐渐化脓溃烂,时有发热,最高体温达40 ℃。门诊就诊后收治入院,给予广谱抗生素治疗,患者症状无缓解,右下肢皮肤溃疡面不断向周围扩展,直径达10 cm 以上,溃疡较深且伴组织坏死。局部皮肤清创同时行病理活检,溃疡组织病理示:表皮轻度角化过度,鳞状上皮增生,灶性溃疡形成,真皮水肿,纤维细胞增生,小血管增生、扩张、出血,可见数个上皮样结节,伴多核巨细胞反应;见数个裂隙样溃疡,较多中性粒细胞、组织细胞浸润;散在含铁血黄素沉着(见图1);考虑为PG。溃疡分泌物细菌、真菌培养均未找到致病菌。后加用甲泼尼龙、环孢素和沙利度胺治疗,患者体温逐渐恢复正常,皮肤溃疡趋于收敛,患者疼痛好转后出院。出院2 周门诊随访发现,患者血红蛋白持续下降,最低时达20 g/L,完全依赖输注红细胞维持生命;且右下肢近膝端处PG 又反复发作2 次,加大甲泼尼龙剂量(40 mg/d)后好转。
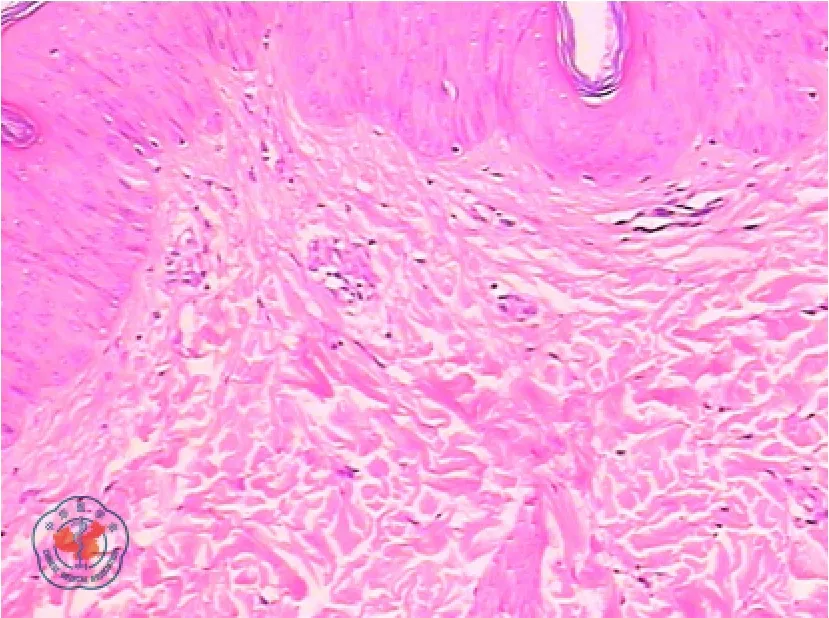
图1 2010 年7 月骨髓增生异常综合征合并坏疽性脓皮病患者右下肢近膝端溃疡组织病理检查结果(HE ×400)
2011 年8 月,患者考虑行allo-HSCT 再次入住我院。供者为其胞姐,HLA 配型全相合(6/6),ABO 血型相合。入院实验室检查:白细胞0.9 ×109/L,血红蛋白27 g/L,血小板30×109/L;铁蛋白3 859.1 ng/mL;骨髓涂片检查仍提示MDS-RA。2011 年9 月4 日,患者右侧手臂上方近三角肌处出现一类圆形皮损,行局部组织活检,仍提示PG 可能。2011 年9 月6 日起予改良BU/CY 方案预处理,-8、-7、-6 d 给予马利兰4 mg·kg-1·d-1,-5、-4 d 给予环磷酰胺1.8 g·(m2)-1·d-1。移植物抗宿主病(graftversus-host disease,GVHD)预防方案为环孢素和短程甲氨蝶呤,从-5 d 开始静脉滴注环孢素1.5 ~3.0 mg·kg-1·d-1,待患者无明显不良反应改为口服6 ~8 mg·kg-1·d-1,分2 次服用,再根据其血药浓度谷值(维持在150 ~250 μg/L)酌情减量至1.5 ~2.0 mg·kg-1·d-1,共用3 ~6 个月;移植后+1 d予甲氨蝶呤15 mg/m2,+3、+6、+11 d 分别予10 mg/m2。回输其胞姐外周血CD34+细胞为4.72 ×106/kg,移植过程顺利。移植12 d 患者造血功能重建,新出现的皮损消失。移植后1 个月通过短串联重复序列PCR 检测证实造血干细胞完全植入。移植过程中和移植后患者均未出现其他移植相关并发症,移植后10 个月停用免疫抑制剂。移植后1 年查血常规示:白细胞4. 7 × 109/L,血红蛋白136 g/L,血小板132 ×109/L。骨髓涂片检查示:骨髓小粒可见,骨髓增生活跃,其中粒系增生尚活跃,占31.5%,各阶段粒细胞比例略偏低,形态大致正常;红系增生明显活跃,占57%,以中晚幼红细胞为主,形态未见明显异常;淋巴细胞占8.5%,形态正常;全片见巨核细胞104 个,其中产板巨核细胞占24%,血小板呈中小簇分布,数量大致正常。截至2014 年9 月,该患者已随访3 年,随访期间复查血常规均在正常范围,未再次复查骨髓象,未观察到类似皮损出现,考虑MDS 和PG 均无复发。
2 讨 论
MDS 是起源于造血干细胞的一组异质性髓系克隆性疾病,部分患者会转变为急性髓细胞白血病。年轻MDS 患者(<50 岁)临床上较少见,与年老MDS 患者相比,年轻患者疾病特点是女性多于男性,临床症状较轻,严重贫血更少见,肾功能损害程度较轻,骨髓中的原始细胞比例更少,RA 和单系造血细胞异常类型的患者比例更高,其总生存期明显高于年老MDS 患者[3]。但是,年轻MDS 患者疾病进展过程与年老患者相似,二者发展为急性髓细胞白血病的概率是一样的,提示临床表现相似的MDS患者中,年轻MDS 患者具有更高风险和较差预后[3]。尽管近年来我们对MDS 的分子和遗传学特征有了更深刻的认识,但是唯一可能治愈MDS 的治疗方法仍然是应用allo-HSCT[1],尤其是对于年轻MDS 患者而言。
PG 是一种非感染性的、以中性粒细胞浸润为特征的溃疡性皮肤疾病,临床上较罕见,但病情较严重,多与一些系统性疾病有关。其发病机制尚不明确,现多认为免疫机制在PG 的发生中起了主导作用。超过50%的PG 患者合并系统性疾病,包括溃疡性结肠炎、MDS、克罗恩病和类风湿性关节炎等[2]。Su 等[4]于2004 年提出的PG 诊断标准是目前我们诊断PG 的主要依据,主要根据临床表现、组织病理学和基础疾病等诊断。PG 的治疗主要是应用免疫抑制剂控制病情,包括环孢素、皮质类固醇、氨苯砜、米诺环素和沙利度胺等。
对于MDS 合并PG 的患者,往往应用皮质类固醇联合沙利度胺进行治疗[5-6];其中部分对口服类固醇无效的患者,静脉应用甲泼尼龙可以提高疗效[5]。也有报道应用大剂量丙种球蛋白治疗MDS合并PG 的患者取得了较好的疗效[7]。Allo-HSCT在理论上可完全或接近完全免疫重建,是治愈自身免疫性疾病的理想方式,因此有些移植中心开始应用allo-HSCT 治疗难治性自身免疫性疾病[8],但由于GVHD 等移植相关并发症发生率较高,限制了其在难治性自身免疫性疾病中的推广应用。PG 患者的长期生存仍是不可预测的,最初对药物治疗有反应的PG 患者中绝大多数会复发[2],应用泼尼松和环孢素治疗的患者疾病复发的比例分别为70%和66%[9],有一些类型的PG 病死率高达30%[10]。我们曾报道过1 例MDS-RA 合并PG 患者,给予泼尼松、吗替麦考酚酯和沙利度胺治疗后病情曾一度控制[11],但最终在治疗19 个月后死亡。
MDS 合并PG 患者应用allo-HSCT 治疗的临床病例目前比较少见。本例患者经过骨髓涂片检查、骨髓活检和染色体检查等明确诊断为MDS,在治疗MDS 的过程中,无明显诱因出现了快速进展的疼痛性溃疡、高热,结合组织病理结果、细菌和真菌培养阴性以及多种抗生素治疗无效等表现,综合考虑为PG,在诊断上是比较明确的。在给予甲泼尼龙、环孢素和沙利度胺联合治疗后,患者病情一度得到缓解,但是PG 复发2 次,且MDS 病情持续进展,期间一度完全依赖输注血制品维持生命。行allo-HSCT 10 个月后患者停用免疫抑制剂,目前已经随访3年,患者MDS 和PG 均未复发。根据这例患者的诊治经过结合相关文献,我们建议,对于MDS 合并PG的年轻患者应尽早考虑行allo-HSCT,以完全控制MDS 和PG。
1 Vaughn JE,Scott BL,Deeg HJ. Transplantation for myelodysplastic syndromes 2013[J]. Curr Opin Hematol,2013,20(6):494-500.
2 Wollina U. Pyoderma gangrenosum—a review[J]. Orphanet J Rare Dis,2007,2:19.
3 Marisavljevic D,Savic A,Zeremski V,et al. Myelodysplastic syndromes in adults aged less than 50 years: incidence and clinicopathological data[J]. J BUON,2014,19(4):999-1005.
4 Su WP,Davis MD,Weenig RH,et al. Pyoderma gangrenosum:clinicopathologic correlation and proposed diagnostic criteria[J]. Int J Dermatol,2004,43(11):790-800.
5 Yamauchi T,Ishida K,Iwashima Y,et al. Successful treatment of pyoderma gangrenosum that developed in a patient with myelodysplastic syndrome[J]. J Infect Chemother,2003,9(3):268-271.
6 Koca E,Duman AE,Cetiner D,et al. Successful treatment of myelodysplastic syndrome-induced pyoderma gangrenosum[J]. Neth J Med,2006,64(11):422-424.
7 Tamaki K,Nakazawa T,Mamehara A,et al. Successful treatment of pyoderma gangrenosum associated with myelodysplastic syndrome using high-dose intravenous immunoglobulin[J]. Inter Med,2008,47(23):2077-2081.
8 Strober J,Cowan MJ,Horn BN. Allogeneic hematopoietic cell transplantation for refractory myasthenia gravis[J]. Arch Neurol,2009,66(5):659-661.
9 Vidal D,Puig L,Gilaberte M,et al. Review of 26 cases of classical pyoderma gangrenosum:clinical and therapeutic features[J]. J Dermatolog Treat,2004,15(3):146-152.
10 Hafner J,Kühne A,Trüeb RM. Successful grafting with EpiDex in pyoderma gangrenosum[J]. Dermatology,2006,212(3):258-259.
11 金玥,俞庆宏,周郁鸿,等. 骨髓增生异常综合征伴坏疽性脓皮病1 例[J]. 临床血液学杂志,2008,21(5):498-499.

