乌司他丁对氧化损伤肾小管上皮细胞的保护作用研究
温海滨,覃 勋,蒙如庆,唐峰年,韦 喆,谭 宁
(1.河池市人民医院肾内科,广西547000;2.桂林医学院科学实验中心,广西桂林541001)
乌司他丁对氧化损伤肾小管上皮细胞的保护作用研究
温海滨1,覃 勋1,蒙如庆1,唐峰年1,韦 喆1,谭 宁2
(1.河池市人民医院肾内科,广西547000;2.桂林医学院科学实验中心,广西桂林541001)
目的探讨乌司他丁对氧化损伤后肾小管上皮细胞的保护作用。方法将肾小管上皮NRK52E细胞随机分为八组,即N组:正常对照组,H组:500 μmol/L过氧化氢(H2O2),A组:100 U/mL乌司他丁,B组:200 U/mL乌司他丁,C组:400 U/mL乌司他丁,D组:500 μmol/L H2O2、100 U/mL乌司他丁,E组:500 μmol/L H2O2、200 U/mL乌司他丁,F组:500 μmol/L H2O2、400 U/mL乌司他丁。检测细胞中超氧化物歧化酶(SOD)活力和丙二醛(MDA)含量,观察细胞氧化损伤情况,以CCK-8法检测细胞的增殖活性,以流式细胞术检测细胞凋亡,以反转录聚合酶链反应检测Caspase-3基因的表达。结果H组细胞凋亡率明显高于N、A、B、C组,差异均有统计学意义(P<0.05);E、F组凋亡率明显低于H组,差异均有统计学意义(P<0.05);H组SOD活力较其他各组明显降低,MDA含量较其他各组明显升高,差异均有统计学意义(P<0.05);与N组比较,H组Caspase-3 mRNA的表达明显增高,差异有统计学意义(P<0.05);与H组比较,A、B组Caspase-3 mRNA的表达降低,差异均有统计学意义(P<0.05)。结论乌司他丁能显著抗氧化,抑制细胞凋亡,乌司他丁预处理对H2O2诱导肾小管上皮细胞氧化应激损伤有保护作用,其作用机制可能与其可下调Caspase-3表达有关。
过氧化氢;创伤和损伤;上皮细胞;肾小管;乌司他丁;氧化应激
急性肾损伤(AKI)是目前临床住院患者常见并发症,其中肾小管的缺血再灌注损伤是主要的病理生理表现,肾小管上皮细胞凋亡与氧化应激损伤在AKI病理生理过程中的作用逐渐受到关注[1]。过氧化氢(H2O2)用于建立细胞氧化损伤的应激模型已得到广泛应用,如应用在血管内皮细胞和心肌细胞[2-3]。乌司他丁是一种新型酶抑制剂,可抑制多种蛋白酶活性、稳定溶酶体膜、清除氧自由基、抑制炎症介质释放,可保护危重症患者的肾功能[4],但其具体机制尚未明确。本研究利用H2O2刺激肾小管上皮NRK52E细胞,模拟氧化应激损伤模型,以模拟体内缺血再灌注导致大量氧自由基损伤,然后通过观察乌司他丁对氧化损伤的肾小管上皮细胞的保护作用,初步探讨其对肾小管缺血再灌注损伤的保护作用机制。
1 材料与方法
1.1 材料
1.1.1 主要材料 NRK52E细胞株(中科院上海细胞库),DMEM培养液、小牛血清(Gibicol公司),CCK-8试剂盒(大连宝生物有限公司),反转录聚合酶链反应(RT-PCR)反应体系(Promega公司),超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(南京建成生物科技有限公司),Caspase-3 mRNA引物(上海赛百盛生物技术有限责任公司合成),乌司他丁(广东天普生化药物股份有限公司)等。
1.1.2 分组 设空白对照组,参照作者前期实验[5]及文献[6],使用H2O2浓度为500 μmol/L,乌司他丁浓度分别制备为100、200、400 U/mL进行干预。共分为八组,即N组∶正常对照组,H组∶500μmol/LH2O2,A组∶100 U/mL乌司他丁,B组∶200 U/mL乌司他丁,C组∶400 U/mL乌司他丁,D组∶500 μmol/L H2O2、100 U/mL乌司他丁,E组∶500 μmol/L H2O2、200 U/mL乌司他丁,F组∶500 μmol/L H2O2、400 U/mL乌司他丁。
1.2 方法
1.2.1 细胞培养 NRK52E细胞复苏后置于DMEM培养液(含10%小牛血清、100 U/mL青霉素、100 μg/mL链霉素)中,在37℃、5%CO2培养箱中传代培养。每2~3天消化传代。细胞生长至40%~50%时,去培养基,同步18h后加入不同实验组药物继续培养。
1.2.2 CCK-8法检测细胞增殖活性 调整对数生长期的NRK52E细胞以5 000个/孔接种于96孔板,置于CO2培养箱培养24 h,细胞贴壁后,按照单用乌司他丁组(A、B、C组)及乌司他丁干预H2O2组 (D、E、F组)加药,并继续培养48 h后加入CCK-8试剂,连续培养2 h后取细胞的离心上清液在450 nm处测吸光度值,并据此绘制生长曲线。
1.2.3 流式细胞术检测细胞凋亡率 按细胞凋亡检测试剂盒说明书的检测方法操作。按照1.1.2项各实验组剂量分别给药,调整细胞为每毫升1×105~1×106后使用流式细胞仪检测细胞凋亡率,重复实验3次,用Multicycle DNA软件分析凋亡细胞。
1.2.4 SOD测定 按照1.1.2项各实验组剂量分别给药后按试剂盒说明书操作步骤,将试剂盒内的试剂配制好后使用550 nm、1 cm光径,双蒸水调零、比色,计算光密度(OD)值,计算SOD活力。
1.2.5 MDA测定 按照1.1.2项各实验组剂量分别给药,MDA与硫代巴比妥酸(TBA)反应生成红棕色的三甲川(3,5,5-三甲基恶唑-2,4-二酮),其最大吸收波长为532 nm。吸取离心的上清液2 mL(N组加2 mL蒸馏水),加入2mL0.6%TBA溶液,混匀物于沸水浴上反应15min,迅速冷却后再离心。取上清液测定532 nm的吸光度。计算MDA含量。
1.2.6 RT-PCR检测Caspase-3 mRNA水平 将N、H、A、B组细胞培养24 h后提取细胞总RNA,RNA以10 μL体系逆转录合成cDNA后稀释30倍。Caspase-3 mRNA引物序列正义链∶5′-TGACCGAGGCTACATTCAGATGACACC-3′,反义链∶5′-CAAGAGAG TTGGGCTGACCAGAAACAC-3′,扩增产物为365 bp;β-actin扩增产物为243 bp。扩增后产物用琼脂糖凝胶电泳检测并与β-action比较,然后计算相对表达水平。
1.3 统计学处理 应用SPSS19.0统计软件进行数据分析,计量资料以±s表示,并进行方差分析,PCR检测结果利用凝胶图像处理系统检测条带灰度值。P<0.05为差异有统计学意义。
2 结 果
2.1 细胞增殖情况及生长曲线 A、B、C组细胞增殖情况与N组比较,差异无统计学意义(P>0.05)。见图1。与N组比较,H组细胞增殖情况变化较大,差异有统计学意义(P<0.05);与H组比较,D组细胞增殖情况无明显变化,差异无统计学意义(P>0.05),E、F组变化较大,差异均有统计学意义(P<0.05),见图2。说明200、400 U/mL乌司他丁能抑制H2O2的氧化损伤,而100 U/mL作用不明显。

图1 不同浓度乌司他丁组对NRK52E细胞生长的影响

图2 乌司他丁干预H2O2各浓度组对NRK52E细胞生长的影响
2.2 各组细胞凋亡率比较 H组细胞凋亡率 [(66.30± 1.38)%]较N组[(3.41±1.54)%]显著增高,差异有统计学意义(P<0.05),而乌司他丁预处理组细胞凋亡率[A组(3.65±2.43)%、B组(3.97±1.23)%、C组(4.04±1.32)%]较N组无明显变化,差异均无统计学意义(P>0.05)。与H组比较,E、F组细胞凋亡率[(31.30±1.56)%、(21.50±1.63)%]降低,差异均有统计学意义(P<0.05);而D组细胞凋亡率[(66.30±2.37)%]无明显变化,差异无统计学意义(P>0.05)。说明200、400 U/mL乌司他丁均可使H2O2诱导的细胞凋亡率降低,而100 U/mL无明显影响。
2.3 SOD测定结果 H组SOD活力[(8.73±1.80)U/mL]较N组[(45.63±2.40)U/mL]明显降低,差异有统计学意义(P<0.05),而A、B、C组SOD活力[(42.87±2.10)、(40.54 ±2.00)、(40.32±1.90)U/mL]较 N组无明显变化,差异均无统计学意义(P>0.05)。D、E、F组SOD活力[(27.73± 2.10)、(35.62±1.90)、(40.43±2.10)U/mL]较H组明显升高,差异均有统计学意义(P<0.05)。说明乌司他丁对SOD活力无明显影响,却能够拮抗H2O2对SOD活力的影响。
2.4 MDA测定结果 H组MDA含量[(53.42±2.80)nmol/mL]较N组[(8.25±2.30)nmol/mL]明显升高,差异有统计学意义(P<0.05),而A、B、C组MDA含量[(8.87±2.10)、(9.04±1.90)、(9.32±1.50)nmol/mL]较N组无明显变化,差异均无统计学意义(P>0.05)。D、E、F组MDA含量[(49.73±2.10)、(38.57±1.80)、(30.53±2.00)nmol/mL]较H组明显降低,差异均有统计学意义(P<0.05)。说明乌司他丁对MDA含量无明显影响,但可以拮抗H2O2对MDA含量的影响。
2.5 乌司他丁对Caspase-3 mRNA水平的影响 随着乌司他丁浓度的增加,Caspase-3 mRNA的表达减少。见图3。与N组比较,H组Caspase-3 mRNA的表达明显增高,差异有统计学意义(P<0.05);与H组比较,A、B组Caspase-3 mRNA的表达降低,差异均有统计学意义(P<0.05)。见图4。

图3 不同处理因素下Caspase-3基因PCR扩增产物电泳图
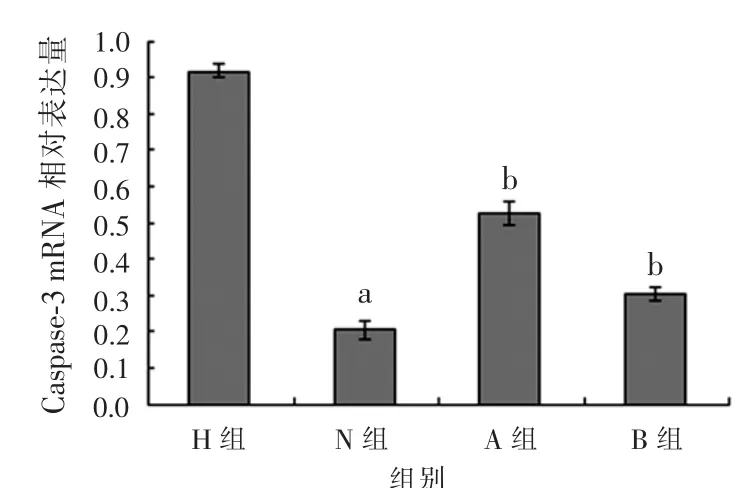
图4 不同处理因素下Caspase-3 mRNA表达结果
3 讨 论
肾脏缺血再灌注损伤是一种常见的临床病理生理过程,常导致急性肾功能衰竭。而肾小管上皮细胞损伤是其主要病理特征。
细胞损伤后机体内H2O2能够大量释放羟氧自由基(OH-),而且通过脂质过氧化反应等一系列反应导致肾小管上皮细胞结构的损伤[7]。SOD作为内源性氧自由基清除剂的代表之一,对机体起保护作用,其活力高低可在一定程度上反映内源性氧自由基的清除活力;MDA作为膜脂质降解产生的主要代谢产物,常用来反映脂质过氧化后的氧自由基对组织损伤的程度,故检测SOD及MDA对评估氧化损伤具有重要意义。
乌司他丁是从人尿液中分离纯化的蛋白酶抑制剂,属人体内源性抑炎物质,其前体是肝脏合成的胰蛋白酶抑制剂。有研究发现,乌司他丁对多种酶,如胰蛋白酶、α-糜蛋白酶等有抑制作用,可抑制多种水解酶的活性、稳定溶酶体膜、抑制炎症介质的过度释放及改善微循环和组织灌注[8-9]。有研究证明,乌司他丁对心肌缺血再灌注损伤有保护作用,其机制与清除氧自由基,抑制炎症介质释放,以及稳定细胞膜及改善微循环等有关[10-11]。也有研究证明,乌司他丁具有抗心肌缺血再灌注损伤作用,其机制可能是通过下调IL-6和IL-8介导的炎性反应而实现[12]。而乌司他丁保护肾功能的作用机制目前具有多种可能,如与其抗氧化作用、抑制氧自由基生成、清除氧自由基、稳定细胞膜及减轻自由基引起的肾组织损伤和改善细胞能量代谢有关。
本研究观察到氧化损伤后NRK52E细胞活力明显下降,而SOD活力减少,MDA增加,证实氧化应激确实参与了缺氧导致的肾小管上皮细胞的损伤。并发现乌司他丁对氧化应激损伤的肾小管上皮细胞也有直接的保护作用,其保护作用可能与乌司他丁通过清除过氧化物代谢、提高细胞抗氧化和抑制其脂质过氧化作用,拮抗H2O2对SOD活力的影响,减轻细胞氧化损伤对缺血再灌注肾小管的损伤,并对肾小管具有保护作用。且其保护效应与其浓度具有一定关系。
以酶原细胞形式存在于正常细胞质中的Caspase-3,在凋亡早期即被激活,而活化后的Caspase-3以级联方式逐级放大激活procaspase-2、procaspase-6、procaspase-8、procaspase-10的凋亡信号,从而诱导细胞凋亡[13]。本研究发现,H2O2诱导的NRK52E细胞的氧化应激损伤主要表现为细胞凋亡,预处理给予乌司他丁培养发现,乌司他丁组与H组比较,可显著改善细胞凋亡率,提高细胞存活率。并发现乌司他丁使SOD活力增加,MDA含量减低,说明乌司他丁可能通过清除氧自由基发挥抗氧化作用,并通过下调Caspase-3的表达,从而抑制细胞凋亡、减轻细胞损伤。
本研究结果表明,乌司他丁对氧化损伤的肾小管上皮细胞具有保护作用,其机制可能与其清除氧自由基、减轻自由基引起的肾组织损伤和改善细胞能量代谢有关;同时发现,在保护肾小管上皮细胞对抗氧化损伤诱导的细胞凋亡过程中能明显抑制Caspase-3 mRNA的表达,乌司他丁抑制细胞凋亡的机制可能与抑制下调Caspase-3的表达有关,并通过阻断细胞的级联凋亡反应,对缺氧导致的肾缺血再灌注损伤起保护作用。其可能机制能为临床进一步有效治疗AKI提供实验基础及靶向治疗的科学理论基础。
[1]Castaneda MP,Swiatecka-Urban A,Mitsnefes MM,et al.Activation of mitochondrial apoptotic pathways in human renal allografts after ischemiareperfusion injury[J].Transplantation,2003,76(1)∶50-54.
[2]苏玲,屠伟峰,陈茜,等.右美托咪定对血管内皮细胞氧化应激损伤的影响[J].实用医学杂志,2013,29(9)∶1397-1399.
[3]欧阳惠碧,屠伟峰,郄文斌,等.乌司他丁提前给药对H9c2细胞氧化应激损伤的影响[J].实用医学杂志,2014,30(12)∶1860-1863.
[4]李宁,谢睿彬,张光华,等.乌司他丁对重型颅脑创伤患者肝肾功能的保护作用[J].中国全科医学,2010,13(30)∶3440-3441.
[5]温海滨,覃勋,唐峰年,等.丹参多酚酸盐预处理对肾小管上皮细胞凋亡的保护机制[J].中国中西医结合肾病杂志,2013,14(11)∶997-999.
[6]Jena S,Chainy GB.Regulation of expression of antioxidant enzymes by vitamin E and curcumin in L-thyroxine-induced oxidative stress in rat renal cortex[J].Mol Biol Rep,2011,38(2)∶1047-1054.
[7]Song JE,Kang WS,Kim DK,et al.The effect of ulinastatin on postoperative blood loss in patients undergoing open heart surgery with cardiopulmonary bypass[J].J Int Med Res,2011,39(4)∶1201-1210.
[8]Fang Y,Xu P,Gu C,et al.Ulinastatin improves pulmonary function in severe burn-induced acute lung injury by attenuating inflammatory response[J].J Trauma,2011,71(5)∶1297-1304.
[9]胡森,周国勇,程中贵,等.乌司他丁对促炎症因子诱导的肺微血管内皮细胞通透性和细胞因子产生的影响[J].感染、炎症、修复,2011,12(4)∶224-227.
[10]Xu CE,Zhang MY,Zou CW,et al.Evaluation of the pharmacological function of ulinastatin in experimental animals[J].Molecules,2012,17(8)∶9070-9080.
[11]许建强,梁建球,袁满娟,等.乌司他丁对心肌缺血-再灌注损伤患者炎症抑制作用的影响[J].实用医学杂志,2013,29(20)∶3406-3408.
[12]王媛媛,曹建,邓莉,等.乌司他丁对大鼠缺血再灌注心肌细胞的保护机制[J].中国医药导报,2014,11(20)∶13-15.
[13]杜红俊,惠延年,王雨生,等.Caspase-3在柔红霉素诱导的人视网膜色素上皮细胞凋亡中的作用[J].第四军医大学学报,2001,22(7)∶609-611.
Study on protective effect of ulinastatin on renal tubular epithelial cells oxidative injury
Wen Haibin1,QinXun1,Meng Ruqing1,Tang Fengnian1,Wei Zhe1,Tan Ning2
(1.Hechi Municipal People′s Hospital,Hechi,Guangxi 547000,China;2.Scientific and Experimental Center,Guilin Medical College,Guilin,Guangxi 541001,China)
ObjectiveTo investigate the protective effect and mechanism of ulinastatin on renal tubular epithelial cells oxidative injury.MethodsRenal tubular epithelial cells NRK52E were randomly divided into 8 groups,group N∶normal control group,group H∶500 μmol/L H2O2,group A∶100 U/mL ulinastatin,group B∶200 U/mL ulinastatin,group C∶400 U/mL ulinastatin,group D∶500 μmol/L H2O2+100 U/mL ulinastatin,group E∶500 μmol/L H2O2+200 U/mL ulinastatin and group F∶500 μmol/L H2O2+400 U/mL ulinastatin.The cellular superoxide dismutase(SOD)activity and methane dicarboxylic aldehyde(MDA)level were detected.The cellular oxidative injury situation was observed.The cellular proliferation activity was observed by MTT assay,apop tosis was detected by flow cytometry and the expression of Caspase-3 gene mRNA was detected by RT-PCR.ResultsThe apoptosis rate in the group H was significantly higher that in the group N,A,B and C,the difference was statistically significant(P<0.05);the apoptosis rate in the group E and F were significantly lower than those in the group H,the difference was statistically significant(P<0.05);compared with the other groups,the activity of SOD decreased obviously,and the content of MDA increased apparently,with statistically significant difference(P<0.05);compared with the group H,the expression of Caspase-3 mRNA in group A and B both decreased,with statistically significant difference(P<0.05).ConclusionUlinastatin has significant antioxidation effect and inhibits apoptosis.Ulinastatin pretreatment has a protective effect on H2O2-induced oxidative stress injury in renal tubular epithelial cells and its mechanism may be related to down-regulation of Caspase-3 expression.
Hydrogenperoxide;Woundsandinjuries;Epithelialcells;Kidneytubules;Ulinastatin; Oxidativestress
10.3969/j.issn.1009-5519.2015.13.004
:A
:1009-5519(2015)13-1937-03
∶2015-03-21)
∶温海滨(1976-),男,广西河池人,硕士研究生,主治医师,主要从事肾脏疾病相关研究;E-mail∶whbniu@163.com。
∶谭宁(E-mail∶wind146wind@yahoo.com.cn)。

