某锅炉房脱硫工艺分析与优化
刘元斌
【摘 要】本文对某链条炉锅炉房脱硫工艺进行介绍、并对其实际应用情况,优缺点和技术经济性作了分析,着重介绍炉内脱硫及双碱法脱硫在本锅炉房的实际应用,将问题一并阐述的同时,提出改进及优化方案。
【关键词】链条炉;固硫剂;双碱法;SO2
1前言
某锅炉房有六台链条炉,主要脱硫措施为脱硫塔双碱法烟气脱硫以达到降低硫含量的目的。
而在实际使用中,虽可达到环保局规定的硫化物排放标准,但是药剂损失严重,运行成本巨大等情况一直存在,尤难解决。
根据部分锅炉房脱硫设备设施运行使用上的经验及新老脱硫技术的应用,结合某链条炉锅炉房现有脱硫工艺现状,提出脱硫工艺优化、改进措施及方案,在达到标准的同时,合理降低运行成本。
2某锅炉房脱硫工艺简介
2.1双碱法脱硫工艺简介
烟气中的SO2在塔内吸收,利用SO2气体与雾化后的碱性吸收液在气液界面上的平衡度、在液相中的溶解度之间的特性关系,尤其是气相中SO2的传质速度、液相中的SO2传质速度、物理吸收传质分系数、物理吸收液相传质分系数、SO2在气相中的分压、SO2在液相中的浓度等特性,借助于气体在液体中的扩散,对SO2及粉尘进行吸收。气液间的化学反应强度及反应时间决定吸收率。
物理吸收主要利用气体、液体的物理特性。当烟气在液体的雾化过程中,实际上是气—液两相间的传热传质过程。
液体被雾化后(单位表面积扩大了2000余倍),迅速向雾状液滴大面积扩散,使烟气中的SO2及粉尘与液滴充分接触。当SO2浓度在气-液两相间达到平衡后,SO2温度降低由气态转入液态,从而更容易被碱性液体充分吸收。
化学吸收主要利用SO2和碱性吸收液的化学特性完成下列化学反应:
酸性:SO2属中等强度的酸性氧化物,可用碱性物质吸收,生成盐类。
氧化性:SO2在水中有中等溶解度,溶于水后生成H2SO3,氧化后可生成稳定的H2SO4。
还原性:在与强氧化剂接触或催化剂及氧存在时,SO2可被氧化成SO3。
2.2主要化学反应原理(火碱法)
①脱硫过程
SO2+H2O=H2SO3=2H++SO32-
2NaOH+2H++SO32-=Na2SO3+2H2O
Na2SO3+SO2+H2O=2NaHSO3
②再生过程
CaO+H2O=Ca(OH)2
Ca(OH)2+2NaHSO3=Na2SO3+CaSO3+1.5H2O
Ca(OH)2+Na2SO3=2NaOH+CaSO3
CaSO3+1/2O2=CaSO4
由方程式可见在石灰浆液(石灰达到过饱和状况)中,NaHSO3很快跟Ca(OH)2反应从而释放出[Na+],[SO32-}跟[Ca2+]反应,反应生成的CaSO3以半水化合物形式慢慢沉淀下来而使[Na+]得到再生。可见NaOH只是作为一种启动碱,起动后实际消耗的是石灰,理论上不消耗火碱。
2.3双碱法实际应用情况
大多数锅炉房在采用火碱双碱法的实际运行中,双碱法的第二个碱法基本无法实现,具体原因如下:
①按照上述原理进行双碱法工艺,运行中制备石膏则将耗费一定的人力、物力及财力;
②回收的火碱与石膏混合,呈悬浮、黏着状,进入脱硫塔内会附着、甚至堵塞喷嘴等附件上,而所回收的火碱浓度也无法保证;
③石膏未有固定的厂家进行回收,经济价值极小,如直接排放也将对堵塞下水管道,产生二次污染;
④生石灰制备熟石灰的过程中反应放热,对工作环境有较大影响,也存在一定的安全隐患。
本锅炉房也与大多数采用火碱双碱法脱硫工艺的锅炉房相同,在双碱法启用不久后改为单碱脱硫,具体工艺为在运行中采用人工加30%质量浓度火碱溶液进行脱硫,实际运行中可达到废气排放标准,但与之同时运行成本也相对较高。
3双碱法工艺优化
3.1现有脱硫剂优化分析
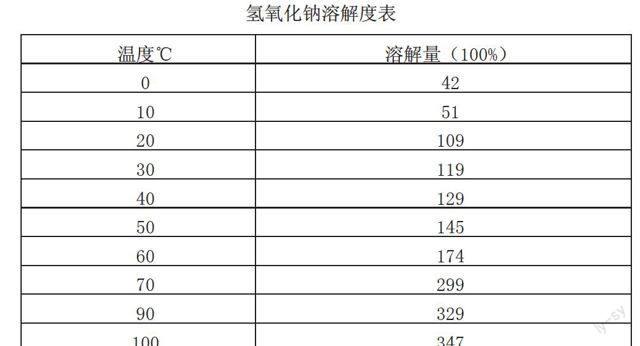
双碱法可采用的与SO2反应的物料有多种,如纯碱、火碱、氧化镁、氧化钙等,而采用火碱进行脱硫的方法成本相对较高。现用脱硫剂为30%质量浓度火碱溶液,只相当于10℃下火碱的溶解度,见表1火碱溶解度表:
可见20℃下的火碱溶解度比例最大,也最经济,因此如继续应用火碱为反应物料,则脱硫剂应在20℃下进行勾兑,质量浓度在100%以上为最佳。
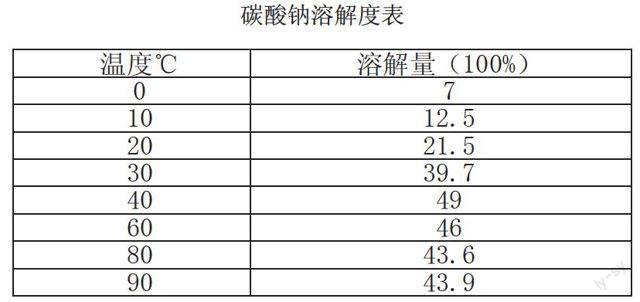
3.2其他脱硫剂探究(纯碱法)
考虑火碱成本较高,可考虑以纯碱替代,纯碱作为反应物料的方程式如下:
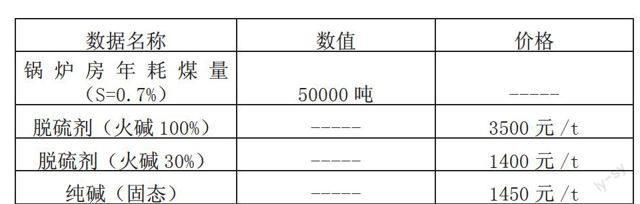
塔内吸收SO2
Na2CO3+SO2=Na2SO3+CO2(1)
CO32-+H2O==HCO3-+OH-(2)
2NaOH+SO2=Na2SO3+H2O(3)
Na2SO3+SO2+H2O=2NaHSO3(4)
以上三式视吸收液酸碱度不同而异,而(1)为所有反应过程中的主反应,碱性较高时(PH>9)以(3)式为主要反应;碱性稍为降低时以(1)式为主要反应;碱性到中性甚至酸性时(5 兩种物料的主反应方程式如下 Na2CO3+SO2=Na2SO3+CO2 2NaOH+2H++SO32-=Na2SO3+2H2O 可见1mol的Na2CO3可与1mol的SO2反应,而2mol的NaOH与1mol的SO2反应。在都处理1molSO2的情况下,分别用量为106g(Na2CO3)及80g(NaOH),使用倍数为1.3倍。 纯碱溶解度稍逊于火碱,由表2碳酸钠溶解度表计算可知,在30℃溶解度下制备碱液,浓度最高可达到28%,正常工况下脱硫塔运行温度在30℃以上,完全可以实现纯碱作为物料脱硫。 为避免操作中存在的不安全因素,暂不考虑钙镁氧化物作为反应物料。 4经济效益分析 4.1参数设定 以下数据为实际用量估算及市场价格采集值,只作为计算效益数据用,不与实际值真实符合,参数见表3 4.1不同浓度火碱脱硫剂费用比较 煤含硫量:0.7%*50000t=350t,可得NaOH用量约为350t*80/64≈437.5t 脱硫剂(火碱100%)费用:3500元/t*437.5t=153.125万元 脱硫剂(火碱30%)费用:1400元/t*3.3*437.5t=202.125万元 4.2纯碱固态脱硫费用 Na2CO3用量约为350t*106/64≈580t 纯碱(固态)费用:1450元/t*580t=84.1万元 4.3经济效益综合比较 通过以上计算可知,在固硫剂停用的情况下,使用纯碱脱硫的成本最低,建议及时改进、推广。 5结论 本文以某锅炉房脱硫工艺为例,通过探讨脱硫工艺及运行现状,提出了文中所述的几项改进措施,得出以下结论: 1、如继续使用火碱脱硫剂,为节省成本应立即要求供货商增加浓度或者采购固态火碱自行制备碱液。 2、将火碱改为纯碱,效果不变,成本将大大降低,也建议采购固态纯碱自行制备碱液。 3、环保是一项利国利民的工作,虽然实施难度大,运行成本高,但必须严格执行,因此要求相关人员在运行管理中,要将理论与实践充分结合,在确保各项指标达标的情况下,积极控制、降低成本。

