西瓜种质资源的遗传多样性分析
戴照义 王运强 刘志雄 郭凤领 焦春海 邱正明


摘 要: 对88份来源不同的西瓜种质资源,采用37个表型性状和22对SSR分子标记进行遗传多样性分析。结果表明:表型性状变异主要体现在果实形状、品质和叶片等性状上,第1、第2、第3主成分的方差贡献率分别为13.6%、11.8%和9.0%,前3个主成分的累计为34.4%,依据表型性状进行聚类分析,在欧氏距离15.0时,可将材料分成2类,在欧氏距离13.5时,可将材料分为3类;SSR分子标记共扩增出的55个多态性位点,平均多态性信息含量为0.41,利用UPGMA法进行聚类分析,88份西瓜种质可以被分为4个组。第1、第2、第3主坐标的方差贡献率分别为22.8%、10.8%和9.1%,前3个主坐标累计为42.7%。
关键词: 西瓜; 种质资源; 遗传多样性; 表型性状; SSR分子标记
Abstract: Genetic diversity of 88 accessions watermelon germplasm resources were analyzed using 37 phenotypic characters and 22 simple repeat sequences(SSR) molecular markers. The results showed that the variations in fruit shape,quality and leaf were the main sources of variations in phenotypic characters. The variance contribution of the first three principle components were 13.6%,11.8% and 9.0%,cumulative proportion was 34.4%. According to the cluster analysis of the phenotypic characters,the watermelon germplasm resources were divided into 2 categories at euclidean distance of 15.0,and 3 categories at euclidean distance of 13.5. The SSR molecular markers amplified 55 polymorphic loci,the average polymorphic information content (PIC) was 0.41. The cluster analysis using UPGMA method showed that 88 watermelon germplasm resources were classified as 4 groups. The variance contribution of the first three principal coordinates were 22.8%,10.8% and 9.1%,cumulative proportion was 42.7%. In conclusion,the 88 watermelon germplasm resources contains relatively abundant genetic variations.
Key words: Citrullus lanatus; Germplasm resources; Genetic diversity; Phenotypic character; SSR molecular markers
西瓜(Citrullus lanatus(Thunb.)Matsum. & Nakai)是重要的經济作物,我国西瓜年种植面积近200万hm2,面积和产量均居世界第一位[1-2]。种质资源是西瓜育种的基础,是西瓜品种更新换代的创新来源。对种质资源进行挖掘利用,可以改良西瓜的品质,提高产量,并增强西瓜抵御各种病虫害的能力[3]。为了保护种质资源,我国建有国家种质长期库和多种作物中期库,其中蔬菜中期库和西瓜甜瓜中期库中分别保存有500余份和1 500余份西瓜种质资源[4]。对西瓜种质资源遗传多样性分析主要依据表型性状和SSR分子标记技术。潘存祥等[5]采用变异系数、多样性指数和聚类分析等方法,对国内外783份西瓜种质资源24个表型性状进行了遗传多样性研究和聚类分析,结果表明,欧氏距离25可作为属内划分西瓜种的遗传距离,20可作为划分西瓜亚种的遗传距离,15可作为划分西瓜变种的遗传距离。范敏等[6]对从美国资源库中引进的1 373份西瓜资源在新疆种植条件下,应用聚类分析和主成分分析方法将其分为5个类群、8大分枝。苏玉环等[7]、陈萍等[8]也分别根据西瓜果实表型性状,对100份和119份西瓜种质资源进行聚类分析,分别将其聚类成4类和10类。分子标记技术以个体间的遗传物质内核苷酸序列碱基变异为基础的遗传标记,直接反映了DNA水平的遗传多态性,具有标记数量丰富、较高的遗传稳定性、多态性数量多、较强的化学稳定性、技术简单快速等[9]。刘丽娟等[10]利用21对SRAP引物标记对28个西瓜品种的遗传多样性进行分析,发现28份西瓜品种的多态性高达72.0%,各材料间相似系数在0.92至0.99之间,并将所有材料聚类划分为4类。李朋飞等[11]运用SRAP分子标记技术对80份西瓜种质资源的遗传多样性进行分析发现,这些西瓜种质的遗传相似系数在0.94~1.00之间,通过聚类划分为3个类群。以上对西瓜遗传多样性的研究分析发现,西瓜种质材料遗传背景较为狭窄,相似度较高,多数品种亲缘关系较近,品种间同源性较高。本研究对88份来源不同的西瓜种质资源进行表型性状和SSR分子标记的遗传多样性分析,为西瓜种质资源的研究利用和新品种选育提供参考。
1 材料与方法
1.1 试验材料
供试材料为湖北省农业科学院经济作物研究所保存的88份西瓜种质资源,材料编号为E01-E88,名称和来源见表1。
1.2 表型性状调查
2013年将试验材料种植在湖北省农科院蔬菜基地中,按照《西瓜种质资源描述规范和数据标准》[12]规定的描述规范、数据采集和记录标准调查表型性状,并对用文字描述部分的表型性状进行赋值。用R软件包对表型性状进行描述性统计分析,计算最大值、最小值、平均数、标准差和变异系数。再对每个性状进行标准化处理,以消除量纲的影响,而后用R软件包进行主成分分析,用NTSYS软件进行聚类分析并作图。
1.3 SSR分析
在田间选取西瓜材料,对其幼嫩新鲜的叶片进行混合取样,采用CTAB法[13]提取基因组DNA。用超微量分光光度计(NanoDrop 2000,Thermo Fisher Scientific,USA)检测DNA纯度和浓度,然后将DNA浓度稀释至20 ng·μL-1备用。选用的23对引物是基于西瓜全基因组序列开发的能最大限度代表遗传多样性的SSR引物[14]。引物由武汉天一辉远生物科技有限责任公司合成。
PCR反应体系(10 μL):2×PCR mix(transgen for PAGE)4 μL;Primer F(10 μmol·L-1)0.5 μL;Primer R(10 μmol·L-1)0.5 μL;gDNA(20 ng·μL-1)1.5 μL;ddH2O 3.5 μL。PCR程序:94 ℃预变性5 min;94 ℃变性30 s;55 ℃退火15 s;72 ℃延伸15 s;34个循环;72 ℃延伸4 min;10 ℃保存。PCR产物经8%非变性聚丙烯酰胺(PAGE)凝胶电泳分离后,采用快速银染法显色并照相记录[15]。
在电泳图上相同的位置如果有带记为“1”,无带记为“0”,将SSR电泳结果转化为数字矩阵。用NTSYS软件进行聚类分析和主坐标分析。用Powermarker软件计算等位基因数量、基因多样性、杂合度和多态性信息含量等遗传参数。
2 结果与分析
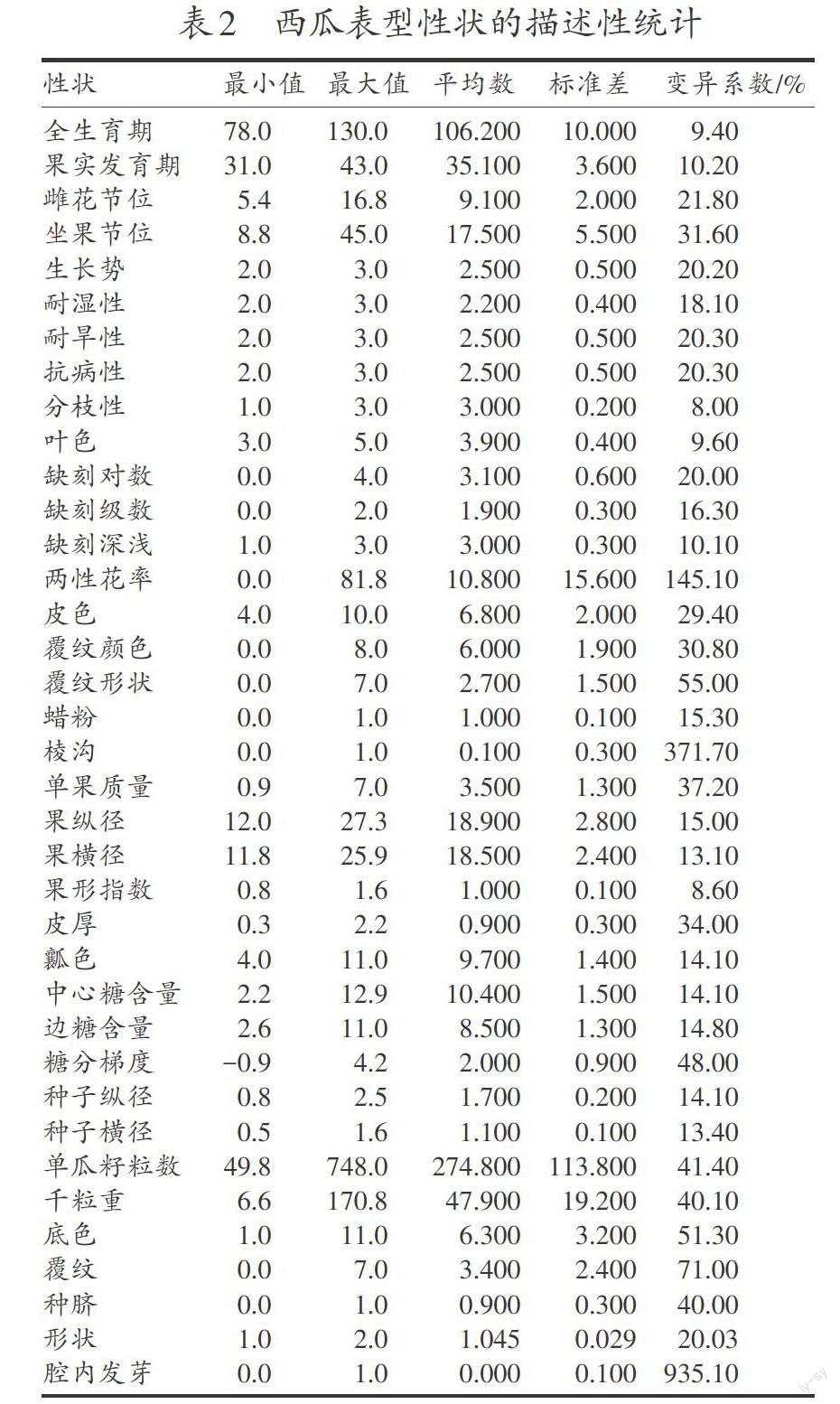
2.1 西瓜表型性状的描述性统计分析
对每个表型性状进行了描述性统计分析,结果见表2。根据各性状的变异系数进行分析可知:这些材料的坐果性状、抗逆性、叶片缺刻对数、果实外观、皮厚、糖分梯度均存在較为丰富的遗传变异,而生育期性状、分枝性、叶色、缺刻深浅、果实形状、种子形状遗传范围相对较窄。西瓜种质资源的主要不利性状如果实表面棱沟、两性花率、腔内发芽等遗传变异均很大,在利用过程中要严格加以选择。
2.2 西瓜表型性状的主成分分析
对各个性状的数据进行标准化后进行主成分分析。结果表明,第1、第2、第3主成分的方差贡献率分别为:13.6%、11.8%和9.0%,前3个主成分的累计方差贡献率为34.4%。由于同时对37个表型性状进行分析,影响因素多,前14个主成分的方差贡献率才达到80%。
根据每个表型性状在前3个主成分中的荷载,前3个主成分主要反映的是果实、叶片和抗性性状的差异,其中第1主成分主要反映的是果实大小、形状和种子大小的差异,第2主成分主要反映的是果实坐果性状和果实品质的差异,第3主成分主要反映抗病性和叶片性状的差异。
2.3 基于表型性状的聚类分析
对表型数据进行标准化处理,计算品种间的欧氏距离,用UPGMA法进行聚类,结果见图1。由图1可知:E09和E58两份材料之间的表型差异最小,而E06和E59与其他种质之间的表型差异相对较大。聚类分析与主成分分析表现出了比较一致的结果。
在欧氏距离15.0时,可将材料分成2类,其中Ⅰ类包括E59这1份野生西瓜材料,其抗病性强、晚熟、难坐果、含糖量低,Ⅱ类包括其他87份材料;在欧氏距离13.5时,可将材料分为3类,其中Ⅰ类同上,Ⅱ-1类仅含E06这1份材料,花皮早熟小果型,种子千粒重6.6克,种子有腔内发芽现象,Ⅱ-2类包括其他86份材料;在欧氏距离12.0时,可将材料分为4类,其中Ⅰ类和Ⅱ-1类同上,Ⅱ-2类又分为2组,其中Ⅱ-2-1组包括E43和E37这2份材料,其余材料为Ⅱ-2-2组。2.4 西瓜种质材料遗传差异的SSR分析
23对核心西瓜SSR标记中,除标记M17扩增失败之外,其他22个标记都扩增出了高质量的条带,并在88份西瓜种质材料之间表现出了多态性。其中M14的电泳结果见图2。
用Powermarker软件分析了SSR标记在88份西瓜种质中检测到的多态性参数,结果见表3。22个SSR标记中平均每个检测到2.5个等位基因。M19检测到的基因多样性指数最高,为0.65,M2检测到的最低,为0.18,平均为0.49。杂合度的分布范围较广,平均为0.52。M2检测到的多态性信息含量最低,为0.17;M19检测到的多态性信息含量最高为,0.58。22个SSR标记在88份材料中检测到的平均多态性信息含量为0.41,表明供试的西瓜种质材料之间蕴藏着中度的遗传多样性。
2.5 基于SSR标记的聚类分析
利用22对核心引物在88份材料中扩增出的55个多态性位点,计算种质间Jaccard相似系数,利用UPGMA法进行聚类分析,聚类结果见图3。由图3可知:22对核心SSR标记并没能检测出E04、E10和E76之间,E09、E58、E69和E71之间,E46和E47之间,E48和E81之间,E78和E79之间的遗传差异,表明这些种质之间的遗传相似度非常高。
在Jaccard相似系数0.50处,可将88份西瓜材料分为4个组,其中E06和E59都分别被单独分为一组,其中E59为野生西瓜材料,晚熟、难坐果、含糖量低、抗病性强,而E06为早熟小果型材料,种子极小,千粒重仅6.6克。E07、E46和E21、E35等38份材料被分为一组,多数材料为花皮、早熟、果型较小;E01、E19和E41、E54等48份材料被分为一组,多数材料为黑皮、中晚熟、果型较大。
2.6 基于SSR标记的主坐标分析
利用22对核心SSR标记对88份西瓜种质进行主坐标分析,其中第1、第2、第3主坐标的方差贡献率分别为22.8%、10.8%和9.1%,前3个主坐标的累计方差贡献率为42.7%。
3 讨 论
本研究的表型性状分析结果中,分枝性、果实纵横径比值、全生育期、叶片颜色、叶片缺刻深浅等变异系数小,具有较稳定的遗传特征;而两性花率、种皮覆纹、果皮覆纹形状、糖分梯度等变异系数大,存在较为丰富的遗传变异。这与纪海波[16]、张法惺[17]的研究结果,在多数性状上结论比较吻合,部分性状则得出了不同的结论。原因一是可能和选用的种质资源的来源不同有关,二是表型性状标记受环境因素和人为因素的影响较大。
本研究前3个主成分的累计方差贡献率仅为34.4%,前14个主成分累计才达到80%。与王志强等[18]的前3个主成分即达到84.31%差别较大,而与纪海波[19]的研究结果比较接近,这是由于采用的表型性状数量不同所致,前者仅采用了6个表型性状,而后者采用了22个。根据荷载分析,第1个主成分主要反映果实和种子的变异,第2主成分主要反映果实品质和熟性的变异,第3主成分主要反映的是叶片性状和抗逆性的差异,可见西瓜种质资源的表型变异主要體现在果实形状、品质和叶片等性状上。
基于表型性状和SSR分子标记的聚类分析,均能较好的将88份西瓜种质资源进行区分,与陈萍[8]、纪海波[19]、潘存祥[5]等的研究得出了相似的结论,两种方法都能将野生西瓜资源E59和种子极小、有腔内发芽现象的小果型西瓜资源E06单独聚为1组。但在其他分组结果上存在一定的差异,与张法惺[20]的研究结果比较一致。
4 结 论
对88份不同来源的西瓜种质资源选择37个表型性状和22对西瓜核心SSR标记进行遗传多样性分析,结果表明这些材料中存在较为丰富的遗传多样性。形态学标记较为直观、具体,但在操作时易受环境因素和人为因素影响。SSR分子标记是从分子水平揭示西瓜种质资源之间的差异,通过选择合适的标记,能够很好的揭示西瓜种质资源的遗传多样性。这两种方法从不同的水平和角度出发,表达不同的遗传信息,可互相补充。
参考文献
[1] 马跃. 透过国际分析,看中国西瓜甜瓜的现状与未来[J]. 中国瓜菜,2011,24(2): 64-67.
[2] 戴照义,王运强,郭凤领,等. 西瓜安全生产技术指南[M]. 北京:中国农业出版社,2012,1-16.
[3] 马双武,王吉明,韦小敏. 我国西瓜特异种质资源研究利用进展[J]. 植物遗传资源学报,2006,7(4): 484-487.
[4] 马双武,王吉明,邱江涛,等. 我国西瓜甜瓜种质资源收集保存现状及建议[J]. 中国西瓜甜瓜,2003(5): 17-19.
[5] 潘存祥,许勇,纪海波,等. 西瓜种质资源表型多样性分析及聚类分析[J]. 植物遗传资源学报,2015,16(1): 59-63.
[6] 范敏,宫国义,张瑞麟,等. 美国资源库西瓜种质的初步观察与数量分类[J].中国西瓜甜瓜,2004(4): 1-3.
[7] 苏玉环,王静华,李文芹,等. 西瓜种质资源果实性状及聚类分析[J].河北农业大学学报,2008,31(6): 21-25.
[8] 陈萍,祝佳强,祝双田,等. 西瓜种质材料果实性状的变异性和聚类分析[J].北方园艺,2010(17): 182-184.
[9] 焦仁海,孙发明,刘兴二,等. 玉米DNA分子标记及其研究进展[J]. 中国农学通报,2006,22(4): 48-51.
[10] 刘丽娟,舒烈波,罗利军,等. SRAP标记与形态学标记在西瓜DUS测试中的比较[J]. 植物遗传资源学报,2011(5): 790-795.
[11] 李朋飞,霍秀爱,程永强,等. 基于SRAP的西瓜种质资源遗传多样性评价[J]. 中国农业科技导报,2013(2): 89-96.
[12] 马双武,刘君璞,王吉明,等. 西瓜种质资源描述规范和数据标准[M]. 北京:中国农业出版社,2005: 9-53.
[13] Murry H G,ThomsPon W F. Rapid isolation of weight DNA[J]. Nucleie Acid Res,1980,8(19): 4321.
[14] Zhang H Y,Wang H,Guo S G,et al. Identification and validation of a core set of microsatellite markers for genetic diversity analysis in watermelon,Citrullus lanatus(Thunb.) Matsum. & Nakai[J]. Euphytica,2012,186(2): 329-342.
[15] Bassam B J,Caetano-Anolles G,Gresshoff PM. Fast and sensitive silver staining of DNA in poly-acrytamide gels[J]. Analytical Bio chemistry,1991, 196(1): 80-83.
[16] 纪海波,张玉鑫,李玉明,等. 西瓜种质资源主要性状的表型多样性[J].西北农林科技大学学报(自然科学版),2013,41(8):34-38.
[17] 张法惺,栾非时,盛云燕. 不同生态类型西瓜种质资源遗传多样性的SSR分析[J]. 中国蔬菜,2010(14): 36-43.
[18] 王志强,郭松,刘声锋,等. 西瓜种质资源果实主要数量性状的主成分分析[J]. 东北农业大学学报,2014,45(3): 59-64.
[19] 纪海波. 西瓜种质资源表型多样性研究[D]. 兰州:甘肃农业大学,2013.
[20] 张法惺. 西瓜种质资源遗传多样性的分析[D]. 哈尔滨:东北农业大学,2010.

