一株高抗氧化活性银杏内生真菌SG0016的鉴定及其培养条件优化
葛 飞,石贝杰,高樱萍,胡梦君,龚 倩,桂 琳
(1 安徽工程大学 生物与化学工程学院,安徽芜湖241000;2 皖南医学院微生物与免疫学教研室,安徽芜湖241000)
植物内生真菌是生活在健康的植物组织内部,形成不明显侵染的一类真菌[1]。因其能产生与宿主植物相似或相同的生理活性成分,从植物内生菌中寻找新型的天然产物和活性物质是目前一个重要的研究方向,受到了越来越广泛的关注[2-4]。植物内生真菌分布非常广泛,能产生多种不同化学结构的代谢产物,具有抗菌、抗氧化、抗肿瘤、抗病毒、杀虫、植物生长调节和免疫调节等生物学活性[5],被认为是寻找新的生物活性物质的重要资源[6]。银杏含有多种功效成分[7],是中国特有的珍稀植物。根据内共生的理论,银杏内生真菌有可能产生与银杏组织相同功效的活性成分,加强对其内生真菌的研究开发具有重要意义[8]。Xiao等[9]对80种分离自银杏的内生真菌的抗菌活性进行了研究,其中15株内生菌能抑制至少一种测试菌,部分银杏内生真菌的代谢产物具有较强的抑菌活性,是寻找和发现抗菌活性物质的潜在资源。鞠秀云等[10]采用气-质联用法对银杏内生菌发酵液中挥发油成分进行了研究,分离出18个峰,被确认为17种化合物。申屠旭萍等[11]对银杏内生真菌No.1028菌株代谢产物的抗真菌活性及其培养生物学特性进行了研究,发现其代谢产物对多种植物病原真菌具有较强的抑制作用。
银杏叶是目前临床使用较广泛的中药材之一,银杏叶提取物制剂已成为全球植物药制剂的重要品种[12]。本课题组前期研究结果发现,从银杏叶中分离的一株内生真菌SG0016,其发酵液甲醇提取物具有较高的DPPH 自由基清除能力。本研究采用形态学和分子生物学相结合的方法对该菌株进行了鉴定,并对其抗氧化培养条件进行了优化,为该菌株的进一步应用和天然抗氧化剂的开发提供了理论依据和新途径。
1 材料和方法
1.1 材 料
(1)菌株:内生真菌SG0016从银杏健康叶片中分离、纯化获得。(2)斜面培养基:PDA 培养基(马铃薯200g,葡萄糖20g,琼脂15g,水1 000mL)。(3)种子液和发酵基础培养基:PDB 培养基(马铃薯200g,葡萄糖20g,水1000mL)。
1.2 仪器和试剂
1.2.1 主要仪器 QHZ-123B 型恒温振荡培养箱 (江苏太仓市华美生化仪器厂);SW-CJ-2F 型超净工作台(苏州安泰空气技术有限公司);RE-25旋转蒸发仪(上海亚荣生化仪器厂);Tecan SUNRISE酶标仪(瑞士Tecan公司);FD-83冷冻干燥机(美国SIM 公司);YXJ-2离心机(湘仪离心机仪器有限公司);TP600 型梯度PCR 仪(日本TaKaRa公司);DYCP-31DN 电泳仪(北京市六一仪器厂);JS-380C全自动数码凝胶成像分析仪(上海培清科技有限公司)。
1.2.2 主要试剂 DPPH 试剂购自美国Sigma公司,葡萄糖等化学试剂均为分析纯。
1.3 试验方法
1.3.1 银杏内生真菌的分离、纯化方法 将采集的新鲜银杏叶表面清洗干净,在无菌操作台中用95%乙醇漂洗2min,再用无菌水冲洗,然后用5.2%次氯酸钠溶液漂洗10s,无菌水冲洗5次,使用无菌纱布将水分滤干。将银杏叶切成0.5cm×0.5cm 小片,每个培养皿中植入3~4块银杏小叶片,置28℃恒温培养箱中培养3~20d。当培养皿上从银杏叶切片处向周围长出菌丝时,采取尖端菌丝挑取法,将内生真菌转移到新PDA 培养基上继续培养、转接、纯化后,转移到PDA 斜面试管中保存、备用。在整个分离过程中设置2个对照组,一是将最后一次冲洗的无菌水于平板中涂布均匀;二是将经表面消毒的银杏叶片放入培养基中,静置20 min 后取出叶片,将这2个对照组与放置银杏叶片的培养皿一起培养,若这2个对照培养皿中未长出菌落则说明表面消毒彻底,进而确定分离出的真菌为银杏内生真菌。
1.3.2 银杏内生真菌发酵液提取物的制备 在250mL锥形瓶中加入100mL PDB培养基。灭菌后,将已培养好的内生真菌接种于PDB培养基。在25℃、170r/min条件下,摇床振荡培养7d,滤去菌丝体备用,滤液用95%乙醇醇沉12h后,浓缩、冻干即为供试样品。
1.3.3 形态学观察 在无菌操作台中挑取少许平板培养的菌丝置于载玻片上,压好盖玻片,确定无气泡后,于光学显微镜下观察、记录、拍照。直接用导电胶粘少许菌丝,置于电子显微镜下观察菌丝和孢子形态。
1.3.4 菌丝体DNA提取 采用苯酚氯仿法。将培养好的发酵液倒入1.5mL 离心管中,离心取菌丝体,冻干。加入200μL 苯酚、氯仿(比例为1∶1),振荡1min,使有机相和水相充分混合。置于12 000 r/min离心机中,室温离心5min。将上层水相转移到一个新的离心管中,0℃下用2~3倍无水乙醇沉淀。在4℃、12 000r/min条件下,离心10min,收集沉淀。将收集到的沉淀用70%乙醇洗涤,室温12 000r/min离心2min,吸去上清液,空气干燥,将沉淀溶于30μL无菌水中。
1.3.5 PCR扩增 采用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′),50μL PCR 扩增反应体系进行DNA 扩增。50μL PCR 扩增反应体系为模板DNA 1μL、dNTP(10mmol/L)1μL、引物各2 μL、10×Buffer 5μL、Taq酶1μL、去离子水40 μL。于94℃预变性5min后,反应程序为95℃变性30s、55℃退火40s、72℃延伸60s,共30个循环,最终于72℃延伸5min。PCR 产物用1%琼脂糖凝胶电泳进行检测,送交上海生工生物工程技术服务有限公司测序。
1.3.6 发酵液抗氧化活性的测定 用甲醇浸提SG0016菌株发酵液冻干物,将浸提液稀释成5mg/mL。在96孔酶标板中分别加入不同样品的溶液100μL和0.2mg/mL的DPPH 溶液100μL,每个样品重复3次。样品加入后,将酶标板置于酶标仪中,参数设置为(震荡30s,温度37℃、波长517 nm),在此条件下测定其吸光度(Ap)。以不加DPPH 的样品空白吸光度(Ac)和加DPPH 但不加样品(以甲醇100μL 代替样品)的吸光度(Amax)为空白对照。自由基清除率(%)按下列公式计算:
自由基清除率(%)=[1-(Ap-Ac)/Amax]×100%
1.3.7 SG0016菌株产抗氧化活性成分培养条件优化 (1)较佳接种量的确定 以PDB培养基为发酵培养基,培养温度为25℃,装液量为100 mL(250 mL的三角瓶,下同),接种量分别为1%、3%、5%、10%和15%,培养时间为9d,按1.3.4所述方法测定发酵液抗氧化活性,每组处理3个平行。
(2)较佳培养温度的确定 以PDB培养基为发酵培养基,装液量为100 mL,接种量10%,培养温度分别为20、23、25、28、30和33℃,培养时间为9 d,按1.3.4所述方法测定发酵液抗氧化活性,每组处理3个平行。
(3)较佳装液量的确定 以PDB培养基为发酵培养基,培养温度为25℃,装液量分别为25、50、75、100和125mL,接种量10%,培养时间为9d,按1.3.4 所述方法测定发酵液抗氧化活性,每组处理3个平行。
(4)较佳培养时间的确定 将SG0016种子液按5%接种量接种于PDB培养基中,培养温度为25℃,装液量为100 mL,从发酵第3 天起,每隔24h取样1次,按1.3.4所述方法测定发酵液抗氧化活性,直到第12天为止,每组处理3个平行。
(5)较佳碳源的确定 以蛋白胨(2%)为氮源,分别选用麦芽糖、蔗糖(分析纯)、葡萄糖(分析纯)、果糖、玉米淀粉、可溶性淀粉(分析纯)、乳糖(分析纯)、马铃薯作为供试碳源,含量均为3%。装液量为100 mL,接种量10%,培养时间为8d,按1.3.4所述方法测定发酵液抗氧化活性,每组处理3个平行。
(6)较佳氮源的确定 以葡萄糖(3%)碳源,选择蛋白胨、酵母浸出膏、豆渣粉、尿素、NH4Cl、硫酸铵、NH4NO3作为供试碳源,含量均为2%。装液量为100mL,接种量10%,培养时间为8d,按1.3.4所述方法测定发酵液抗氧化活性,每组处理3个平行。
(7)正交试验 在上述单因素试验的基础上,采用正交表L9(34),以菌株发酵液提取物DPPH 自由基清除率为指标,以接种量(A),培养温度(B),装液量(C)和培养时间(D)为试验因素进行正交试验。每个因素选取3个水平,每个水平进行3次重复试验,筛选出各因素之间的最佳组合。
2 结果与分析
2.1 SG0016菌株鉴定结果
2.1.1 SG0016菌株形态学特征 菌株SG0016在PDA 平板上生长初期为白色绒毛状,生长较为缓慢(图1,A),培养5d左右,白色绒毛状菌丝上生出暗绿色孢子并逐渐连成一片,在PDA 培养基上呈暗绿色,背面褐色,边缘不整齐(图1,B)。子囊壳散生或群生,卵形或近球形,表生(图1,C)。子囊孢子亚球形或卵圆形(图1,D)。

表1 正交试验因素水平Table 1 Lists of factor and level indices for orthogonal analysis
2.1.2 SG0016 的分子生物学鉴定 利用引物ITS1和ITS4扩增得到大小为500~750bp的PCR产物(图2),测序结果表明,目的片段长度为553 bp。将测定的碱基序列与GenBank中的已知序列进行比对分析,结果显示,菌株SG0016 的rDNAITS扩增片段的碱基序列与Chaetomiumglobosumstrain OUCMBI101038序列相似性为99%,仅有6个碱基的差异。结合形态学和分子生物学鉴定结果,确定菌株SG0016为球毛壳菌,将其命名为ChaetomiumglobosumSG0016。
2.2 SG0016菌株液态培养条件优化
2.2.1 培养时间对发酵液DPPH 自由基清除率的影响 由图3,A 可以看出,随着培养时间的延长发酵液甲醇提取物对DPPH 自由基清除率逐渐升高。第8天时,清除率达到最高,为91.74%;培养时间继续延长时,自由基清除率呈下降趋势,在第12天时,自由基清除率降低到61.15%。因此,确定较佳培养时间为8d。
2.2.2 接种量对发酵液DPPH 自由基清除率的影响 微生物液态发酵过程中,接种量大小影响菌体生长速度和代谢产物的量。由图3,B可见,接种量在1%~10%范围内时,随着接种量的增加,自由基清除率逐步升高;接种量为10%时,DPPH 自由基清除率最高,为90.16%。接种量进一步增大为15%时,发酵液的自由基清除能力反而降低到88.06%。原因能是由于接种量过大,菌体生长过快,反而抑制了具有抗氧化活性的代谢产物的积累。因此,确定较佳接种量为10%。
2.2.3 装液量对发酵液DPPH 自由基清除率的影响 由图3,C可以看出,随着装液量的增加,发酵液的自由基清除率呈现先增大后减小的趋势。当装液量为100mL时,发酵液DPPH 自由基清除率最高,为90.72%。当装液量继续增大时,自由基清除率又开始减小。因此,确定较佳的摇瓶装液量为100mL。
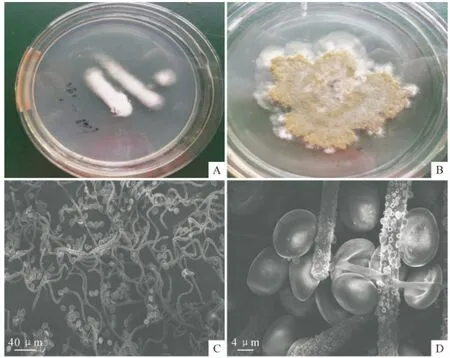
图1 菌株SG0016形态特征Fig.1 The colony and spore morphology of the SG0016strain

图2 菌株SG0016PCR 产物凝胶电泳图谱M.DL2000;1~3均为菌株SG0016Fig.2 The electrophoretogram of PCR products of the SG0016strain M.DL2000;1-3were PCR products of SG0016strain
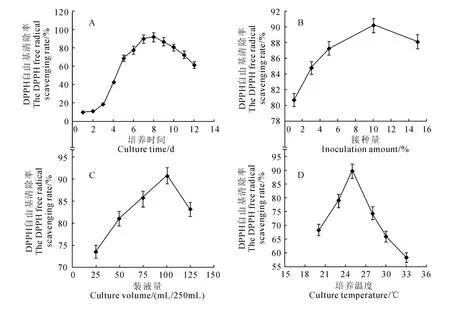
图3 培养条件对发酵液DPPH 自由基清除率的影响Fig.3 Effect of culture conditions on the DPPH free radical scavenging rate of the broth
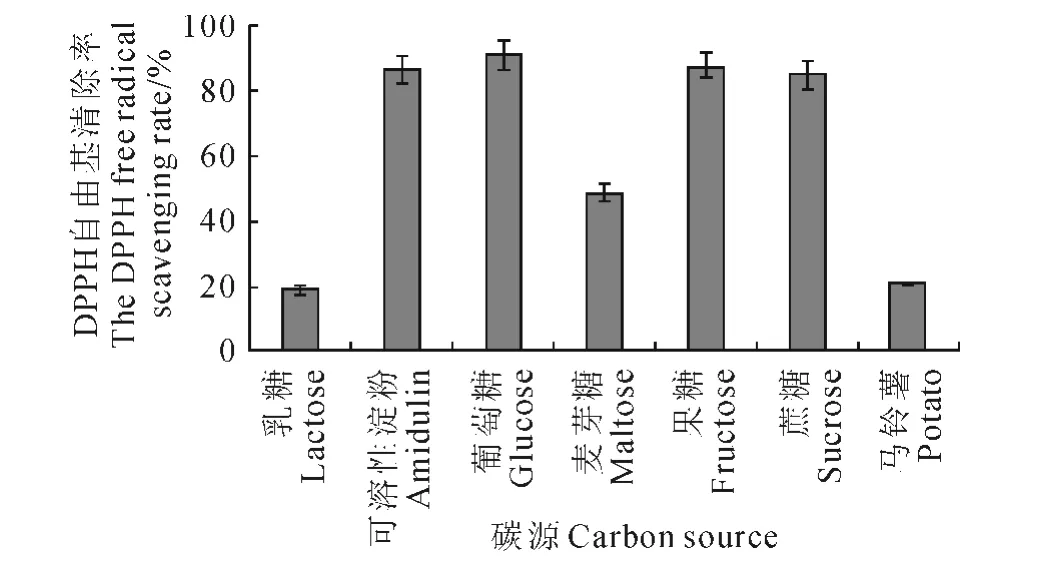
图4 碳源对发酵液DPPH 自由基清除率的影响Fig.4 Effect of carbon sources on the DPPH free radical scavenging rate of the broth

图5 氮源对发酵液DPPH 自由基清除率的影响Fig.5 Effect of nitrogen sources on the DPPH free radical scavenging rate of the broth
2.2.4 培养温度对发酵液DPPH自由基清除率的影响 由图3,D可以看出,培养温度在20~25℃范围时,随温度的升高,SG0016菌株发酵液清除DPPH自由基能力随之增大。培养温度为25℃,自由基清除率达到最大,为89.60%。温度继续升高时,自由基清除率下降,说明培养温度过高可能会抑制SG0016菌株具有抗氧化活性代谢产物积累。因此,确定较佳最佳培养温度为25℃。
2.2.5 碳源对发酵液DPPH自由基清除率的影响 比较了7种不同碳源对球毛壳菌SG0016菌株发酵液DPPH 自由基清除能力的影响,结果(图4)表明,SG0016菌株可利用试验提供的7种碳源。当以葡萄糖为碳源时,发酵液的DPPH自由基清除率最高,为90.86%;其次为果糖和可溶性淀粉,自由基清除率分别为87.37%和86.75%;乳糖作为碳源时菌株自由基清除能力最差,仅为18.68%。因此,选择葡萄糖为球毛壳菌SG0016菌株进行液态发酵的较佳碳源。
2.2.6 氮源对发酵液DPPH自由基清除率的影响 在碳源试验的基础上,比较了7种不同氮源对球毛壳菌SG0016菌株发酵液DPPH 自由基清除能力的影响。由图5可以看出,以酵母浸出膏为氮源时,发酵液的DPPH 自由基清除率最高,为91.53%。以尿素为氮源时,效果最差,自由基清除率仅为18.97%。因此,选择酵母膏作为较佳氮源。

表2 培养条件正交试验结果Table 2 Analysis of orthogonal experiments of culture conditions
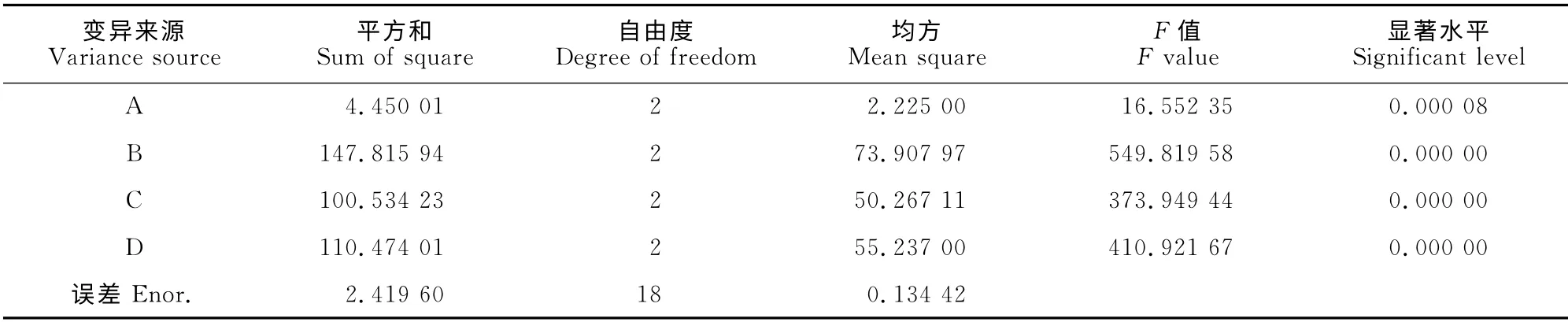
表3 正交设计方差分析表(完全随机模型)Table 3 Variance analysis of orthogonal experiment(total random model)
2.2.7 正交试验结果 以接种量、培养温度、装液量和培养时间为影响因素的四因素三水平的正交试验结果及方差分析结果见表2和表3。由表2可以看出,B(培养温度)的极差最大,即对菌株发酵液DPPH 自由基清除率影响较大,其次是培养时间(D)、装液量(C)和接种量(A)。
利用DPS统计软件进行正交设计方差分析(完全随机模型),发现进行试验的4个因子在99%置信度下对指标的影响均达到极显著水平(P<0.01)。因此,对于该菌株发酵液中积累清除DPPH生物活性成分的最佳培养条件组合为B1D1C2A2,即培养温度23℃、培养时间7d、装液量100mL和接种量10%。
2.2.8 验证试验 采用正交试验获得的最佳发酵条件和单因素试验获得的较佳碳源、氮源进行球毛壳菌SG0016 菌株液体发酵试验,测定发酵液的DPPH 自由基清除率(取3 次试验的平均值)为96.17%,比优化前提高了23.6%,说明上述试验获得的最佳培养条件和碳、氮源有利于SG0016菌株发酵液中抗氧化活性成分的分泌和积累。
3 讨 论
在有关植物内生真菌研究中,经常侧重于活性菌株的筛选,而忽略真菌的进一步分类鉴定,进而导致大量的重复研究,因此,确定植物内生真菌的种属地位显得尤为必要。本试验经形态学和分子生物学鉴定,确定SG0016 菌株为球毛壳菌,将其命名为ChaetomiumglobosumSG0016,杜少康等[13]也从不同地区的银杏叶片中分离出多株毛壳菌属内生真菌。球毛壳菌具有多种生物活性[14-15],国内外对球毛壳菌,特别是银杏内生球毛壳菌的研究报道较少。李虎强等[16]从银杏内生真菌球毛壳菌的次生代谢产物中分离得到了12种化合物,找到了抗菌活性较高的胶霉毒素,但并没有获得高抗氧化活性的代谢产物。刘小莉等[17]在对银杏内生真菌抗氧化活性的研究中发现,银杏内生炭角菌YX-28的提取物具有较强的抗氧化活性,在β-胡萝卜素/亚油酸试验中,其400μg/mL的甲醇粗提物具有72.9%的抑制活性。由于球毛壳菌SG0016菌株具有较高的抗氧化活性,因此对其进一步的开发利用具有重要的理论和实践价值。
本研究在单因素试验的基础上,通过正交试验,确定球毛壳菌SG0016菌株液体发酵的最佳培养条件为培养温度23℃、培养时间7d、装液量100mL和接种量10%。在最佳培养条件下,SG0016 菌株发酵液的DPPH 自由基的清除率可达96.17%,比优化前提高了23.6%。
[1]REN A ZH(任安芝),GAO Y B(高玉葆).Plants endophyte,a class of broad prospects for application of microbial resources[J].Microbiology(微生物学通报),2001,28(6):90-93(in Chinese).
[2]GARY S,BRYN D.Bioprospecting for microbial endophytes and their natural products[J].MicrobiologyandMolecularBiologyReview,2003,67(4):491-502.
[3]YANG Y H(杨银河),YE Y(叶 烨),LI CH Y(李成云),etal.Chemical constituents of endophytePenicilliumsp.DCS82fromDaphniphyllumlongeracemosum[J].Guihaia(广西植物),2013,33(4):571-574(in Chinese).
[4]DENG H H(邓慧华),HONG W(洪 伟),WU CH ZH(吴承祯),etal.Separation,selection and identification on producing lipid strains of endophytic fungi fromPinusmassoniana[J].JournalofPlantResourcesandEnvioronment(植物资源与环境学报),2014,23(2):27-33(in Chinese).
[5]GUTIERREZ R M P,GONZALEZ A M N,RAMIREZ A M.Compounds derived from endophytes:A review of phytochemistry and pharmacology[J].CurrentMedicinalChemistry,2012,19(18):2 992-3 030.
[6]DEBBAB A,ALY AH,PROKSCH P,etal.Bioactive secondary metabolites from endophytes and associated marine derived fungi[J].FungalDiversity,2011,49(1):1-12.
[7]LIU X L(刘小莉),DENG M SH(董明盛).Study on endophytic fungus isolated from ChineseGinkgobilobaL.[J].FoodScience(食品科学),2007,28(6):205-208(in Chinese).
[8]DENG ZH SH(邓振山),ZHAO L F(赵龙飞),ZHANG W W(张薇薇),etal.Isolation of endophytic fungi fromGinkgobilobaL.and their antagonism on theValsamalimiyabe et Yamada[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2009,29(3):608-613(in Chinese).
[9]XIAO Y,LI H X,WANG J X,etal.Antifungal screening of endophytic fungi fromGinkgobilobafor discovery of potent anti-phytopathogenic fungicide[J].FEMSMicrobiologyLetters,2013,339(2):130-136.
[10]JU X Y(鞠秀云),FENG Y J(冯友建),CHEN F M(陈凤美),etal.Volatile constituents and their fibrinolytic activity of endophytic fungusFusariumsp.GI024fromGinkgobiloba[J].Microbiology(微生物学通报),2006,33(6):8-11(in Chinese).
[11]SHENTU X P(申屠旭萍),CHEN L ZH(陈列忠),YU X P(俞晓平).Anti-fungi activities and cultural haracteristics of gingko endophytic fungus No.1028[J].ActaPhytophylacicaSinica(植物保护学报),2007,34(2):147-152(in Chinese).
[12]WANG S J(汪素娟),KANG A(康 安),DI L Q(狄留庆),etal.Progress in pharmacokinetic study on main active ingredients ofGinkgo bilobaleaf extract[J].ChineseTraditionalandHerbalDrugs(中草药),2013,44(5):626-631.
[13]DU SH K(杜少康),CHEN SH L(陈双林),LIN D(林 岱),etal.Diversity of endophytic fungi in leaves ofGinkgobiloba[J].Mycosystema(菌物学报),2009,28(4):504-511(in Chinese).
[14]XIE H(谢 辉),CHEN SH L(陈双林).Antioxidant activity of endophyticChaetomiumglobosumfromEucommiaulmoides[J].Mycosystema(菌物学报),2009,28(4):591-596(in Chinese).
[15]QIN J C,ZHANG Y M,GAO J M,etal.Bioactive metabolites produced byChaetomiumglobosum,an endophytic fungus isolated fromGinkgobiloba[J].BioorganicandMedicinalChemistryLetters,2009,19(6):1 572-1 574.
[16]李虎强.银杏内生真菌球毛壳菌次生代谢产物及抑菌活性的研究[D].陕西杨陵:西北农林科技大学,2011.
[17]LIU X L(刘小莉),CHEN X H(陈晓红),DONG M SH(董明盛).Antioxidant activity of an endophyticXylariasp.fromGinkgobilob[J].JournalofNanjingAgriculturalUniversity(南京农业大学学报),2008,31(1):102-106(in Chinese).

