高温高压下CO2在水中溶解度实验及理论模型
侯大力,罗平亚,王长权,孙 雷,汤 勇,潘 毅
1.成都理工大学油气藏地质及开发工程国家重点实验室,成都 610059 2.西南石油大学油气藏地质及开发工程国家重点实验室,成都 610500 3.长江大学石油工程学院,武汉 430100
高温高压下CO2在水中溶解度实验及理论模型
侯大力1,2,罗平亚2,王长权3,孙 雷2,汤 勇2,潘 毅2
1.成都理工大学油气藏地质及开发工程国家重点实验室,成都 610059 2.西南石油大学油气藏地质及开发工程国家重点实验室,成都 610500 3.长江大学石油工程学院,武汉 430100
利用自行研制的高温高压反应釜,在不同温度、压力和矿化度条件下测试CO2在地层水中的溶解度。实验结果表明:温度一定的条件下,CO2在水中的溶解度随压力的增加而增加;压力一定的条件下,CO2在水中溶解度的主要变化趋势为随温度的增加而降低,当温度大于100 ℃、压力在22 MPa左右时,CO2在地层水中的溶解度将发生异常,出现低压(小于22 MPa)时随温度的增加而降低,高压(大于22 MPa)时随温度的增加而略微升高;在温度压力都一定的条件下,CO2在水中的溶解度随矿化度的增加而降低。并且,在新测得的实验数据和已有的实验数据的基础上,通过修正PR-HV状态方程中的参数,建立了一个能够精确计算CO2在水中溶解度的模型;并将该模型与其他模型对比。对比结果表明,该模型计算精度最高,平均相对误差仅为2.69%。
高温高压;CO2;溶解度;理论模型
0 引言
目前,在石油和天然气储层、深层咸水层和枯竭的煤层等地质储层中实施CO2地质埋存的减排处理,是减缓温室效应最有效的现实选择[1]。CO2地质埋存形式分为4种:构造封存、溶解封存、游离相封存和矿物封存[2]。其中,溶解封存是指CO2不断与油气藏中的原油、天然气和地层水接触并溶解,以达到埋存的目的。但是,油气藏中水体体积往往比油气藏体积大很多倍[3-4],在进行地质封存潜力评价时,CO2与地层水互溶的影响不容忽视。针对CO2在水中溶解度的变化规律,前人在大量的实验数据基础上建立了一些理论预测模型,这些模型都是基于温度、压力和矿化度的函数。Duan等[5]对已有的实验数据和计算模型进行了较为全面的总结和评价,并建立了一种较为准确的计算模型;但是,该模型没有考虑真实气体的非理想特性,且随着地层水矿化度的增加,模型的计算误差将会增大。Chang等[6]、Furnival等[7]通过前人测试的大量的CO2溶解度实验值进行回归拟合,得到了一种计算较为方便的经验模型;但该模型没有考虑强极性物质水与CO2之间的离子相互作用,而且仅适用于计算CO2在低矿化度地层水中的溶解度,对于矿化度较高的地层水,计算误差较大。由于上述方法都有一定的局限性,因此,有必要对CO2在地层水的溶解度开展研究,建立一个较为完善的模型,使其不仅能够计算CO2在低矿化度和高矿化度地层水中的溶解度,而且考虑CO2真实气体的非理想特性和强极性物质水与CO2之间的相互作用。笔者在新的实验数据和已有的实验数据[8-21]基础上,通过修正Peng-Robinson(PR)-Huron-Vidal(HV)状态方程中的参数,建立了一个能够精确计算CO2在水中的溶解度的模型。
1 实验
1.1 实验样品及实验设备
实验所用的CO2纯度为99.999%。实验所用的水样分为两部分,一部分水样(样品1、3、4)由纯净水和实验室配制的地层水组成,另一部分(样品2)是矿场取得的地层水,实验所用水样的离子分析结果如表1所示。
实验利用高温高压反应釜对配制的含过饱和CO2的地层水溶液进行单次脱气测试,主要实验设备包括高温高压反应釜、高压驱替泵、气液分离装置、气量计、水离子分析仪和电子天平等,各仪器的技术指标如表2所示,各实验设备的精度足以满足实验测试的需要。实验流程图如图1所示。

表1 地层水的离子分析结果

图1 CO2在地层水中溶解度实验测试流程图Fig.1 Experimental schematic diagram of CO2 solubility in formation water
1.2 实验条件、方法和步骤
实验条件主要包括温度、压力和水矿化度三方面。实验温度压力为:35~135 ℃,8~50 MPa;水样品1--4的矿化度分别为0,4 128,25 000,50 000 mg/L。
实验采用Antonin Chapoy测试N2在地层水和纯水中溶解度的方法[22],但是本文在其实验方法的基础进行了改进,在气液分离器与气量计之间加装了2 m的绕盘管线,以保证排出气体体积的准确性,避免室温变化对气体体积的影响。实验步骤如下:
1)清洗高温高压反应釜并更换所有堵头和活塞密封圈。
2)将一定量的水样转入高温高压反应釜的样品端,并用高压管线和高压驱替泵连接。
3)将过量的CO2转至已转入水样的高温高压反应釜的样品端,并将压力和温度升至实验所需的温度和压力。
4)搅拌高温高压反应釜的样品,使CO2快速溶解在水样品中并快速达到平衡。
5)将达到平衡的饱和CO2的地层水样品端朝下,停止搅拌,静止10 min后测试水中CO2的溶解量,测试时准确计量排出水质量和气体体积。
6)为保证排出气体体积的准确性,对排出气体进行冷却恒温处理;而且,为了保证实验测试水中CO2的溶解量的准确性,重复实验步骤5)、6)三次以上,以保证实验结果的一致性。
1.3 实验方案
采用4组不同矿化度的地层水样品,在温度变化为35~135 ℃、压力变化为8~50 MPa的条件下,测试相应的含过饱和CO2地层水脱出气体量,计算不同温度压力下CO2在地层水中的溶解度。具体测试方案见表3。

表3 CO2在地层水中溶解度实验测试方案
2 实验结果与分析
由图2a--d可以看出,温度一定的条件下,CO2在水中的溶解度随压力的增加而增加,且由于低压(小于22 MPa)下CO2在水中的溶解系数高,溶解度随压力变化增加幅度较大,因此,随压力进一步增加,溶解系数不断下降,当压力达到一定值后溶解度的增加幅度趋于一条直线。图2e表明,压力一定的条件下,CO2在水中溶解度随温度变化的主要趋势为随温度的增加而降低,温度越低CO2在地层水中溶解度越高;当温度大于100 ℃、压力在22 MPa左右时,CO2在地层水中溶解度将发生异常,出现在低压时随温度的增加而降低、但在高压(大于22 MPa)时反而超过低于100 ℃时的溶解度的现象。说明高温(超过100℃)高压条件下CO2在水中的溶解能力随温度的升高而增强。这是地层水的蒸发效应所致,更多的CO2溶解到地层水中,使得CO2在地层水中的溶解度出现异常,这为进行CO2在水中溶解埋存提供了更大的空间[23]。图2f表明,在温度压力都一定的条件下,CO2在水中的溶解度随矿化度的增加而降低,且高压下矿化度对CO2在水中溶解度影响更明显。
3 理论模型
传统的Peng-Robinson状态方程不适用于强极性物质水的活度计算,而Vander Waals 混合规则不适用于高度非理想体系的气液平衡关联,不适用高含CO2体系高压近临界相平衡计算,不适合有极性水和高含CO2的高度非对称体系的相平衡计算。因此,采用Huron等[24]提出的逸度系数模型(Huron-Vidal)结合Peng-Robinson状态方程的方法来描述CO2-水体系的热力学性质,即PR-HV模型。PR-HV模型描述如下:
(1)
(2)
(3)


图2 CO2在地层水中溶解度实验测试结果Fig.2 Test results of CO2 Solubility in the formation water
ai,bi,αi分别用下式表达:
(4)

(5)
(6)
式中:Tci为i组分的临界温度,℃;pci为i组分的临界压力,MPa;Tri为i组分的对比温度,Tri=T/Tci;m为一个关于偏心因子的函数,m=0.376 46+1.542 6ω-0.269 92ω2,ω为偏心因子。
在不限定压力的条件下,Gibbs自由能按以下公式计算:
(7)

根据化工热力学原理可知,以(T,p)为独立变量的组分i的逸度系数通式为
(8)
式中:φi为i组分的逸度系数;vt为体系总体积,cm3/mol;Z为偏差因子;ni、nj分别为i和j组分的摩尔数。
则Peng-Robinson方程结合Huron-Vidal混合规则的逸度系数为
(9)
式中:φm为混合物的逸度系数;Zm为混合物的偏差因子;vm为混合体系的摩尔体积,m3/mol;γi为混合物中i组分的活度系数。
利用上述方程,并基于实验数据修正了PR-HV模型中的H2O、NaCl和CO2之间的交互作用系数,使得计算结果与实验测试结果更为吻合。PR-HV组分的临界参数、混合规则及模型参数分别列于表4和表5。
4 结果与讨论
将PR-HV模型的计算结果和其他3个应用广泛的模型(Duan模型[5]、Chang模型[6]和Furnival模型[7])的计算结果进行比较。从图3可以看出,PR-HV模型计算值与实验值之间有很好的相关性。为了进一步对比分析实验值与修正参数PR-HV模型计算值之间的偏差,分别将不同温度下CO2在不同矿化度水中溶解度实验值与4个模型(PR-HV模型、Duan模型、Chang模型和Furnival模型)计算值进行了对比,对比结果见表6和图4。从表6和图4可以看出,修正参数的PR-HV模型的计算值与实验值匹配都较好:样品2的平均相对误差最小,仅为2.32%,样品4的平均相对误差最大,为3.18%,综合平均相对误差为2.69%;当矿化度较低时,实验值与Duan模型计算结果匹配较好,尤其是样品2,平均相对误差仅为2.24%,但当矿化度增加时,误差将会增加;所有矿化度水样中,实验值与采用Chang模型和Furnival模型计算值偏差较大,综合平均相对误差分别为10.24%和7.46%。

表4 PR-HV模型中组分的临界参数
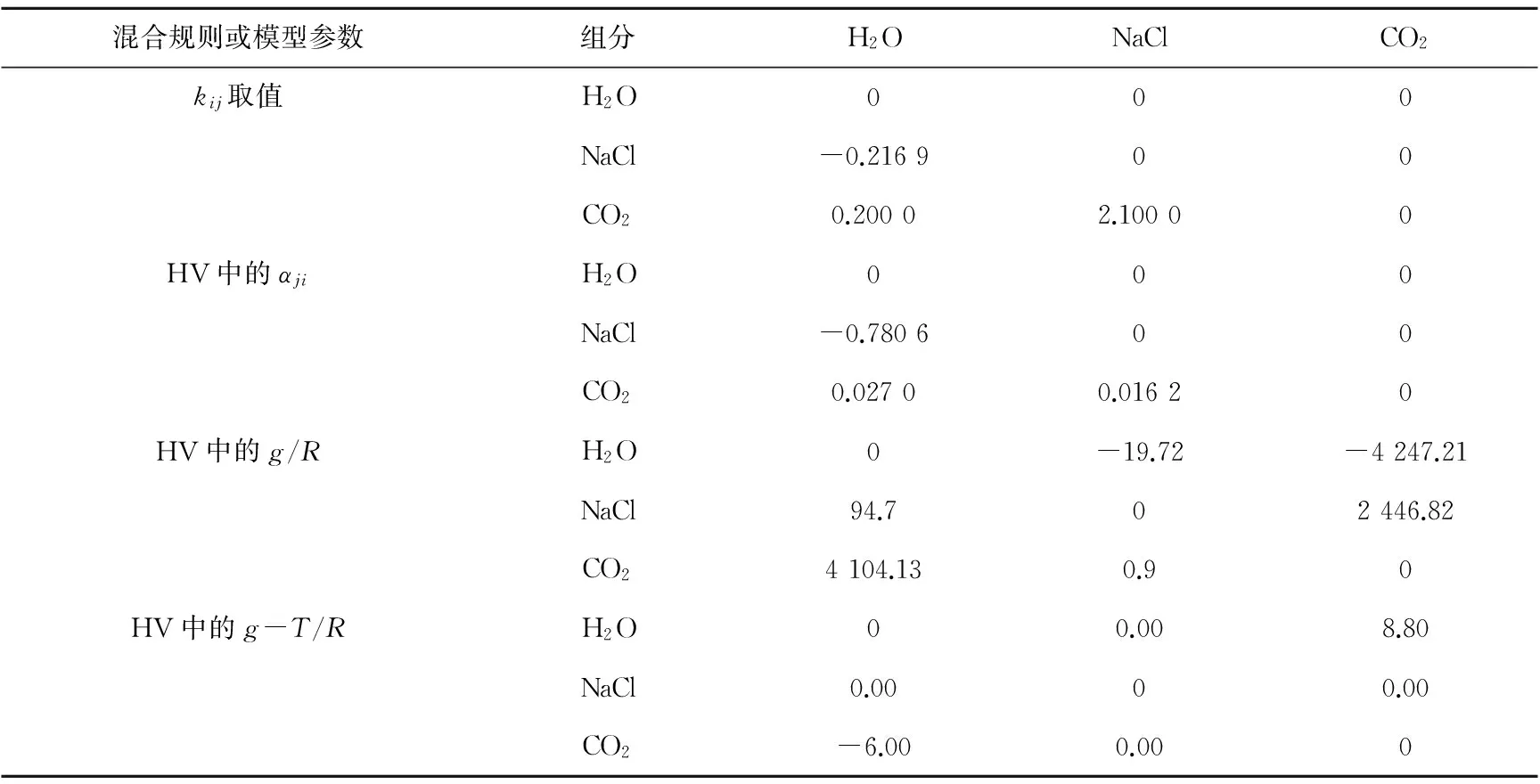
表5 PR-HV模型的混合规则及模型参数
注:g为玻尔兹曼因子。

图3 CO2在不同矿化度地层水中溶解度实验测试结果Fig.3 Test results of CO2 solubility in different salinity formation water
表6 CO2在不同矿化度水中溶解度实验值与模型计算值平均相对误差对比表
Table 6 Contrast table of experiment value, the model calculation value and average error for CO2solubility in different salinity water
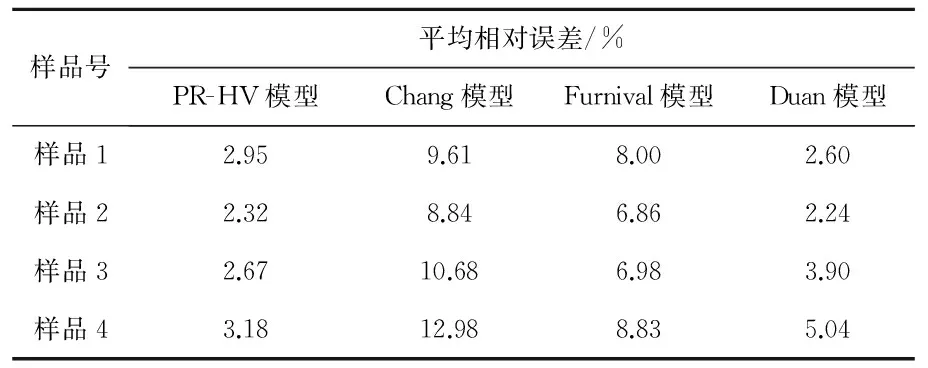
样品号平均相对误差/%PR-HV模型Chang模型Furnival模型Duan模型样品12.959.618.002.60样品22.328.846.862.24样品32.6710.686.983.90样品43.1812.988.835.04

图4 CO2在水中溶解度实验值与模型计算值平均误差对比(所有实验数据统计)Fig.4 Average error of experimental value and calculated value by different models for the CO2 in water solubility (all the experiment data statistics)
5 结论
1)温度一定条件下,CO2在水中的溶解度随压力的增加而增加,且低压下CO2在水中的溶解系数高;当压力达到一定值后溶解度的增加幅度趋于一条直线;溶解度曲线在10 MPa附近出现平缓的拐点。
2)压力一定的条件下,CO2在水中溶解度随温度变化的主要趋势为随温度的增加而降低,当温度大于100 ℃,压力在22 MPa左右时,CO2在地层水中溶解度将发生异常,出现在低压时随温度的增加而降低,但在高压时CO2在水中溶解度将会超过低于100 ℃时的溶解度。说明高温(超过100 ℃)高压条件下CO2在水中的溶解能力随温度的升高而增强,这为进行CO2在水中溶解埋存提供了更大的埋存空间。
3)在温度压力都一定的条件下,CO2在水中的溶解度随矿化度的增加而降低,且高压下矿化度对CO2在水中溶解度影响更明显。
4)实验值与模型计算值对比分析表明,PR-HV模型和Duan模型计算值与CO2在水中溶解度的实验值吻合度较高,其中,Duan模型计算值在低矿化度与实验值吻合较好,而PR-HV模型在高矿化度适应性更好,因此,说明实验结果可靠,误差较小。
[1] 许志刚,陈代钊,曾荣树,等. CO2地下地质埋存原理和条件[J].西南石油大学学报:自然科学版,2009,31(1):91-97. Xu Zhigang, Chen Daizhao, Zeng Rongshu, et al, The Principles of CO2Geological Storage and the Conditions of CO2Geological Storage[J]. Journal of Southwest Petroleum University:Natural Sciences, 2009, 31(1):91-97.
[2] 沈平平,廖维新.二氧化碳地质埋存与提高石油采收率技术[M]. 北京:石油工业出版社,2009. Shen Pingping, Liao Weixin.The Geological Storage of CO2and EOR Technology[M]. Beijing: Petroleum Industry Press, 2009.
[3] 汤勇,杜志敏,张哨楠,等.高温气藏近井带地层水蒸发和盐析研究[J]. 西南石油大学学报:自然科学版,2007,29(2):96-99. Tang Yong, Du Zhimin, Zhang Shaonan, et al.Research on the Evaporation of Formation Water and Salting-Out in the Near Wellbore Formation in Hot Gas Reservoir[J]. Journal of Southwest Petroleum University:Natural Sciences, 2007, 29(2):96-99.
[4] 李琴,李治平,胡云鹏,等.深部盐水层 CO2埋藏量计算方法研究与评价[J].特种油气藏,2011,18(5):6-10,32. Li Qin, Li Zhiping, Hu Yunpeng, et al.Assessment and Research on the Calculation Method of the Amount of CO2Storage for Deep Saline Aquifers[J]. Special Oil & Gas Reservoirs, 2011, 18(5):6-10,32.

[6] Chang Y B, Coats B K, Nolen J S, et al. A Com-positional Model for CO2Floods Including CO2Solubility in Water[J]. SPEJ,1998,1(2):155-160.
[7] Furnival J S, Horstmann S, Fischer K, et al. Experimental Determination and Prediction of Gas Solubility Data for CO2+H2O Mixtures Containing NaCl or KCl at Temperatures Between 313 and 393 K and Pressures up to 10 MPa[J].Industrial & Engineering Chemistry Research, 2002, 41(1): 4393-4398.
[8] Mao S D, Zhang D H, Li Y Q, et al. An Improved Model for Calculating CO2Solubility in Aqueous NaCl Solutions and the Application to CO2-H2O-NaCl Fluid Inclusions[J]. Chemical Geology, 2013(6):43-58.
[9] Yan W , Huang S L ,Stenby E H. Measurement and Modeling of CO2Solubility in NaCl Brine and CO2-Saturated NaCl Brine Density[J]. International Journal of Greenhouse Gas Control,2011,5(6):1460-1477.
[10] Bikkina P K, Shoham O,Uppaluri R. Equilibrated Interfacial Tension Data of the CO2-Water System at High Pressures and Moderate Temperatures[J]. Journal of Chemical & Engineering Data, 2011, 56(1):3725-3733.
[11] Liu Y H, Hou M Q, Yang G Y, et al. Solubility of CO2in Aqueous Solutions of NaCl, KCl, CaCl2and Their Mixed Salts at Different Temperatures and Pressures[J]. The Journal of Supercritical Fluids, 2011, 56(2):125-129.
[12] 李德栋.气-水-盐-矿体系相平衡耦合化学平衡及其在二氧化碳地质储存数值模拟中的应用[D].兰州:中国科学院兰州分院,2008. Li Dedong.Phase Equilibria and Coupled Chemical Equilibrium in Gas-Water-Sale-Mine System and its Application in Numerical Modeling for the Geological Storage of CO2[D]. Lanzhou: Lanzhou Branch,Chinese Academy of Science, 2008.
[13] Jo1decke M, Kamps A P,Maurer G. Experimental Investigation of the Solubility of CO2in (Acetone + Water)[J]. Journal of Chemical & Engineering Data, 2007, 52(6):1003-1009.
[14] Hu J W, Duan Z H, Zhu C, et al. PVT Properties of the CO2-H2O and CO2-H2O-NaCl Systems Below 647 K: Assessment of Experimental Data and Thermodynamic Models[J]. Chemical Geology, 2007(2):249-267.
[15] Portier S,Rochellec C. Modeling CO2Solubility in Pure Water and NaCl-Type Waters from 0 to 300 ℃ and from 1 to 300 bar:Application to the Utsira Formation at Sleipner[J]. Chemical Geology, 2005, 217(3):187-199.
[16] Duan Z H,Sun R. An Improved Model Calculating CO2Solubility in Pure Water and Aqueous NaCl Solutions from 273 to 533 K and from 0 to 2 000 bar[J]. Chemical Geology, 2003(4):257-271.
[17] Bando S, Takemura F, Nishio M,et al. Solubility of CO2in Aqueous Solutions of NaCl at (30 to 60) ℃ and(10 to 20) MPa[J]. Journal of Chemical & Engineering Data, 2003, 48(4):576-579.
[18] Diamond L,Akinfiev N. Solubility of CO2in Water from -1.5 to 100 ℃ and from 0.1 to 100 MPa: Evaluation of Literature Data and Thermodynamic Modeling[J]. Fluid Phase Equilibria, 2003, 208(1):265-290.
[19] Enick R,Klara S. CO2Solubility in Water and Brine Under Reservoir Conditions[J]. Chem Eng Commun, 1990, 90(3):23-33.
[20] Nighswander J A, Kalogerakis N,Mehrotra A K. Solubilities of Carbon Dioxide in Water and 1 wt% Sodium Chloride Solution at Pressures up to 10 MPa and Temperatures from 80 to 200 Degree[J]. Journal of Chemical & Engineering Data, 1989, 34(3):355-360.
[21] 郑菲,施小清,吴吉春,等. 深部咸水层CO2地质封存数值模拟参数的全局敏感性分析:以苏北盆地盐城组为例[J].吉林大学学报:地球科学版,2014,44(1):310-318. Zheng Fei, Shi Xiaoqing, Wu Jichun, et al. Global Parametric Sensitivity Analysis of Numerical Simulation for CO2Geological Sequestration in Saline Aquifers: A Case Study of Yancheng Formation in Subei Basin[J]. Journal of Jilin University: Earth Science Edition, 2014, 44(1):310-318.
[22] Chapoy A, Mohammadi A H, Tohidi B, et al .Gas Solubility Measurement and Modeling for the Nitrogen+Water System from 274.18 K to 363.02 K[J]. J Chem Eng Data, 2004, 49(3):1110-1115.
[23] Spycher N,Pruess K. A Phase-Partitioning Model for CO2-Brine Mixtures at Elevated Temperatures and Pressure: Application to CO2-Enhanced Geothermal Systems[J].Transp Porous Med, 2010, 82(1):173-196.
[24] Huron M J,Vidal J. New Mixing Rules in Simple Equations of State for Representing Vapor-Liquid-Equilibria of Strongly Non-Ideal Mixtures[J]. Fluid Phase Equilibria, 1979, 3(4):255-271.
Experimental Research and Theoretical Model for CO2Solubility in Water Under High Temperature and High Pressure
Hou Dali1,2,Luo Pingya2,Wang Changquan3,Sun Lei2,Tang Yong2,Pan Yi2
1.TheStateKeyLaboratoryofOilandGasReservoirGeologyandExploitation,ChengduUniversityofTechnology,Chengdu610059,China2.TheStateKeyLaboratoryofOil&GasReservoirGeologyandExploitationEngineering,SouthwestPetroleumUniversity,Chengdu610500,China3.PetroleumEngineeringCollegeofYangtzeUniversity,Wuhan430100,China
By using the independently developed high-temperature/high-pressure reactor,CO2water solubility has been tested under different temperatures,pressures and salinities. The results show that the water solubility of CO2increases with pressure under a certain temperature, while it declines with the increase of temperature under a certain pressure. However, when temperature is above 100 ℃ and pressure is around 22 MPa,the solubility is prone to decrease with increasing temperature under a low pressure (less than 22 MPa) and the solubility is prone to slightly increase with increasing temperature under a high pressure(greater than 22 MPa). Besides, under a certain temperature and pressure,CO2water solubility decreases with the increase of water salinity. On the basis of measured and existing data, a new model has been built to calculate CO2water solubility precisely by modifying the parameters of PR-HV EOS. In comparison to other models, its accuracy is higher with an average relative error of 2.69%.
high temperature and high pressure;CO2;solubility;theoretical model
10.13278/j.cnki.jjuese.201502205.
2014-07-25
国家“十二·五”科技攻关重大专项 (2011B-1507)
侯大力(1983--),男,讲师,博士,主要从事油气藏相态、油气藏数值模拟及注气提高采收率技术研究,E-mail:houdali08@163.com。
10.13278/j.cnki.jjuese.201502205
TE357
A
侯大力,罗平亚,王长权,等.高温高压下CO2在水中溶解度实验及理论模型.吉林大学学报:地球科学版,2015,45(2):564-572.
Hou Dali,Luo Pingya,Wang Changquan,et al. Experimental Research and Theoretical Model for CO2Solubility in Water Under High Temperature and High Pressure.Journal of Jilin University:Earth Science Edition,2015,45(2):564-572.doi:10.13278/j.cnki.jjuese.201502205.

