Chk1/chk2在Aβ致伤海马神经元中的表达及意义①
黄昕艳,尉荣翠,杨 智,李 壮,刘 爽
(1.佳木斯大学附属第二医院神经内科,黑龙江 佳木斯 154002;2.佳木斯大学附属第一医院肿瘤科,黑龙江 佳木斯 154003;3.佳木斯大学遗传教研室,黑龙江 佳木斯 154002)
Chk1/chk2在Aβ致伤海马神经元中的表达及意义①
黄昕艳1,尉荣翠1,杨 智1,李 壮2,刘 爽3
(1.佳木斯大学附属第二医院神经内科,黑龙江 佳木斯 154002;2.佳木斯大学附属第一医院肿瘤科,黑龙江 佳木斯 154003;3.佳木斯大学遗传教研室,黑龙江 佳木斯 154002)
目的:探讨Chk1/chk2在Aβ致伤海马神经元中的表达及意义。方法:应用新生(3d以内)SD大鼠采用急性分离、胰酶消化的方法培养海马神经细胞,分别于Aβ25-35致伤0h、8h、16h、24h,并采用免疫细胞染色观察各时间点Chk1/chk2表达情况。结果:体外培养的神经细胞生长状态良好,免疫细胞染色鉴定结果表明Chk1、chk2蛋白在Aβ致伤神经元后,随致伤时间延长均有表达,且以chk1表达显著,在致伤16h有差异明显(P<0.05)。结论:Chk1/chk2共同参与了在Aβ致伤海马神经元中的DNA损伤修复,以chk1表达更显著,提示可望为AD中神经元的DNA损伤修复提供新的干预点。
海马神经元;Chk1/chk2;Aβ
近年来的研究指出,细胞周期的异常可能是AD发生的较早期事件,这种异常的细胞周期可导致细胞的凋亡,最终引发AD。成熟神经元再进入细胞周期与DNA损伤有关,在DNA损伤修复过程中不可回避的涉及到细胞周期检测点激酶Chk1和(或)Chk2的活化[1],而Chk1和(或)Chk2在Aβ致伤神经元中的激活情况尚未见报道,故本研究以Aβ致伤神经元为AD的细胞模型,探讨Chk1和Chk2在Aβ致伤神经元的表达差异,为AD中神经元的DNA损伤修复提供全新的干预点。
1 材料与方法
1.1 材料
新生SD大鼠(1~3d),由佳木斯大学实验动物中心提供(动物质量合格证号:黑动字第99102001)。药物及试剂 DMEM/F12干粉培养基、B27、胎牛血清均购自美国Sigma公司,Aβ25-35购自北京博奥森生物技术有限公司,兔抗大鼠单克隆神经元特异性烯醇化酶(neuron specific enolase,NSE)单克隆抗体、SABC即用型试剂盒、DAB显色试剂盒购于Boster公司。
1.2 方法
1.2.1 海马神经元的原代培养[2]
选用出生3d内的SD大鼠,解剖分离出海马,经0.125%胰酶消化8~12min,用含有10%胎牛血清的DMEM/F12种植液终止消化。经悬浮、离心、过滤等步骤收集细胞,用种植液制成密度为5×105个/mL的单细胞悬液,接种于预先铺有多聚赖氨酸的6孔培养板内,置于37℃,5%CO2培养箱中培养。24h后换含2%B27的DMEM/F12培养基,每隔3d半量换液1次。
1.2.2 原代神经元鉴定[3,4]
NSE免疫细胞化学鉴定:培养至第7d的神经细胞,以PBS轻洗3遍,4%多聚甲醛固定30min后,PBS洗2次。0.4% TritonX-100破膜20min,PBS洗3遍,山羊封闭血清封闭30min,滴加NSE(1:200稀释) 一抗,4℃湿盒内孵育过夜。次日加二抗室温避光孵育50min,加新鲜配制的DAB溶液显色,光镜观察。
1.2.3 Aβ25-35致伤及实验分组
海马神经元培养7d后,弃原培养液,加入DMEM培养液及终浓度为10μmol/L的Aβ25-35(前期实验筛选的最佳致伤浓度)孵育,Aβ25-35肽分别孵育0h、8h、16h、24h终止培养,分别以chk1、chk2为一抗,进行免疫细胞化学染色。每组6孔,每张盖玻片上随机选取6个视野,高倍镜下综合染色强度和阳性细胞所占比例进行半定量测定。染色强度评分标准:不着色0分;黄色1分;棕黄色2分;黄褐色3分。阳性细胞所占比例评分标准:阳性细胞数<10%者0分;10%~40%者1分;40%~70%者2分;>70%者3分。两种评分相乘,结果记为免疫化学评分值,以均数±标准差表示。
1.3 统计学方法
采用SPSS13.0统计软件包进行统计分析,以P<0.05作为差异有统计学意义。
2 结果
2.1 神经元形态学观察及鉴定
接种后的海马神经细胞呈圆形,单个均匀分布,2h后开始贴壁,培养24h后细胞大部贴壁且部分已长出突起,随养时间延长,突起逐渐增多、延长并交织成网。培养至7d细胞生长成熟,见图1。NSE免疫染色显示90%以上的培养细胞为阳性染色,符合细胞原代培养纯度要求,见图2。

图1 7d,神经细胞原代培养7d(×200)
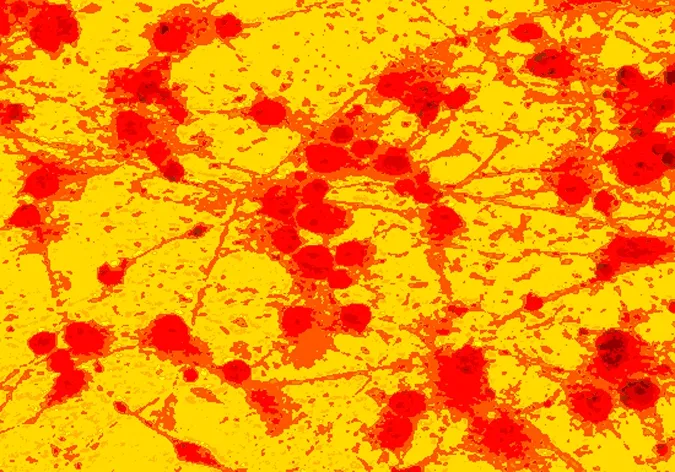
图2 7d,NSE免疫细胞染色(DAB显色)
2.2 Chk1、Chk2蛋白在Aβ致伤神经元中的表达
Chk1、chk2蛋白在Aβ致伤神经元后,随致伤时间延长均有表达,阳性细胞表达定位在细胞核及细胞质,并以细胞核为主。 Chk1与chk2蛋白表达在0h、8h无显著差异,在致伤16h及24h, Chk1与chk2蛋白表达水平明显高于对照组(P<0.05),且chk1与chk2表达有显著性差异(P<0.05),见表1。

表1 chk1、chk2蛋白在Aβ致伤神经元中的表达(免疫化学积分)
注:*与正常对照组比较,P<0.05;△与chk2蛋白表达比较P<0.05。
3 讨论
Aβ可通过多种途径产生神经毒性作用,近年来提出了AD发病过程中大量神经细胞凋亡机制的假说-细胞周期假说。CHK1、CHK2是细胞周期检查点蛋白,在DNA损伤所致的周期阻滞中起到重要作用,其不仅能够引起细胞周期阻滞,而且还直接或间接参与了DNA损伤的修复过程[5]。
在本研究中,通过免疫细胞化学观察,Aβ肽致伤神经细胞的8h、16h、24h均可看到CHK1、CHK2的蛋白表达,在Aβ肽致伤16h时CHK1、CHK2表达显著,同时可以看到CHK1、CHK2相比较,CHK1的表达更明显,CHK1和CHK2功能上的相互重叠增强了损伤细胞的自我保护能力。
DNA受损后,可触发一系列的级联效应,DNA修复蛋白复杂多样,作为DNA损伤修复的关卡反应蛋白,有研究报道CHK1或CHK2的高表达可以提高DNA修复效率,改变细胞凋亡的命运[6]。
目前,CHK抑制剂在阻止细胞周期停滞、抑制DNA修复,诱导DNA损伤细胞凋亡方面的研究受到广泛关注[7,8],大量结果表明CHK抑制剂在抑制DNA修复的治疗中越来越显现出其优势[9],这些问题的解决对于挽救AD中大批损伤神经元的命运至关重要。而随着细胞周期检验点和DNA修复机制研究的深入,针对性的选择周期检验点或DNA修复通路中的关键蛋白,已成为近年来干预细胞周期治疗的新靶点。
[1]Wang WJ,Wu SP,Liu JB,et al.MYC regulation of CHK1and CHK2 promotes radioresistance in a stem cell-like population of nasopharyngeal carcinoma cells[J].Cancer Res,2013,73(3):1219-1231
[2]王廷华,冯忠堂.神经细胞培养理论与技术[M].北京:科学出版社,2005,83-84
[3]黄昕艳,赵锦程,尉荣翠,等. Aβ_(25-35)寡聚体对大鼠海马神经细胞的活性影响及形态学观察[J].中风与神经疾病杂志,2013,30(3):218-221
[4]胡旭慧,黄昕艳,朱晓峰. Aβ_(25~35)寡聚体对原代培养海马神经元突触的损伤作用[J].黑龙江医药科学,2010,33(3):113
[5]冯旭,黄昕艳,江清林,等. BDNF对Aβ致伤大鼠海马神经元突触功能修复的影响[J]. 黑龙江医药科学,2013,36(6):7-10
[6]Karnitz LM,Flatten K S,Wagner J M,et al.Gemcitabine-induced Activation of checkpoint signaling pathways that affect tumor cell survival[J]. Mol Pharmacol,2005,68:1636-1644
[7]Ashwell S,Zabludoff S. DNA damage detection and repair pathways—recent advances with inhibitors of checkpoint kinases in cancer therapy[J]. Clin Cancer Res,2008,14:4032-4037
[8]Helleday T,Petermann E,Lundin C,et al.DNA repair Pathways as targets for cancer therapy[J]. Nat Rev Cancer,2008,8:193-204
[9]Mukhopadhyay U K,Senderowicz A M,Ferbeyre G. RNA silencing of Checkpoint regulators sensitizes P53-defective prostate cancer cells to Chemotherapy while sparing normal cells[J].Cancer Res,2005,65:2872-2881
黑龙江省教育厅课题,编号:12521570和12521543。
黄昕艳(1969~)女,黑龙江佳木斯人,学士,主任医师。
刘爽(1975~)女,黑龙江佳木斯人,博士,教授。E-mail:lockandkey@sina.com。
R741.02
A
1008-0104(2015)01-0072-02
2014-08-12)

