沉积物中五氯酚对底栖生物的急慢性毒性效应
钟文珏,张瑜,韩雨薇,祝凌燕
天津城市生态环境修复与污染防治重点实验室,教育部环境污染过程与基准重点实验室,南开大学环境科学与工程学院, 天津300071
沉积物中五氯酚对底栖生物的急慢性毒性效应
钟文珏,张瑜,韩雨薇,祝凌燕*
天津城市生态环境修复与污染防治重点实验室,教育部环境污染过程与基准重点实验室,南开大学环境科学与工程学院, 天津300071
以淡水底栖动物花翅羽摇蚊幼虫和淡水单孔蚓为研究对象,研究了沉积物中五氯酚对底栖生物的急慢性毒性效应。五氯酚对花翅羽摇蚊幼虫96 h及10 d的半数致死浓度(LC50)分别为20.6 mg·kg-1和12.5 mg·kg-1,28 d羽化半数抑制浓度(EC50)为0.79 mg·kg-1。沉积物中五氯酚对花翅羽摇蚊幼虫的羽化具有延滞作用,而且对雌性摇蚊羽化的延滞作用大于雄性,最终导致羽化摇蚊的性别失衡。淡水单孔蚓对五氯酚的耐受力较摇蚊幼虫强。五氯酚对淡水单孔蚓的96 h及14 d的LC50分别为37.6 mg·kg-1和20.2 mg·kg-1,对淡水单孔蚓21 d生长抑制的EC50为1.39 mg·kg-1。研究结果对推导五氯酚沉积物质量基准和进行沉积物生态风险评价提供依据。
五氯酚;底栖生物;急性毒性;慢性毒性;沉积物环境质量基准
五氯酚(pentachlorophenol, PCP)被公认为环境中重要的持久性有机污染物。2001年5月23日的斯德哥尔摩公约上,PCP被列为首批优先控制持久性有机污染物之一[1]。许多国家早在20世纪80年代就已经禁止了PCP的生产和使用,但是在我国,PCP曾被广泛应用于灭钉螺、防腐、杀菌消毒等,长江中下游多个省市地区持续使用PCP数十年之久[2]。虽然我国也已于2001年禁止投资生产PCP,但是由于其降解缓慢,在水体环境中仍然广泛存在。Gao等[3]研究发现PCP在我国水体中普遍存在,并且长江流域地表水中PCP的含量远高于其他流域,最高浓度可达到594 ng·L-1。PCP具有较高的辛醇/水分配系数(logKow=5.04),进入水体后极易吸附到沉积物中并长期存在。国内外水体沉积物中均有PCP检出。例如,巴西圣保罗沿海平原地区沉积物中PCP的浓度范围为21~135 μg·kg-1[4]。德国和荷兰内陆河流沉积物中PCP的浓度分别为11.25~29 μg·kg-1和4.48 μg·kg-1[5]。与国外沉积物中PCP残留量相比,我国水体沉积物中PCP残留量相对较高,有些区域的残留量已超过国外水平的上千倍。例如,海河流域沉积物中PCP含量最高达到13.7 mg·kg-1[6],而洞庭湖流域沉积物中PCP的含量高达48.3 mg·kg-1[7]。PCP在生物体内很难降解代谢,底栖生物长期暴露于含有PCP的沉积物当中,很容易产生生物富集。蓄积于沉积物中的PCP可能对底栖生物造成危害,并通过食物链进入人体,对人体健康产生较大的危害。应该重视水体沉积物中残留的PCP可能引起的环境问题。目前关于PCP毒性的研究多集中在上覆水水中PCP对水生生物毒性方面,例如,Zha等[8]研究发现,PCP影响青鳉体内的雌激素受体活性、芳烃受体活性和繁殖行为,在200 μg·L-1以下浓度暴露2周后雌鱼的产卵量明显降低。然而关于沉积物中PCP对底栖生物的危害研究非常少,即使有一些关于底栖生物的研究,也都是针对水中PCP进行的,而不是考虑沉积物的直接暴露。例如,潘建林等[9]研究了PCP对克氏原螯虾的毒性,结果显示,PCP对小虾的24 h和48 h的半数致死浓度(LC50)分别为80 mg·L-1和67.5 mg·L-1,对大虾的24 h和48 h的LC50分别为750 mg·L-1和500 mg·L-1。金小伟等[10]研究了PCP对河蚬的急性毒性,获得PCP对河蚬的24 h、48 h、72 h和96 h的LC50分别为0.98、0.52、0.23、0.23 mg·L-1。因此,本文主要针对沉积物中PCP对淡水底栖生物急慢性毒性开展研究,为淡水沉积物质量基准制定和进行沉积物生态风险评价提供基础数据,具有重要意义。
1 材料与方法(Materials and methods)
1.1 沉积物
本研究采用Pasteris等[11]推荐的方法,采集天津周边地区自然保护区内相对洁净的沉积物进行加标染毒。沉积物经自然风干后,过40目筛去除粗颗粒,室温保存。洁净沉积物中未检出PCP,其他理化性质如下:pH值为7.67;有机质含量为4.11%;阳离子交换量为38.47 cmol(+)·kg-1;含水率为1.03%;机械组成为64%的粉砂、12%的沙子和24%的黏土。
1.2 试剂
PCP试剂(98%纯度),购自美国ALDRTCH公司。甲醇、正己烷、乙腈、丙酮、二氯甲烷均为色谱纯级别,并购自天津市康科德科技有限公司。
1.3 受试生物
花翅羽摇蚊(Chironomus kiiensis)幼虫,属于摇蚊科、双翅目长角亚目(Diptera: Nematocera)。摇蚊科的幼虫生物量约占底栖生物量的70%~80%,是种类多、分布广、生物量大的淡水底栖动物类群之一[12]。同时摇蚊幼虫也是美国环保局(US EPA)和欧盟推荐的生物毒性测试物种[13]。淡水单孔蚓(Monopylephorus limosus),属单孔蚓属,颤蚓科,是淡水底栖动物常见物种,在我国广泛分布于陕西、江苏、浙江、江西、湖北等省及长江流域[14],对沉积物污染具有良好的指示作用。因此本文选取花翅羽摇蚊幼虫和淡水单孔蚓为受试生物。
1.4 沉积物染毒
将溶于甲醇的PCP储备液加到少许洁净沉积物中,机械混匀10 min,然后将染毒沉积物放置在黑暗处挥发48 h。将剩余沉积物分多次逐步加入到染毒的沉积物中混匀,重复此过程直至所有的沉积物都混匀,沉积物总量为50 g干重。混匀后加入200 mL曝气水搅拌,室温下避光平衡14 d,使泥水达到平衡。平衡后,测定沉积物中PCP的实际浓度(方法回收率为85%~90%)。PCP对底栖生物急性、亚慢性和慢性毒性的实际染毒浓度如表1所示。每组实验的每个浓度均设置5个平行,同时设置试剂空白组(沉积物中加入与储备液体积相同的甲醇溶剂及等量曝气水)和空白对照组(沉积物中只加入等量曝气水)。
1.5 花翅羽摇蚊幼虫毒性实验
花翅羽摇蚊幼虫取自沈阳化工研究院安全评价中心。驯养条件如下:花翅摇蚊培养在23 cm×43 cm×20 cm带有纱网罩的玻璃缸中,密度为3 000~5 000只/缸,培养液为48 h曝气除氯处理的自来水,培养液pH (7.5±0.3),溶解氧>6 mg·L-1,电导率900~1 100 μS·cm-1,水温控制在(23±1)℃,光暗比时间控制为16 h∶8 h,每隔3天喂食1~2 g鱼食,每天测试培养液水质情况,水质情况异常时及时更换培养液。实验用摇蚊幼虫,选用卵孵化后10 d左右、体长约为0.5 cm的二龄摇蚊幼虫进行暴露实验。实验中保证温度、pH、上覆水硬度等参数以及喂食次数与驯养期间环境条件一致,试剂空白与空白对照组的平均存活率均大于80%。
根据US EPA的底栖生物标准实验方法[15-16],进行96 h、10 d及28 d摇蚊幼虫毒性实验,实验中保证温度、pH、上覆水硬度等参数以及喂食次数与驯养期间环境条件一致,试剂空白组与空白对照组的平均存活率均大于80%。对于96 h和10 d实验,实验期间每天观察记录幼虫行为及形态变化,实验结束后过筛,记录存活数、个体体重及羽化个体,失踪个体计为死亡数。对于28 d实验,一周后将烧杯口用纱布罩住,每天定期观察,记录摇蚊幼虫活动行为、死亡和羽化情况,死亡摇蚊个体算作未羽化个体。当有羽化蚊子出现时,将蚊子移出并分辨其性别。28 d实验结束后,记录存活幼虫数量,并计算其存活率、羽化率、20%羽化时间(EMt20)和50%羽化时间(EMt50)。
1.6 淡水单孔蚓毒性实验
淡水单孔蚓为本课题组从下水管道中自行提取,并长期驯养。淡水单孔蚓驯养条件如下:淡水单孔蚓培养在无菌的卫生脱脂棉为基质的曝气水中,培养液的pH为6.80~7.30,溶解氧>4 mg·L-1,总硬度为10~250 mg·L-1(以CaCO3计),电导率900~1 100 μS·cm-1,水温控制在(23.0±1.0) ℃,采用16 h:8 h自然光照,每周喂食2~4 g玉米面。实验用淡水单孔蚓,选用5 cm左右、健康敏捷且大小一致的淡水单孔蚓进行暴露实验。实验中保证温度、pH、上覆水硬度等参数以及喂食次数与驯养期间环境条件一致,试剂空白与空白对照组的平均存活率均大于80%。
对淡水单孔蚓分别进行96 h、14 d和21 d毒性实验,实验结束后将沉积物过筛,记录淡水单孔蚓死亡率和生长抑制情况。
1.7 PCP的分析检测
沉积物样品冷冻干燥24 h后,取1 g于50 mL离心管中,加入20 mL正己烷,将离心管在摇床上振荡30 min,超声萃取1 h,然后以10 000 r·min-1转速下高速离心20 min,取10 mL上清液氮吹,用乙腈复溶,待测。
样品分析在配置有紫外检测器的高效液相色谱仪(HPLC 1206,安捷伦)上进行,色谱柱为C-18柱。流动相:11 mmol·L-1H3PO4(30%)和乙腈(70%),检测波长219 nm,流速1 mL·min-1,进样量50 μL。外标法进行定量分析。
1.8 统计分析
实验结果半数致死浓度(LC50)及半数效应浓度(EC50)均采用SPSS19统计软件的概率回归法计算得出,运用SigmaPlot软件及Origin软件作图。
2 结果与讨论(Results and discussion)
2.1 PCP对花翅羽摇蚊幼虫的毒性效应
2.1.1 PCP对花翅羽摇蚊幼虫的急性和亚慢性毒性效应
在96 h急性毒性实验中,摇蚊幼虫死亡率随暴露浓度的增加而增加,并呈现较好的相关性(图1A,
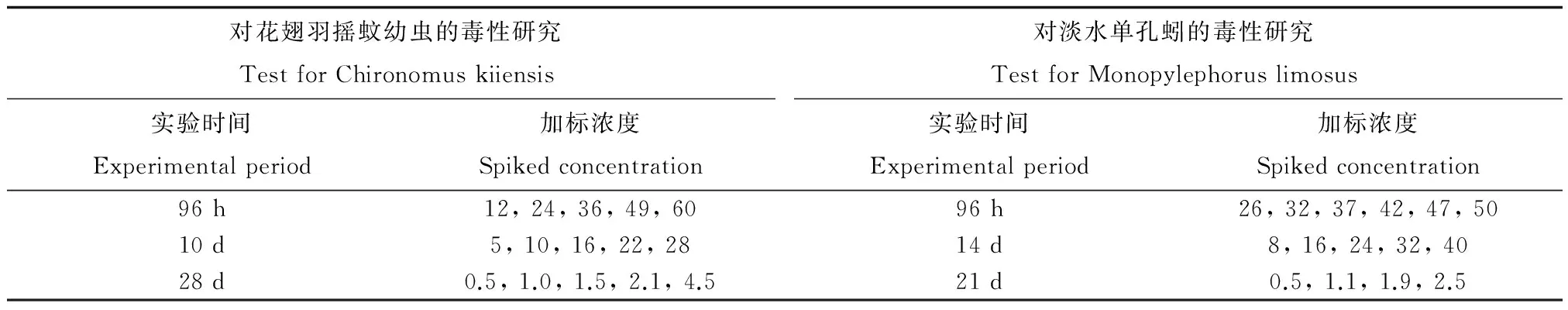
表1 沉积物中五氯酚(PCP)的实际加标浓度(mg·kg-1干重)
R2=0.94)。当PCP暴露浓度从12 mg·kg-1上升到60 mg·kg-1时,花翅羽摇蚊幼虫的死亡率从20%上升到100%。观察发现:高浓度PCP使沉积物中摇蚊幼虫产生剧烈反应,身躯呈“C”字型栖息在水体-沉积物界面处,并且不停的翻动,显示出对生存环境的极大抗拒。48 h后沉积物表面开始出现僵硬的对机械刺激毫无反应的摇蚊幼虫躯体,死亡的摇蚊个体一般会在死亡48 h内发生解体自溶现象。未解体死亡个体的躯体由红慢慢变白,体表未发现肉眼可见损伤。 在10 d亚慢性毒性实验中,摇蚊幼虫的死亡率与PCP浓度同样呈现良好的正相关性(图1B,R2=0.96)。当摇蚊幼虫暴露于较高浓度组(28 mg·kg-1)时,
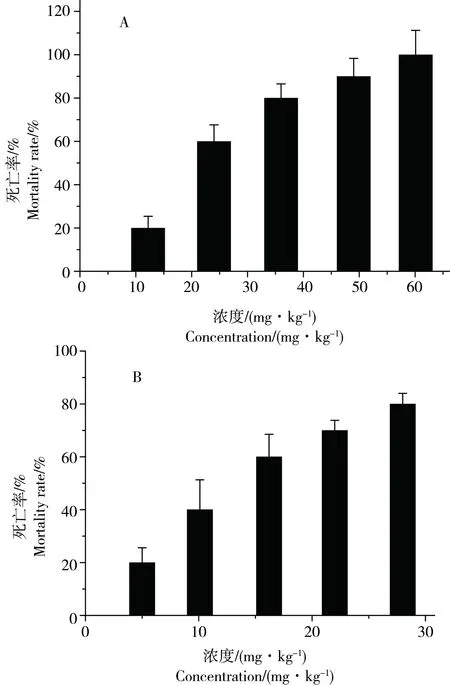
图1 PCP对花翅羽摇蚊幼虫96 h和10 d毒性实验果注:A图为96 h毒性实验结果,其中摇蚊幼虫死亡率随PCP浓度变化的相关系数为R2=0.94;B图为10 d毒性实验结果,其中摇蚊幼虫死亡率随PCP浓度变化的相关系数为R2=0.96。Fig. 1 The toxic effect of PCP to Chironomus kiiensis in 96 h-test and 10 d-testNote: A is the results for 96 h-test. Correlation coefficient between the concentration of PCP and mortality rate of Chironomus kiiensis is R2=0.94. B is the results for 10 d-test. Correlation coefficient between the concentration of PCP and mortality rate of Chironomus kiiensis is R2=0.96.
在第3天便出现毒性反应,钻出沉积物表面并且不停扭动身体;第6天开始在沉积物表层发现死亡摇蚊幼虫个体。当摇蚊幼虫暴露于低浓度组(5 mg·kg-1)时,第8天才开始呈现死亡现象。
用概率回归法计算PCP对花翅羽摇蚊幼虫的96 h和10 d的LC50及95%置信区间如表2所示。
2.1.2 PCP对花翅羽摇蚊幼虫的慢性毒性效应
羽化时间是摇蚊幼虫生命周期实验中常用的指示终点[17-20],通常羽化时间比生长终点要敏感[21],这可能是由于羽化涉及3个龄期和复杂的羽化过程。因此,在28 d暴露实验中,除了存活率之外,还对羽化率和羽化时间等进行了观测。对照空白及试剂空白组中摇蚊均在15 d内达到100%羽化,说明背景污染及溶剂效应对花翅摇蚊的羽化率无显著性影响,该实验结果符合毒性实验标准。28 d暴露实验中的花翅摇蚊幼虫的存活率、羽化率、50%羽化时间和20%羽化时间的结果如表3所示,结果发现花翅羽摇蚊的羽化率随着沉积物中PCP浓度的增加显著降低(R2=0.75)。根据存活率和羽化率结果,利用概率回归法获得PCP对花翅羽摇蚊幼虫的28 d-LC20和羽化抑制EC50如表4所示。

表2 PCP对花翅羽摇蚊幼虫的96 h-LC50和10 d-LC50及其95%置信区间(mg·kg-1)
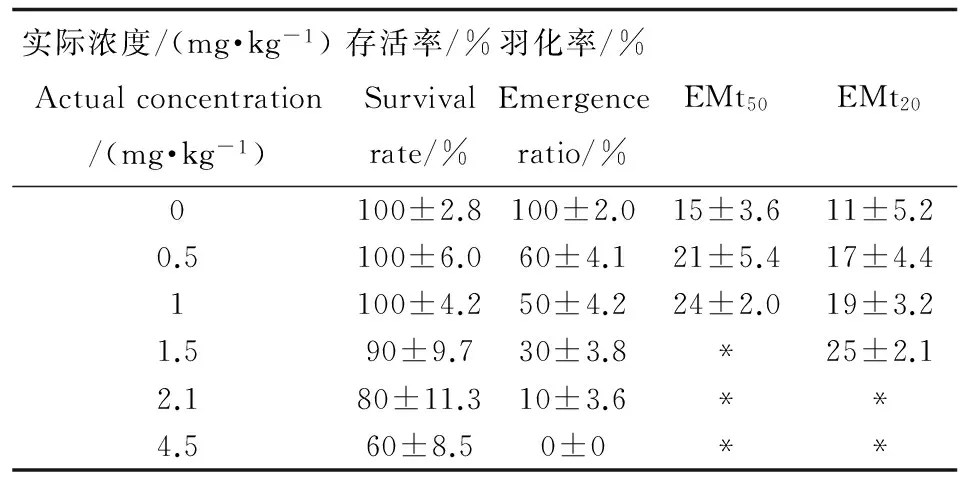
表3 28 d实验中PCP对摇蚊存活率和羽化时间的影响
注:数据=平均值±标准偏差;0 mg·kg-1代表试剂空白对照组;*代表暴露过程中羽化个体未达50%或20%;EMt50和EMt20分别表示50%羽化时间和20%羽化时间。Note: Data=mean±standard deviation; 0 mg·kg-1represent blank control; * represent emergence ratio did not reach 50% or 20%; EMt50and EMt20represent 50% emergence time and 20% emergence time.
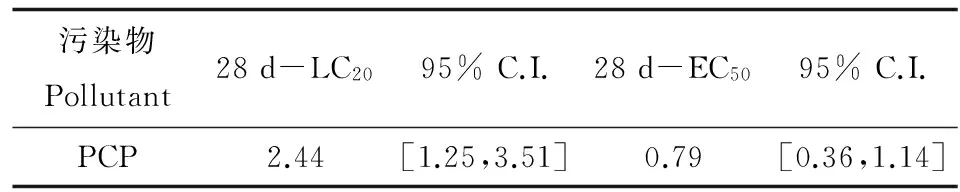
表4 28 d慢性毒性实验中PCP对摇蚊的LC20、羽化抑制的EC50值及95%置信区间(mg·kg-1)
除羽化率之外,本研究还对不同浓度PCP对摇蚊羽化时间的影响进行了观察。EMt20和EMt50分别指20%和50%的花翅羽摇蚊幼虫羽化的时间。试剂空白组、0.5 mg·kg-1和1 mg·kg-1浓度组摇蚊幼虫的EMt50分别为15 d、21 d和24 d;试剂空白组、0.5 mg·kg-1、1 mg·kg-1和1.5 mg·kg-1浓度组摇蚊的EMt20分别为11 d、17 d、19 d和25 d。由此可见,PCP在一定程度上抑制了摇蚊幼虫的羽化,使羽化时间有了不同程度的延滞。这一结果与之前一些关于其他污染物对摇蚊幼虫的慢性毒性研究相一致。有研究表明重金属(Pb、Cd)、多环芳烃、林丹、毒死蜱和氯氰菊酯等都可导致摇蚊幼虫羽化时间延迟[17,20,22,23]。但是值得注意的一点是,根据Ristola等[21]的研究,当摇蚊幼虫暴露于较高浓度的、与PCP具有相似结构且同样具有内分泌干扰效应的2,4,5-三氯酚时,却会加速摇蚊羽化,使平均羽化时间缩短。影响摇蚊幼虫羽化时间的因素很多,除不同的污染物通过促进或者抑制摇蚊幼虫体内的激素分泌影响摇蚊幼虫的羽化时间之外,不同的营养物质含量、不同的饲料、不同的摄食习惯、不同的外部环境都可影响摇蚊幼虫的羽化时间[21,24-25]。因此,还需要进一步深入的研究。
在记录羽化时间和羽化率的同时,还记录了PCP对羽化花翅羽摇蚊性别比的影响。结果发现对照组及低浓度组(0.5 mg·kg-1)羽化的摇蚊个体的性别比例几乎为1∶1,而当PCP浓度达到1 mg·kg-1时,雌雄性别比例为1∶1.5;PCP浓度为1.5 mg·kg-1时,雌雄性比为1∶2;当PCP浓度增至2.1 mg·kg-1时,羽化的摇蚊幼虫均为雄性个体。也就是说PCP对雌性摇蚊的羽化抑制作用要显著大于雄性摇蚊,同时这种延滞作用随着PCP浓度的增加而增强。之前也有一些关于污染物对羽化摇蚊性别比影响的研究,但是结果各不相同。比如,Lee等[26]曾研究了八氯苯乙烯对摇蚊幼虫(Chironomus tentans)羽化性别比的影响,发现八氯苯乙烯使得羽化摇蚊雄性数量明显减少。而Watts等[27]发现17α-乙炔雌二醇对羽化摇蚊的性别比有严重影响,但是其影响没有规律可循。由此可见,污染物对羽化摇蚊性别比影响的机制还需要更深入探讨。
2.2 PCP对淡水单孔蚓的毒性效应
2.2.1 PCP对淡水单孔蚓的急性和亚慢性毒性效应 图2显示了96 h急性毒性实验和14 d亚慢性毒性实验中淡水单孔蚓的死亡率与PCP浓度的关系。由图可见,淡水单孔蚓的死亡率与PCP的浓度具有良好的相关性。其中96 h急性毒性实验和14 d亚慢性毒性实验中,淡水单孔蚓死亡率与PCP浓度的相关系数分别为R2=0.99(图2A)和R2=0.94(图2B)。比较图2A和图2B发现,淡水单孔蚓暴露于26 mg·kg-1和42 mg·kg-1的PCP中96 h死亡率分别为10%和60%;而暴露于24 mg·kg-1和40 mg·kg-1PCP中14 d死亡率就高达50%和90%。由此可以看出随着暴露时间的延长,PCP对淡水单孔蚓的毒性效应是显著增加的。PCP对淡水单孔蚓的96 h及14 d的LC50及95%置信区间如表5所示。
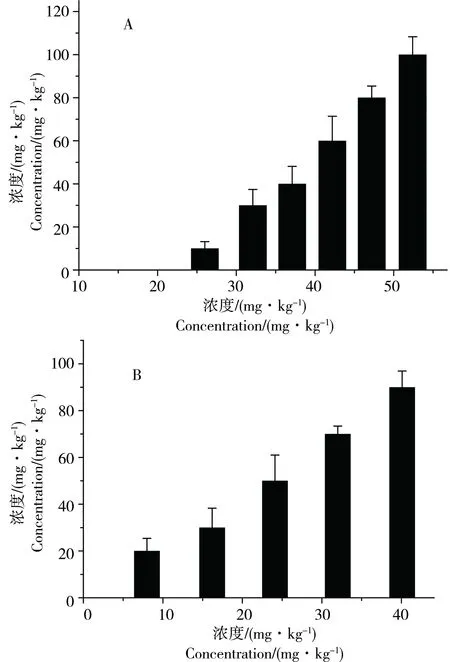
图2 PCP对淡水单孔蚓的96 h和14 d毒性实验结果注:A图为96 h毒性实验结果,其中淡水单孔蚓死亡率随PCP浓度变化的相关系数为R2=0.99;B图为14 d毒性实验结果,其中淡水单孔蚓死亡率随PCP浓度变化的相关系数为R2=0.94。Fig. 1 The toxic effect of PCP to Monopylephorus limosus in 96 h-test and 14 d-testNote: A is the results for 96 h-test. Correlation coefficient between the concentration of PCP and mortality rate of Monopylephorus limosus is R2=0.99. B is the results for 14 d-test. Correlation coefficient between the concentration of PCP and mortality rate of Monopylephorus limosus is R2=0.94.
2.2.2 PCP对淡水单孔蚓的慢性毒性效应
本研究在淡水单孔蚓慢性毒性实验中记录了暴露21 d后淡水单孔蚓的存活情况及生长受抑制情况(表6),生长抑制率的计算方法如公式(1)所示。
生长抑制率%=(空白组体重增长-实验组体重增长)/空白组体重增长×100%

(1)
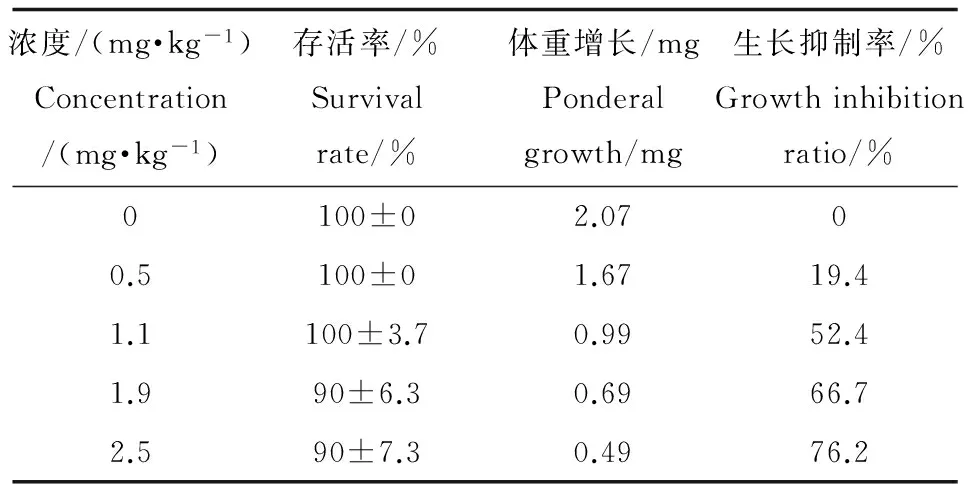
表6 21 d实验中PCP对淡水单孔蚓的存活及生长抑制情况
暴露21 d后,当PCP暴露浓度小于1.1 mg·kg-1时,淡水单孔蚓几乎全部存活;即使PCP浓度达到2.5 mg·kg-1时也只造成淡水单孔蚓10%左右的死亡率。
从表6可以看出虽然PCP对淡水单孔蚓的致死毒性效应较弱,但却可以不同程度地影响其生长发育,而且随着暴露浓度的增加,PCP对淡水单孔蚓的生长抑制现象较为明显。当PCP浓度达到2.5 mg·kg-1时,对淡水单孔蚓的生长抑制率可高达90%。21 d暴露实验中PCP对淡水单孔蚓生长抑制效应的EC50为1.39 mg·kg-1。
2.3 沉积物中PCP的生态风险初步评估
表7列出了我国多个地区沉积物中PCP的含量,浓度范围在0.00042~48.3 mg·kg-1之间,其中污染最严重的区域是洞庭湖,该区域PCP的最高含量可达其他区域的上千倍。这可能是洞庭湖曾长期大量使用五氯酚钠消灭血吸虫中间宿主钉螺造成的[7]。将表7中各区域沉积物中PCP含量与本研究获得毒性数据相比发现,洞庭湖污染较严重样本中PCP含量已远远高于花翅羽摇蚊幼虫和淡水单孔蚓的96 h-LC50值,说明这些地区的PCP污染已经可对花翅羽摇蚊幼虫和淡水单孔蚓产生很强的急性毒性效应,可能对该区域的底栖生态环境造成较严重的破坏。对于海河流域,虽然大部分地区沉积物中的PCP含量不足以对摇蚊幼虫和淡水单孔蚓造成很强的急性毒性,但是也有个别样点的PCP含量超出了花翅羽摇蚊幼虫的10 d-LC50值,对花翅羽摇蚊幼虫产生了较强的亚慢性致死效应。其他调查区域沉积物中PCP的含量均没有超过本研究推算出的急慢性毒性效应阈值,说明这些区域沉积物中的PCP对于花翅羽摇蚊幼虫和淡水单孔蚓2种底栖生物暂时是安全的。但是由于沉积物中PCP难以降解,可以长期稳定存在,因此这些区域沉积物中的PCP污染同样不容忽视。
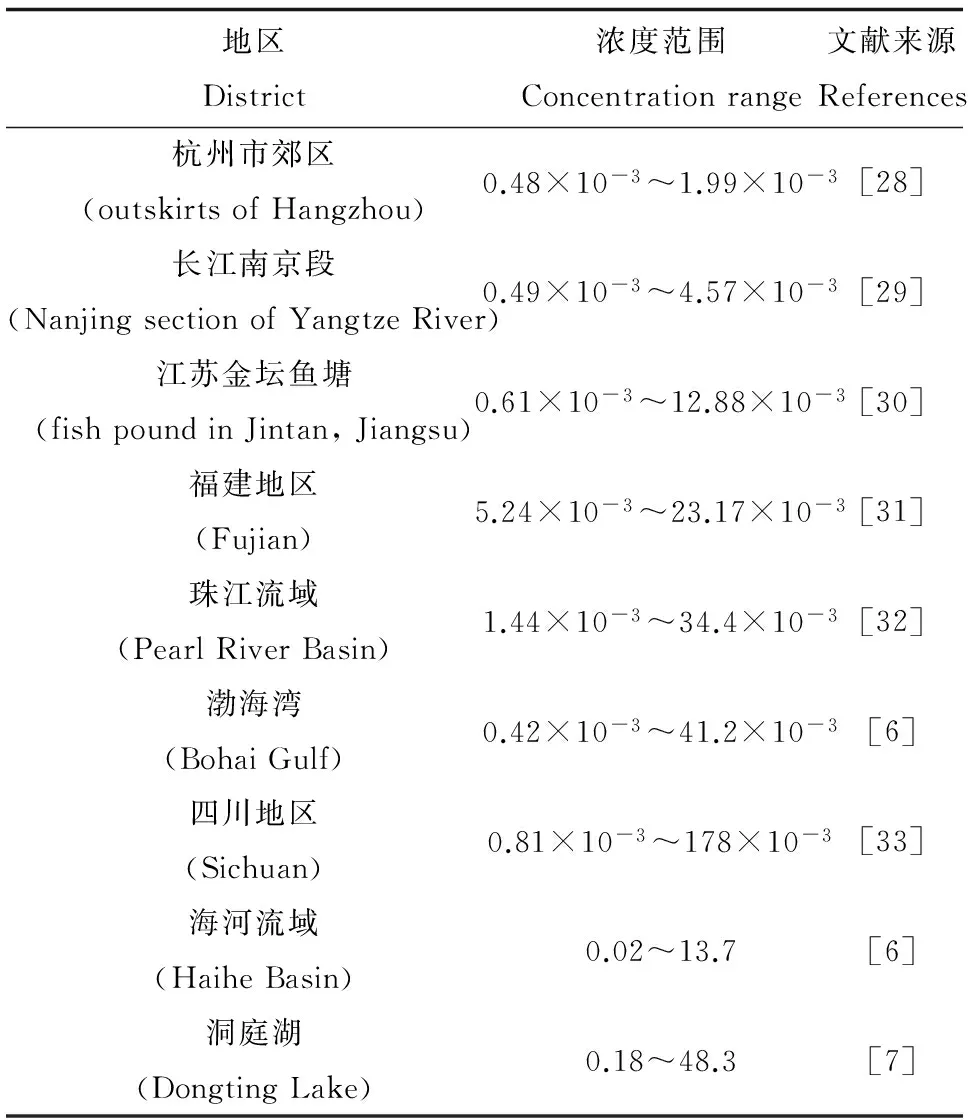
表7 我国各地区沉积物中PCP含量(mg·kg-1)
本文以淡水底栖生物花翅羽摇蚊幼虫和淡水单孔蚓为研究对象,研究了沉积物中PCP对底栖生物的急慢性毒性效应,分别计算了PCP对花翅羽摇蚊幼虫的96 h和10 d的LC50、28 d羽化抑制效应的EC50,以及PCP对淡水单孔蚓的96 h和10 d的LC50、21 d生长抑制效应的EC50。比较PCP对2种生物的毒性发现,淡水单孔蚓对PCP的耐受力较摇蚊幼虫强。PCP对花翅羽摇蚊幼虫的羽化具有延滞作用,而且对雌性摇蚊羽化时间的延滞作用大于雄性个体,导致羽化后性别失衡,最终可能导致种群的减少。对我国各区域沉积物中PCP进行初步的风险评估发现,洞庭湖区域沉积物中的PCP含量可对花翅羽摇蚊幼虫和淡水单孔蚓造成较强的急性毒性效应,严重影响了底栖生物的生存环境,。本文研究结果为推导PCP沉积物质量基准和进行沉积物生态风险评价提供依据,为全面保护水环境质量提供数据支撑。
[1] 岳瑞生. 《关于就某些持久性有机污染物采取国际行动的斯德哥尔摩公约》及其谈判背景[J]. 世界环境, 2001(1): 24-28
[2] Perelo L W. Review: In situ and bioremediation of organic pollutants in aquatic sediments [J]. Journal of Hazardous Materials, 2010, 177(1): 81-89
[3] Gao J, Liu L, Liu X, et al. Levels and spatial distribution of chlorophenols 2, 4-dichlorophenol, 2, 4, 6-trichlorophenol, and pentachlorophenol in surface water of China [J]. Chemosphere, 2008, 71(6): 1181-1187
[4] Do Nascimento N R, Nicola S M C, Rezende M O O, et al. Pollution by hexachlorobenzene and pentachlorophenol in the coastal plain of Sao Paulo State, Brazil [J]. Geoderma, 2004, 121(3): 221-232
[5] Muir J, Eduljee G. PCP in the freshwater and marine environment of the European Union [J]. Science of the Total Environment, 1999, 236(1): 41-56
[6] 刘金林, 胡建英, 万祎, 等. 海河流域和渤海湾沉积物和水样中五氯酚的分布[J]. 环境化学, 2006, 25(5): 539-542
Liu J L, Hu J Y, Wan Y, et al. Distribution of pentachlorophenol in sediments and water from Haihe Basin and Bohai Bay [J]. Environmental Chemistry, 2006, 25(5): 539-542 (in Chinese)
[7] 张兵, 郑明辉, 刘芃岩, 等. 五氯苯酚在洞庭湖环境介质中的分布[J]. 中国环境科学, 2001, 21(2): 165-167
Zhang B, Zheng M H, Liu P Y, et al. Distribution of pentachlorophenol in Dongting Lake enviromental medium [J]. China Environmental Science, 2001, 21(2): 165-167 (in Chinese)
[8] Zha J M, Wang Z J, Schlenk D. Effects of pentachlorophenol on the reproduction of Japanese medaka (Oryzias latipes) [J]. Chemico-Biological Interactions, 2006, 161(1): 26-36
[9] 潘建林, 宋胜磊, 唐建清, 等, 五氯酚钠对克氏原螯虾急性毒性试验[J]. 农业环境科学学报, 2005, 24(1):60-63
Pan J L, Song S L, Tang J Q, et al. Acute toxicity of sodium pentachlorophenate to Cambarus Clakii [J]. Journal of Agro-Environment Science, 2005, 24(1): 60-63 (in Chinese)
[10] 金小伟, 查金苗, 许宜平, 等. 3种氯酚类化合物对河蚬的毒性和氧化应激[J]. 生态毒理学报, 2009, 4(6): 816-822
Jin X W, Zha J M, Xu Y P, et al. Toxicity and oxidative stress of three chlorophenols to freshwater clam Corbicula fluminea [J]. Asian Journal of Ecotoxicology, 2009, 4(6): 816-822 (in Chinese)
[11] Pasteris A, Vecchi M, Reynoldson T B, et al. Toxicity of copper-spiked sediments to Tubifex tubifex (Oligochaeta,Tubificidae): A comparison of the 28-day reproductive bioassay with a 6-month cohort experiment [J]. Aquatic Toxicology, 2003, 65(3): 253-265
[12] Ferrington Jr L C. Global diversity of non-biting midges (Chironomidae; Insecta-Diptera) in freshwater [M]// Martens K. Freshwater Animal Diversity Assessment. Dordrecht: Springer Netherlands, 2008: 447-455
[13] Lagauzère S, Terrail R, Bonzom J M. Ecotoxicity of uranium to Tubifex tubifex worms (Annelida, Clitellata, Tubificidae) exposed to contaminated sediment [J]. Ecotoxicology and Environmental Safety, 2009, 72(2): 527-537
[14] China Animal Scientific. Database, Monopylephorus limtosus. (2012-12-15) [2014-03-15]. http://www.zoology.csdb.cn/
[15] Williams K A, Green D W J, Pascoe D, et al. The acute toxicity of cadmium to different larval stages of Chironomus riparius (Diptera: Chironomidae) and its ecological significance for pollution regulation [J]. Oecologia, 1986, 70(3): 362-366
[16] OECD. OECD 218. OECD guidelines for the testing of chemicals: Sediment-water chironomid toxicity test using spiked sediment [R]. Paris: OECD, 2004
[17] Taylor E J, Blockwell S J, Maund S J, et al. Effects of lindane on the life-cycle of a freshwater macroinvertebrate Chironomus riparius Meigen (Insecta: Diptera) [J]. Archives of Environmental Contamination and Toxicology, 1993, 24(2): 145-150.
[18] Leslie H A, Kraak M H S, Hermens J L M. Chronic toxicity and body residues of the nonpolar narcotic 1, 2, 3, 4-tetrachlorobenzene in Chironomus riparius [J]. Environmental Toxicology and Chemistry, 2004, 23(8): 2022-2028
[19] Marinkovic M, Verweij R A, Nummerdor G A, et al. Life cycle responses of the midge Chironomus riparius to compounds with different modes of action[J]. Environmental Science & Technology, 2011, 45(4): 1645-1651
[20] Paumen M L, Borgman E, Kraak M H S, et al. Life cycle responses of the midge Chironomus riparius to polycyclic aromatic compound exposure [J]. Environmental Pollution, 2008, 152(1): 225-232
[21] Ristola T, Kukkonen J V K, Pellinen J. Body residues and responses of the midge Chironomus riparius to sediment-associated 2, 4, 5-trichlorophenol in subchronic and chronic exposures [J]. Archives of Environmental Contamination and Toxicology, 1999, 37(1): 42-49
[22] Agra A R, Soares A M V M. Effects of two insecticides on survival, growth and emergence of Chironomus riparius Meigen [J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(4): 501-504
[23] Ebau W, Rawi C S M, Din Z, et al. Toxicity of cadmium and lead on tropical midge larvae, Chironomus kiiensis Tokunaga and Chironomus javanus Kieffer (Diptera: Chironomidae) [J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(8): 631-634
[24] Dewey S L. Effects of the herbicide atrazine on aquatic insect community structure and emergence [J]. Ecology, 1986, 67(1): 148-162
[25] Lowell R B, Culp J M, Wrona F J. Stimulation of increased short‐term growth and development of mayflies by pulp mill effluent [J]. Environmental Toxicology and Chemistry, 1995, 14(9): 1529-1541
[26] Lee S W, Choi J. Multi-level ecotoxicity assay on the aquatic midge, Chironomus tentans (Diptera, Chironomidae) exposed to octachlorostyrene [J]. Environmental Toxicology and Pharmacology, 2009, 28(2): 269-274
[27] Watts M M, Pascoe D, Carroll K. Chronic exposure to 17α-ethinylestradiol and bisphenol A-Effects on development and reproduction in the freshwater invertebrate Chironomus riparius (Diptera: Chironomidae) [J]. Aquatic Toxicology, 2001, 55(1): 113-124
[28] 柴剑荣, 俞苏霞, 阮征, 等. 土壤和底泥中五氯酚及其钠盐检测方法研究[J]. 卫生研究, 2011, 40(5): 642-644
[29] 许士奋, 蒋新, 谭永睿, 等. 长江沉积物种痕量氯代酚类化合物的测定[J]. 环境化学, 2000, 19(2): 154-158
Xu S F, Jiang X, Tan Y R, et al. Determination of trace chlorophenols in Yangtse River sediment [J]. Environmental Chemistry, 2000, 19(2): 154-158 (in Chinese)
[30] 许晓国. 江苏金坛鱼塘水, 底泥, 鱼体和渔民血中五氯酚暴露水平研究[D]. 上海: 复旦大学, 2010: 40-41
Xu X G. The research on exposure levels of pentachlorophenol in pond water, sediment, fish, and the human plasma of fishman in Jintan of Jiangsu [D]. Shanghai: Fudan University, 2010: 40-41 (in Chinese)
[31] 吕华东, 黄心宜, 林玉珍, 等. 环境中五氯酚污染监测与人体摄入蓄积情况[J]. 福建环境, 1996, 13(1): 23-25
[32] Hong H C, Zhou H Y, Luan T G, et al. Residue of pentachlorophenol in freshwater sediments and human breast milk collected from the Pearl River Delta, China [J]. Environment International, 2005, 31(5): 643-649
[33] 冯亚平, 方亚群, 傅文昭, 等. 五氯酚对环境污染及居民健康影响研究[J]. 四川环境, 1995, 14(1): 34-37
Feng Y P, Fang Y Q, Fu W Z, et al. Environmental contamination of pentachlorophenol and resident health research [J]. Sichuan Environment, 1995, 14(1): 34-37 (in Chinese)
◆
Acute and Chronic Toxic Effects of Pentachlorophenol on the Benthic Organisms in Sediments
Zhong Wenjue, Zhang Yu, Han Yuwei, Zhu lingyan*
Tianjin Key Laboratory of Remediation & Pollution Control for Urban Ecological Environment, Key Laboratory of Pollution Processes and Environmental Criteria of Ministry of Education, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China
27 May 2014 accepted 12 August 2014
This study was designed to assess the acute and chronic toxic effects of pentachlorophenol (PCP) on Chironomus kiiensis and Monopylephorus limosus in sediment. For Chironomus kiiensis, the median lethal concentrations (LC50) in 96 h and 10 d tests were 20.6 mg kg-1and 12.5 mg kg-1, and the median effect concentration (EC50) of emergence in 28 d test was 0.79 mg kg-1. PCP could delay the emergence time of Chironomus kiiensis, especially for female. Meanwhile, PCP could affect the sex ratio of the newly born Chironomus kiiensis. Compared with Chironomus kiiensis, PCP displayed lower toxicity to Monopylephorus limosus. The LC50of PCP on Monopylephorus limosus in 96 h and 14 d test were 37.6 mg kg-1and 20.2 mg kg-1, respectively. The EC50of growth inhibition in 21 d test was 1.39 mg kg-1. The results of this study would provide a basis for deriving the sediment quality criteria and assessing ecological risk of PCP.
pentachlorophenol; benthic organisms; acute toxicity; chronic toxicity; sediment criteria
国家水体污染控制与治理科技重大专项(2012ZX07501-003-04);教育部创新团队(IRT 13024);高等学校博士学科点专项科研基金(新教师类)(20130031120018);中央高校基本科研业务费专项资金资助
钟文珏(1979-),女,博士,研究方向为水环境质量基准与生态风险评价,E-mail: wenjue07@126.com;
*通讯作者(Corresponding author),E-mail: zhuly@nankai.edu.cn
10.7524/AJE.1673-5897.20140528001
2014-05-28 录用日期:2014-08-12
1673-5897(2015)1-297-08
X171.5
A
祝凌燕(1969—),女,博士后,南开大学特聘教授,主要研究方向有持久性有机污染物的环境污染过程及生物有效性、新型高效修复材料制备及水体污染控制效应机理、水体沉积物环境质量基准等,在国内外学术刊物上发表高水平论文100余篇,其中SCI论文70篇。
钟文珏, 张瑜, 韩雨薇, 等. 沉积物中五氯酚对底栖生物的急慢性毒性效应[J]. 生态毒理学报, 2015, 10(1): 297-304
Zhong W J, Zhang Y, Han Y W, et al. Acute and chronic toxic effects of pentachlorophenol on the benthic organisms in sediments [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 297-304 (in Chinese)

