利用N-乙酰-β-D-氨基葡萄糖苷酶含量评价农药对花翅摇蚊种群发育的影响
周素锐,张文萍,李少南,朱国念
浙江大学农药与环境毒理研究所,杭州 310029
利用N-乙酰-β-D-氨基葡萄糖苷酶含量评价农药对花翅摇蚊种群发育的影响
周素锐,张文萍,李少南*,朱国念
浙江大学农药与环境毒理研究所,杭州 310029
为了进一步探索种群水平的生态风险评估方法,本文利用β-N-Acetyl-D-glucosaminidase(NAGase)的变化量来监测农药对摇蚊种群发育的影响。从花翅摇蚊Chironomus kiiensis体内分离纯化得到电泳纯的NAGase,并通过免疫大白兔制得NAGase的多克隆抗体。运用间接非竞争ELISA法检测抗体特异性,结果表明其与共同存在于水体的一些生物的NAGase的交叉反应率为隆线溞4.41%、老年低额溞3.12%、多刺裸腹溞3.40%、中华薄壳介4.17%、日本沼虾3.23%、白纹伊蚊7.50%、小球藻<0.5%。运用抗体测得毒死蜱、氰戊菊酯和阿维菌素3种杀虫剂对于摇蚊NAGase释放量的12 d-EC50分别为1.2012、0.0043和0.6281μg·L-1,以NAGase活力作为测试终点,测得相应的12 d-EC50:1.4765、0.0051和0.6756 μg·L-1,两者差异不显著,但均显著低于以死亡作为测试终点的12 d-LC50:4.8171、0.0954和2.1340 μg·L-1,且毒力大小均为氰戊菊酯>阿维菌素>毒死蜱。上述结果表明,利用NAGase多克隆抗体可以特异性地检测农药对花翅摇蚊种群发育的影响。
毒死蜱;氰戊菊酯;阿维菌素;花翅摇蚊;风险评估;N-乙酰-β-D-氨基葡萄糖苷酶;ELISA
N-乙酰-β-D-氨基葡萄糖苷酶(β-N-acetyl-D-glucosaminidase, NAGase)与几丁质内切酶(Endochitinase)、几丁质外切酶(Exochitinase)共同构成几丁质代谢酶系,参与几丁质的代谢并将几丁质最后降解为氨基葡萄糖[1]。在节肢动物中,几丁质酶主要存在于表皮层中的上表皮以及消化道的围食膜基质中,参与食物消化及生理周期性蜕皮等。水生节肢动物在其生长发育及繁殖过程中需经历多次脱皮,在此过程中,它们会将脱皮液中的NAGase释放到水中。动物数量越多,个体越大,被释放到水中的酶的量越多。因此,在实验室和野外考察中,水中NAGase活力的大小可以作为水生节肢动物的生物量指示因子[2-4]。然而除了节肢动物,NAGase广泛存在于真菌、植物等不同类型的生物当中,在测定NAGase活力时,由于其反应底物不具有特异性,测定结果难免受到其他生物来源的NAGase的干扰。进一步的研究发现,来自不同生物NAGase,其动力学特征并不相同,分子量和分子结构也不相同[5-7],据此,以基于抗原抗体反应的免疫化学方法[8]来测定NAGase,想必可以增强该酶作为生物量指示因子的特异性,从而更加有效地监测评估外来化学品对水生节肢动物特定种群的影响。
摇蚊属于节肢动物门昆虫纲双翅目,是淡水池塘中的优势种,在水生生态系统的物质和能量循环中发挥着重要作用[9-10]。作为农业害虫的近亲,它们易受农药,特别是杀虫剂的胁迫,是水体食物链中的“敏感环节”[11]。正因为如此,摇蚊常被用来作为底泥污染的指示生物。然而有关农药等有毒化学品对于摇蚊影响的生态毒理学资料长期以来却十分欠缺。究其原因,作为底栖生物,人们或许可以检测到毒物影响摇蚊的最终结果(如羽化率的降低),但是很难对影响过程(如对发育进程的影响)进行监测。本项研究从花翅摇蚊Chironomus kiiensis幼体中提取NAGase,纯化后制备多克隆抗体,然后采用酶联免疫吸附测定法(ELISA)检测暴露于毒死蜱、氰戊菊酯、阿维菌素的幼虫释放到培养液中的NAGase的免疫含量(NAGase-IR)随种群生长发育而发生的变化。之所以选用上述三种杀虫剂,一方面基于它们在农业害虫防治中十分常见,同时也是因为它们对摇蚊、大型溞等水生节肢动物毒性较高[12-16]。希望本项研究的结果能够为摇蚊NAGase多克隆抗体在水生生态毒理学研究中的应用奠定基础。
1 材料与方法(Materials and methods)
1.1 供试生物
花翅摇蚊Chironomus kiiensis、隆线溞Daphnia carinata、老年低额溞Simocephalus vetulus、多刺裸腹溞Moina macrocopa、中华薄壳介Dolerocypris sinensis均采自浙江大学华家池,经过分离纯化后连续培养一年以上,物种由南开大学生命科学学院环境和资源生物学实验室鉴定;白纹伊蚊Aedes albopictus由浙江大学昆虫所提供;日本沼虾Macrobrachium nipponense购自杭州南肖埠水产市场;小球藻(Chlorella vulgaris)购自中国科学院淡水藻种库。
1.2 供试药剂
97%毒死蜱原药、98%氰戊菊酯标准品和98.3%阿维菌素原药分别购自“浙江新农化工有限公司”、德国“Dr. Ehrenstorfer公司”和“南通泰禾化工有限公司”;Sephadex G-150和DEAE Sephadex A-25购自上海源叶生物科技公司;丙烯酰胺、N,N-亚甲基双丙烯酰胺、氨基-2-脱氧-β-D吡喃葡糖苷(4-MUF-NAG)、4-甲基伞形酮(4-MUF)为Sigma产品;羊抗兔IgG-HRP为杭州华安科技有限公司产品;其他试剂均为国产分析纯。
1.3 试验仪器
“GEMIN XPS FluorescenceMicroplateReader”、“VERSA MAXMicroplateReader”购自“Molecular Devices Corporation”;“DNX-9620电脑洗板机”购自“北京普朗新技术有限公司”;“DYCZ-24DN型双垂直电泳仪”购自“北京六一仪器厂”;“UV-1800紫外可见分光光度计”购自“上海欣茂仪器有限公司”;“HL-2型恒流泵”、“DBS-100电脑全自动部分收集器”购自“上海沪西分析仪器厂”。
1.4 试验方法
1.4.1 酶的分离纯化
参照黄小红等[17]的方法,以花翅摇蚊幼虫为材料,按照1:2(W/V)比例加入预冷的50 mmol·L-1Tris-HCl (pH 7.2)缓冲液,冰浴匀浆3~5 min。然后在4℃、10 000 r·min-1下离心30 min,弃去上层沉淀,上清液即为粗酶液。然后采用硫酸铵分级分离,收集60%~80%饱和度的沉淀蛋白,经DEAE Sephadex A-25离子交换柱层析后再经Sephadex G-150凝胶过滤柱层析,测定各管总蛋白含量[18]和酶活性[19],合并酶活性高的管,经透析、浓缩之后采用聚丙烯酰胺凝胶垂直板状凝胶电泳[20]鉴定酶蛋白纯度。
1.4.2 间接非竞争ELISA方法
(1)抗体的制备:按照免疫学方法[21],选用2只健康的新西兰纯种大白兔作为免疫用动物,制得的抗血清经过Protein A 柱纯化,分装冷藏备用。
(2)抗血清效价的测定参照刘洪翠等[22]测定抗血清的方法。以抗血清稀释倍数表示其效价,即 OD450nm约等于1的抗血清稀释倍数为抗血清效价。
(3)抗原抗体最适工作浓度的选择:运用方阵法对抗原抗体的最适工作浓度进行选择:NAGase稀释浓度分别为0.32、0.64、1.27、2.55、5.09、7.64、10.18、13.57、20.37 μg·mL-1,针对每一浓度设置不同的抗血清稀释倍数(1:2000;1:4000;1:6000;1:8000;1:10000;1:16000;1:20000),测定OD450值。
(4)标准曲线:将标准品(纯花翅摇蚊NAGase)稀释成系列质量浓度(0.01、0.10、0.50、1.00、2.00、4.00、8.00、10.00、16.00、20.00 μg·mL-1),抗血清1:10000倍稀释,用间接非竞争 ELISA 方法测定得标准曲线(图3),用分析软件DPS进行渐进回归分析。
1.4.3 NAGase抗血清特异性
包被100 μL蛋白浓度为0.31 mg·mL-1的花翅摇蚊粗酶于96孔酶标板。将其他生物来源的粗酶稀释成NAGase活性与花翅摇蚊相同的浓度,包被于96孔酶标板,每孔100 μL。使每一种粗酶分别与不同稀释倍数的兔抗花翅摇蚊NAGase抗血清反应,测定OD450值[22]。
1.4.4 三种农药对花翅摇蚊的毒力
设置5个试验浓度:毒死蜱(1.0、2.0、4.0、8.0、16.0 μg·L-1),氰戊菊酯(0.02、0.04、0.08、0.16、0.32 μg·L-1),阿维菌素(0.4、0.8、1.6、3.2、6.0、8.0 μg·L-1),各设1个空白对照和1个丙酮对照,每个浓度设5个重复。每个烧杯含200 mL稀释液,接入40头体型健壮、大小一致的摇蚊1龄幼虫,试验期间以螺旋藻粉作为饵料。试验开始后第12天,对照组幼虫都变为4龄,此时停止试验并记录各浓度组摇蚊幼虫存活数,由此计算出三种农药的LC50。
1.4.5 三种农药对水中NAGase释放量的影响
设置5个试验浓度:毒死蜱(0.5、1.0、2.0、4.0、8.0 μg·L-1),氰戊菊酯(0.002、0.004、0.008、0.016、0.032 μg·L-1),阿维菌素(0.2、0.4、0.8、1.6、3.2 μg·L-1),各设1个空白对照和1个丙酮对照,每个浓度设5个重复。分别在试验开始后的第2、5、8、10、12 天采集培养液2 mL,过0.22 μm滤膜[23],分别测定滤液中的NAGase免疫含量(NAGase-IR)[22]和NAGase活力[19],根据测定结果计算出三种农药的EC50。
1.4.6 NAGase活力的测定
参照Mark and Laurent[19]的方法。以4-MUF-NAG为底物,在360 nm激发波长,450 nm发射波长下测定其发光值。酶活力的定义:在上述条件下,每分钟催化底物水解产生1 μmol MUF的酶量,即NAGase的1个活性单位。
1.4.7 数据处理
采用DPS数据处理软件对数据进行差异显著性分析或建立“剂量-反应”方程。
2 结果与分析(Results and analysis)
2.1 酶的分离与纯化
由表1和图1、图2可知,经硫酸铵盐析,DEAE Sephadex A-25 阴离子交换柱和Sephadex G-150 分子筛柱纯化后,酶的比活力达到8.06 U·mg-1,纯化倍数为33,所得的NAGase纯度达到电泳纯。
2.2 间接非竞争性ELISA
2.2.1 最适抗原抗体工作浓度
根据定义,当阳性孔的OD450值约为1.0阴性对照孔OD450值小于0.1时,抗原抗体达到最适工作浓度[24]。由表2可知,抗原浓度为7.64 μg·mL-1抗体浓度为1:10000时,阳性孔OD450值最接近1,所以7.64μg·mL-1和1:10000被认为分别是抗原和抗体的最适工作浓度。
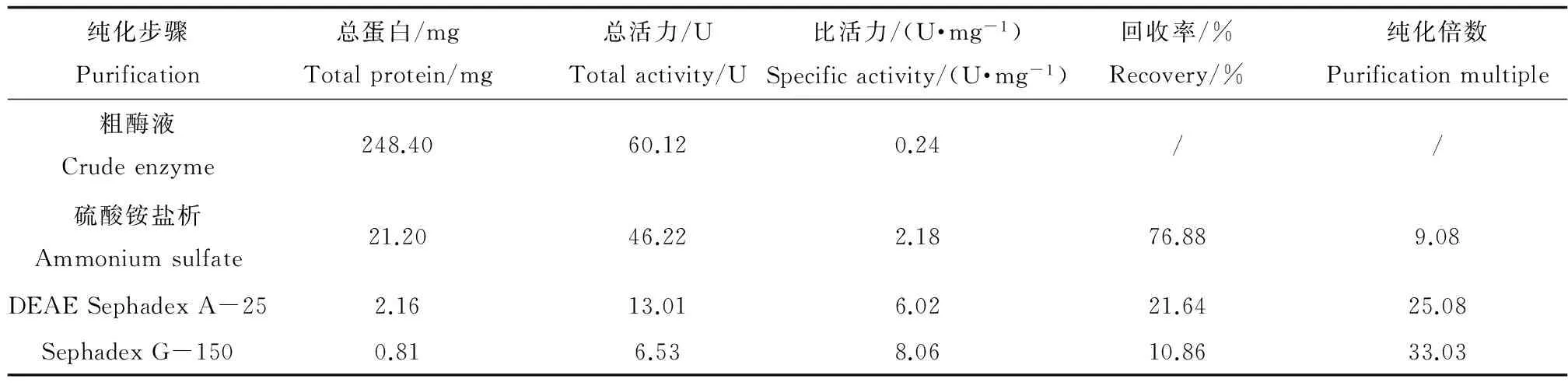
表1 花翅摇蚊NAGase的纯化效果

图1 纯酶的PAGE电泳图Fig. 1 PAGE of NAGase
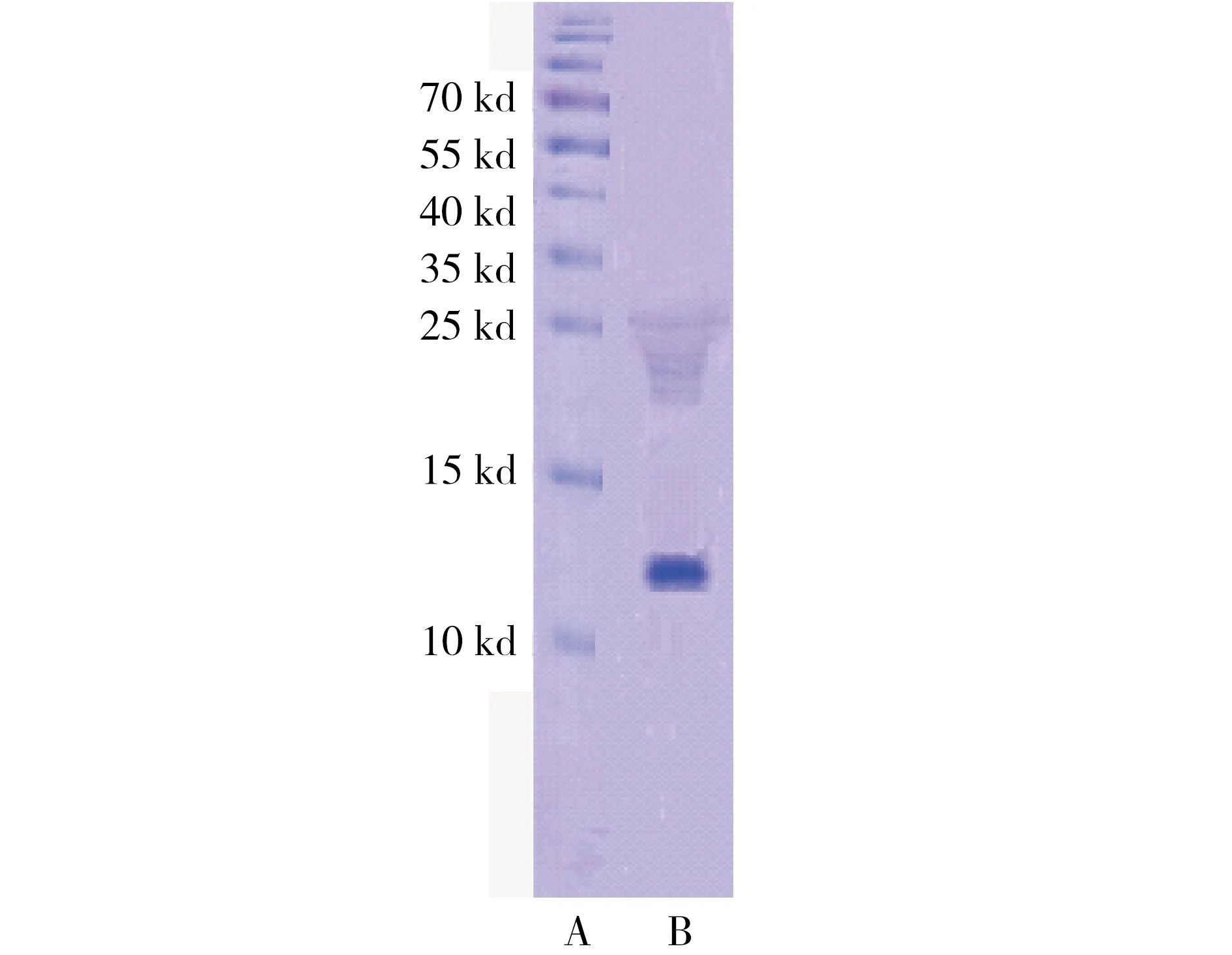
图2 纯酶SDS-PAGE电泳图(A:标准蛋白;B:纯化后的酶)Fig. 2 SDS-PAGE of NAGase(A: Markers; B: Enzyme after purification)
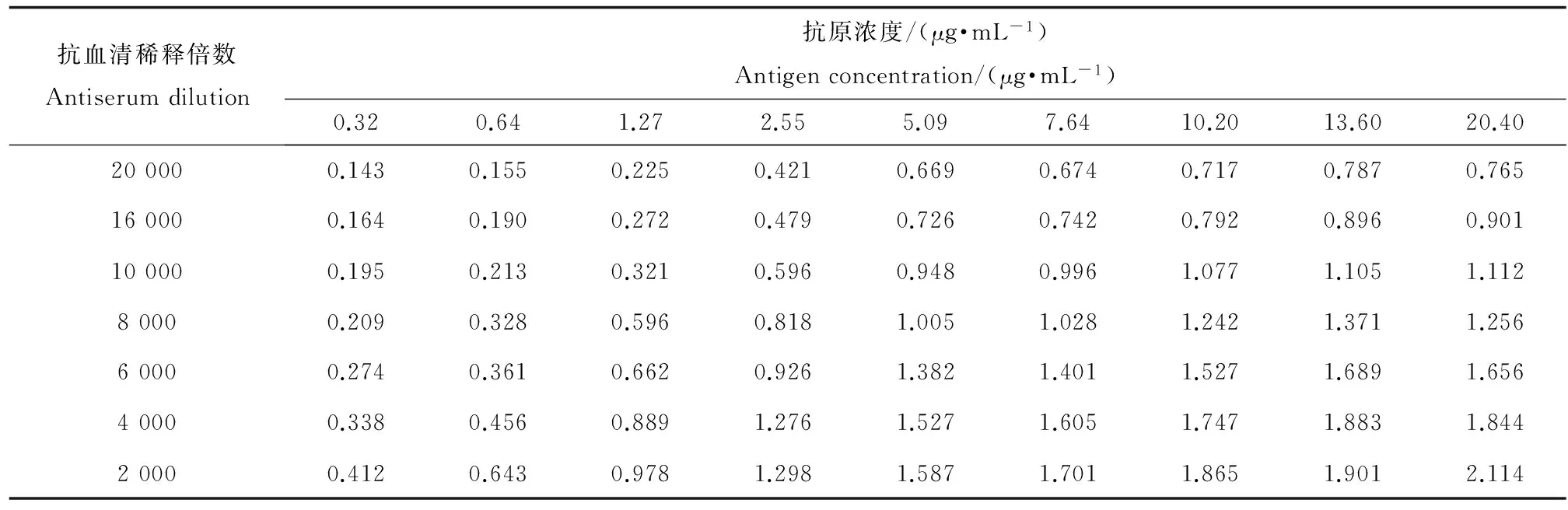
表2 方阵法确定间接非竞争ELISA法最适抗原抗体浓度结果(OD450)
2.2.2 标准曲线
图3为抗体在1:10000稀释倍数下,抗原测定的标准曲线,曲线方程为:Y=a+b (ecx),其中a=1.0991,b=-1.0208,c=-0.275811,相关系数r2=0.9986,标准误差S=0.013。
2.3 花翅摇蚊NAGase抗体的特异性
表3显示水中常见的一些节肢动物和绿藻NAGase活力测定结果。由表3可知,NAGase在所测生物中均具有分布,比活力大小为:日本沼虾>隆线溞>花翅摇蚊>多刺裸腹溞>老年低额溞>白纹伊蚊>中华薄壳介>小球藻。
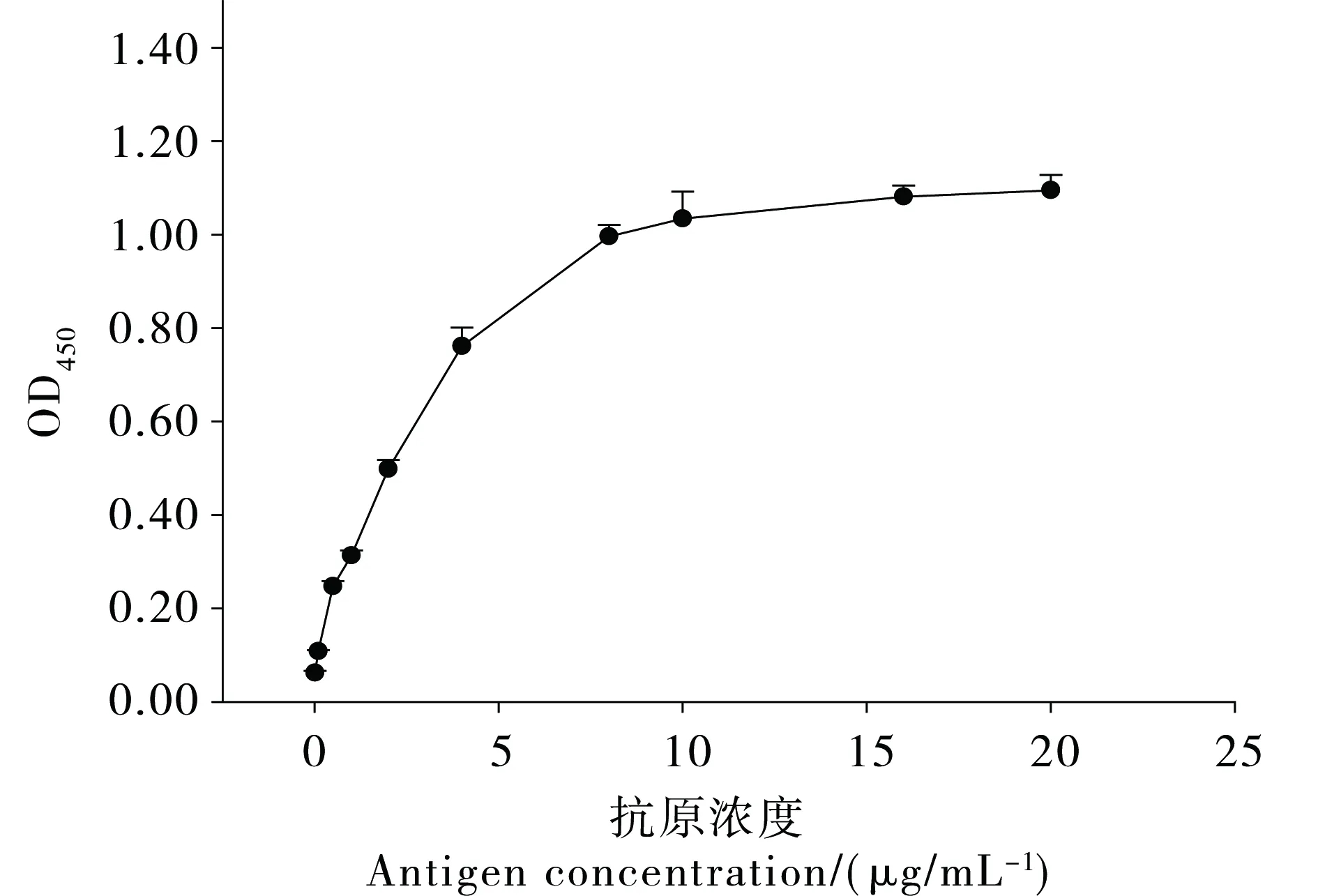
图3 间接非竞争ELISA法的标准曲线Fig. 3 Standard curve for indirect and non-competitive ELISA
由表4可知,在保持粗酶样品中NAGase活力基本一致的条件下,花翅摇蚊NAGase抗体与隆线溞、老年低额溞、多刺裸腹溞、中华薄壳介、日本沼虾、白纹伊蚊、小球藻NAGase的交叉反应率分别为4.41%、3.12%、3.40%、4.23%、3.23%、7.50%和<0.5%。
2.4 农药对花翅摇蚊幼虫的毒力
毒死蜱、氰戊菊酯和阿维菌素对花翅摇蚊幼虫的毒力测定结果如表5所示。由表5可知毒死蜱、氰戊菊酯和阿维菌素的12 d-LC50分别为4.8171(2.731~5.537)、0.0954(0.075~0.121)和2.1340(1.650~2.730)μg·L-1,可见3种杀虫剂对花翅摇均具有较高的毒力。由于三种药剂LC50的95%置信区间没有重叠,所以对花翅摇蚊12 d毒力:氰戊菊酯>阿维菌素>毒死蜱,且差异显著。
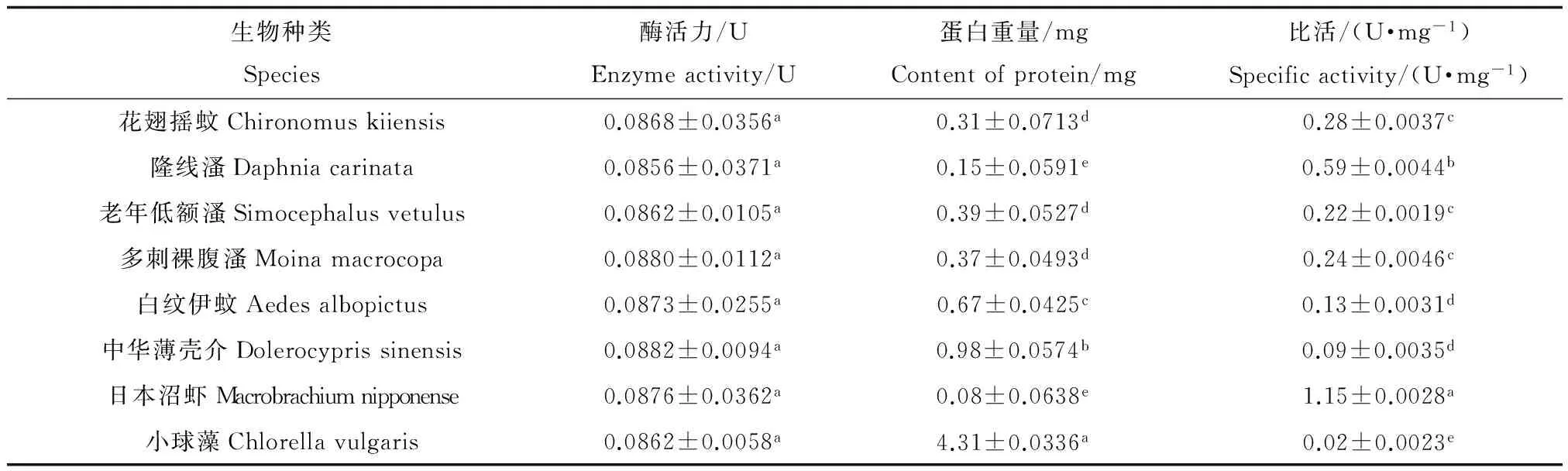
表3 不同水生生物的NAGase活性比较
注:表中数据为平均值±标准误差,同列数据,以不同英文字母标注的,表示处理之间差异显著(p<0.05)。
Note: Data in the table is mean ±SE and the data marked by different letters in the same column indicate significant difference between treatments (p<0.05).
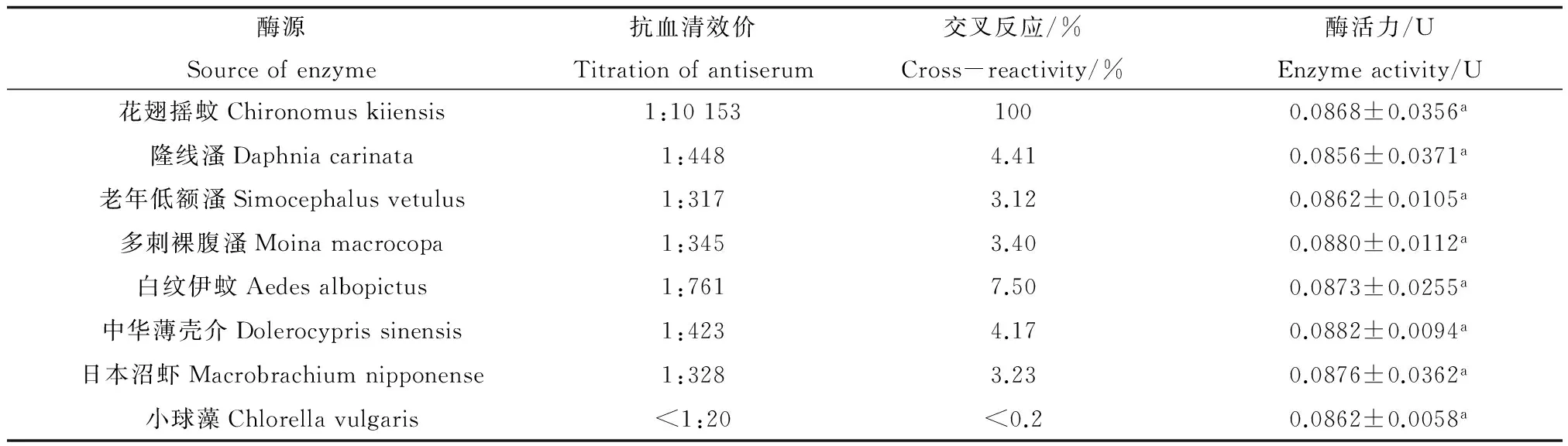
表4 花翅摇蚊NAGase抗血清的特异性
注:定义花翅摇蚊NAGase的交叉反应率为100%;其他生物体的交叉反应率(%)=各种生物体抗血清效价/花翅摇蚊的抗血清效价×100%;表中数据为平均值±标准误差,同列数据,以不同英文字母标注的,表示处理之间差异显著(p<0.05)。
Note: Defining the cross-reactivity of Chironomus kiiensis is 100%; Other organisms cross reactivity rate(%)=the titer of antiserum from various organisms/the titer of antiserum from Chironomus kiiensis×100%;data in the table is mean ±SE and the data marked by different letters in the same column indicate significant difference between treatments (p<0.05).
2.5 农药对水中NAGase-IR释放量的影响
毒死蜱、氰戊菊酯和阿维菌素对花翅摇蚊幼虫NAGase-IR水中释放量的影响如表6所示。从表6中可以看出三种杀虫剂对NAGase-IR的12 d-EC50分别为1.2012、0.0043、0.6281 μg·L-1。因此,花翅摇蚊在三种农药作用下,其释放到水中的NAGase-IR受到了影响,且受试药剂的浓度与其NAGase-IR释放量存在相关关系。
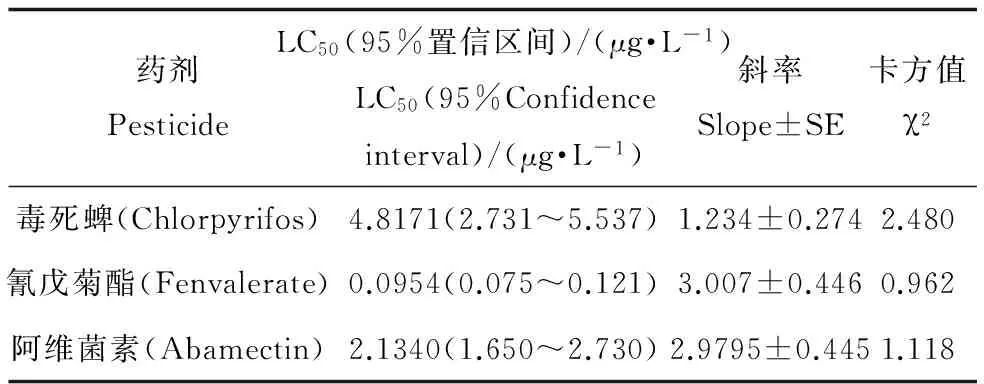
表5 三种农药对花翅摇蚊幼虫毒力
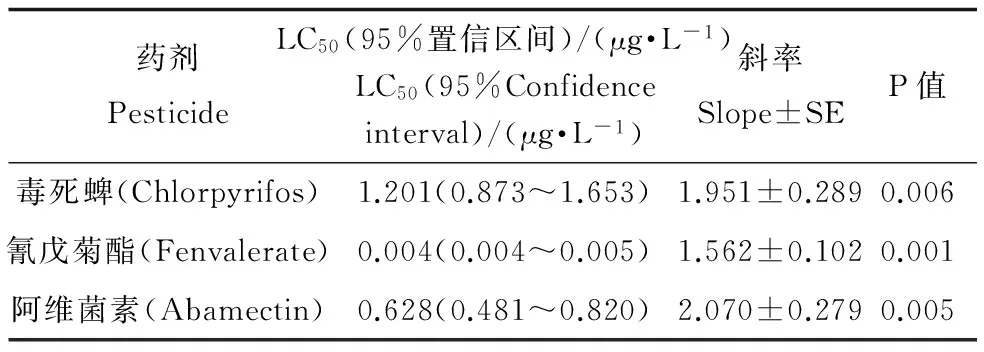
表6 三种农药对花翅摇蚊NAGase-IR的抑制作用
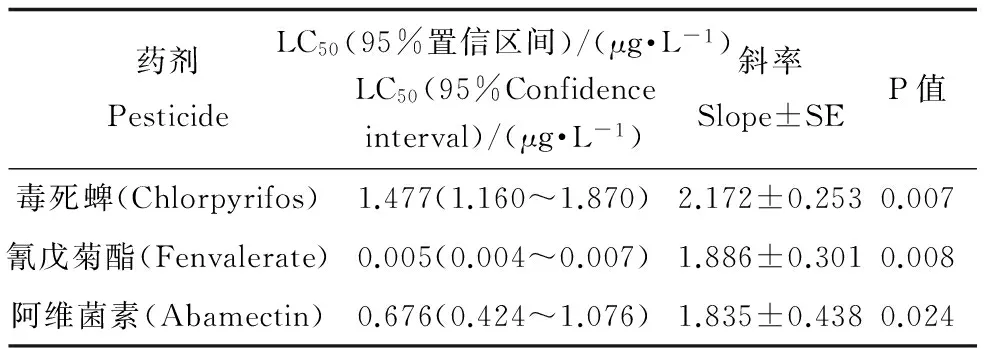
表7 三种农药对花翅摇蚊NAGase活力的抑制作用
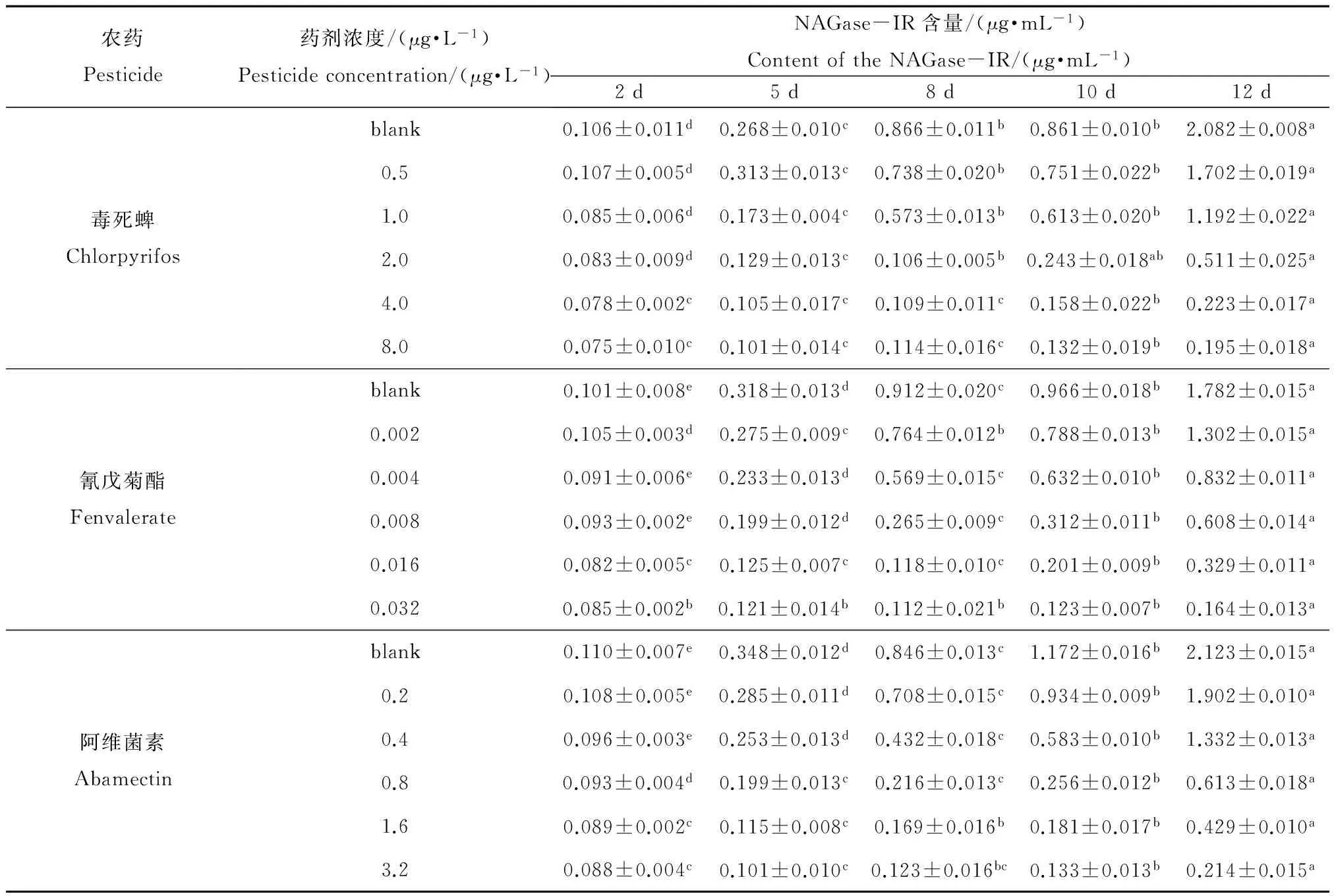
表8 不同农药对NAGase-IR的影响
注:表中数据为平均值±标准误差,同行数据,以不同英文字母标注的,表示处理之间差异显著(p<0.05)。Note: data in the table is mean ±SE and the data marked by different letters in the same line indicate significant difference between treatments (p<0.05).
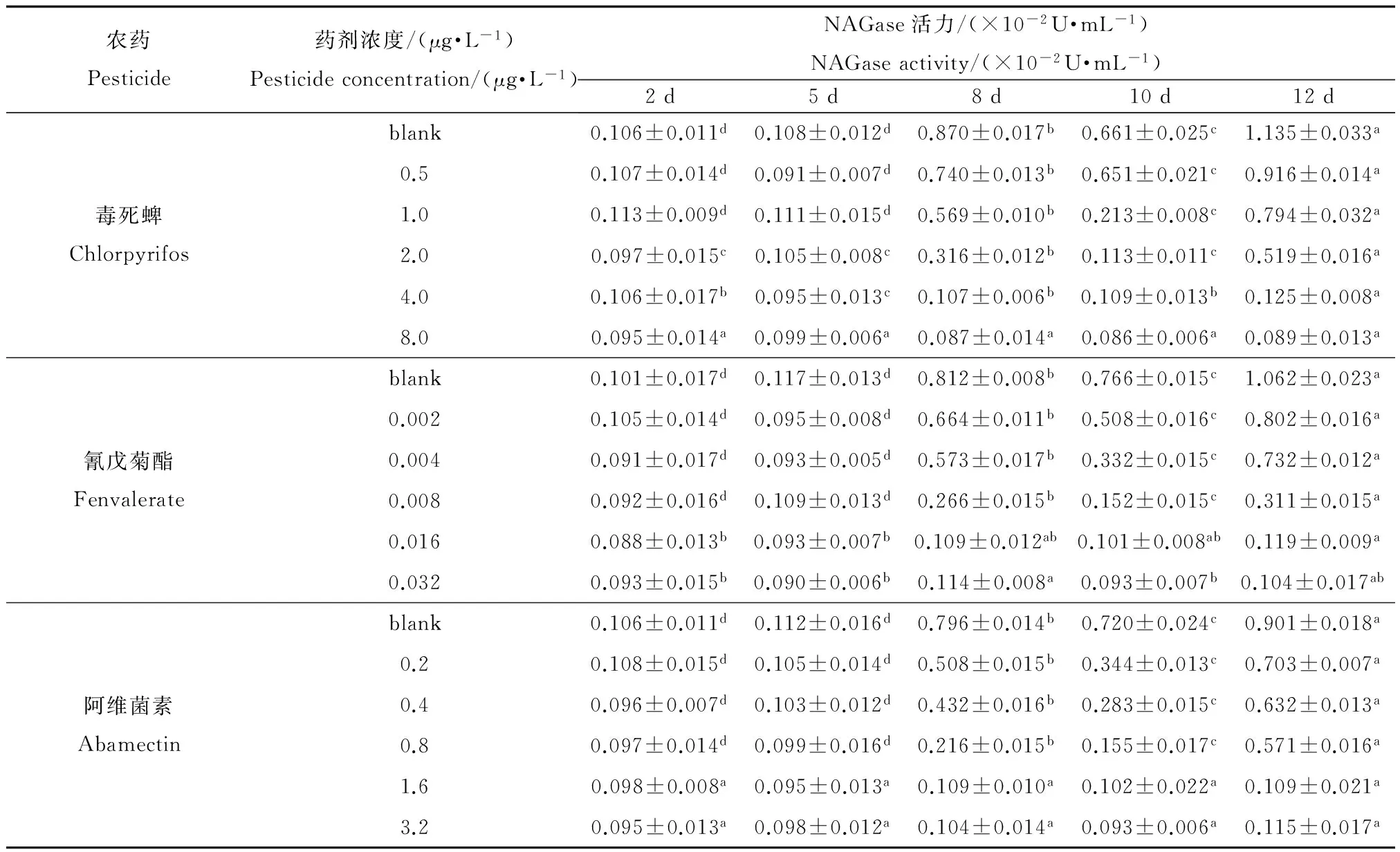
表9 不同农药对NAGase活力的影响
注:表中数据为平均值±标准误差,同行数据,以不同英文字母标注的,表示处理之间差异显著(p<0.05)。Note: Data in the table is mean ±SE and the data marked by different letters in the same line indicate significant difference between treatments (p<0.05).
表8显示了在毒死蜱、氰戊菊酯和阿维菌素作用下,花翅摇蚊幼虫释放到水中的NAGase-IR的含量随时间的变化。由表8可以看出,在同一药剂浓度下,水中NAGase-IR的含量随时间增长不断增大,且到试验结束时,水中NAGase-IR浓度均明显高于试验开始时;另外,对同一种药剂,随着其浓度的增大,NAGase-IR浓度的变化量反而减少,与对照相比,药剂浓度越高,NAGase-IR浓度出现明显增大所需要的时间越长。
2.6 农药对水中NAGase活力的影响
毒死蜱、氰戊菊酯和阿维菌素对花翅摇蚊幼虫培养液中NAGase活力的影响如表7所示。从表7中可以看出,三种农药对NAGase活力12 d-EC50分别为1.4765、0.0051、0.6756 μg·L-1。
在毒死蜱、氰戊菊酯和阿维菌素作用下,花翅摇蚊幼虫释放到水中的NAGase的活力随时间的变化如表9所示。由表9可以看出,在同一药剂浓度下,随着时间的增长,NAGase活力出现上升、下降再上升的变化趋势;同时,对于同一药剂,随着药剂浓度的增大,NAGase活力变化量却随之减少,与对照相比,在较高的浓度组,NAGase活力则几乎没有出现明显的增长。
3 讨论(Discussion)
为制备NAGase的多克隆抗体,本试验从花翅摇蚊Chironomus kiiensis幼虫体内分离得到电泳纯的NAGase,测得其亚基分子量约为13 KD,这是首次关于摇蚊科NAGase亚基分子量的报道。Angulo[25]和Filho[26]曾研究过与摇蚊同属为双翅目的羊肤蝇Oestrus ovis和埃及伊蚊Aedes aegypti NAGase亚基的分子量,前者在20~63 KD之间,后者分别为33KD和40KD,两者均高于花翅摇蚊,可见即使在双翅目昆虫内部,NAGase在结构上也存在某种程度的差异。
在本项研究中制备花翅摇蚊NAGase多克隆抗体的目的在于寻找一种针对摇蚊的生物量的相对特异性的检测方法,既方便对花翅摇蚊种群发育进行实时监测,又克服了用NAGase活力作为检测指标时,其结果可能会受到的其他生物来源的NAGase的干扰。特异性研究的结果显示,花翅摇蚊NAGase多克隆抗体与包括枝角类、中华薄壳介、虾在内的甲壳动物的NAGase的交叉反应率很低,仅在3.12%~4.17%之间,它与小球藻的交叉反应率更是低于0.5%(表4),这说明在生物量检测中,该抗体不仅能将摇蚊与甲壳动物分开,受到绿藻干扰的可能性也很小。在昆虫纲内部,摇蚊NAGase抗体与同属双翅目的伊蚊的交叉反应率只有7.50%。这说明花翅摇蚊的抗体有可能将昆虫纲的某些动物剔除。
当水生节肢动物的数量及生长受到外界因素影响时,其释放到水中的NAGase含量也会发生改变[27-29]。在三种农药的作用下,花翅摇蚊生长受到抑制,其NAGase的水中释放量也相应减少。本试验运用抗体测得毒死蜱、氰戊菊酯和阿维菌素三种杀虫剂对于NAGase-IR的12 d-EC50分别为1.2012 (0.873~1.653)、0.004(0.004~0.005)和0.628(0.481~0.820) μg·L-1(表6);以酶活力测试三种农药相应的EC50分别为1.477(1.160~1.870)、0.005(0.004~0.007)和0.676(0.424~1.076) μg·L-1(表7)。以死亡作为测试终点的12 d-LC50分别为4.8171 (2.731~5.537)、0.0954 (0.075~0.121)和2.1340 (1.650~2.730) μg·L-1(表5)。由3种方法的EC50、LC50及其95%置信区间可知,用NAGase-IR变化来表示三种农药对花翅摇蚊的影响,其EC50值略低于用NAGase活力表示的EC50,但差异并不显著;而这两种方法所得到的EC50均显著低于用死亡率表示的LC50。可见用NAGase-IR及活力的变化来表示农药对花翅摇蚊影响时比用死亡率更加灵敏。在农药作用下,NAGase-IR及其活力发生变化可能是因为农药抑制了花翅摇蚊的生长发育,使其蜕皮时产生的NAGase量受到影响[30];也可能是因为农药的作用,使花翅摇蚊的生物量发生改变,从而导致产生的NAGase受到影响。
由表9中可以看出,在试验的某些时段,水中NAGase的活力不但不上升,反而有所下降。其可能的原因是,在这些时段,摇蚊处于两次脱皮之间的生长期,其向水中释放NAGase的量减少,与此同时,已经释放的酶在不断降解,直至下一次蜕皮时有新的酶释放出来。然而在相应时段,NAGase-IR含量的绝对值并未出现明显下降(表8)。这说明即使NAGase的催化活性因酶的降解而丧失,作为抗原,NAGase-IR仍然可以被抗体检测到。从抗原和酶的角度进行比较,前者的稳定性和持久性一般优于后者[31]。可见NAGase-IR比NAGase活力本身更适合于测量生物量在一段时间以来的积累情况。
从灵敏度的角度比较利用NAGase活力和NAGase-IR作为检测指标的两种方法,由表8和表9可知,NAGase-IR浓度在第5天出现明显上升,相比之下,NAGase活力开始出现明显上升的转折点最早在第8天;另外,在最大药剂浓度时,NAGase-IR浓度在第12天时明显高于第2天的,但是并没有检测到NAGase活力出现明显上升,这进一步反映出NAGase-IR相较于NAGase活力要更加灵敏。
致谢:感谢南开大学生命科学学院环境和资源生物学实验室王新华老师在水生生物鉴定上的帮助和支持。
[1] Davis B, Eveleigh D E. Chitin, Chitin Chitosan and Related Enzymes [M]. Oriando:Academic Press, 1984: 61-179
[2] Conley J M, Schorr M S, Hanson M L, et al. Is ambient chitobiase activity a monitoring tool for impacts on secondary production in loticsystems[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2009, 66: 1274-1281
[3] Hanson M, Lagadic L. Chitobiase activity as an indicator of aquatic ecosystem health[J]. Health Manage, 2005, 8: 441-450
[4] Richards S M, Kelly S E, Hanson M L. Zooplankton chitobiase activity as an endpoint of pharmaceutical effect [J]. Archives of Environment Contamination and Toxicology, 2008, 54: 637-644
[5] Vrba J. Comment to Sherr and Sherr (1999): Is there any appropriate way to distinguish different β-N-acetylhexosaminidase activities in aquatic environments [J]. FEMS Microbiology Ecology, 2000, 33: 81-84
[6] Vrba J, Callieri C, Bittl T, et al. Are bacteria the major producers of extracellular glycolytic enzymes in aquaticenvironments [J]. International Review of Hydrobiology, 2004, 89(1): 102-117
[7] Vrba J, Kofroňová-Bobková J, Pernthaler J, et al. Extracellular low-affinity (β-N-acetylglucosaminidases) linked to the dynamics of Diatoms and Crustaceans in freshwater systems of different trophic degree [J]. International Review of Hydrobiology, 1997, 82(2): 277-286
[8] Gerrit P, Reinhard S, Rolf M, et al. Isoforms of an N-acetyl-β-D-glucosaminidase from the Antarctickrill, Euphausia superba: Purification and antibody production[J]. Comparative Biochemistry and Physiology, 1998, 120: 743-751
[9] Shang J G, Zhang L, Shi C J, et al. Influence of chironomid larvae on oxygen and nitrogen fluxes across the sediment-water interface (Lake Taihu, China)[J]. Journal of Environmental Sciences, 2013, 25(5): 978-985
[10] Jiang P H, Ji L, Xiao W J, et al. Bioturbation of two chironomid species on nutrient exchange at sediment-water interface in a Chinese shallow eutrophic lake[J]. Fresenius Environmental Bulletin, 2010, 19(5a): 902-910
[11] 王印, 王军军, 秦宁, 等. 应用物种敏感性分布评估DDT和林丹对淡水生物的生态风险[J]. 环境科学学报, 2009, 29(11): 2407-2414
[12] 张雪梅, 王成菊. 农药对大型蚤的毒作用研究进展[J]. 农药科学与管理, 2007, 28(12): 53-57
[13] 张晓群, 张大弟, 徐正泰. 氰戊菊酯在池塘生态系统中的消解[J]. 上海农业学报, 1992, 8(4): 77-82
[14] 葛士林, 曹传旺, 王志英. 3种农药对红裸须摇蚊体内蛋白质质量分数和AChE活性的影响[J]. 东北林业大学学报, 2011, 39(1): 108-109
[15] 赵燕, 汤保华,蔡磊明,等. 杀菌剂戊唑醇对花翅摇蚊(Chironomus kiiensis)幼虫的急性毒性和抗氧化酶系统的影响[J]. 农药, 2012, 51(6): 445-448
[16] 程燕, 周军英, 单正军, 等. 国内外农药生态风险评价研究综述[J]. 农村生态环境, 2005, 21(3): 62-66
[17] 黄小红, 王寿昆, 黄一帆, 等. 日本沼虾(Macrobrachium nipponense)N-乙酰-β-D-氨基葡萄糖苷酶初步纯化及部分性质[J]. 应用与环境生物学报, 2006, 12(6): 804-808
[18] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of microgram quantities of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254
[19] Mark L H, Laurent L. Chitobiase activity as an indicator of aquatic ecosystem health[J]. Aquatic Ecosystem Health and Management, 2005, 8(4): 441-450
[20] 李建武, 萧能庚, 余瑞元, 等. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1997
[21] 余平. 免疫学实验[M]. 武汉: 华中科技大学出版社, 2012: 8
[22] 刘洪翠, 杨艳霞, 李少南. 大型溞胆碱酯酶间接非竞争酶联免疫吸附定量分析法的建立[J]. 浙江大学学报: 农业与生命科学版, 2012, 38(3): 347-354
[23] Oosterhuis S S, Baars M A, Klein C M. Release of the enzyme chitobiase by the copepod Temoralongicornis: Characteristics and potential tool for estimating crustacean biomass production in the sea[J]. Marine Ecology-Progress Series, 2000, 196: 195-206
[24] 杨利国, 胡少昶, 魏平华, 等. 酶免疫测定技术[M]. 南京: 南京大学出版社, 1998: 385-481
[25] Angulo-Valadez C E, Cepeda-Palacios R, Ascencio F, et al. Proteolytic activity in salivary gland products of sheep bot fly (Oestrus ovis) larvae[J]. Veterinary Parasitology, 2007, 149(1/2):117-125
[26] Filho Benedito P D, Lemos Francisco J A, Secundino Nágila F C, et al. Presence of chitinase and beta-N-acetylglucosaminidase in the Aedes aegypti: A Achitinolytic system involving peritrophic matrix formation and degradation[J]. Insect Biochemistry and Molecular Biology, 2002, 32(12): 1723-1729
[27] Akash R, John C. Rate of chitobiase degradation as a measure of development rate in planktonic Crustacea[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2000, 57: 1965-1968
[28] Avila T R, Machado A A de S, Bianchini A. Estimation of zooplankton secondary production in estuarine waters: Comparison between the enzymatic (chitobiase) method and mathematical models using crustaceans[J].Journal of Experimental Marine Biology and Ecology, 2012, 416-417: 144-152
[29] Sastri A R, Dower J F. Field validation of an instantaneous estimate of in situ development and growth for marine copepod communities [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2006, 63: 2639-2647
[30] 林建成. 节肢动物几丁质酶及其在蜕皮中的生理作用[J]. 德州学院学报, 2005, 21(6): 45-49
[31] 杨艳霞. 大型溞ChE免疫测定:有机磷杀虫剂的生物指示[D]. 杭州: 浙江大学, 2010
◆
Assessing the Impact of Pesticides on Population Development ofChironomuskiiensisBased on Content of β-N-Acetyl-D-glucosaminidase
Zhou Surui, Zhang Wenping, Li Shaonan,*Zhu Guonian
Institute of Pesticide and Environmental Toxicology, Zhejiang University, Hangzhou 310029
15 May 2014 accepted 3 June 2014
Risk assessment on population level is still challenged by its proper in terms of methodology. In this work, population development of Chironomus kiiensis was assessed by quantity of β-N-Acetyl-D-glucosaminidase (NAGase) released from the larvae. To do so, the NAGase was purified from the bodies and polyclonal antibodies were obtained by immunizing rabbits with the purified enzyme. Indirect and non-competitive enzyme-linked immunosorbent assay (ELISA) was employed to analyze specificity of the antibodies, and the results showed that the cross reactions was 4.41% for Daphnia carinata, 3.12% for Simocephalus vetulus, 3.40% for Moina macrocopa, 4.17% for Dolerocypris sinensis, 3.23% for Macrobrachium nipponense, 7.50% for Aedes albopictus, and <0.5% for Chlorella vulgaris. After being exposed for 12 days to pesticides, the EC50based on residues of NAGase, which was determined by ELISA, was 1.201 μg·L-1for chlorpyrifos, 0.004 μg·L-1for fenvalerate, and 0.628 μg·L-1for abamectin. The EC50determined by activity of NAGase was 1.477 μg·L-1for chlorpyrifos, 0.005 μg·L-1for fenvalerate, and 0.676 μg·L-1for abamectin. However, the LC50were measured to be 4.817 μg·L-1for chlorpyrifos, 0.095 μg·L-1for fenvalerate, and 2.134 μg·L-1for abamectin. Our results suggested that the impact of pesticides on population development of Chironomus kiiensis could be assessed distinctively by quantity of NAGase released by the larvae.
chlorpyrifos; fenvalerate; abamectin; Chironomus kiiensis; risk assessment; β-N-acetyl-D-glucosaminidase; ELISA
浙江省自然科学基金 ( LY12B07008)
周素锐(1987-),女,硕士,研究方向为水生生态毒理学,E-mail: 21116108@zju.edu.cn;
*通讯作者(Corresponding author),E-mail: snli@zju.edu.cn
10.7524/AJE.1673-5897-20140515001
2014-05-15 录用日期:2014-06-03
1673-5897(2015)1-288-09
X171.5
A
李少南(1963—),男,副教授,主要研究方向为水生生态毒理学。
周素锐,张文萍,李少南,等. 利用N-乙酰-β-D-氨基葡萄糖苷酶含量评价农药对花翅摇蚊种群发育的影响[J]. 生态毒理学报,2015, 10(1): 288-296
Zhou S R, Zhang W P, Li S N, et al.Assessing the impact of pesticides on population development of Chironomus kiiensisbased on content of β-N-acetyl-D-glucosaminidase[J]. Asian Journal of Ecotoxicology, 2015, 10(1): 288-296 (in Chinese)

