小鼠发情周期中黄体大小及细胞的数量变化规律
宋孟秋,马永生,曹玉凤,刘 阳,杨 焕,范艳乐,陈 炯,殷玉鹏,赵善廷,陈树林*
(1.西北农林科技大学动物医学院,陕西杨凌712100;2.甘肃民族师范学院生命科学院,甘肃合作747000)
黄体(corpus luteam,CL)是哺乳动物卵巢排卵后其中的颗粒细胞和内膜细胞分化而成的一个暂时性内分泌器官,主要分泌孕酮,在哺乳动物的生殖调控中起着重要的作用[1]。黄体主要包括分泌类固醇类细胞和不分泌类固醇类细胞,其中,前者主要为大黄体细胞(large luteal cells,LLCs)和小黄体细胞(small luteal cells,SLCs),而后者则多为内皮细胞、纤维母细胞和巨噬细胞等[2]。由于LLCs与SLCs的分界线模糊,而SLCs又具有向LLCs分化的可能性[3],同时离体黄体组织中LLCs和SLCs的数量比例并不能代表黄体中两种细胞的真实比例[4-5],因而,多年来关于两种细胞的真实数据及大小也一直都是学者争论的焦点。对黄体细胞大小通用的描述是通过黄体组织切片上黄体细胞的断面进行测量而得到的结果,而这并不能真实地反映黄体细胞的立体大小。为了探索周期性黄体大小及其不同类型细胞的数量变化规律,本研究分别采用自发生长的不同时期的黄体组织,测量不同时期黄体内的细胞立体大小并计算不同立体大小的细胞所占比例,为新的黄体细胞分类体系的建立和计算机模拟构建周期性黄体的三维立体构象提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雌性昆明种小鼠,8周龄~10周龄,平均体重26g±0.5g,第四军医大学实验动物中心提供。所有试验小鼠饲养在环境温度17℃~24℃、相对湿度为55%±5%、自然光照条件下,自由采食、饮水。
1.1.2 主要试剂与仪器设备 苏木精与伊红染液,Solarbio公司产品;切片石蜡(硬蜡56℃~58℃,软蜡54℃~56℃),上海华永石蜡有限公司产品;石蜡切片机RM2235,德国Leica公司生产;Olympus CHC型光学显微镜,日本Olympus光学工业株式会社;捷达801形态学分析软件,江苏捷达科技公司。
1.2 方法
1.2.1 发情周期鉴定及样本采集 左手保定小鼠,右手将细棉签用生理盐水润湿后缓缓插入阴道约0.5cm,轻轻转动并将蘸有阴道分泌物的细棉签在载玻片上均匀涂抺,待自然干燥后用碱性美蓝染液染色5min后蒸馏水洗涤,并使之干燥,显微镜下观察阴道涂片的细胞形态与分布变化以确定其发情状况。用100mL/L水合氯醛腹腔注射对小鼠进行麻醉,后迅速暴露胸腔,将注射用针头刺入左心室用固定,同时用眼科剪剪开右心耳,之后缓慢注入100 mL左右生理盐水以冲洗心血管中的血液,最后换用40mL/L多聚甲醛磷酸缓冲液(pH7.4)150mL进行灌注固定。充分固定后,将两侧卵巢(如小米粒大小并带有结缔组织)小心地用眼科手术剪摘取,放入40mL/L多聚甲醛中保存。
1.2.2 石蜡切片制作及HE染色 从固定液中取出卵巢组织,流水冲洗12h,小心剥离剔除其上的结缔组织和脂肪等组织,梯度酒精脱水后二甲苯透明并用石蜡进行包埋,在石蜡切片机上把卵巢完整地切成厚度为6μm的连续纵向切片,标明每一张切片的先后顺序,并做好记录,然后置于45℃恒温箱中烘干。将干燥后的切片进行脱蜡复水,苏木精染色7min,盐酸乙醇分化20s,伊红染色7min,自来水洗去浮色后梯度酒精脱水,二甲苯透明后用中性树胶封片。
1.2.3 图像分析及数据处理 在10×10倍镜野下对每一例卵巢切片上发育较好的黄体部分进行拍照,将照片去除非黄体部分后用形态分析软件对照片进行分析,测量这些照片中黄体的最大切面的直径大小,同时统计每张照片上黄体细胞的总数目,结果直接存于软件系统,进行统计学处理。在40×10倍镜野下随机地对切片上某些细胞的平面细胞区域进行拍照,然后对与此切片连续相邻的若干张切片上和前述区域对位的平面细胞区域进行拍照,将这几张切片的上述平面细胞区域组成一立体细胞区域并用软件分析测量,每1个立体细胞区域内测量8个黄体细胞的立体大小,得出这8个黄体细胞在这些照片上的最大断面的长短径,再根据这些细胞所在切片的张数得出细胞的纵径估计值(纵径以切片厚度6μm为单位),从而得出这个立体细胞区域内8个黄体细胞的立体大小数据;共分析10个立体细胞区域得到80个黄体细胞的立体大小数据,然后对不同大小的黄体细胞所占比例进行定量划分。
2 结果
2.1 不同时期卵巢及黄体的大小
各时期黄体的形状近似于球体,故其体积可以以其最大切面的直径来表示。本研究中将小鼠周期性黄体从开始形成到生长增大直至退化的整个过程中划为四个时期,分别为黄体Ⅰ期、黄体Ⅱ期、黄体Ⅲ期及黄体Ⅳ期,其与发情周期的一般相对应关系是黄体Ⅰ期→发情后期、黄体Ⅱ期→发情间期、黄体Ⅲ期→发情前期和黄体Ⅳ期→发情期。数据表明,发情周期中,卵巢大小的变化无显著性差异(表1);而黄体体积变化中,发情后期与发情前期黄体最大切面大小无显著性差异,发情间期与发情期黄体最大切面分别与其他时期相比均差异极显著,其中,发情间期黄体切面最大,而发情期黄体切面最小,说明发情周期中黄体大小变化明显(表2和图1)。

表1 不同时期卵巢长、宽和高的乘积平均值及标准差(n=10)Table 1 The average and standard deviation of products of length,width and high of every ovary in different periods(n=10)

表2 不同时期黄体最大切面平均直径(n=10)Table 2 The average diameter of the biggest transverse section of corpus luteum in different periods(n=10)
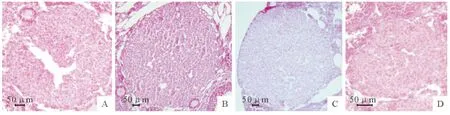
图1 A.Ⅰ期黄体切片图;B.Ⅱ期黄体切片图;C.Ⅲ期黄体切片图;D.Ⅳ期黄体切片图(HE,400×)Fig.1 A.The paraffin section picture ofⅠperiod CL;B.The paraffin section picture ofⅡperiod CL;C.The paraffin section picture ofⅢperiod CL;D.The paraffin section picture of IV period CL(HE,400×)
2.2 不同时期黄体中细胞总数量的统计
不同时期黄体中细胞的总数量因卵巢与黄体自身活动状况的不同而发生着变化。数据显示,不同时期中黄体细胞的总数量各不相同且互相之间均存在显著差异(表3)。

表3 各时期黄体的平均细胞数目Table 3 The average cell number of corpus luteum in each period
2.3 不同时期黄体细胞立体大小及其比例
不同时期黄体细胞的立体大小及其数量因卵巢所处的发情周期阶段不同而存在差异。因数值过多,在10个细胞区域中各随机选取1个黄体细胞最大断面的长径、短径及纵径数据并由表格的形式列出(表4)。

表4 不同时期黄体中的黄体细胞立体大小(μm)Table 4 The three-dimensional size of corpus luteum cells in different period corpus luteum(μm)
将每个细胞的长径、短径和纵径数值相乘,其中纵径数值以其中间值作近似处理,所得数据按500 μm3为单位的划分区间进行分布统计,从而将每一时期的80个上述数据在不同数值区间内分布的情况进行分析统计,从而得出不同时期的黄体中不同立体大小的黄体细胞所占比例。饼状图显示,Ⅰ期黄体中黄体细胞主要以数值乘积在2 501μm3~3 000μm3和3 001μm3~3 500μm3的细胞居多,1 001μm3~1 500μm3的细胞也占一定比例,其他数值区间内的细胞所占比例较小。Ⅱ期黄体中黄体细胞以数值乘积在3 001μm3~3 500μm3的细胞最多,其次是比例相当的数值乘积在2 501μm3~3 000μm3和3 501μm3~4 000μm3的细胞,其他数值区间内的细胞所占比例较小,另外这一时期的黄体中有一定比例的数值乘积很大的细胞。Ⅲ期黄体中黄体细胞总体上与Ⅱ期黄体一致的同时,数值乘积比较小的1 001μm3~1 500μm3的小细胞明显的比Ⅱ期黄体多。Ⅳ期黄体中黄体细胞以数值乘积在1 001μm3~1 500μm3的细胞最多且比例很大,其他数值区间内的细胞所占比例相当,但这一时期的黄体中数值乘积在3 000μm3以上的细胞很少(图2)。
3 讨论
周期性黄体的体积大小在发情周期的不同时期存在着显著的差异,说明周期性黄体自发生、生长直至退化的不同时期内其体积发生了明显的变化。然而,在整个发情周期中,尽管黄体体积的变化较为明显,卵巢体积却没有明显的变化,无论是在卵巢中黄体占优势的时期还是卵泡占优势的时期,卵巢内部只是发生着卵泡和黄体的体积大小此消彼长的变化,而卵巢体积的始终如一可能是保持卵巢功能稳定的一个调控途径。
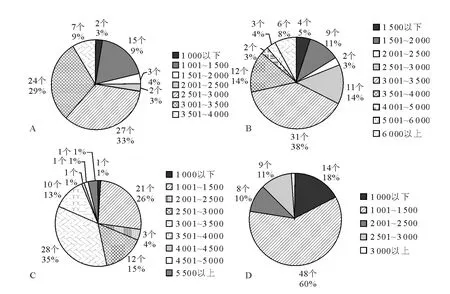
图2 不同时期黄体中细胞三维数值相乘所得数据在不同数值区间内的分布Fig.2 The product distribution of three-dimensional size of different period CL cells in different numerical areas
黄体中大小黄体细胞的数量比例在不同报道中差异较大,其原因是两种细胞分类标准在各个研究中存在很大差异,很难直接比较[6]。在牛黄体中,有学者认为直径大于18μm的细胞为LLCs[7],而也有文献中认为大于23μm的才为LLCs[4];在羊黄体中,LLCs和SLCs的最小与最大直径分别被报道为30μm和16μm[8]。而本研究数据显示,在周期性黄体自发生、生长直至退化的过程中,其黄体细胞数目先是成一个上升态势直至Ⅱ期黄体,而后随着黄体组织的开始退化,其中的细胞数目也随之减少,整个过程中细胞数目呈正态分布的趋势发生变化。通过统计学分析,在不同时期的周期性黄体中细胞总数目依时期不同而存在极显著差异,且其中某一时期的细胞总数目与其他任一时期的细胞总数目间存在极显著差异。究其原因,可能是在黄体化时,由于激素、细胞因子等一些生物活性物质的作用,黄体细胞分化增殖,导致其数量逐渐地达到一个高峰,黄体发育达到成熟,以支持黄体功能的发挥,如卵泡抑素(follistatin,FS)可通过与活化素结合,以自分泌形式参与颗粒细胞内甾体激素和糖蛋白激素合成与分泌的调节,从而促进颗粒细胞分化与黄体形成[3];优势卵泡发生排卵形成红体后,其中合成的白细胞介素-1(interleukin-1,IL-1)可通过旁分泌方式促进黄体细胞增殖及本身的分化[9-10]。而当周期性黄体退化时,大量黄体细胞的染色质浓缩、边聚,在核膜下形成电子密度较高的半圆形或不规则结构,细胞内空泡较多,并且形成由质膜包裹形成表面光滑的半圆形凋亡小体,后者被巨噬细胞或周围邻近的同类细胞吞噬[11],这样就造成了黄体细胞数目自Ⅲ期黄体后逐渐减少的情况,尤其是黄体组织在进入Ⅲ期黄体阶段时因黄体的显著退化而使得黄体细胞数目急剧减少。
本研究中,我们获得了黄体各个方面的静态信息,这些静态信息体现了周期性黄体自发生、生长直至退化消失的整个过程中其内部组织结构发生的动态变化,有利于计算机模拟重构周期性黄体组织的立体构象,从而为开展相关的一些研究提供便利;这也对通过在组织和细胞水平上获得数据,继而利用计算机模拟重构生物组织乃至器官等的立体构象提供了思路。
[1]Uniyal S,Panda R P,Chouhan V S,et al.Expression and localization of insulin-like growth factor system in corpus luteum during different stages of estrous cycle in water buffaloes(Bubalusbubalis)and the effect of insulin-like growth factorⅠon production of vascular endothelial growth factor and progesterone in luteal cells culturedinvitro[J].Theriogenology,2015,1(83),58-77.
[2]Baithalu R K,Singh S K,Gupta C,et al.Insulin stimulates progesterone secretion to a greater extent than LH in early pregnant buffalo luteal cells culturedinvitro[J].Anim Reprod Sci,2013,142(3-4):131-136.
[3]陈北亨,王建辰.兽医产科学[M].北京:中国农业出版社,2001.
[4]Weber D M,Fields P A,Romrell L J,et al.Functional differences between small and large luteal cells of the late-pregnant vs non-pregnant cow[J].Biol Reprod,1987,37(3):685-697.
[5]Hansel W,Alila H W,Dowd J P,et al.Control of steroidogenesis in small and large bovine luteal cells[J].Aust J Biol Sci,1987,40(3):331-347.
[6]蒙学莲,刘学荣,崔 燕.哺乳动物发情周期黄体的组织学研究进展[J].动物医学进展,2004,25(6):10-13.
[7]Chegini N,Ramani N,Rao C V.Morphological and biochemical characterization of small and large bovine luteal cells during pregnancy[J].Mol Cell Endocrinol,1984,37(1):89-102.
[8]Oshea J D,Rodgers R J,Wright P J.Cellular composition of the sheep corpus luteum in the mid-and late-luteal phases of the estrous cycle[J].J Reprod Fertil,1986,76(2):685-691.
[9]陈其新,毛鑫智,杨利国.细胞因子对动物卵巢生殖活动的调控[J].国外畜牧科技,2000,27(3):37-39.
[10]范瑞文.IFN和IL对卵巢生殖活动及胚胎附着的生理调控[J].畜牧兽医杂志,2001,20(2):13-15.
[11]Choi J,Jo M,Lee E,Choi D.The role of autophagy in corpus luteum regression in the rat[J].Biol Reprod,2011,85(3):465-472.