液泡膜Na+/H+逆向转运蛋白基因沉默对霸王叶气孔特征的影响
袁惠君,马 清,未 丽,胡 静,王 沛,王锁民
(1.草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020;2.兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
液泡膜Na+/H+逆向转运蛋白基因沉默对霸王叶气孔特征的影响
袁惠君1,2,马 清1,未 丽1,胡 静1,王 沛1,王锁民1
(1.草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020;2.兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
以霸王(Zygophyllumxanthoxylum)野生型植株(WT)、液泡膜Na+/H+逆向转运蛋白基因(ZxNHX)的RNA干扰(ZxNHX-RNAi)株系L2和L7为材料,分析了ZxNHX沉默后霸王叶下表皮气孔特征的变化情况。结果表明,50 mmol·L-1NaCl处理下,ZxNHX-RNAi株系叶下表皮气孔开度达到峰值的时间比WT延迟了4 h;渗透胁迫下,L7气孔开度的峰值比WT显著下降12%。对照条件下,L7气孔大小显著低于WT,达到峰值的时间比WT延迟6 h。无论是对照条件还是盐处理或渗透胁迫下,ZxNHX-RNAi株系叶组织含水量均显著低于WT,尤其是盐处理下,L7比WT低40%。可见,ZxNHX通过调控霸王叶的水分状况,进而影响气孔运动。
霸王;气孔;液泡膜Na+/H+逆向转运蛋白基因ZxNHX;基因沉默
气孔是由一对保卫细胞围成的孔状结构,是植物体与外界环境进行水分、气体交换的门户[1]。保卫细胞对环境条件非常敏感,在干旱、渗透胁迫等环境因素胁迫下能通过主动调节细胞渗透势,引起水势变化而发生膨压运动,进而调节气孔孔径大小[2],应答环境中水分的改变[3-5]。气孔的运动直接调控植物的蒸腾作用和光合作用,进而影响植物的生长和作物的产量[6-7]。
霸王(Zygophyllumxanthoxylum)是一种广泛分布在我国西北干旱荒漠区的蒺藜科多年生多浆旱生型灌木,具有超强的抗旱性和耐盐性[8-10]。干旱胁迫下,霸王能大量吸收Na+并有效转运至叶中,作为一种有益的渗透调节剂降低细胞的渗透势,提高细胞的吸水能力[11]。50 mmol·L-1NaCl能显著促进霸王生长,提高其抗旱能力[11-13]。
液泡膜Na+/H+逆向转运蛋白(NHXs)介导Na+、K+区域化至液泡,以进行渗透调节并维持促进细胞生长所必需的膨压[14]。干旱和盐处理下,霸王叶中Na+积累与ZxNHX基因转录丰度增加成正相关关系[15],表明在干旱和盐胁迫下ZxNHX基因在调控植物体内Na+平衡方面起重要作用。最近的研究表明,在中生植物拟南芥(Arabidopsisthaliana)中,AtNHX1和AtNHX2蛋白在保卫细胞中大量表达,AtNHX1和AtNHX2基因敲除导致atnhx1和atnhx2突变体液泡内K+的浓度仅为野生型植株的30%,表明AtNHX1和AtNHX2蛋白介导K+区域化至液泡[16]。同时,AtNHX1和AtNHX2基因敲除导致细胞膨压和细胞膨胀下降,气孔保卫细胞宽度减小,导致渗透胁迫下气孔关闭变慢等气孔的发育和功能缺陷[16-17]。但是,有关NHXs基因对多浆旱生植物气孔发育和功能的影响尚未见报道。
为此,本研究以霸王ZxNHX-RNAi株系为材料,比较了转基因株系与野生型材料在盐处理和渗透胁迫条件下气孔开度等的变化特征,以分析ZxNHX基因对多浆旱生植物气孔功能的影响。
1 材料与方法
1.1 材料培养
霸王野生型植株(WT)及ZxNHX-RNAi株系(L2和L7)均为兰州大学草类逆境生理与基因工程实验室培养。L2和L7分别为ZxNHX沉默程度不同的两个株系[18],与WT相比,在50 mmol·L-1NaCl处理下, L2和L7叶中ZxNHX的转录丰度分别下降8%和45%。
从WT、L2和L7母株剪取茎尖扦插至装有蛭石的穴盘中,浇灌1/2Hoagland营养液进行培养得到T0代幼苗。1/2Hoagland营养液包括2 mmol·L-1KNO3,0.5 mmol·L-1NH4H2PO4,0.25 mmol·L-1MgSO4·7H2O,0.1 mmol·L-1Ca(NO3)2·4H2O,0.5 mmol·L-1Fe-citrate,92 mmol·L-1H3BO3,18 μmol·L-1MnCl2·4H2O,1.6 μmol·L-1ZnSO4·7H2O,0.6 μmol·L-1CuSO4·5H2O,0.7 μmol·L-1(NH4)6Mo7O24·4H2O。每4天换一次营养液,温室的昼夜温度为(24±2)℃/(18±2)℃,光照时间16 h·d-1,光照强度约600 μmol·m-2·s-1,相对湿度约为65%。4周后,挑选健壮整齐的WT、L2和L7幼苗移栽至装有蛭石的花盆中。6个月后分别进行盐处理和渗透胁迫处理,并测定各株系气孔大小。
1.2 材料处理方法
处理如下,(1)WT、L2和L7用正常的1/2 Hoagland营养液浇灌7 d后,测定叶组织含水量及气孔大小,并观察叶下表皮保卫细胞壁结构;(2)WT、L2和L7分别用正常的1/2 Hoagland营养液(对照,Control)和含有50 mmol·L-1NaCl的1/2 Hoagland营养液浇灌7 d(盐处理组,50 mmol·L-1NaCl),测定气孔开度的日变化;(3)WT、L2和L7分别用正常的1/2Hoagland营养液(对照组,Control)和用山梨醇(D-sorbitol)配成的总渗透势为-0.5 MPa的1/2 Hoagland溶液(渗透胁迫组,-0.5 MPa)浇灌72 h,测定气孔开度的日变化。每2 d更换一次处理液,以保持处理液浓度的相对恒定。每个处理取4个重复,并测定各株系气孔大小。
1.3 各种指标的测量方法
气孔开度和气孔大小的测定方法为:分别在9:00、11:00、15:00、17:00取下待测叶片后,立即撕取叶下表皮,制成临时装片,在光学显微镜下用测微尺测定气孔的内横径、内纵径、外横径、外纵径,然后计算出气孔开度、气孔大小。气孔开度和气孔大小的计算参考文献所用的方法[19]:气孔开度=内横径×内纵径;气孔大小=外横径×外纵径。
取各处理中从茎尖起第3茎节叶片,用蒸馏水迅速将其表面冲洗干净,吸水纸吸干后,称鲜重(Fresh weight,FW);鲜材料放入105 ℃的烘箱中杀青10 min后,80 ℃烘干至恒重,称干重(Dry weight,DW),组织含水量的计算参考Wang等[20]报道的公式(FW-DW)/DW,式中,FW为鲜重,DW为干重。
1.4 数据计算和统计分析
用Excel制图,SPSS 13.0软件(SPSS Inc., Chicago, IL, USA)进行统计分析,采用单因素方差分析比较不同处理间各项指标的差异。
2 结果与分析
2.1 盐处理下ZxNHX沉默对霸王叶气孔开度的影响
对照条件下,WT和L2叶下表皮气孔开度均在11:00达到峰值,随后减小,L7的气孔开度在15:00才达到峰值,随后减小;L2气孔开度的峰值与WT无显著差异(P<0.05),但L7比WT减小30%(图1)。50 mmol·L-1NaCl处理下,WT叶下表皮气孔开度仍在11:00达到峰值,随后减小,而L2和L7的气孔开度均在15:00才达到峰值,随后减小,WT、L2和L7气孔开度的峰值之间差异不显著(图1)。
2.2 渗透胁迫下ZxNHX沉默对霸王叶气孔开度的影响
无论是对照还是-0.5 MPa渗透胁迫下,WT和L2叶下表皮气孔开度均在11:00达到峰值,随后减小,L7的气孔开度在15:00才达到峰值,随后减小(图2)。对照条件下,WT、L2和L7气孔开度的峰值之间差异不显著(P<0.05);-0.5 MPa渗透胁迫下,L2与WT气孔开度的峰值之间差异不显著,但L7比WT减小12%(图2)。
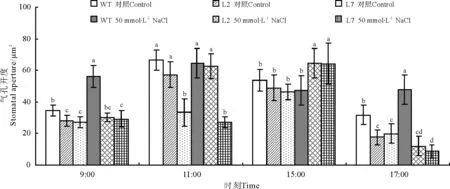
图1 盐处理下ZxNHX沉默对霸王叶气孔开度的影响Fig.1 Stomatal aperture variation in abaxial leaves of 6-month-old wild-type(WT)and ZxNHX-silenced lines(L2,L7)ofZ. xanthoxylum under control conditions and 50 mmol·L-1 NaCl for 7 d
注:不同小写字母表示同一时间不同株系的处理间差异显著(P<0.05)。下图同.
Note: Different lower case letters for the same time indicate significant difference among 6-month-old wild-type(WT) andZxNHX-silenced lines(L2, L7) ofZ.xanthoxylumat 0.05 level. The same below.
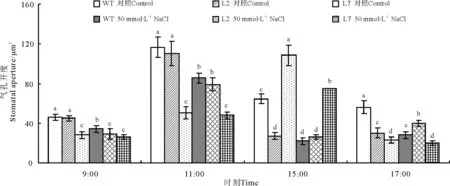
图2 渗透胁迫下ZxNHX基因沉默对霸王叶气孔开度的影响Fig.2 Stomatal aperture variation in abaxial leaves of 6-month-old WT and ZxNHX-silenced lines(L2, L7)ofZ. xanthoxylum under control conditions and -0.5 MPa osmotic stress treatment for 3 d
2.3ZxNHX沉默对霸王叶气孔大小的影响
对照条件下,WT处理叶下表皮气孔开度在上午9:00达到峰值,而L2和L7处理分别在11:00和15:00才达到峰值。L7处理在9:00、11:00、15:00时的气孔开度分别比WT处理减小32%、27%、18%(图3)。
2.4ZxNHX沉默对霸王叶组织含水量的影响
在对照和盐处理下,L2和L7叶组织含水量均低于WT。与WT相比,L2和L7叶组织含水量在对照条件下分别降低21%和27%;50 mmol·L-1NaCl处理下分别降低30%和40%。渗透胁迫下,WT、L2和L7之间叶组织含水量差异不显著(图4)。
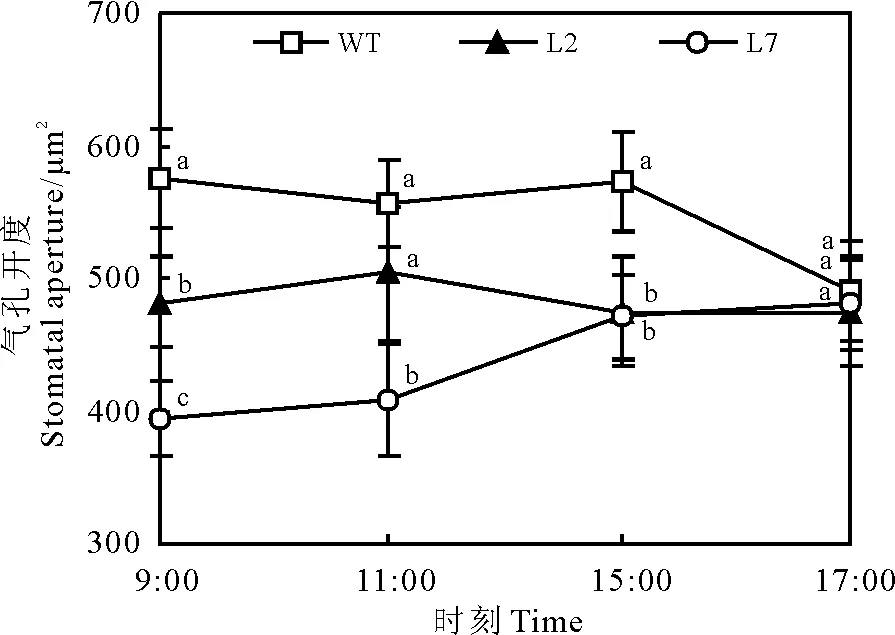
图3 对照条件下ZxNHX基因沉默对 霸王叶气孔大小的影响Fig.3 Stomatal size variation in abaxial leaves of 6-month-old WT and ZxNHX-silenced lines(L2,L7)ofZ. xanthoxylum under control conditions
注:不同小写字母表示同一时间不同处理间差异显著(P<0.05)。
Note: Different lowercase letters for the same time indicate significant difference among 6-month-old wild-type(WT) andZxNHX-silenced lines(L2, L7) ofZ.xanthoxylumat 0.05 level.
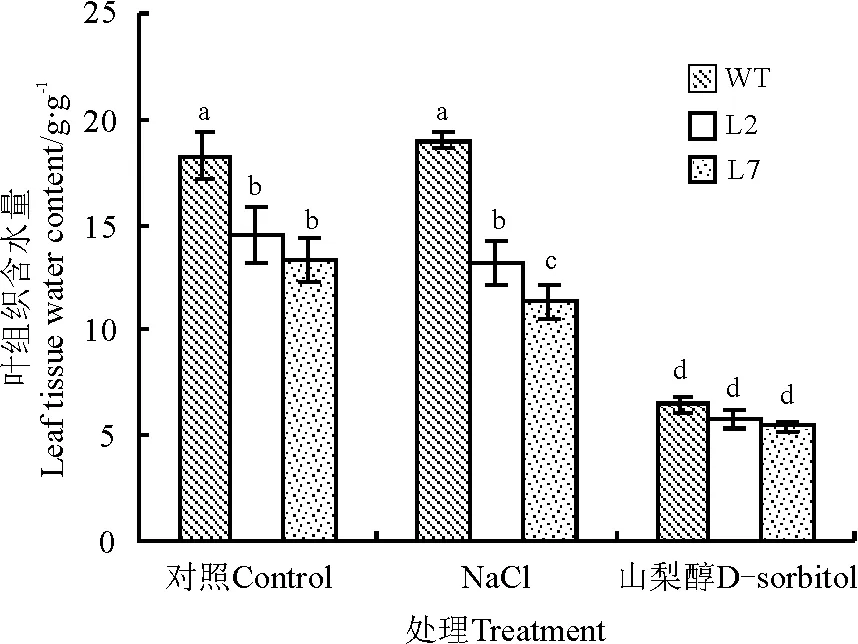
图4 ZxNHX沉默对霸王叶组织含水量的影响Fig.4 Tissue water content of leaves in WT andZxNHX-silenced lines(L2,L7)of Z. xanthoxylumunder control,50 mmol·L-1 NaCl for 7 d and -0.5 MPa osmotic stress treatment for 72 h
注:不同小写字母表示不同处理间差异显著(P<0.05)。
Note: Different lowercase letter indicate significant difference among 6-month-old wild-type(WT) andZxNHX-silenced lines(L2, L7) ofZ.xanthoxylumat 0.05 level.
3 讨论与结论
植物NHX属于一价阳离子/质子反向转运蛋白超家族(Cation/proton antiporter,CPA)中的一类蛋白,这个超家族包括两支CPA1和CPA2[21-22]。在拟南芥中,CPA2家族含有8个分支共28个基因,其中大部分基因为人们所不熟悉的阳离子/ H+反向转运蛋白(CHXs)[23]。一些定位在内膜系统膜泡上的CHXs可能在维持细胞pH稳定,离子平衡和膜泡运输中起重要作用[23],定位在保卫细胞上的CHXs则与气孔渗透调节有关[24]。拟南芥中NHX类蛋白包括8个成员,根据序列相似性和亚细胞定位分为两组:一组为细胞内膜系统组,定位在液泡膜和内体膜上共6个成员(AtNHX1-AtNHX6),又分为液泡组(AtNHX1-AtNHX4)和内体组(AtNHX5和AtNHX6)[16]。另一组为质膜组,定位在质膜上,包括AtNHX7/SOS1和AtNHX8两个成员,其序列、功能与内膜系统组差异极大[16]。
与野生型相比,拟南芥nhx1/nhx2双敲除突变体中气孔保卫细胞宽度减小,正常条件下nhx1/nhx2双敲除突变体气孔导度增加,易失水萎蔫,而渗透胁迫下气孔关闭变慢[16-17]。本研究中,ZxNHX沉默导致正常条件下,气孔开度达到峰值的时间推迟;50 mmol·L-1NaCl处理下气孔开度达到峰值的时间从11:00推迟至15:00;而在渗透胁迫下气孔开度显著下降,表明ZxNHXs沉默影响气孔的开闭运动的灵活性,使其对环境的适应性减弱。
影响气孔开闭运动的一个重要因素是叶的水分状况[25-26]。大量研究表明,干旱条件下,植物的水分供应减少,叶水势下降,膨压随之降低而引起气孔关闭[5,27]。Franks[7]的研究表明,气孔的开放和叶面积的增加依赖于细胞的膨胀,而细胞的膨胀取决于其渗透调节能力。实际上,对霸王而言,Na+作为一种有益的渗透调节物质积累在叶中用于渗透调节。干旱胁迫下,多浆旱生植物霸王能大量吸收Na+并有效转运至叶中,通过ZxNHX将细胞胞质中过多的Na+区域化至液泡中,降低细胞的渗透势,提高细胞的吸水能力[11,13,15]。本研究中,ZxNHX沉默引发霸王叶组织含水量和气孔开度显著下降。在正常的生长条件下,拟南芥中的AtNHX1和AtNHX2介导K+区域化至液泡,影响细胞的渗透调节和细胞膨胀[16-17],并能通过介导K+在保卫细胞液泡中的积累调控气孔的开闭运动[28]。可见,ZxNHX通过调控霸王叶的水分状况,进而影响气孔大小和气孔开闭运动。
致谢:该论文是第二届全国草业生物技术大会评选出的优秀论文,并得到中国草业生物技术专业委员会提供的版面费支持。
[1] Buckley T N.The control of stomata by water balance[J].New Phytologist,2005,168:275-292.
[2] 孟繁霞,张蜀秋,娄成后.气孔功能的结构基础[J].植物学通报,2000,17(1):27-33.
[3] 袁惠君,宋占午,丁兰,杨红,梁桂霞,王莱.人参果试管苗与移栽成活苗气孔行为比较[J].西北师范大学学报(自然科学版),2001,37(4):89-92.
[4] 袁惠君,宋占午,杨红,丁兰,王莱.草莓试管苗与土培苗气孔形态和气孔密度的比较[J].兰州理工大学学报,2004,30(5):79-80.
[5] 郭瑶琳,王俊斌,丁博,李明,陈帅君,张卫国,黄国中,谢晓东.低空气湿度下气孔运动的调控[J].植物生理学报,2014,50(8):1144-1150.
[6] 许大全.气孔运动与光合作用[J].植物生理学通讯,1984(6):6-12.
[7] Franks P J.Higher rates of leaf gas exchange are associated with higher leaf hydrodynamic pressure gradients[J].Plant,Cell and Environment,2006,29:584-592.
[8] Liu J Q,Pu J C,Liu X M.Comparative studies on water relations and xeromorphic structures of some plant species in the middle part of the desert zone in China[J].Acta Botanica Sinica,1987,29:662-673.
[9] Liu J Q,Li Z J,Pu J C,Zheng S D.Comparative studies on relationships between proline accumulation and photosynthesis, respiration and chlorophyll content of some plant species in the middle part of the desert zone in China[J].Acta Botanica Sinica,1988,30:85-95.
[10] 裴世芳,傅华,陈亚明,李景斌.放牧和围封下霸王灌丛对土壤肥力的影响[J].中国沙漠,2004,24(6):763-767.
[11] Ma Q,Yue L J,Zhang J L,Wu G Q,Bao A K,Wang S M.Sodium chloride improves photosynthesis and water status in the succulent xerophyteZygophyllumxanthoxylum[J].Tree Physiology,2012,32:4-13.
[12] Ma Q,Lou J Q,Wang S M.Effects of Na+on photosynthetic characteristics ofZygophyllumxanthonylonseedlings under osmotic stress[J].Acta Prataculturae Sinica,2010,19:198-203.
[13] Yue L J,Li S X,Ma Q,Li S X,Ma Q,Zhou X R,Wu G Q,Bao A K,Zhang J L,Wang S M.NaCl stimulates growth and alleviates water stress in the xerophyteZygophyllumxanthoxylum[J].Journal of Arid Environments,2012,87:153-160.
[14] 刘佳,崔继哲,付畅.植物Na+/H+逆向转运蛋白NHX及其生物学功能[J].科技通报,2008,24(6):785-791.
[15] Wu G Q,Xi J J,Wang Q,Bao A K,Ma Q,Zhang J L,Wang S M.TheZxNHXgene encoding tonoplast Na+/H+antiporter from the xerophyteZygophyllumxanthoxylumplays important roles in response to salt and drought[J].Journal of Plant Physiology,2011,168:758-767.
[16] Bassil E,Coku A,Blumwald E.Cellular ion homeostasis:Emerging roles of intracellular NHX Na+/H+antiporters in plant growth and development[J].Journal of Experimental Botany,2012,63:5727-5740.
[17] Barragán V,Leidi E O,Andrés Z,Rubio L,De Luca A,Fernández J A,Cubero B,Pardo J M.Ion exchangers NHX1 and NHX2 mediate active potassium uptake into vacuoles to regulate cell turgor and stomatal function inArabidopsis[J].The Plant Cell,2012,24:1127-1142.
[18] Yuan H J,Ma Q,Wu G Q,Wang P,Hu J,Wang S M.ZxNHX controls Na+and K+homeostasis at the whole-plant level inZygophyllumxanthoxylumthrough feedback regulation of the expression of genes involved in their transport[J].Annals of Botany,2015,115(3):495-507.
[19] Franks P J,Beerling D J.Maximum leaf conductance driven by CO2effects on stomatal size and density over geologic time[J].PNAS,2009,106(25):10343-10347.
[20] Wang S M,Zhang J L,Flowers T J.Low-affinity Na+uptake in the halophyteSuaedamaritima[J].Plant Physiology,2007,145:559-571.
[21] Saier J M H.A functional-phylogenetic classification system for transmembrane solute transporters[J]. Microbiology and Molecular Biology Reviews,2000,64:354-411.
[22] Brett C L,Tukaye D N,Mukherjee S,Rao R.The yeast endosomal Na+(K+)/H+exchanger Nhx1 regulates cellular pH to control vesicle trafficking[J].Molecular Biology of the Cell,2005,16:1396-1405.
[23] Chanroj S,Wang G,Venema K,Zhang M W,Delwiche C F,Sze H.Conserved and diversified gene families of monovalent cation/H+antiporters from algae to flowering plants[J].Frontiers in Plant Science,2012,3:25.
[24] Padmanaban S,Chanroj S,Kwak J M,Li X,Ward J M,Sze H.Participation of endomembrane cation/H+exchanger AtCHX20 in osmoregulation of guard cells[J].Plant Physiology,2007,144:82-93.
[25] 钱宝云,李霞.植物气孔运动调节的新进展[J].植物研究,2013,33(1):120-128.
[26] 杨金华,杜克久.植物叶片气孔运动机制研究进展[J].河北林果研究,2011,26(1):47-53.
[27] 张岁岐,李金虎,山仑.干旱下植物气孔运动的调控[J].西北植物学报,2001,21(6):1263-1270.
[28] Andrés Z,Pérez-Hormaeche J,Leidi E O,Schlücking K,Steinhorst L,McLachlan D H,Schumacher K,Hetherington A M,Kudla J,Cubero B,Pardo J M.Control of vacuolar dynamics and regulation of stomatal aperture by tonoplast potassium uptake[J].PNAS,2014,111(17):1806-1814.
(责任编辑 王芳)
Effects of tonoplast Na+/H+antiporters gene silence on leaf stomata characteristics ofZygophyllumxanthoxylum
YUAN Hui-jun1,2, MA Qing1, WEI Li1, HU Jing1, WANG Pei1, WANG Suo-min1
(1.State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China; 2.College of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China)
The stomata characteristics of differentZygophyllumxanthoxylumlines including wild type(WT)andZxNHX-silenced lines(L2 and L7)using post-transcriptional gene silencing were analyzed. Under 50 mmol·L-1NaCl treatment, 4 more hours was required for stomatal aperture ofZxNHX-silenced lines reached to peak value compared with WT. Under -0.5 MPa osmotic stress treatment, the peak value of stomatal aperture in L7 lines significantly decreased by 12% compared with that of WT. Under control conditions, the stomatal size of L7 lines significantly reduced and 6 more hours was required for stomatal aperture reached to peak value compared with WT. Leaf tissue water contents inZxNHX-silenced lines were always significantly lower than that in WT under all the treatments, especially under 50 mmol·L-1NaCl treatment, leaf tissue water content of L7 lines was 40% less than that of WT. These results suggestedZxNHXregulated stomatal activities by controlling leaf water status ofZ.xanthoxylum.
Zygophyllumxanthoxylum; stomata; the tonoplast Na+/H+antiportersZxNHX; gene silencing
WANG Suo-min E-mail:smwang@lzu.edu.cn
10.11829j.issn.1001-0629.2014-0555
2014-12-08 接受日期:2015-03-25
973项目(2014CB138701);国家自然科学基金(31170431、31460629)
袁惠君(1974-),女,甘肃天水人,在读博士生,研究方向为植物逆境生理与分子生物学。E-mail:gsyhj@163.com
王锁民(1965-),男,甘肃宁县人,教授,博导,博士,研究方向为植物逆境生理与分子生物学。E-mail:smwang@lzu.edu.cn
Q943.2
A
1001-0629(2015)06-0902-06
袁惠君,马清,未丽,胡静,王沛,王锁民.液泡膜Na+/H+逆向转运蛋白基因沉默对霸王叶气孔特征的影响[J].草业科学,2015,32(6):902-907.
YUAN Hui-jun,MA Qing,WEI Li,HU Jing,WANG Pei,WANG Suo-min.Effects of tonoplast Na+/H+antiporters gene silence on leaf stomata characteristics ofZygophyllumxanthoxylum[J].Pratacultural Science,2015,32(6):902-907.

