Th17/Treg细胞在复发缓解型多发性硬化中的表达
李晓玲 张博 于春梅 阎湘 王满侠
Th17/Treg细胞在复发缓解型多发性硬化中的表达
李晓玲 张博 于春梅 阎湘 王满侠
目的 探讨辅助T细胞17(Th17)和调节性T细胞(Treg)相关细胞因子白细胞介素17(IL-17)和白细胞介素35(IL-35)在复发缓解型多发性硬化(RRMS)发病机制中的作用及甲泼尼龙对其表达的影响。方法 收集急性期RRMS患者36例,神经系统非炎性疾病患者32例作为对照组,采用酶联免疫法(ELISA)检测两组患者治疗前及治疗后2周时血清和脑脊液中IL-17、IL-35的水平。结果 RRMS组治疗前血清和脑脊液IL-17水平显著高于对照组(P<0.01),而其IL-35水平均低于对照组(P<0.05)。与治疗前相比,RRMS组治疗后血清和脑脊液IL-17下降(P<0.01),而IL-35升高(P<0.05)。RRMS组治疗前血清中IL-17水平与IL-35水平呈负相关(r=-0.551,P=0.041)。结论 Th17/Treg表达的失衡与RRMS的发病有关,甲泼尼龙治疗可使血清、脑脊液IL-17水平下降,IL-35水平升高,进而抑制炎性反应。
多发性硬化;Th17细胞;Treg细胞;白细胞介素-17;白细胞介素-35
多发性硬化(multiple sclerosis,MS)是以中枢神经系统白质炎性脱髓鞘病变为主要病理特点的自身免疫性疾病,其确切的病因及发病机制迄今尚不清楚。复发缓解型MS(relapsing remitting multiple sclerosis,RRMS)是MS最常见的类型,其发病与自身免疫有关。最近研究结果显示,Th17/Treg细胞亚群比例和功能失衡对MS的发生、发展有重要意义[1]。白细胞介素-17(IL-17)由辅助T细胞17(helper-T cell type 17,Th17)分泌,与RRMS的自身免疫反应有关[2]。调节性T细胞(regulatory T lymphocyte,Treg)功能失活是RRMS发病的主要原因之一[3]。IL-35是至今发现的由Treg释放的能阻止免疫应答过度反应的新型信号分子[4]。目前,Th17/Treg细胞相关炎性反应因子在RRMS发病机制中的作用及甲泼尼龙对其影响的研究尚未见相关报道。本研究通过检测RRMS患者血清、脑脊液中IL-17和IL-35的水平,并观察甲泼尼龙治疗对其表达的影响,旨在深入研究Th17/Treg细胞失衡在RRMS发病中的作用。
1 对象和方法
1.1 临床资料 收集2009-03-2013-06在兰州大学第二医院神经内科住院部、急门诊就诊的RRMS患者36例,符合McDonald诊断标准[5],均为急性发作期,入院前3个月未使用糖皮质激素及免疫抑制剂。其中男性16例,女性20例,平均年龄(29.25±7.38)岁,入院时EDSS评分2.5~8.0分,平均(6.42±1.61)分,病程3个月到4年,平均(27.21±5.3)年。均有新发阳性体征和(或)症状,其中肢体无力15例,感觉异常10例,视力减退4例,共济失调3例,两种或两种以上症状20例。头颅MRI检查均有新的增强病灶,剔除合并自身免疫性相关疾病、严重感染、高血压、糖尿病、消化道溃疡及慢性肝病或肝功能异常患者。
另选神经系统非炎性疾病患者32例为对照组,包括偏头痛患者23例,紧张性头痛患者9例,其中男性 11例,女性12例,平均年龄(31.09±8.68)岁。本组患者头颅CT或MRI正常;脑脊液常规、生化、细胞学正常,寡克隆区带阴性。排除标准:(1)急、慢性感染;(2)合并其他自身免疫性疾病;(3)应用非甾体类抗炎药物者,或6个月内接受免疫抑制剂或糖皮质激素或其他免疫治疗;(4)并发严重心、肝、肾功能不全。RRMS组和对照组在性别构成和年龄比较差异无统计学意义。本研究纳入患者均签署知情同意书,经兰州大学第二医院伦理委员会批准通过。
1.2 方法
1.2.1 治疗方法:RRMS组患者入院后予以甲基泼尼松龙1000 mg/d,3 d后减至500 mg,每3 d减一半减至30 mg时改为泼尼松35 mg口服,每周减5 mg至停药。
1.2.2 标本采集和IL-13、IL-35测定:两组患者分别于治疗前(RRMS组本次复发后1周之内)、治疗后2周时采静脉血5 mL并留取脑脊液标本,直接分装至0.5 mL EP管内,-80℃冰箱冻存,采用ELISA法分别检测血清、脑脊液中IL-17、IL-35水平,试验步骤按照ELISA法试剂盒(武汉博士德试剂公司)进行操作。
1.3 统计学处理 采用SPSS13.0软件对数据进行统计分析。计量资料采用均数±标准差表示,组内治疗前后比较采用配对t检验;两组间比较采用两个独立样t检验;IL-17与IL-35的相关性分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 RRMS组治疗前后IL-17、IL-35水平比较 RRMS组治疗后血清和脑脊液IL-17水平较治疗前下降(P<0.01);而IL-35水平较治疗前均升高(均P<0.05)。结果见表1。
2.2 两组患者治疗前IL-17、IL-35比较 RRMS组治疗前血清、脑脊液IL-17水平均高于对照组(均P<0.01),而IL-35水平均低于对照组(均P<0.05)。结果见表2。
2.3 RRMS组血清IL-17与IL-35的相关性分析 MS组治疗前血清IL-17水平与IL-35水平呈负相关(r=-0.551,P=0.041)。
2.4 RRMS组治疗前后EDSS评分比较 RRMS组治疗后2周EDSS评分较治疗前降低(4.15±0.76比6.42±1.6;t=2.31,P=0.041)。
3 讨论
MS发病与自身免疫相关,Th17/Treg平衡对维持正常免疫应答,防止自身免疫具有重要的意义。IL-17、IL-23、IL-21等是Th17细胞分泌的重要相关细胞因子[6]。Th17细胞功能亢进,Treg细胞功能低下,在MS发病中发挥重要作用,深入研究二者的平衡、失衡机制,对MS病理机制研究及诊治具有重要价值。
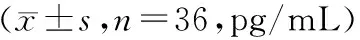
表 1 RRMS组治疗前后血清和脑脊液IL-17、IL-35水平比较

表 2 RRMS组治疗前和对照组血清及脑脊液IL-17、IL-35水平比较
Th17主要是CD4+效应性记忆性T细胞,活化后可以产生IL-17,是早期产生的具有广泛生物学活性的炎性细胞因子[7]。本研究发现,急性期RRMS患者与对照组相比血清和脑脊液中的IL-17水平明显升高。IL-17可刺激成纤维细胞、内皮细胞分泌各种细胞因子,如IL-6、IL-8、前列腺素E2、单核细胞化学趋化性蛋白-1和粒细胞集落刺激因子,还可促进补体C3等急性期反应蛋白的产生,诱导炎性反应[8-9]。IL-17、IL-23、IL-21、IL-6等细胞因子之间存在复杂的细胞因子网络,它们相互作用、诱导炎性反应。本研究发现RRMS患者经激素治疗后IL-17在血清和脑脊液中水平下降,表明甲泼尼龙可通过抑制Th17的分化,减少IL-17的产生以减轻炎性反应,抑制神经系统的损害,通过治疗2周时其EDSS评分与治疗前相比下降。
Treg在体内执行免疫抑制功能,限制过度及错误的免疫应答,其功能低下,失去了对免疫炎性反应的抑制作用是MS发病的主要原因,RRMS患者的Treg数量与功能较健康人均明显下降。IL-35可显著抑制Th17细胞的分化[10],转化生长因子(TGF-β)通过加速Th17细胞的分化促进前炎性反应[11]。干扰素-γ(IFN-γ)阻止TGF-β诱导的Th17分化[12-13]。然而,IFN-γ可以被IL-35上调,因此IL-35在Th17的分化过程中有免疫抑制作用。本研究发现急性期RRMS患者血清和脑脊液中IL-35水平明显低于对照组。FOXP3是Treg细胞的表面标志物[14],可能IL-35参与抑制FOXP3的表达使Treg细胞的免疫抑制功能下降,也可能与其下调INF-γ有关,这有待于进一步的研究。同时,本研究发现,甲泼尼龙治疗后RRMS患者血清和脑脊液中IL-35水平明显升高,表明激素可以促进IL-35的表达,进而恢复Treg的功能达到抑制炎症反应的结果。
综上所述,本研究结果显示RRMS患者血清和脑脊液IL17及IL-35水平在治疗前后以及与神经系统非炎性疾病患者比较发生了显著变化。因此,炎性反应可能是打破Th17/Treg平衡,Th17功能亢进、Treg功能低下的关键,提示Th17/Treg失衡与RRMS的发病密切相关。通过治疗前与治疗后2周的EDSS评分的比较,可见糖皮质激素对RRMS急性期的治疗有效。关于糖皮质激素究竟是通过改善炎性环境促进Treg功能恢复,还是通过恢复Treg、抑制Th17的功能达到抑制炎性反应,从而改善病情,或是两者都有需要进一步研究。
[1]Azam J,Vahid S, Abbasali P, et al. Biased Treg/Th17 balance away from regulatory toward inflammatory phenotype in relapsed multiple sclerosis and its correlation with severity of symptoms[J].J Neuroimmunol,2013,262(1-2):106-112.
[2]Gold R, Luhder F. Interleukin-17 extended features of a key player in multiple sclerosis[J].Am J Pathol,2008,172(1):8-10.
[3]中华医学会神经病学分会神经免疫学组.中国免疫学会神经免疫分会多发性硬化诊断和治疗中国专家共识(2011版)[J].中华神经科杂志,2012,45:274-280.
[4]Collision LW, Workman CJ, Kuo TT, et al. The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J].Nature,2007,450(7169):566-569.
[5]Mcdonald WI, Compston A, Edan G, et al.Recommended diagnostic criteria for multiple sclerosis:guidelines from Inernational panel on the diagnosis of multiple sclerosis[J].Ann Neurol,2001,50(1):121-127.
[6]Chen YC, Chen SD, Miao L, et al. Serum levels of interleukin(IL)-18,IL-23 and IL-17 in Chinese patients with multiple sclerosis[J].J Neuroimmunol,2012,243(1-2):56-60.
[7]Reynolds JM, Angkasekwinai P, Dong C. IL-17 family member cytokines: regulation and function in innate immunity[J].Cytokine Growth Factor Rev,2010, 21(6):413-423.
[8]Muls N, Jnaoui K, Dang HA, et al. Upregulation of IL-17, but not of IL-9, in circulating cells of CIS and relapsing MS patients. Impact of corticosteroid therapy on the cytokine network[J].J Neuroimmunol,2012,243(1-2):73-80.
[9]Gu Y, Hu X, Liu C, et al. Interleukin (IL)-17 promotes macrophages to produce IL-8, IL-6 and tumour necrosis factor alpha in aplastic anaemia[J].Br J Haematol, 2008,142(1):109-114.
[10]Niedbala W, Wei XQ, Cai B, et al. IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells[J]. Eur J Immunol, 2007,37(11):3021-3029.
[11]Harrington LE, Hatton RD, Mangan PR, et al. Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nature Immunol,2005,6(11):1123-1132.
[12]Wahl SM, Wen J, Moutsopoulos N.TGF-beta :a mobile purveyor of immune privilege[J].Immunol Rev,2006,213(1):213-237.
[13]Park H, Li Z, Yang XO, et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nature Immunol,2005,6(11):1133-1141.
[14]Park JH, Ko JS, Shin Y, et al.Intranuclear interatomic inhibition of FOXP3 suppresses functions of Treg cells[J].Biochem Biophys Res Commun,2014,451(1):1-7.
(本文编辑:时秋宽)
Expression of Th17/Treg cytokines in patients with relapsing remitting multiple sclerosis
LIXiaoling,ZHANGBo,YUChunmei,YANXiang,WANGManxia*.
*DepartmentofNeurology,theSecondHospitalofLanzhouUniversity,LanzhouGansu730030,China
WANG Manxia,Email:wmx322@aliyun.com
Objective To investigate the role of T helper type 17 (Th17)and Treg-related cytokines interleukin-17(IL-17) and interleukin-35(IL-35) in relapsing remitting multiple sclerosis(RRMS) in the pathogenesis, and the affect of methylprednisolone to their expression.Methods We recruited RRMS patients and noninflammatory neurological controls, and detected the levels of IL-17 and IL-35 in serum and cerebrospinal fluid(CSF) with ELISA kit in both controls and RRMS patients before and after methylprednisolone treatment. Results Compared with the control group, the levels of IL-17 in serum and CSF in patients with RRMS were higher before treatment (P<0.01), and the levels of IL-35 in serum and CSF in patients with RRMS were lower before treatment (P<0.05). The levels of IL-17 in serum and CSF in patients of RRMS were lower after treatment than those before treatment (P<0.01), while the levels of IL-35 in serum and CSF were higher after treatment (P<0.05). Correlation analysis showed that IL-17 and IL-35 were negative correlated in the serum of RRMS before treatment(r=-0.551,P=0.041). Conclusions Th17/Treg expression imbalance is related to the pathogenesis of RRMS. Methylprednisolone treatment can decrease the levels of IL-17 in the serum and CSF, and elevate levels of IL-35 in the serum and CSF, thus methylprednisolone can inhibit the inflammatory response.
multiple sclerosis; T helper type 17; Treg-related; interleukin 17; interleukin 35
10.3969/j.issn.1006-2963.2015.03.001
甘肃省科技支撑计划项目(项目编号:1304FKCA086)
730030 兰州大学第二医院神经内科(李晓玲、阎湘、王满侠);兰州大学第一医院(张博);甘肃省中医院(于春梅)
王满侠,Email:wmx322@aliyun.com
R744.5+1
A
1006-2963 (2015)03-0153-04
2014-10-13)

