3D-ASL与DSC对星形细胞瘤血流灌注评估的相关性研究
袁涛, 丁芳芳, 全冠民, 杨素君
·中枢神经影像学·
3D-ASL与DSC对星形细胞瘤血流灌注评估的相关性研究
袁涛, 丁芳芳, 全冠民, 杨素君
目的:探讨星形细胞瘤动脉自旋标记(3D-ASL)与动态磁敏感对比增强(DSC)对脑血流量(CBF)评估的相关性。方法:70例经病理证实的星形细胞瘤患者[毛细胞型星形细胞瘤(Ⅰ级)4例,弥漫性星形细胞瘤(Ⅱ级)28例,间变性星形细胞瘤(Ⅲ级)22例,胶质母细胞瘤(Ⅳ级)16例]行常规MR平扫、3D-ASL、DSC及增强T1WI检查,分别测量肿瘤实性区最大CBF、近瘤周区及镜像区CBF,计算肿瘤实性区及近瘤周区rCBF;评估两种灌注方法rCBF的相关性。结果:70例星形细胞瘤3D-ASL和DSC法实性区rCBF(采用中位数与四分位数间距表示,下同)分别为3.069、2.151和3.7943、3.825,相关系数r=0.944;两者近瘤周区rCBF分别为0.913、0.576和1.095、0.783,r=0.732。高级别胶质瘤(HGG)组(38例)3D-ASL和DSC法实性区rCBF分别为3.662、2.054和4.179、3.468,r=0.918;两者近瘤周区rCBF分别为1.171、0.760和0.974、0.703,r=0.757。低级别胶质瘤(LGG)组(32例)3D-ASL和DSC实性区rCBF分别为2.109、2.205和2.591、3.988,r=0.931;两者近瘤周区rCBF分别为0.781、0.438和0.965、0.944,r=0.840。结论:3D-ASL与DSC法测量星形细胞瘤实性及近瘤周区rCBF值均有较好的相关性,且LGG组相关性更好,提示3D-ASL对星形细胞瘤CBF的评估具有可行性。
星形细胞瘤; 磁共振成像; 动脉自旋标记; 动态磁敏感对比增强; 脑血流量
星形细胞瘤是脑内最常见的神经胶质瘤,其治疗方案和预后在一定程度上取决于可靠的术前评估,其中包括对肿瘤微血管生成这一重要指标的评估。近年来,MR灌注成像为星形细胞瘤的评估开拓了新视角,其方法包括动态磁敏感对比增强(dynamic susceptibility contrast,DSC)和动脉自旋标记(arterial spin labeling,3D-ASL),两者均可通过评估微血管灌注为星形细胞瘤的诊断、鉴别及术后评估提供更多信息,其中DSC较为成熟,研究证实DSC灌注成像参数脑血流量(cerebral blood flow,CBF)与星形细胞瘤微血管密度(microvessel density,MVD)及血管内皮生长因子(vascular endothelial growth factor,VEGF)表达具有较好的相关性,为活体动态评估MVD及VEGF表达提供了可能性[1]。
DSC灌注成像在星形细胞瘤诊断、分级及术前评估方面的价值已得到公认,但这种灌注成像需要注射外源性对比剂,且必须在对比剂首过时采集数据,不能在短时间内重复检查。3D-ASL较DSC具有无创性及可重复性强等优势,目前已有研究证实健康成人在两台同一机型MR扫描仪分别进行一次3D-ASL检查,扫描间隔时间为10~15 d,所得结果一致性较好,说明3D-ASL可用于随访及多中心研究[2]。但是目前关于3D-ASL评估脑血流准确度的研究较少,尤其缺乏3D-ASL灌注成像对星形细胞瘤的探讨[3]。本研究以DSC为对照,通过对星形细胞瘤3D-ASL与DSC检查rCBF的相关性进行评价,旨在探讨3D-ASL在星形细胞瘤灌注评估的可靠性。
材料与方法
1.病例资料
搜集2012年10月-2013年12月病理证实为星形细胞瘤的患者70例,其中男41例,女29例,年龄9~75岁,平均(40.67±13.25)岁,包括高级别胶质瘤(high grade glioma,HGG)38例,低级别胶质瘤(low-grade glioma,LGG)32例。病理检查由2位高年资神经病理医师(主任医师)按2007年WHO神经系统肿瘤组织学分类标准[4]进行独立评价,若2位医师诊断意见不同,协商后统一诊断意见。70例星形细胞瘤中毛细胞型星形细胞瘤(Ⅰ级)4例、弥漫性星形细胞瘤(Ⅱ级)28例、间变性星形细胞瘤(Ⅲ级)22例、胶质母细胞瘤(Ⅳ级)16例。主要临床症状包括头晕、呕吐、癫痫发作及偏身感觉障碍等。本研究获得医院伦理委员会批准,检查前所有患者均告知检查详情并签署知情同意书。
2.检查方法
所有患者均行常规MRI平扫、3D-ASL灌注、DSC灌注及MRI增强检查。采用GE Discovery MR 750 3.0T磁共振扫描仪,标准8通道头颅相控阵线圈,行常规MR平扫及3D-ASL扫描后,肘静脉团注对比剂钆喷酸葡胺后行DSC检查,随即行T1WI增强扫描。
常规MRI扫描参数:轴面T1WI(T1-FLAIR序列) TR 1750 ms,TE 25.0 ms,T1 780 ms;轴面T2WI(FSE序列) TR 4257 ms,TE 103.8 ms;轴面T2-FLAIR TR 8400 ms,TE 148.5 ms,TI 2100 ms,层厚5.0 mm,层间隔1.0 mm,矩阵512×256,视野24 cm×24 cm,激励次数1;矢状面T2WI(FRFSE序列)TR 3260 ms,TE 93.2 ms,层厚5.0 mm,层间隔1.0 mm,矩阵384×384,视野24 cm×24 cm,激励次数2。
3D-ASL扫描参数:3D-ASL(3D Spiral),TR 4632 ms,TE 10.5 ms,T1 1525.0 ms,视野24 cm×24 cm,矩阵512×8,层厚4 mm。扫描层数40层,激励次数3,扫描时间4 min 29 s。为保证图像质量,扫描前均行ASSET序列匀场处理,扫描范围包括全脑。增强T1WI扫描参数:轴面T1WI(3D-FSPGR序列)TR 8.2 ms,TE 3.2 ms,T1 450 ms,层厚1.2 mm,矩阵256×256,视野24 cm×24 cm,激励次数1。
DSC扫描参数(GRE-EPI序列):TR 230 ms,TE 100 ms,层厚5.0 mm,层间距1.0 mm,视野23 cm×23 cm,矩阵128×128。经肘静脉注射对比剂钆喷酸葡胺(Gd-DTPA,拜耳保健医药公司),剂量0.1 mmol/kg,注射流率为4 mL/s,共采集1000幅图像。
3.图像处理及数据分析
将采集到的原始图像于ADW 4.5工作站采用Functool软件进行后处理,构建每一扫描层面的CBF伪彩图,了解肿瘤各层面大体血流灌注分布情况。
实性区相对CBF测量及计算:根据肿瘤各层面CBF伪彩图,在3D-ASL与DSC法CBF伪彩图同一层面,依据色阶确定肿瘤实性CBF最大区域(红色),采用公认的“热点法”放置ROI,避开囊肿、出血、大血管及伪影明显区域,面积50~60 mm2,每个ROI测量3次,取平均值为肿瘤实性区最大CBF(CBF实性)。再采用复制ROI的方法测量同层面对侧正常脑组织的CBF值(CBF镜像)。根据公式:rCBF实性=CBF实性/CBF镜像,获得肿瘤实性区rCBF。
近瘤周区相对CBF测量及计算:瘤周区定义为常规MR瘤体周围不强化、T2WI表现为高信号的区域[5],由于越邻近实体组织越容易受到肿瘤组织的污染,血管增殖越明显[6],因此本研究瘤周区选取距离肿瘤强化边缘1 cm处放置ROI,即近瘤周区,测量3次,取平均值,以同样方法获得近瘤周区rCBF。
4.统计学处理
采用SPSS 13.0软件包进行统计学分析,首先进行数据正态性检验,经统计学分析本研究数据不符合正态分布,以中位数及四分位数间距表示,两种灌注方法之间的比较采用Wilcoxon符号秩和检验。以P<0.05为差异有统计学意义。3D-ASL及DSC法与肿瘤实性区及近瘤周区rCBF的相关性是两个独立样本之间的评估,采用Spearman线性相关检验。

图1 女,38岁,左侧额叶弥漫性星形细胞瘤(WHO Ⅱ级)。a) T2WI示左侧额叶不规则等、高混杂信号病灶; b) 增强T1WI示病灶呈线样轻度强化; c) DSC图像rCBF实性为1.331,rCBF瘤周为0.729 ; d) 3D-ASL CBF伪彩图示斑片状高灌注伴周围较低灌注区;rCBF实性为1.110,rCBF瘤周为0.619。 图2 男,28岁,左侧额叶-胼胝体膝部多形性胶质母细胞瘤(WHO Ⅳ级)。a) T2WI示不规则混杂信号病灶伴周围水肿; b) 增强T1WI示病变明显线样强化; c) DSC图像rCBF实性为7.287,rCBF瘤周为1.731; d) 3D-ASL CBF伪彩图示高灌注区与强化区相对应,周围呈较低灌注区;rCBF实性为5.253,rCBF瘤周为1.290。
结 果
1.3D-ASL与DSC法rCBF值及其相关性
星形细胞瘤实性区3D-ASL和DSC法rCBF(图1、2)相关性很好(r=0.944,P<0.01);两种灌注方法近瘤周区rCBF(图1、2)相关性较好(r=0.732,P<0.01)。星形细胞瘤实性区rCBF较近瘤周区相关性好(表1)。
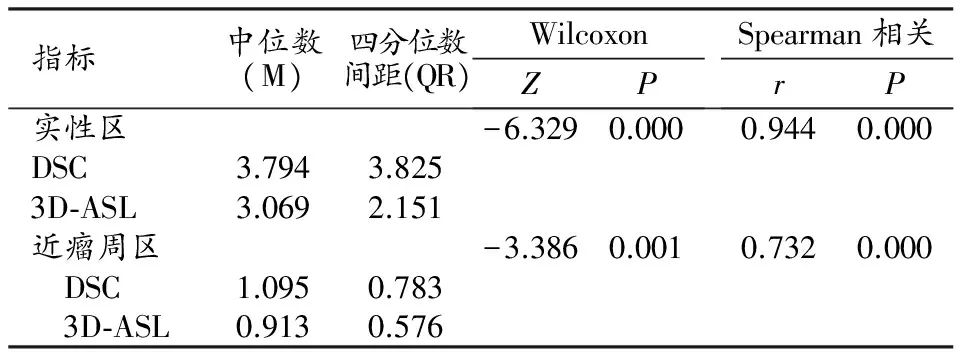
表1 两种灌注方法肿瘤实性区与近瘤周区rCBF值比较
注:本组数据不符合正态分布,用中位数及四分位数表示,下同。
2.HGG组及LGG组两种灌注方法rCBF值及其相关性
HGG实性区3D-ASL和DSC法rCBF相关性很好(r=0.918,P<0.01);两种灌注方法近瘤周区rCBF相关性较好(r=0.757,P<0.01,表2)。

表2 HGG组两种灌注方法肿瘤实性区及近瘤周区rCBF值比较
LGG组实性区3D-ASL和DSC法rCBF相关性很好(r=0.931,P<0.01);两种灌注方法近瘤周区rCBF相关性较好(r=0.840,P<0.01,表3,图3~5)。LGG组实性区及近瘤周区rCBF相关性均较HGG组好。

表3 LGG组两种灌注方法肿瘤实性区及近瘤周区rCBF值比较
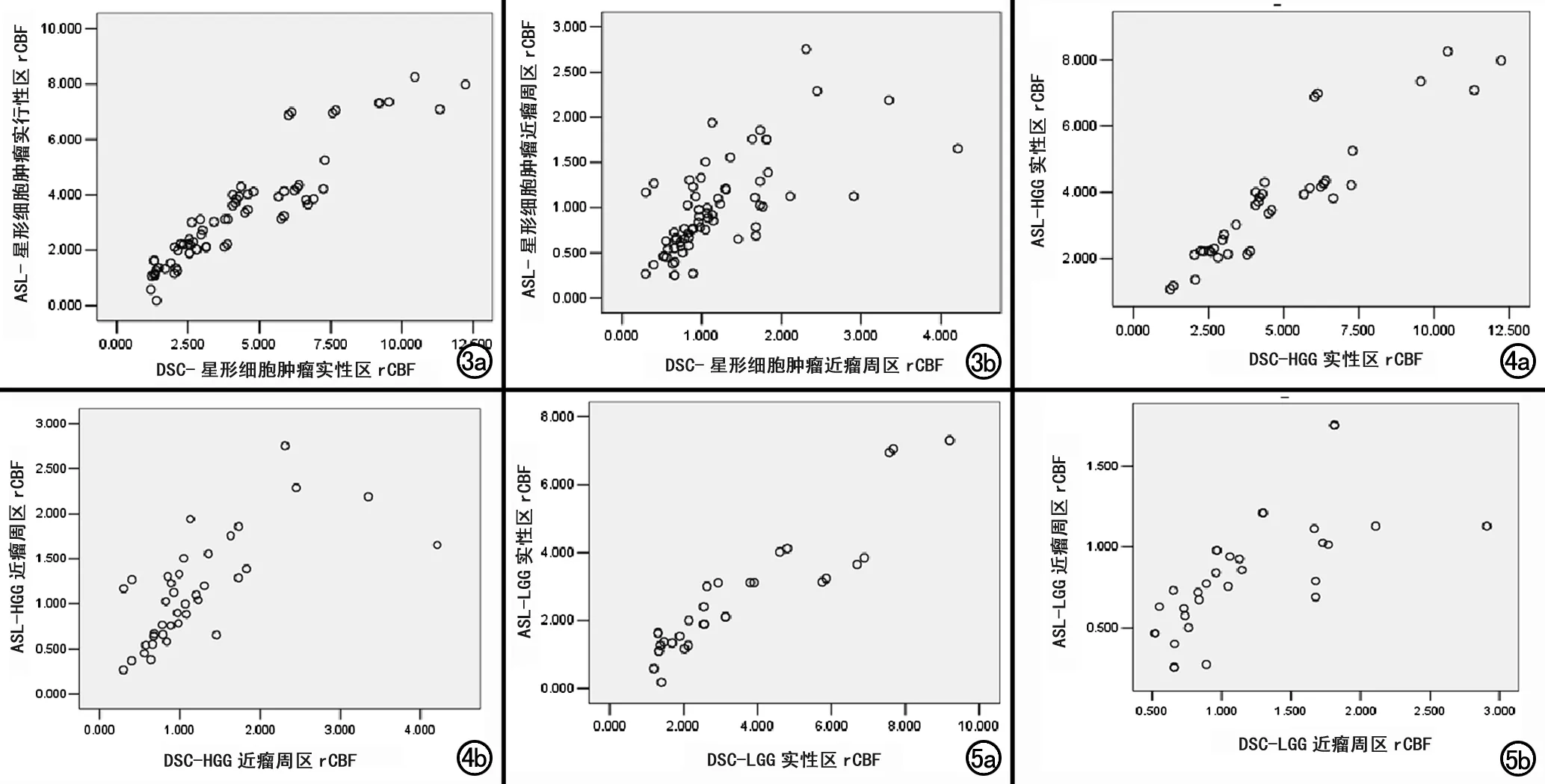
图3 70例星形细胞瘤(38例HGG,32例LGG)3D-ASL与DSC法rCBF相关性散点图。a) 肿瘤实性区rCBF相关性散点图; b) 近瘤周区rCBF相关性散点图。 图4 38例HGG组3D-ASL与DSC法rCBF相关性散点图。a) 肿瘤实性区rCBF相关性散点图; b) 近瘤周区rCBF相关性散点图。 图5 32例LGG组3D-ASL与DSC法rCBF相关性散点图。a) 肿瘤实性区rCBF相关性散点图; b) 近瘤周区rCBF相关性散点图。
1.星形细胞瘤3D-ASL与DSC法rCBF相关性研究的必要性
近年来迅速发展的磁共振灌注成像是一种功能成像方法,通过反映组织内部微血管密度及分布情况,在传统MRI诊断困难时可提供有价值的信息。磁共振灌注成像技术根据引入内、外源性对比剂的差异,分为DSC与3D-ASL两类[1]。目前被临床广泛认可并使用的是DSC方法,DSC法通过静脉团注顺磁性对比剂后采用快速扫描方法,获得对比剂首次通过感兴趣区的一系列动态图像,获得血流动力学信息,目前多用于脑肿瘤术前诊断、分级及术前评估等,但是所得血流动力学参数准确性易受血脑屏障破坏、对比剂剂量及注射流率等因素的影响,并且容易产生顺磁性伪影[7]。3D-ASL以自由弥散的水作为内在示踪剂,利用反转脉冲标记上游区的动脉血,该标记血流从标记层流入成像层,根据局部组织纵向弛豫时间T1的变化,将标记前、后的图像减影从而获得CBF图像。3D-ASL与DSC相比主要有以下三方面优点:①无需注射对比剂,完全无创;②不易受血脑屏障的影响,对CBF评估更准确[5];③操作简单,不存在对比剂注射与排泄影响,更适合患者短时间重复检查。因此,3D-ASL在婴、幼儿及肾功能不全患者脑灌注应用方面具有较大优势[8]。然而,3D-ASL在星形细胞瘤中的应用仍处于初步临床和实验研究阶段,相关研究较少,所提供信息的可靠性有待于进一步验证。本研究通过3D-ASL与DSC对星形细胞瘤进行对照研究,旨在探讨3D-ASL测量CBF的准确性及其在星形细胞瘤中的应用价值。
MR灌注成像参数较多,其中对肿瘤评估最有价值的是CBF,反映的是血液输送量,即组织的供血血管数量及单个血管血流量的综合体现[9],对于肿瘤组织的病理血管密度评估效果较好,并且CBF是3D-ASL与DSC的唯一共同参数。国内外已有研究[7,10]表明,CBF可对组织灌注进行有效评估,目前关于两种灌注方法的CBF的相关性研究也有一些报道。如Järnum等[11]采用脉冲动脉自旋标记(pulsed arterial spin labeling,p3D-ASL)和DSC技术对28例行常规MR增强的脑肿瘤(12例胶质母细胞瘤,2例间变性星形细胞瘤,4例少突胶质细胞瘤,1例毛细胞型星形细胞瘤,4例脑膜瘤,3例转移瘤,1例淋巴瘤,1例原始神经外胚层肿瘤)进行研究,发现两种方法rCBF对脑肿瘤血管灌注评估有很好的相关性(r=0.82)。此外,Lehmann等[12]利用p3D-ASL和DSC对27例不同种类脑肿瘤患者进行研究,验证了3D-ASL方法检测脑肿瘤的可行性,结果显示p3D-ASL可以像DSC一样较好评价肿瘤血流灌注,并且两种方法rCBF密切相关(r=0.97)。
但是上述研究中肿瘤类型较多,未将各类型进行分类探讨,并且未对近瘤周区进行研究。本研究对70例星形细胞瘤实性区与及近瘤周区rCBF的相关性进行了探讨。
2.星形细胞瘤两种灌注方法rCBF的相关性
星形细胞瘤早期为无血管期,生长缓慢,一旦进入血管期,瘤体体积迅速增大,并向周围组织浸润,肿瘤血管的生成是星形细胞瘤生长、浸润及转移的重要基础[13]。相关研究证实,在血管生成过程中水通道蛋白-1(aquaporin-1,AQP1)与VEGF的表达呈明显正相关,两者共同作用促进内皮细胞迁移,最终诱发肿瘤新生血管生成[14,15]。MR灌注成像参数CBF通过反映微血管密度及分布,为星形细胞瘤的研究提供了新途径[16]。本研究结果说明3D-ASL及DSC法所得结果的一致性与相关性均较好,证实了3D-ASL对于星形细胞瘤实性区评估的可行性。大量研究证实近瘤周区微观结构的认识可对星形细胞瘤的评估提供更多补充信息,水肿是瘤细胞向周围浸润形成的结果[17,18],尽管异型性相对较轻[19],但是仍然存在异常血管增殖。本研究观察70例星形细胞瘤近瘤周区rCBF值,发现其相关性较实性区低,分析其原因,可能包括以下两点:首先,星形细胞瘤近瘤周区病理成分复杂,包括血管源性水肿、肿瘤细胞浸润、灰白质和反应性胶质增生等,并且邻近实体组织的标本会受到肿瘤组织的污染,瘤细胞浸润越多,血管增殖越明显[6],瘤周组织MVD计数量较小,界限难以确定;其次,血流通过时间的多变、不易确定,对白质等低血流区灌注的低估以及上矢状窦等大静脉的污染等都会影响灌注测量的准确性。以上原因均在一定程度上影响rCBF测量的准确性,导致两种灌注方法的测量值偏差较大。
以往研究证实不同级别肿瘤血管的结构形态不同,肿瘤级别与MVD计数呈线性正相关[1,20],并且进一步证实HGG与LGG组rCBF差异有统计学意义[13],因此有必要对HGG与LGG分别进行探讨。
3.HGG与LGG组3D-ASL与DSC法rCBF相关性分析
星形细胞瘤分级与微血管形态、MVD计数直接相关[1,21-23],因此将星形细胞瘤按级别分组研究rCBF的相关性具有重要价值。本研究对38例HGG及32例LGG两种灌注方法实性区rCBF的相关性进行研究,证实LGG较HGG实性区rCBF相关性好。近瘤周区微观结构对星形细胞瘤的分级及判断预后具有重要作用,以往研究发现HGG与LGG近瘤周区VEGF表达均为阳性,VEGF是调控肿瘤血管生成作用最强、特异性最高的因子之一,不仅能促进肿瘤细胞增殖,还能促进血管内皮细胞增殖及肿瘤血管生成,且VEGF计数与星形细胞瘤级别明显相关[1,20]。本研究证实LGG组的实性区及近瘤周区rCBF相关性均优于HGG组,考虑其原因可能包括以下几点:①VEGF参与肿瘤血管形成,且VEGF在LGG中的表达率较HGG低,因此LGG较HGG生长较慢,实性区及近瘤周区血管增殖程度也相对较轻[23],并且相关研究证实LGG肿瘤结构发育不完整[24,25],管壁菲薄,基底膜不完整,通透性高于正常血管,导致HGG对比剂渗漏较LGG增加;②血脑屏障破坏程度与星形细胞瘤级别呈正相关,HGG血脑屏障破坏程度较LGG严重。以上原因导致DSC法中HGG组较LGG组对比剂渗漏增加[26,27],HGG组DSC与3D-ASL法rCBF之间的偏差较大,也间接支持了本研究中LGG组较HGG组两种灌注方法rCBF相关性更好的结论。
本研究通过对星形细胞瘤实性区及近瘤周区rCBF进行分析,试图探讨DSC与3D-ASL血流灌注参数的相关性,并得出初步结论。由于本研究Ⅰ级星形细胞瘤数量较少,未将I级与Ⅱ级、Ⅲ级与Ⅳ级星形细胞瘤进一步分组讨论, 因此关于星形细胞瘤DSC与3D-ASL相关性的确切结论有待于增加样本量进一步证实。
总之,本研究表明星形细胞瘤实性区3D-ASL与DSC两种灌注方法的rCBF呈明显正相关,近瘤周区两者rCBF相关性较实性区稍低,并且LGG组实性区及近瘤周区的rCBF相关性均高于HGG组,提示3D-ASL可较好地反映星形细胞瘤的血流特点及高、低级别星形细胞瘤之间的差异。
[1] 韩彤,张云亭,刘力,等.星形细胞瘤磁敏感加权成像和灌注成像测量指标与肿瘤内微血管密度和血管内皮细胞生长因子的相关性研究[J].中华放射学杂志,2013;47(12):1086-1091.
[2] 娄昕,吴冰,黄点点,等.正常成人后循环脑区动脉自旋标记灌注成像的可复性研究[J].中华放射学杂志,2014,48(2):151-154.
[3] Lobel U,Sedlacik J,Sabin ND.Three-dimensional susceptibility-weighted imaging and two-dimensional T2*-weighted gradient-echo imaging of intratumoral hemorrhages in pediatric diffuse intrinsic pontine glioma[J].Neuroradiol,2010,12(52):1167-1177.
[4] 占传家,朱文珍,王承缘.2007年世界卫生组织对于中枢神经系统肿瘤的分类[J].放射学实践,2008,23(2):122-127.
[5] 袁涛,王巍巍,全冠民.高、低级别星形细胞瘤近瘤周区CTP研究[J].中国临床医学影像杂志,2011;22(10):685-688.
[6] Haris M,Husain N,Singh A,et al.Dynamic contrast-enhanced (DCE) derived transfer coefficient (ktrans) is a surrogate marker of matrix metalloproteinase 9 (MMP-9) expression in brain tuberculomas[J].J Magn Reson Imaging,2008,28(3):588-597.
[7] Petcharunpaisan S,Ramalho J,Castillo M,et al.Arterial spin labeling in neuroimaging[J].World J Radiol,2010,2(10):384-398.
[8] Zaro-Weber O,Moeller-Hartmann W,Heiss WD,er al.The performance of MRI-based cerebral blood flow measurements in acute and subacute stroke compared with 150-water positron emission tomography identification of penumbral flow[J].Stroke,2009,40(7):2413-2421.
[9] 3D-ASLlani I,Borogovac A,Wright C,at al.An investigation of statistical power for continuous arterial spin labeling imaging at 1.5T[J].Neuroimage,2008,9(3):1246-1256.
[10] Noguchi T,Yoshiura T,Hiwatashi A,et al.Perfusion imaging of brain tumors using arterial spin-labeling:correlation with histopathologic vascular density[J].AJNR,2008,29(4):688-693.
[11] Järnum H,Elena G,Steffensen,et al.Perfusion MRI of brain tumors:a comparative study of pseudo-continuous arterial spin labeling and dynamic susceptibility contrast imaging[J].Neuroradiology,2010,52(4):307-317.
[12] Lehmann P,Monet P,de Marco G,et a1.A comparative study of perfusion measurement in brain tumours at 3 Tesla MR:arterial spin labeling versus dynamic susceptibility contrast enhanced MRI[J].Eur Neurol,2010,64(1):21-26.
[13] Winkler F,Kienast Y,Fuhrmann M,et al.Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peritumoral angiogenesis[J].Glia,2009,57(12):1306-1315.
[14] Evangelista AM,Thompson MD,Bolotina VM,et al.Nox4 and Nox2 dependent oxidant production is required for VEGF induced SERCA cysteine-674 S-glutathiolation and endothelial cell migration[J].Free Radic Biol Mcd,2012,53(12):2327-2334.
[15] Onzani E,Bazzotti R,Perego C,et al.AQPl is not only a water channel:it contributes to cell migration through Lin7/beta-catenin[J].PloS One,2009,4(7):e6167.
[16] Sadeghi N,D'Haene N,Decaestecker C,et al.Apparent diffusion coefficient and cerebral blood volume in brain gliom as:relation to tumor cell density and tumor microvessel density based on stereotactic biopsies[J].AJNR,2008,29(3):476-482.
[17] Abreu-Rodfiguez I,Sainchez Silva R,Martins AP,et al.Functional and transcriptional induction of aquaporin-1 gene by hypoxia;analysis of promoter and role of Hif-la[J].PloS One,2011,6(12):e28385.
[18] Nico B,Ribat'ti D.Role of aquaporins in cell migration and edema formation in human brain tumors[J].Exp Cell Res,2011,317(17):239l-2396.
[19] Kim CS,Jung S,Jung TY,et al.Characterization of invading glioma cells using molecular analysis of leading edge tissue[J].J Korean Neurosurg Soc,2011,50(3):157-165.
[20] Hsu YY,Yang WS,Lim KE,et al.Vessel size imaging using dual contrast agent injections[J].Magn Reson Imaging,2009,30(5):1078-1084.
[21] Huebert RC,Jagavelu K,Hendrickson HI,et al.Aquaporin-1 promotes angiogenesis,fibrosis,and portal hypertension through mechanisms dependent on osmotically sensitive microRNAs[J].Am J Pathol,2011,179(4):1851-1860.
[22] Pan XY,Guo H,Han J,et al.Ginsenoside Rg3 attenuates cell migration via inhibition of aquaponn 1 expression in PC-3M prostate cancer cells[J].Eur J Pharmacol,2012,683(1):27-34.
[23] Winkler F,Kienast Y,Fuhrmann M,et al.Imaging glioma cell invasion invivo reveals mechanisms of dissemination and peritumoral angiogenesis[J].Glia,2009,57(12):1306-1315.
[24] Jia Z,Geng D,Xie T,et al.Quantitative analysis of neovascular permeability in glioma by dynamic contrast-enhanced MR imaging[J].Clin Neurosci,2012,19(6):820-823.
[25] Server A,Graff BA,Orheim TE,et al.Measurements of diagnostic examination performance and correlation analysis using microvascular leakage,cerebral blood volume,and blood flow derived from 3T dynamic susceptibility weighted contrast-enhanced perfusion MR imaging in glial tumor grading[J].Neuroradiology,2011,53(6):435-447.
[26] Erver A,Josefsen R,Kulle B,et al.Proton magnetic resonance spectroscopy in the distinction of high-grade cerebral gliomas from single metastatic brain tumors[J].Acta Radiol,2010,51(3):316-362.
[27] Hu LS,Baxter LC,Pinnaduwage DS,et al.Optimized preload leakage-correction methods to improve the diagnostic accuracy of dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging in post-treatment gliomas[J].AJNR,2010,31(1):40-48.
Correlation study of arterial spin labeling and dynamic susceptibility-weighted contrast enhanced MR imaging in the blood flow of astrocytoma
YUAN Tao,DING Fang,QUAN Guang-min,et al.Department of Radiology,Second Hospital of Hebei Medical University,050000,P.R.China
Objective: To study the correlationship between three dimensional arterial spin labeling (3D-ASL) and dynamic susceptibility weighted contrast enhanced (DSC) MR imaging in the blood flow of astrocytoma.Methods:Seventy cases of pathology proven astrocytoma underwent conventional MR plain and contrast enhanced,3D-ASL and DSC sequences.According to WHO classification of central nervous system tumors and grading criteria,there were pilocytic astrocytoma (gradeⅠ,4 cases),diffuse astrocytoma (grade Ⅱ,28 cases),anaplastic astrocytoma (grade Ⅲ,22 cases) and glioblastoma (grade Ⅳ,16 cases).Maximum cerebral blood flow (CBF) was measured in the solid region and immediate peritumoral region of the tumor as well as the mirror region of the contra-lateral.The rCBF of the solid region and immediate peri-tumoral region were calculated.The differences and correlation between the two perfusion methods were analyzed.Results:Of the 70 astrocytomas,the rCBF values (median,interquartile range) measured by 3D-ASL and DSC in solid region were (3.069,2.151) and (3.7943,3.825) respectively,the correlation coefficient was (r=0.944);the rCBF values in peritumoral region were (0.913,0.576) and (1.095,0.783) respectively,the correlation coefficient was (r=0.732).In high grade glioma (HGG) group (n=38),the rCBF value measured by 3D-ASL and DSC in solid region were (3.662,2.054) and (4.179,3.468) respectively,the correlation coefficient was (r=0.918),the rCBF values in the peritumoral region were (1.171,0.760) and (0.974,0.703) respectively,the correlation coefficient was (r=0.757).In low grade glioma (LGG) group (n=32),the rCBF values of 3D-ASL and DSC in solid region were (2.109,2.205) and (2.591,3.988) respectively,the correlation coefficient was (r=0.931),the rCBF values in the peritumoral region were (0.781,0.438) and (0.965,0.944) respectively,the correlation coefficient was (r=0.840).Conclusion:The rCBF vlaues measured by 3D-ASL and DSC were positively correlated in astrocytoma,and the correlationship of rCBF in LGG group was better than that in HGG group.3D-ASL can be a good alternative method for DSC to evaluate the perfusion in astrocytic tumors.
Astrocytic tumors;Magnetic resonance imaging;Arterial spin labeling;Dynamic susceptibility weighted contrast enhanced;Cerebral blood flow
050000 石家庄,河北医科大学第二医院影像科(袁涛、全冠民);056001 河北,邯郸中心医院影像科(丁芳芳、杨素君)
袁涛(1976-),女,河北定州人,博士,副教授,主要从事神经及胸部影像诊断工作。
全冠民,E-mail:quanguanmin@163.com
R739.41; R445.2
A
1000-0313(2015)09-0922-06
10.13609/j.cnki.1000-0313.2015.09.008
2015-03-10
2015-05-01)