茅台酱香型酒糟中总黄酮及总多酚含量的测定
王兴东,牟明月,任雅奇,许志玲,张前军*,周清娣
(1.贵州大学 精细化工研究开发中心,贵州 贵阳 550025;2.贵州大学 化学与化工学院,贵州 贵阳 550025;3.贵州茅台酒股份有限公司,贵州 仁怀 564501;4.澳大利亚悉尼大学 化学学院,澳大利亚 悉尼 1797)
酒糟是白酒产业的最大副产物,由于采用的原料、生产工艺各不相同,造成酒糟中营养成分种类与含量都各不相同[1-2]。赤水河流域酱香型酒糟是以当地生产的糯性高粱和小麦为原料,经酒曲发酵完后再蒸馏出酒后留下来的固形物,独特原料与当地特有微生物群在整个发酵酿酒过程中发生了复杂的生物化学变化,生成多种化学成分。目前有关酒糟化学成分研究报道较少,王金华等[3]从酒糟中提取得到9.79%的水溶性戊聚糖;张世仙等[4-5]采用气相色谱-质谱法分析茅台酱香型酒糟的香气成分,并探索了从茅台酱香型酒糟中提取水溶性膳食纤维的最佳工艺条件;张云鹏等[6]对白酒糟植酸提取条件进行了优化。黄酮和多酚类化合物属于生理活性显著、种类繁多的天然产物,大量研究表明,黄酮和多酚类化合物具有抗肿瘤、抗菌、抗病毒以及抗氧化等功效[7-8],但迄今为止,国内很少有对酒糟总黄酮和总多酚含量测定的研究和报道。
本研究对以槲皮素为对照品,采用紫外分光光度法测定茅台酱香型酒糟中总黄酮含量;以没食子酸为对照品,用Folin-Ciocateu比色法测定酒糟中总多酚含量,以期建立酱香型酒糟中总黄酮及总多酚含量测定方法,为综合利用该地区酒糟资源,开发医药、保健等高附加值的产品奠定基础。
1 材料与方法
1.1 材料与试剂
酱香型酒糟:贵州省仁怀市茅台镇。
槲皮素(纯度为97%):中国药品生物制品药物检定所;没食子酸(纯度为98%):贵州迪大生物有限公司;无水乙醇:天津市富宇精细化工有限公司;硝酸铝、钨酸钠、硫酸锂:天津市科密欧化学试剂有限公司;硝酸钠(NaNO3)、亚硝酸钠(NaNO2):成都金山化学试剂有限公司;氢氧化钠:天津市永大化学试剂有限公司;钼酸钠:天津市化学试剂四厂;磷酸:重庆川江化学试剂厂;碳酸钠:天津市北联精细化学品开发有限公司。所用试剂均为分析纯。
1.2 仪器与设备
UV-2450紫外分光光度计:上海仪电分析仪器有限公司;SB-5200D超声波清洗器:宁波新芝生物科技股份有限公司;RE-52A旋转蒸发仪、B-220恒温水浴锅:上海亚荣生化仪器厂;TP-114电子天平:美国丹佛仪器公司。
1.3 试验方法
1.3.1 总黄酮含量测定方法
总黄酮含量的测定采用紫外分光光度法。
(1)供试品溶液的制备
称取干燥粉碎后的酒糟1.000 g于100 mL的圆底烧瓶中,加入50 mL体积分数75%的乙醇回流2 h,回流3次,将3次滤液合并,旋干,再用体积分数60%的乙醇溶液溶解,置于100 mL的容量瓶中,补加体积分数60%乙醇溶液定容至刻度,摇匀,作为供试品溶液[9]。
(2)槲皮素标准曲线制作[9]
精密称取槲皮素标准品0.021 g,用体积分数60%的乙醇溶液定容于100 mL容量瓶中,得质量浓度为0.210 g/L的槲皮素对照品溶液。
分别取质量浓度为0.210 g/L的槲皮素标准品溶液0、2.5 mL、5.0 mL、7.5 mL、10.0 mL、12.5 mL,置于25 mL容量瓶中,加入体积分数60%的乙醇溶液至12.5 mL,再加5%NaNO20.75 mL,摇匀,放置5 min,加入10%Al(NO3)3溶液0.75 mL,摇匀,放置5 min,加入4%NaOH溶液10 mL;分别用体积分数60%的乙醇定容至刻度,摇匀,放置15 min[10]。分别在波长510 nm处分别测其吸光度值,以槲皮素对照品质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。按照标准曲线回归方程计算样品中总黄酮的含量。
1.3.2 总多酚含量测定
总多酚含量的测定采用Folin-Ciocateu比色法。
(1)供试品溶液的制备
酒糟干燥粉碎后称取2.000 g置于100 mL容量瓶中,加入30mL无水乙醇,加热回流10h,抽滤后减压浓缩成浸膏,无水乙醇溶解定容至100mL,过滤,滤液作为供试品溶液[12]。
(2)福林-酚(Folin-Ciocalteu)试剂的配制备
称取钨酸钠25 g、钼酸钠6.25 g,然后加175 mL的水、12.5 mL的85%磷酸、25 mL的浓盐酸,置于500 mL的圆底烧瓶中,加入沸石,加热回流10 h,冷却,再加硫酸锂37.5 g、水12.5 mL和溴水适量,加热煮沸15 min,得金黄色溶液,冷却,过滤至250 mL的棕色容量瓶中,加水稀释至刻度。临用前加水一倍,摇匀[11-12]。
(3)没食子酸标准曲线的制作对照品溶液的制备
精密称取没食子酸0.025 7 g,用无水乙醇溶解,转移至100 mL棕色容量瓶中,用无水乙醇稀释至刻度,摇匀,即得质量浓度为0.257 g/L的没食子酸标准品溶液。
精密吸取质量浓度为0.257 g/L的没食子酸标准品溶液0、0.05 mL,0.15 mL、0.25 mL、0.35 mL、0.45 mL、0.55 mL置于25 mL容量瓶中,分别加入2.5 mL的Folin-Ciocalteu试剂、4mL10%Na2CO3溶液,用蒸馏水定容,摇匀,室温条件下显色80 min,分别在波长765 nm处测定吸光度值[13],以没食子酸对照品质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。按照标准曲线回归方程计算样品中总多酚的含量。
1.3.3 显色条件的确定[12]
(1)Folin-Ciocalteu试剂加入量的确定
精密吸取质量浓度为0.257 g/L没食子酸标准溶液0.2 mL 6份分别置于25 mL容量瓶中,分别加入(1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL)Folin-Ciocateu试剂和4.0 mL 10%Na2CO3溶液,蒸馏水定容,摇匀,在室温条件下显色80 min,以相应溶液为空白试剂,在波长765 nm处测定吸光度值,确定Folin-Ciocalteu试剂的最佳加入量,整个试验过程避光操作。
(2)Na2CO3加入量的确定
精密吸取质量浓度为0.257g/L没食子酸标准溶液0.2mL 6份分别置于25 mL容量瓶中,分别加入2.0 mL、3.0 mL、4.0 mL、5.0 mL、6.0 mL 10%Na2CO3溶液和2.5 mL Folin-Ciocalteu试剂,蒸馏水定容,摇匀,在室温条件下显色80 min,以相应溶液为空白试剂,在波长765 nm处测定吸光度值,确定Na2CO3的最佳加入量,整个试验过程避光操作。
(3)显色时间的确定
精密吸取质量浓度为0.257g/L没食子酸标准溶液0.2mL 6份分别置于25 mL容量瓶中,加入2.0 mL Folin-Ciocalteu试剂和4.0 mL的10%Na2CO3溶液,用蒸馏水定容,以不加入没食子酸的为空白试剂,在室温条件下显色不同时间,分别在波长765nm处测定吸光度值,确定显色的最佳时间,整个试验过程避光操作。
2 结果与分析
2.1 槲皮素标准曲线的建立
以槲皮素质量浓度(X)为横坐标,吸光度值(Y)为纵坐标,绘制标准曲线,结果见图1。
由图1可知,槲皮素标准曲线线性回归方程为Y=5.234 0X+0.005 0,相关系数R2=0.997 6,说明槲皮素对照品在0.021 0~0.105 0 g/L质量浓度范围内与吸光度值呈良好的线性关系。

图1 槲皮素标准曲线Fig.1 Standard curve of quercetin
2.2 没食子酸标准曲线的建立
以没食子酸质量浓度(X)为横坐标,吸光度值(Y)为纵坐标,绘制标准曲线,结果见图2。

图2 没食子酸标准曲线Fig.2 Standard curve of gallic acid
由图2可知,没食子酸标准曲线线性回归方程为Y=140.00X-0.005 8,相关系数R2=0.999 7,说明没食子酸在0.000 5~0.005 7 g/L质量浓度范围与吸光度值呈良好的线性关系。
2.3 总黄酮测定方法学考察
2.3.1 稳定性试验
取同一供试品溶液5.0 mL置于25 mL的容量瓶中,参照1.3.1方法配制后分别放置0、15 min、30 min、45 min、60 min后测定吸光度值,分别为0.235、0.242、0.236、0.232、0.239,相对标准偏差(relative standard deviation,RSD)=1.62%。供试品溶液制备后1 h内稳定,吸光度值无明显变化。结果表明,该方法稳定性良好。
2.3.2 精密度测定
取同一供试品溶液5.0 mL 5份,参照1.3.1方法配制后以不加供试品的相应溶液作为空白试剂,测定其吸光度值,分别为0.205、0.203、0.213、0.206、0.208,RSD=1.84%。结果表明,该方法精密度良好。
2.3.3 重复性试验
称取同一批干燥粉碎后的酒糟5份,每份1.000 g,按照1.3.1操作制备供试品溶液,取其5.0 mL供试品溶液置于25 mL的容量瓶中,测定其吸光度值,结果分别为0.211、0.222、0.202、0.223、0.235,RSD=5.76%。结果表明,该方法重复性良好。
2.3.4 加标回收率试验
称取同一批干燥粉碎后的酒糟5份,每份0.500 0 g,置于100 mL的圆底烧瓶中,按照1.3.1的方法制成供试品溶液,精密加入对照品适量,测定吸光度值并计算回收率,结果见表1。
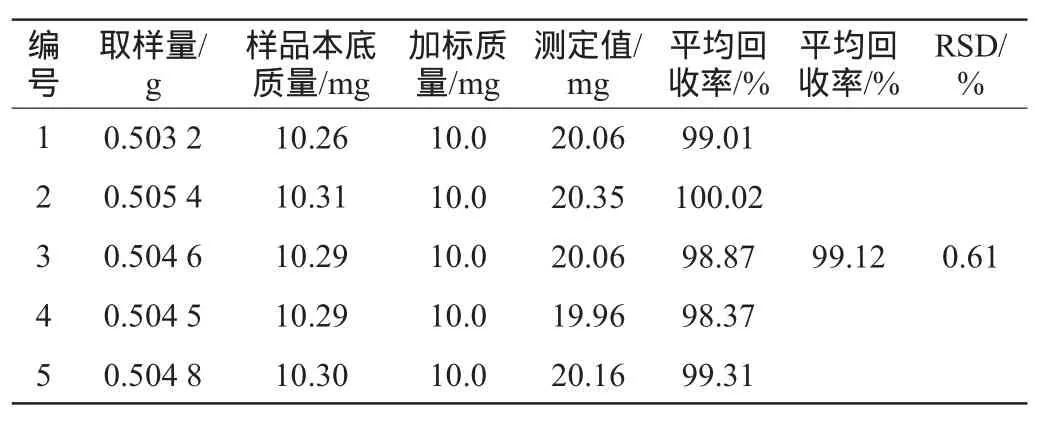
表1 总黄酮测定加标回收率试验结果Table 1 Results of adding standard recovery rate tests for total flavonoids determination
由表1可知,酒糟中总黄酮的回收率为98.37%~100.02%,平均回收率为99.12%,相对标准偏差为0.61%,说明该方法的准确度较好,能满足酒糟中总黄酮的检测要求。
2.4 福林酚法显色条件的确定
2.4.1 试剂加入量的确定

图3 Folin-Ciocalteu试剂加入量对吸光度值的影响Fig.3 Effect of Folin-Ciocalteu reagent addition on absorbance value
由图3可知,随Folin-Ciocalteu试剂的加入量的增加,吸光度值先下降后上升,最后下降,这可能是由于酒糟乙醇溶液本身呈黄色,随着Folin-Ciocalteu试剂的加入,W+6与体系中酚羟基作用还原成蓝色W+5,与酒糟溶液颜色产生消减,吸光度值降低,当Folin-Ciocalteu试剂加到最大量后,体系中的酚羟基作用完全形成深蓝色复合物,吸光度值达到最大值。当Folin-Ciocalteu试剂体积为2.0 mL时吸光度值到达最低,为0.271;当Folin-Ciocalteu试剂体积为2.5 mL时吸光度值到达最高,为0.284。因此,选择Folin-Ciocalteu试剂最佳加入量为2.5 mL。
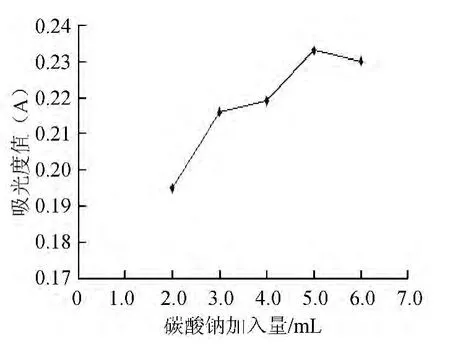
图4 10%Na2CO3加入量对多酚含量的影响Fig.4 Effect of 10%Na2CO3addition on absorbance value
2.4.2 Na2CO3加入量的确定光度值,结果分别为0.323、0.322、0.323、0.323、0.323,RSD=0.138%,可以看出在显色80 min后的40 min内吸光度值变化不大,说明该方法稳定性良好。
2.5.3 重复性实验
重复1.3.2方法制备供试品溶液。精密吸取0.6 mL供试品溶液,依照1.3.2方法测定吸光度值,结果分别为0.316、0.306、0.308、0.323、0.320,RSD=2.35%,结果表明,该方法重复性良好。
2.5.4 加标回收率试验
称取同一批酒糟5份,每份1.000 g左右,依照1.3.2方法制备供试品。精密加入对照品适量,参照1.3.2方法测定吸光度值并计算回收率,结果见表2。
由图4可知,随着Na2CO3溶液加入量的增加,总多酚含量也随之增加,当10%Na2CO3体积为5.0 mL时,吸光度值为最大。之后稍有下降,因此,选择10%Na2CO3溶液的最佳加入量为5.0 mL。
2.4.3 显色时间的确定

表2 总多酚测定加标回收率实验结果Table 2 Result of adding standard recovery rate tests for total polyphenol determination

图5 显色时间对吸光度值的影响Fig.5 Effect of reaction time on absorbance value
由图5可知,随着显色时间的延长,吸光度值呈上升趋势,说明多酚含量也逐渐增加。当显色时间为80 min时,吸光度值最大,之后随着显色时间的增长吸光度值趋于平缓,因此选择显色时间为80 min。
2.5 多酚测定方法学考察[14-15]
2.5.1 精密度试验
精密吸取同一供试品溶液5份0.6 mL分别置于25 mL容量瓶中,参照1.3.2方法测定吸光度值,结果分别为0.318、0.316、0.319、0.317、0.317,RSD=0.359%。结果表明,该方法精密度良好。
2.5.2 稳定性实验
精密吸取0.6 mL供试品溶液至25 mL容量瓶中,参照1.3.2方法配制后在波长765 nm处每隔10 min测定一次吸
由表2可知,测定酒糟中总多酚的加标回收率为99.40%~100.31%,平均加标回收率为99.82%,检测结果相对标准偏差为0.33%,说明该方法具有良好的准确性,能满足酒糟中总多酚的检测要求。
3 结论
本实验分别以槲皮素和没食子酸为标准品,建立了测定酒糟中黄酮和多酚含量的紫外分光光度法和Folin-Ciocalteu比色法,确定了Folin-Ciocalteu比色法最优的测定条件:加入Folin-Ciocalteu试剂2.5 mL、10%Na2CO3溶液4 mL,室温下显色80 min。结果表明,茅台酱香型酒糟中总黄酮含量为20.40 mg/g,总多酚含量为4.78 mg/g。总黄酮及总多酚分别在0.021 0~0.105 0 g/L(R2=0.997 6)和0.000 51~0.005 765 g/L(R2=0.999 7)与吸光度值线性关系良好,平均回收率分别为99.12%、99.82%,相对标准偏差(RSD)分别为0.609%、0.33%。本方法操作简单,结果准确可靠,稳定性和重复性良好,适用于酱香型酒糟中黄酮和多酚的定量测定。茅台酱香型酒糟中具有一定含量的黄酮和多酚类化合物,具有医药、化学品、食品等方面的开发前景,为酒糟的深度开发利用提供了参考价值。
[1]谭之磊,刘建辉,马 凯,等.白酒糟综合利用新技术[J].广东化工,2015,42(7):72-73.
[2]李 建,叶 翔.酒糟综合利用多元化研究[J].中国酿造,2013,32(12):121-124.
[3]王金华,李东生,陈 雄.啤酒糟中水溶性戊聚糖的提取及纯化[J].食品工业,2003(4):10-12.
[4]张世仙,金 茜,曾启华,等.茅台酱香型酒糟香气成分分析[J].中国酿造,2012,31(1):188-189.
[5]张世仙,张素英,曾启华,等.碱法提取茅台酒糟中水溶性膳食纤维的工艺研究[J].中国酿造,2011,30(10):126-128.
[6]张云鹏,刘 军,陈 娟.白酒糟植酸提取条件的优化[J].中国酿造,2010,3(4):125-127.
[7]庞道睿,刘 凡.廖森泰,等.植物源多酚类化合物活性研究进展及其应用[J].广东农业科学,2013,40(4):91-94.
[8]延 玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展[J].有机化学,2008,28(9):1534-1544.
[9]罗 兰,郭丽冰,曾长青.大山楂丸中总黄酮的含量测定[J].时珍国医国药,2007,18(9):2207-2208.
[10]董 玉,王爱民,陈朝军,等.文冠木中总黄酮的含量测定方法研究[J].蒙医药论坛,2008,30(5):364.
[11]李 杰,赵声兰,陈朝银.Folin-Ciocalteu比色法测定核桃青皮果蔬酵素总多酚含量[J].中国酿造,2015,34(9):130-134.
[12]吴晓青,陈 丹,邱红鑫,等.芙蓉李中总多酚含量测定方法的优选[J].中国中医药科技,2011,2(18):131-133.
[13]陈 晨,文怀秀,罗智敏,等.白刺色素和黑果枸杞色素中花色苷与总多酚的测定[J].光谱实验室,2010,5(27):1796-1798.
[14]李文仙,俞 丹,林 玲,等.Folin-Ciocalteu比色法应用于蔬菜和水果总多酚含量测定的研究[J].营养学报,2011,3(33):302-307.
[15]任 飞,杜宏涛,张继文,等.柿子皮提取物中多酚含量及其抗氧活性[J].西北农业学报,2011,20(4):144-147.

