茅山地区蝉花菌株的分离及其多糖生物活性的研究
陈成+许佳伟+孙细涓+贾俊强+桂仲争
摘要:对采自江苏句容茅山地区的蝉花进行组织分离,获得1株组织分离菌株,运用rNDA ITS区段对分离菌株进行分子生物学鉴定。结果表明,该菌株为虫草属类的被孢霉属菌株,命名为JR_cds1。蝉花中虫草素含量显著高于蚕蛹虫草和冬虫夏草。通过水提醇沉以及Sevage法除蛋白等方法提取蝉花多糖,研究其生物学活性及抑菌作用,结果显示,该蝉花多糖具有较高的清除DPPH自由基活性,高的Fe2+ 螯合能力,抑制血管紧张素转化酶(ACE)的活性;对大肠杆菌(G-)和枯草芽孢杆菌(G+)以及链格孢属真菌显示较好的抑菌效果。
关键词:蝉花;菌株分离;分子鉴定;多糖;抗氧化;抑菌作用
中图分类号: Q936 文献标志码: A
文章编号:1002-1302(2015)04-0347-05
收稿日期:2015-01-27
基金项目:国家公益性行业(农业)科研专项(编号:201403064)。
作者简介:陈 成(1991—),女,硕士研究生,主要从事微生物资源利用研究。Tel:(0511)85616716;E-mail:317657686@qq.com。
通信作者:桂仲争,研究员,博士生导师,主要从事生物资源功能性利用研究。Tel:(0511)85616716;E-mail:srizzgui@hotmail.com。
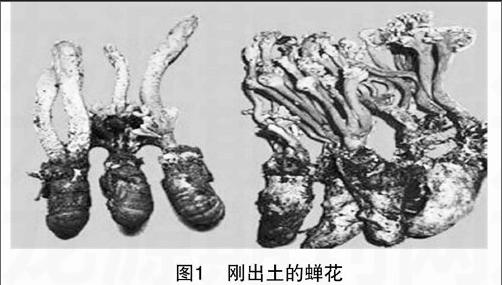
蝉花(Ophiocordyceps sobolifera)又称蝉菌蝉蛹草,是麦角菌科真菌蝉拟青霉寄生竹蝉若虫后的复合体,与冬虫夏草相类似的虫草[1],为名贵中药材。蝉花是从单个或是2~3个蝉幼虫头部生长出来,约3.4 cm长,从顶端开花分枝(如图1)。秋季来临,蝉钻入土中,逐渐变成蝉蛹,在羽化前被虫草类真菌寄生,在适宜的环境下开始萌发成菌丝体,吸收虫体的营养,菌丝体从营养阶段转化为有性阶段,渐渐从顶端开花分枝,故而得名蝉花。蝉花主要分布在我国的四川、江苏、浙江、福建以及安徽、云南东部。
早在宋代唐慎微的《征类本草》,明朝李时珍的《本草纲目》以及之后的药典都有蝉花功效的记载,蝉花的历史记载比冬虫夏草早800年,被称为最古老的虫草。蝉花与冬虫夏草同属于虫草类中药材,主要包含的有效成分有:虫草素、腺苷、虫草多糖、虫草酸等;蝉花含有16种氨基酸,其中人体必需氨基酸7种,虫体与菌座游离氨基酸总量及水解氨基酸含量略低于冬虫夏草[2]。《本草纲目》记载,该菌功同蝉蜕,可止疟疾;《类证本草》中也提到蝉花能够主治小儿惊癫、夜啼、心悸等[3]。国内外研究表明,蝉花具有提高免疫力、抗疲劳、保肾、改善、睡眠、抗肿瘤、保肝、抗辐射和明目等多重作用。因此,蝉花可以作为冬虫夏草的代用品,达到滋补养生的作用。但天然的蝉花非常稀少,野生金蝉花更稀奇珍贵,这限制了蝉花大量使用。不同地区不同生态环境采集的蝉花分离物,极具物种多样性,它们在遗传和形态上具有明显的差异,故蝉花菌株的分离与鉴定是蝉花研究的关键环节。
多糖是由许多单糖聚合而成的天然高分子化合物,是生命有机体的重要组成部分。已发现许多真菌多糖具有清除自由基、提高抗氧化酶活性和抑制脂质过氧化的活性起到保护生物膜和延缓衰老的作用[4]。本研究对从江苏省句容市茅山镇竹林山区采取的蝉花菌株进行分离鉴定,研究蝉花主要活性成分含量、蝉花多糖的抗氧化活性以及对细菌(大肠杆菌、枯草芽孢杆菌)和真菌(链格孢属)的抑菌效果。以明确该蝉花菌株的基本生物学特性及其多糖的生物学活性,为进一步开发蝉花提供依据。
1 材料与方法
1.1 蝉花及试验菌种
野生蝉花采自江苏省句容市茅山镇竹林山区,海拔约 150 m。试验用大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)由笔者所在实验室保存;链格孢属(Alternaria sp.)由笔者所在实验室从桑椹中分离并保存。
1.2 试剂
腺苷标准品和鼠李糖等为上海化学试剂公司进口分装,虫草素标准品购自常州大康保健药品有限公司。
Ezup柱式真菌基因组DNA抽提试剂盒、酵母膏、蛋白胨、氯化钠、琼脂、氯仿、正丁醇、浓硫酸、苯酚、1,1-二硝基-2-三硝基苯肼(DPPH)、维生素C、菲洛嗪、铁氰化钾、氯化亚铁、EDTA均购自Bio Basic有限公司。其他试剂均为分析纯,购于国药集团化学试剂有限公司。
1.3 主要仪器与设备
L-7420型高效液相色谱仪(日本东芝高技术公司)、RF-20A超高灵敏度荧光检测器(岛津国际贸易上海有限公司)、SY-601型超级恒温水浴(天津市欧诺仪器仪表有限公司)、AL104-IC型电子天平(上海梅特勒-托利多仪器有限公司)、H205DR-1型高速冷冻离心机(长沙湘仪离心机仪器有限公司)、WFZ-UV-2100型紫外可见分光光度计(上海尤尼柯仪器有限公司)、无菌超净台(上海新苗医疗器械制造有限公司)、5424型台式高速离心机(德国Eppenderf公司)、JD-801M型凝胶电泳图像分析系统(江苏捷达科技发展有限公司)、MG 96G型PCR仪(杭州朗基科学仪器有限公司)、GNP9270型隔水式恒温培养箱(上海精密实验设备有限公司)、LRH-250-Z型振荡培养箱(韶关市泰宏医疗器械有限公司)、DHG-9143BS型电热鼓风干燥器(上海新苗医疗器械制造有限公司)
1.4 蝉花菌株的分离与鉴定
1.4.1 组织分离 将新鲜蝉花分为菌膜、子座、菌核三部分进行菌种分离。用灭菌后的解剖刀除去表皮,各部位切成(2~3) mm×(2~3) mm的组织块,用0.1%的HgCl2溶液浸泡3~4 min,75%乙醇浸泡1 min进行表面消毒,无菌水漂洗,无菌滤纸吸干。置于含氨苄青霉素的PDA平板上,25 ℃倒置培养。待组织块周边长出菌丝后,挑菌落边缘菌丝,移至新的培养基,纯化菌株,获得蝉花菌株,保存备用。endprint
1.4.2 菌株的形态观察 将分离的菌株分别接种到沙氏、查氏和PDA培养基上,25 ℃培养3~4 d,观察菌落颜色、大小、形状及边缘形状。在显微镜下观察菌丝有无隔,分生孢子梗,分生孢子大小、形状等。
1.4.3 菌株的分子鉴定 采用Ezup柱式真菌基因组DNA抽提试剂盒,对在PDA液体培养基上培养4 d的菌丝球抽提基因组DNA,采用真菌ITS区扩增通用引物。(ITS1:TCCGTAGGTGAACCTGCGG,ITS2:TCCTCCGCTTATTGATATGC)对核糖体转录间隔区ITS进行PCR扩增,扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。琼脂糖凝胶电泳,检测PCR扩增产物,DNA胶回收试剂盒回收PCR扩增产物,连接到 pMD-18T 载体,再转化到大肠杆菌Top10细胞中,筛选阳性克隆,送上海生工生物工程股份有限公司测序。获得的ITS序列进行Blast比对,利用软件ClusterX进行多重序列比对,软件Mega中Neighbour-Joining方法(邻接法,NJ)构建系统发育树,对分离菌株与Genebank 数据库中登录的近源菌株系统发育关系进行分析。结合形态学特征,确定菌株的分类地位。
1.5 蝉花主要活性成分的测定
虫草素和腺苷的提取与测定:依据《中国药典》2005版,采用高效液相色谱法[5-6]。
虫草酸的提取与测定:采用分光光度计法[6-7]。
1.5 蝉花多糖的制备与含量测定
1.5.1 蝉花多糖的制备 (1)多糖提取:称取100 g蝉花干粉,加2 000 mL水于80 ℃水浴浸提10 h,布氏漏斗抽滤得滤液,连续浸提2次,合并滤液。滤液用旋转蒸发仪于80 ℃浓缩至一定体积。(2)醇沉:加入无水乙醇至终浓度为90%,置于4 ℃过夜,离心得沉淀,将沉淀复溶于一定蒸馏水中。(3)除蛋白、去离子:用Sevag法除去多糖溶液中的蛋白质。再用自来水和蒸馏水分别透析48 h除去小分子物质和部分色素。
1.5.2 蝉花多糖的含量测定 采用苯酚-硫酸法[8]测定蝉花多糖的含量。以葡萄糖为标准对照,于490 nm处测定吸光度,根据葡萄糖含量与吸光度回归方程计算多糖含量。
1.6 蝉花多糖抗氧化活性
1.6.1 清除DPPH自由基能力 参照Luo等的方法[8]并略有调整。称取一定量的1,1-二苯基-2-三硝基苯肼(DPPH),用无水乙醇配成0.04 mg/mL的DPPH溶液。分别取 2 mL 不同浓度(2、4、6、8、10 mg/mL)的蝉花多糖提取液,加入DPPH溶液2 mL,混合均匀,室温放置30 min后,5 000 r/min离心10 min。取上清液于517 nm处测吸光度。用维生素C作阳性对照。样品中自由基清除率用下面公式计算:
清除率=[1-(D1-D2)/D0]×100%。
式中:D0为2 mL无水乙醇+2 mL DPPH溶液的吸光度;D1为2 mL样品溶液+2 mL DPPH溶液的吸光度;D2为2 mL样品溶液+2 mL无水乙醇的吸光度。
1.6.2 总还原能力 采用Tsais等的方法[9]测定。在10 mL离心管中分别加入用0.2 mol/L pH值6.6的磷酸缓冲液配制的不同浓度(2、4、6、8、10 mg/mL)的蝉花多糖提取液,加入1%铁氰化钾2 mL,混合均匀后于50 ℃反应20 min。取出后加入10%三氯乙酸2 mL终止反应,5 000 r/min离心10 min。取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL FeCl3,混匀后静置10 min,在700 nm处测吸光度。维生素C作阳性对照。
1.6.3 对Fe2+铁离子螯合能力 参考Decker等的方法[10]并略有调整。分别取3 mL不同浓度(2、4、6、8、10 mg/mL)的蝉花多糖提取液,加入2 mmol/L的FeCl2溶液0.05 mL和 5 mmol/L 的菲洛嗪溶液,剧烈振荡后室温放置10 min,于 562 nm 处测吸光度。EDTA为阳性对照。样品对Fe2+的螯合率计算公式如下:
螯合率=[D0-(D1-D2)]/D0×100%。
式中:D0为3 mL蒸馏水代替反应体系中样品溶液后的吸光度;D1为样品溶液反应后的吸光度;D2为0.05 mL的蒸馏水代替反应体系中FeCl2溶液后的吸光度。
1.6.4 对血管紧张素转化酶(ACE)抑制率 将10 μL ACE酶液与10 μL不同浓度(6、12、18、24、30 mg/mL)蝉花多糖提取液混合均匀,对照组加入10 μL蒸馏水代替蝉花多糖提取液,37 ℃水浴5 min,然后加入浓度为6.5 mmol/L 的HHL(马尿酰-组氨酰-亮氨酸)反应底物(用pH值8.3的硼酸盐缓冲液配制),37 ℃水浴反应30 min,之后加入85 μL 1 mol/L的HCL终止反应,再向反应混合液中加入1 mL乙酸乙酯,摇匀数分钟后,4 000 r/min离心10 min,吸取上清液800 μL,放入干燥箱里90 ℃烘干后,加入等量的蒸馏水溶解,检测D228 nm值。空白对照在加入HHL底物之前加入85 μL浓度为1 mol/L的HCl,使ACE失活,以后的操作步骤与蝉花多糖提取液的处理一致[11]。
ACE抑制率=[C-(S-B)]/C×100%。
式中:C为未加蝉花多糖提取液对照组的吸光度;B为空白对照组的吸光度;S为添加蝉花多糖提取液试验组的吸光度。
1.7 蝉花多糖的抑菌试验
1.7.1 蝉花多糖对细菌的抑菌作用 在超净工作台中,将灭菌后的培养基趁热倒入培养皿中,待其凝固后,用移液枪吸取 0.1 mL大肠杆菌或枯草芽孢杆菌悬液于平板上,用涂布器涂布均匀。用打孔器在上述平板中心的四角对称位置,打上大小一致、直径为6 mm的4个小孔,分别加入大肠杆菌、枯草芽孢杆菌、抗生素(阳性对照)和无菌水(阴性对照)。将上述平板于25 ℃培养箱中黑暗培养3~4 d,取出观察抑菌效果。endprint
1.7.2 蝉花多糖对真菌的抑菌作用 在超净台中,用无菌打孔器在培养基平板中心及其四角对称位置,打上4个直径为6 mm的小孔。平板中心放入链格孢属菌块,其余4孔分别设为加入0.1 mL无菌水的空白对照、0.1 mL蝉花多糖的试验组2组和0.1 mL抗真菌药咪康唑的阳性对照。将上述平板于25 ℃培养箱中黑暗培养3~4 d,取出观察抑菌效果。
2 结果与分析
2.1 蝉花菌株的分离
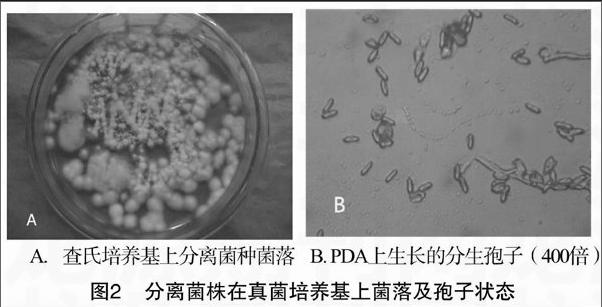
将经蝉花组织块接种到PDA培养基上,经多次分离纯化培养得到单菌落,并在显微镜下观察菌落特点。蝉花分离初期菌落在PDA培养基上,菌落致密,浅黄色,菌落白色其上布满白色孢子粉(图2-A)。分生孢子显微镜下观察呈短柱形(图2-B)。
2.2 蝉花菌株ITS区段基因分子鉴定
本试验中采用ITS1、ITS2引物对蝉花基因组DNA进行ITS区段扩增,PCR扩增结果如图2。PCR扩增出的条带十分明亮,条带大小在500~750 bp之间,符合ITS1-5.8S-ITS2理论大小,将胶切割,回收,连接载体,转化后摇菌挑斑,送上海生工生物工程股份有限公司测序。测序结果在NCBI上比对,下载相邻种属ITS序列。
经Clustal X1.83软件对测序结果和从GenBank中搜索到的相似序列进行对位排列,并辅以人工校对,系统发育分析采用MEGA4中的邻近相邻法(neighbor-joining;NJ)构建、分析,各分支的置信度经bootstrap 1 000次循环检验各分支的系统学意义与可靠性。结合GenBank上的9个虫草有关序列进行了系统发育树构建。分枝统计支持率评估采用Bootstrap法,自展值为1 000。由图4可知,所有序列形成2个大的分支,分离的蝉花菌种与被孢霉属(Mortierella sp.)以及拟青霉属(Paecilomyces)、蝉花(Cordyceps sobolifera)构成了一个大的分支。与虫草属(Cordyceps)相似度达到95%,暂命名为 JR_cds1。
2.3 蝉花主要活性成分
虫草素、腺苷、虫草酸和多糖等含量是评价虫草类的主要质量指标。表1为蝉花JR_cds1主要成分含量,其中虫草素含量达3.437 mg/g,在所有虫草类产品中最高。
表1 蝉花菌株JR_cds1主要成分含量
成分 含量(mg/g)
虫草素 3.437
腺苷 1.251
虫草酸 57.75
多糖 9.514
2.4 蝉花多糖抗氧化活性
2.4.1 对DPPH自由基的清除率 DPPH自由基是一种人工合成的稳定自由基,被广泛用于评价抗氧化物质清除自由基的活性。维生素C是一种抗氧化活性高的还原剂,维生素C常作为抗氧化活性的阳性对照。由图5中可以看出,随着多糖浓度增加,对DPPH自由基清除率也越大。当多糖浓度为10 mg/mL时其清除率达到88.1 %,接近维生素C的清除率。表明蝉花多糖有良好的清除自由基作用。
2.4.2 蝉花多糖总还原能力 一般来说,物质还原能力越强,其抗氧化活性也越高。以维生素C作为阳性对照,蝉花JR_cds1多糖的总还原能力随着多糖浓度的增加而提高,总还原能力与多糖浓度呈正相关关系。
2.4.3 蝉花多糖对Fe2+的螯合能力 一些过渡金属离子如Fe2+等极容易通过Fenton反应产生羟自由基,触发一系列脂质过氧化反应,而螯合剂则通过螯合这些过渡金属离子来抑制氧化反应。因此, 对金属离子螯合能力的测定是评价其抗
氧化活性的一项重要指标[12]。EDTA是常用的螯合剂,常作为阳性对照。由图7可知,当多糖浓度为2~4 mg/mL时随着多糖浓度的增加,亚铁离子螯合率随之快速提高;随着多糖浓度的提高其螯合率增加幅度趋缓;当多糖浓度为 10 mg/mL 时,其螯合率达到54.2 %。
2.4.4 蝉花多糖对ACE的抑制率 血管紧张素转换酶(ACE)可水解血管紧张素Ⅰ羧基端二肽,产生使血压上升的物质——血管紧张素Ⅱ,还可以切除降血压活性物质缓激肽的羧基端二肽,使之失活,因此通过抑制ACE活性即可实现降低血压之目的。目前已有大量抑制ACE活性的天然产物被发现,如食源性的黄酮类芸香苷和黄连素等[13]。本试验研究了蝉花多糖对ACE活性的抑制作用,图8显示,蝉花多糖对ACE活性有较好的抑制作用。随着多糖浓度的增加,其抑制效果逐渐提高,当多糖浓度为30 mg/mL时,其抑制率超过80%。
2.5 蝉花多糖的抑菌试验
2.5.1 蝉花多糖的抑菌作用 试验比较了革兰氏阴性菌大肠杆菌(G-)和革兰氏阳性菌枯草芽孢杆菌(G+)与蝉花多糖共培养时的生长效果。由图9-A可以看出,蝉花多糖对大肠杆菌有抑制作用,图中孔1、孔2(蝉花多糖)周围有明显抑菌圈,虽然没有阳性对照青霉素明显,但相对无菌水而
言,效果显著。图9-B中3为氯霉素,作为抑制枯草芽孢杆菌的阳性对照,孔1、孔2(蝉花多糖)周围的细菌明显比阴性对照组(无菌水)稀少,表现出一定的抑菌性。
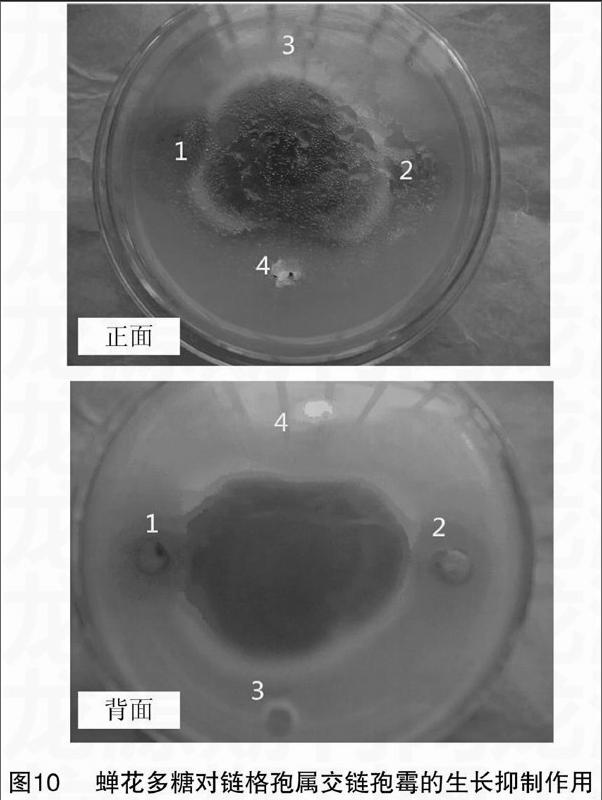
2.5.2 蝉花多糖对链格孢属交链孢霉的抑菌作用 试验以31.7 mg/mL的多糖浓度与链格孢属交链孢霉共培养,图10为真菌生长培养皿的正面图和背面图。中央为接种的交链孢霉菌块,在距其中心点2 cm的上、下、左、右处分别用无菌打孔器打孔。设抗真菌药物咪康唑为阳性对照(孔4),无菌水为阴性对照(孔3),孔1和孔2为蝉花多糖。图10 显示,菌丝向孔3(无菌水对照)方向生长不受限制,呈弧形;而菌丝向孔1、孔2和孔4方向生长受到明显抑制,形成一个弯弧形,孔4阳性对照与其他试验组差异显著,表明蝉花多糖对交链孢霉的生长具有显著的抑制作用。
3 分析与讨论endprint
据报道,蝉拟青霉的寄主有7种,即竹蝉(Platylomia pieli)、山蝉(Cicada flammata)、蟪蛄(Platyleura kaempferi)、云南黑蝉(Cicadatra shaluensis)、草蝉(Mogannia conica)、小鸣蝉(Oncotympana ella)和透翅蝉(Hyalessa ronsnana),多分布在中国南方诸省。竹蝉常见于毛竹产区, 是蝉拟青霉的重要寄
主。此虫6年1代,每代5龄,常年生活在土壤中,以老龄若虫最易感病。在气温18~24 ℃,相对湿度大于80%的温暖湿润季节,在浅土层活动的老龄若虫接触带菌的土壤发生感染。到翌年6、7月份,温湿度合适,发病死亡虫体前端长出浅黄色或蛋黄色孢梗束,突破表土,伸向地面,形成蝉花[14]。在江苏句容茅山地区生长着竹林的丘陵地带(海拔80~200 m),地势平缓,土质疏松,湿度较大,地面覆盖有枯枝落叶层,是竹蝉活动的主要林地。
真菌基因组DNA包含着一些非编码基因,如信号序列、间隔序列,无功能序列。这些基因在结构、功能和变异程度上差异很大,是真菌在分子水平上研究的良好区段[15]。其中rDNA ITS序列由于片段小、易于扩增,在真菌形态不同的种间甚至同种的分离菌株间存在高度的差异,因此常用于属内种间或种内群体的比较分析[16]。有报道基于ITS序列的分析比较,从不同地理来源的蝉花上分离出C.cicadae 和 L. fungicola,说明寄生于蝉若虫并形成蝉花的真菌有2种甚至多种,与蛹虫草及其无性型同轮枝菌属具有密切的关系[17]。本试验中分离的菌株为被孢霉属(Mortierella),与虫草属(Cordyceps)构成了2个相近的分支。可以推测:寄生真菌表型特征的趋同现象、基因水平上的多样性是寄生真菌为适应寄主而产生的结果[17]。由此可见,本研究分离得到的1株虫草属真菌极可能是蝉花菌种的某一无性型菌株。张传博等从江苏省句容市天王镇磨盘山分离到1株金蝉花,鉴定为大蝉草,也属虫草属,命名为磨盘山金蝉虫草[18],该菌株的形态特征与本研究分离的虫草属JR_cds1相似,是否为同一菌属还有待进一步鉴定。
蝉花含有与冬虫夏草相似或一致的活性物质如虫草素、腺苷、多糖及虫草酸等。本研究显示,蝉花中虫草素的含量(3.437 mg/g)显著高于蛹虫草(2.83 mg/g)和冬虫夏草(003 mg/g),腺苷含量(1.251 mg/g)接近冬虫夏草 (0.48 mg/g) 的3倍[6,19],提示蝉花有较高的营养价值,具有开发利用前景。
多糖为免疫调节剂,具有多种生物学活性。本试验研究了蝉花多糖的抗氧化和抑制血管紧张素转换酶(ACE)的活性。结果显示,蝉花多糖具有较好的清除DPPH自由基能力,一定的总还原能力和对Fe2+ 的螯合能力。其对Fe2+ 的螯合能力与Wu等研究的蛹虫草多糖结果[20]相近。有报道称,能清除DPPH自由基的物质与其抑制脂质过氧化能力呈一定的正相关,因此DPPH自由基体系适用于评价天然产物的抗氧化性[21]。王吉标等研究了蝉花多糖水提物,结果显示,在相同的浓度下,金蝉花正丁醇部位和多糖的总抗氧化性能较强,仅次于维生素C[22],说明蝉花多糖的确有较好的抗氧化性。但不同的提取方法会影响测得的结果。
翁梁采用比浊法研究了野生蝉花多糖与人工蝉花多糖对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑制作用,显示蝉花多糖对大肠杆菌的抑制作用最为明显,且抑菌效果与多糖浓度成正比[23]。本试验蝉花多糖对大肠杆菌、枯草芽孢杆菌有抑菌作用的结果与之吻合。此外,本研究结果还显示,蝉花多糖对真菌的抑制效果明显优于对细菌的抑制效果(图10)。多糖抑制微生物生长的作用机制尚不清楚。有报道认为,杯牛漆多糖对大肠杆菌的抑制作用是通过抑制细胞黏附来实现的[24];而紫萁多糖广谱抗菌性是因为多糖溶解形成的胶体溶液能在细胞表面或胶体表面形成保护层[25]。蝉花多糖的抑菌作用机制有待深入研究。
参考文献:
[1]程东庆,丁志山,林美爱,等. 蝉花真菌的分离及液体发酵培养[J]. 中药材,2006,29(2):99-101.
[2]官宗华,宋玉良,滕 晔,等. 金蝉花菌种的分离和培养[J]. 内蒙古中医药,2012,31(18):34.
[3]刘爱英,胡海燕,罗 力,等. 蝉花及其分离真菌的形态多样性(摘要)[C]//2008全国药用真菌学术研讨会论文集.中国菌物学会药用真菌专业委员会、中国药学会药用真菌专业组,2008:45-46.
[4]李小定,荣建华,吴谋成. 真菌多糖生物活性研究进展[J]. 食用菌学报,2002,9(4):50-58.
[5]郭 澄,朱 杰,张 纯,等. 高效液相色谱法测定人工虫草菌丝中腺苷和虫草素的含量[J]. 中国中药杂志,1998,23(4):44-45,64.
[6]朱雅红,桂仲争. 蛹虫草液体菌种通气发酵培养及其营养成分分析[J]. 食品与生物技术学报,2009,28(5):699-704.
[7]葛 新,白小红,李云兰.分光光度法测定蛹草D-甘露醇的含量[J]. 山西医科大学学报,2001,32(4):317-318.
[8]Luo W Z M,Rao G. Identification of bioactive compounds in Phyllenthus emblica L. fruit and their free radical scavenging activities[J]. Food Chemistry,2009,114(2):499-504.
[9]Tsais Y,Huang S J,Mau J L. Antioxidant properties of hot water extracts from Agrocybe cylindracea[J]. Food Chemistry,2006,98:670-677.endprint
[10]Decker E A,Welch B. Role of ferritin as a lipid oxidation catalyst in muscle food[J]. Journal of Agricultural and Food Chemistry,1990,38:674-677.
[11]Jia J M H,He R. The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J]. Food Chemistry,2010,119(1):336-342.
[12]Park D S,Kim K T,Park Y J,et al. PCR-based sensitive detection of wood-decaying fungus Phellinus linteus by specific primer from rDNA ITS regions[J]. Formerly the Korean Journal of Mycology,2001,29(1):7-10.
[13]刘艳伟,任子旭,方 银,等. 桑枝皮提取物抑制血管紧张素转换酶活性的提取工艺优化[J]. 蚕业科学,2014,40(3):499-504.
[14]肖建辉,梁宗琦,刘爱英. 虫草无性型及其相关真菌多糖的研究开发现状[J]. 药学学报,2002,37(7):589-592.
[15]Sánchez-Ballesteros J G V,Peláez F. Phylogenetic study of Hypoxylon and related genera based on ribosomal ITS sequences[J]. Mycologia,2000,92:964-977.
[16]朱有勇,王云月,Lyon B. 大丽轮枝菌核糖体基因ITS区段的特异扩增[J]. 植物病理学报,1999,29(3):250-255.
[17]Obornik M,Jirku M,Dolezel D. Phylogeny of mitosporic entomopathogenic fungi:is the genus Paecilomyces polyphyletic?[J]. Canadian Journal of Microbiology,2001,47(9):813-819.
[18]张传博,王艳丽,易 萌,等. 江苏省天王镇磨盘山金蝉花分离菌株鉴定及系统发育分析[J]. 广东农业科学,2013,40(15):152-154,封4.
[19]桂仲争,滕国琴,贾俊强,等. 蛹虫草食药用开发价值[J]. 中国食物与营养,2012,18(3):70-73.
[20]Wu F Y,Hui Y,Ma X N,et al. Comparison of the structural characterization and biological activity of acidic polysaccharides from Cordyceps militaris cultured with different media[J]. World Journal of Microbiology and Biotechnology,2012,28(5):2029-2038.
[21]Kim S Y K J,Jung M. Y.antioxidant activities of selected oriental herb extracts[J]. Journal of the American Oil Chemists Society,1994,71(6):633-640.
[22]王吉标,欧阳臻,赵 明,等. 响应面分析法优化金蝉花多糖的提取工艺[J]. 天然产物研究与开发,2014(3):438-443.
[23]翁 梁. 野生蝉花与人工蝉花多糖的提取及抑菌试验[J]. 农业科技与装备,2010(11):22-24,29.
[24]马宝瑕,陈 新,邓军娥. 中药多糖研究进展[J]. 中国医院药学杂志,2003,23(6):42-44.
[25]罗娅君,杨葵华. 药用蕨类植物多糖研究进展[J]. 绵阳师范学院学报,2008,27(11):71-74.endprint

