导数光谱法快速测定蚕蛹中的多糖含量
吴海燕+袁秋梅
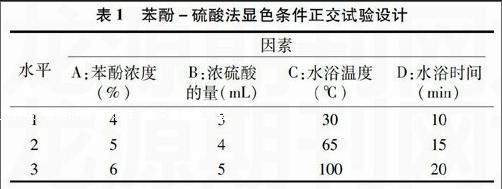
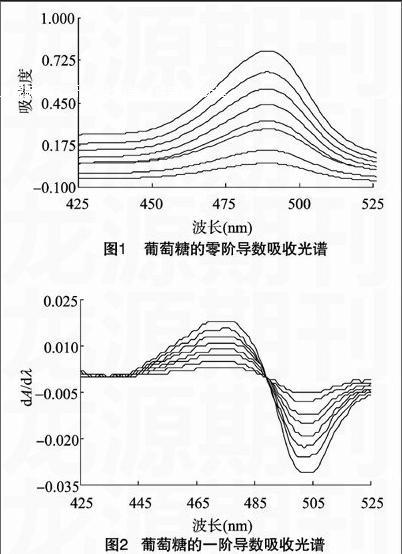

摘要:在425~525 nm波长范围内,扫描多糖-苯酚-硫酸显色反应体系零阶及一阶导数光谱图,发现一阶导数光谱的波峰与波谷间距值与多糖含量成正比。在一阶导数光谱图中,以波峰-波谷间距为纵坐标、以葡萄糖浓度为横坐标,求得标准曲线回归方程,建立了苯酚-硫酸显色导数光谱测定蚕蛹多糖的方法。该测定方法的相对标准偏差为3.08%,平均回收率在99.46%~101.54%;显色体系在120 min中稳定性好,测定的准确度、精密度高,可以用于蚕蛹中多糖含量的测定。
关键词:多糖-苯酚-硫酸显色反应;导数光谱;蚕蛹多糖;正交试验
中图分类号: S131+.2;R284.2 文献标志码: A
文章编号:1002-1302(2015)04-0309-03
收稿日期:2014-06-03
基金项目:江苏省教育厅“青蓝工程”资助项目(编号:201423);江苏省南通市农村科技创新及产业化项目(编号:HL2012025)。
作者简介:吴海燕(1978—),女,江苏南通人,副教授,主要从事食品综合利用、食品安全检测的研究。E-mail:why022@126.com。
蚕蛹为蚕蛹科昆虫家蚕的蛹,具有生津止咳、消食理气等作用,为药膳同源传统中药材,具有很高的营养和药用价值。蚕蛹多糖是蚕蛹中的主要活性成分之一[1-2]。近年来研究表明,蚕蛹多糖具有明显增强机体免疫功能的作用[3-6]。
目前蚕蛹多糖的测定方法广泛采用苯酚-硫酸法,此法虽简单、快速、无需多糖纯品和高级仪器,但要求被测溶液本身无颜色或颜色较淡[7],而且由于蚕蛹本身有一定的颜色,会对测定产生较大干扰。因此蚕蛹在测定前一般要经过脱色或其他处理,费时费力,容易产生较大误差;另外,蚕蛹多糖结构比较复杂,仅仅用葡萄糖作为标准品不能精确反映多糖含量。
导数光谱又称微分光谱,是将吸收光谱进行数学变换,得到关于波长的微分系数(dA/dλ)对波长(λ)的导数光谱图,属于紫外吸收光谱派生的1个分支[8]。对于复杂的多组分物质,导数光谱可不经分离而直接检测,方法简便、快速、准确、灵敏;导数光谱法对重叠谱带及平坦谱带的分辨率高、噪声低,能从重叠的吸收光谱中分离出各自的吸收峰,并能分别进行定量,可排除杂质和颜色的干扰[9-10]。因此导数光谱法近年来在食品、药品鉴别分析测定领域得到迅速发展和广泛应用[11-14]。本试验采用一阶导数光谱法测定蚕蛹多糖含量,以期为蚕蛹多糖的开发利用和工业化生产提供试验依据。
1 材料与方法
1.1 主要试剂与材料
蚕蛹粉由南通福尔生物制品有限公司提供;葡萄糖、苯酚、浓硫酸、无水乙醇等试剂均为国产分析纯。
1.2 主要仪器与设备
TU-1901紫外-可见分光光度计,北京通用普析仪器有限责任公司;DZF-6020真空干燥箱,上海精宏实验设备有限公司;SHA-C数显水浴恒温振荡器,金坛市精达仪器制造厂;RE-52AA旋转蒸发器,上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 多糖的提取 称取5 g脱脂蚕蛹粉末,加入100 mL蒸馏水,在功率为500 W的超声波中提取30 min,过滤,滤液为粗多糖提取液。
1.3.2 多糖的测定
1.3.2.1 线性关系分析 精确量取0、0.10、0.20、0.30、040、0.50、0.60、0.70、0.80 mL 0.1mg/mL葡萄糖溶液,分别置于10 mL干燥比色管中,加蒸馏水至体积为1.00 mL,加入 0.50 mL 一定浓度的精制苯酚溶液,混匀后迅速加入浓H2SO4,放置于水浴锅中加热一定时间,取出冷却至室温。用TU-1901紫外-可见分光光度计在420~550 nm波长范围内扫描,记录葡萄糖的零阶和一阶导数吸收光谱,以一阶导数光谱中波峰与波谷间距对葡萄糖含量进行直线回归。
1.3.2.2 样品的测定 将蚕蛹多糖提取液定容至250 mL,取10 mL提取液定容至100 mL待测,精确吸取待测液 100 mL 置于10 mL干燥比色管中,按“1.3.2.1”节方法绘制零阶和一阶导数吸收光谱。将一阶导数光谱中波峰与波谷间距值代入直线回归曲线,求得样品的多糖含量。
1.3.3 苯酚-硫酸法的显色条件优化 以苯酚浓度(A)、浓硫酸用量(B)、水浴温度(C)、水浴时间(D)为考察因素,每个因素各取3个水平,按L9(34)正交表设计试验确定苯酚-硫酸法显色的最优试验条件,详见表1。
表1 苯酚-硫酸法显色条件正交试验设计
水平
因素
A:苯酚浓度
(%) B:浓硫酸
的量(mL) C:水浴温度
(℃) D:水浴时间
(min)
1 4 3 30 10
2 5 4 65 15
3 6 5 100 20
1.3.4 精密度试验 取6份同一批次的脱脂蚕蛹样品,按照“1.3.1”节的方法进行多糖的提取,提取后的每份试样按照“1.3.2.2”节的方法求得的一阶导数光谱中波峰与波谷间距值,测定蚕蛹多糖含量来确定方法的精密度。
1.3.5 回收率试验 精确称取5 g蚕蛹样品,加入葡萄糖标准品,分别制备添加量为4、8、16 mg/g的样品,每个添加量均测定6个平行样,按“1.3.1”节的方法提取后,按“1.3.2”节的方法测定多糖含量,计算多糖的回收率。
1.3.6 稳定性试验 精确称取适量多糖样品,按照“1.3.1”节的方法进行多糖的提取,按“1.3.2”节的方法显色后每隔30 min测定其一阶光谱导数值的波峰与波谷间的间距值变化。endprint
2 结果与分析
2.1 导数光谱试验
取葡萄糖对照品、空白溶液、蚕蛹多糖提取液,分别在420~550 nm波长范围内扫描,记录葡萄糖的吸收光谱(图1);利用UVWin5.0软件对葡萄糖零阶吸收光谱求导,得到葡萄糖一阶导数光谱(图2)。一阶导数光谱在425~525 nm间波峰-波谷间距值(dA/dλ)与葡萄糖含量进行直线回归(图3),可见一阶导数光谱在425~525 nm间的dA/dλ与葡萄糖含量成正比,因此选择一阶导数光谱在425~525 nm间的波峰-波谷间距值作为定量的依据。
2.2 显色条件的选择
苯酚-硫酸法显色原理为:多糖类物质在硫酸作用下先水解成单糖分子,并迅速脱水成糖醛衍生物,糖醛衍生物再与酚性物质(如苯酚)络合成有色物质。试验发现,此有色物质的一阶导数光谱在425~525 nm间的波峰-波谷间距值定量效果最好。正交试验数据和极差分析结果见表2。
正交试验中极差的大小反映各个因素对测定指标影响程度,根据表2的极差分析可知,各因素对波峰-波谷间距值影
表2 苯酚-硫酸法显色条件正交试验结果的极差分析
编号 A:苯酚
浓度 B:浓硫酸
的量 C:水浴
温度 D:水浴
时间 dA/dλ
1 1 1 1 1 0.016
2 1 2 2 2 0.032
3 1 3 3 3 0.023
4 2 1 1 3 0.023
5 2 2 3 1 0.021
6 2 3 1 2 0.028
7 3 1 3 2 0.036
8 3 2 1 3 0.032
9 3 3 2 1 0.032
k1 0.024 0.025 0.025 0.023
k2 0.024 0.028 0.029 0.032
k3 0.033 0.028 0.027 0.026
R 0.009 0.003 0.004 0.009
注:dA/dλ为一阶导数光谱在425~525 nm间的波峰与波谷间距值。
响程度为:A= D>C>B,苯酚-硫酸法的最佳显色条件为 A3B2C2D2组合,即苯酚的浓度为6%,浓硫酸的用量为4 mL,水浴温度65 ℃,水浴时间为15 min。
2.3 标准曲线
以葡萄糖一阶导数吸收光谱在425~525 nm 间的波峰-波谷间距(dA/dλ)为纵坐标、葡萄糖含量(m)为横坐标求得标准曲线(图3),回归方程为:dA/dλ=0.582 1m+0.001 4,r2=0.998 2。结果表明,葡萄糖浓度在1.81~14.55 μg/mL范围内呈良好的线性关系。
2.4 精密度试验
蚕蛹多糖含量的精密度试验相对标准偏差为3.08%,表明采取一阶导数光谱法测定蚕蛹中多糖含量的方法重现性较好。精密度试验结果见表3。
表3 精密度试验结果
蚕蛹样品 蚕蛹多糖含量(mg/g)
平行样1 20.271
平行样2 21.130
平行样3 21.130
平行样4 20.271
平行样5 21.989
平行样6 21.130
平均值 20.987
精密度RSD 3.08%
2.5 回收率试验
回收率试验结果表明,添加量为4 mg/g的样品,平均回收率为99.46%,RSD值为2.82%;添加量为8 mg/g的样品,平均回收率为101.54%,RSD值为2.38%;添加量为16 mg/g的样品,平均回收率为101.25%,RSD值为2.05%,表明采用一阶导数光谱法测定蚕蛹中多糖含量的方法准确可靠,符合定量分析的准确度要求。多糖的回收率结果见表4。
表4 回收率试验结果
样品
序号 样品中含
量(mg/g) 加标量
(mg/g) 测定值
(mg/g) 回收率
(%) RSD值
(%)
1 20.987 4 24.566 98.31
2 20.987 4 25.425 101.75
3 20.987 4 24.566 98.31
4 20.987 4 23.707 94.87
5 20.987 4 25.425 101.75
6 20.987 4 25.425 101.75
1~6平均 99.46 2.82
7 20.987 8 29.720 102.53
8 20.987 8 28.861 99.57
9 20.987 8 28.861 99.57
10 20.987 8 28.861 99.57
11 20.987 8 29.720 102.53
12 20.987 8 30.579 105.49
7~12平均 101.54 2.38
13 20.987 16 36.592 98.93
14 20.987 16 38.310 103.57
15 20.987 16 38.310 103.57
16 20.987 16 37.451 101.25
17 20.987 16 37.451 101.25endprint
18 20.987 16 36.592 98.93
13~18平均 101.25 2.05
2.6 稳定性试验
表5稳定性试验结果表明,蚕蛹多糖一阶导数光谱的波峰与波谷间距值在显色后30 min达到最大,在120 min内基本稳定,RSD值为2.72%。
表5 稳定性试验结果
时间(min) dA/dλ
0 0.026
30 0.027
60 0.026
90 0.026
120 0.025
150 0.021
3 结论
导数光谱法测定多糖能消除背景颜色的干扰,可以使蚕蛹多糖不经脱色处理直接测定,提高了测定准确度,避免了由于脱色导致多糖的损失。
本试验利用一阶导数光谱法测定蚕蛹多糖含量。通过试验优化最佳显色条件为:苯酚的浓度为6%,浓硫酸的用量为4 mL,水浴温度为65 ℃,水浴时间为15 min。显色反应体系的一阶导数光谱值与多糖含量成正比,回归方程为:dA/dλ=0.582 1m+0.001 4,r2=0.998 2。测定方法的相对标准偏差为3.08%,平均回收率在99.46%~101.54%之间,显色体系在120 min中稳定性好,测定的准确度和精密度高,可以用于蚕蛹中多糖含量的测定。
参考文献:
[1]藏其中,万淑莹,何光星,等. 蚕蛹多糖的分离和分析[J]. 中成药,1992,14(3):35-36.
[2]刘 静,徐 立,黄先智. 蚕蛹的生物活性成分及药理作用研究进展[J]. 食品科学,2012(17):303-307.
[3]Zhang M,Haga A,Sekiguchi H,et al. Structure of insect chitin isolated from beetle larva cuticle and silkworm(Bombyx Mori)pupa exuvia[J]. International Journal of Biological Macromolecules,2000,27(1):99-105.
[4]黄林清,周世文,张诗平,等. 蚕蛹多糖对小鼠免疫功能的影响[J]. 解放军药学学报,2002,18(1):11-13.
[5]孙 龙,冯 颖,何 钊,等. 蚕蛹多糖的碱液提取及免疫活性初步研究[J]. 林业科学研究,2007,20(6):782-786.
[6]王国基,殷伟芬,王 俊,等. 蚕蛹多糖对小鼠免疫功能的影响[J]. 江苏大学学报:医学版,2007,17(5):373-375.
[7]伍善广,赖泰君,孙建华,等. 蚕蛹多糖脱蛋白方法研究[J]. 食品科学,2011,32(14):21-24.
[8]Sánchez R F,Bosch O C. Recent development in derivative ultraviolet/visible absorption spectrophotometry:2004—2008:a review[J]. Analytica Chimica Acta,2009,635(1):22-44.
[9]苟许雁,杨 圣,王亚军.紫外可见分光光度计的双向导数光谱法[J]. 分析测试学报,2010,29(7):675-679.
[10]El-Sayed A A,El-Salem N A.Recent developments of derivative spectrophotometry and their analytical applications[J]. Analytical Sciences,2005,21(6):595-614.
[11]耿 霞,梁 冰,梁玉祥,等. 苯酚-硫酸导数光谱法快速测定中药中多糖的研究[J]. 四川大学学报:工程科学版,2002,34(3):62-64.
[12]陈悦娇,马应丹,谢武珊. 导数光谱法快速测定食用菌多糖[J]. 食品与发酵工业,2004,30(6):108-111.
[13]Karljikovic-Rajic K,Novovic D,Marinkovic V,et al. First-order UV-derivative spectrophotometry in the analysis of omeprazole and pantoprazole sodium salt and corresponding impurities[J]. Journal of Pharmaceutical and Biomedical Analysis,2003,32(4/5):1019-1027.
[14]Din E,Yücesoy C,Onur F. Simultaneous spectrophotometric determination of mefenamic acid and paracetamol in a pharmaceutical preparation using ratio spectra derivative spectrophotometry and chemometric methods[J]. Journal of Pharmaceutical and Biomedical Analysis,2002,28(6):1091-1100.endprint

