金纳米颗粒在食品抗氧化能力评价中的检测应用
马滔+马小媛+王周平
摘要:选取没食子酸、咖啡酸、原儿茶酸、阿魏酸、香草酸5种酚酸化合物和康师傅东方树叶、农夫山泉水溶C100这2种茶饮料作为还原剂,诱导金纳米颗粒的生长,并利用分光光度计测定所形成金纳米颗粒的吸光度,以评价各试验物质的抗氧化能力。结果表明,5种酚酸化合物抗氧化能力从强到弱依次为没食子酸>咖啡酸>原儿茶酸>香草酸>阿魏酸;2种茶饮料抗氧化能力从强到弱依次为农夫山泉水溶C100>康师傅东方树叶绿茶。通过与传统清除2,2-二苯基-1-苦基肼自由基(DPPH·)水平以评价抗氧化能力的方法相比,基于金纳米材料检测抗氧化剂抗氧化能力的方法准确可靠、操作简单、响应迅速,值得推广应用。
关键词:金纳米颗粒;抗氧化能力;酚酸化合物;DPPH·
中图分类号: TS201.2 文献标志码: A
文章编号:1002-1302(2015)04-0282-04
收稿日期:2014-05-16
基金项目:国家自然科学基金(编号:21375049);国家科技支撑计划(编号:2012BAK08B01);江苏省科技支撑计划(编号:BE2012614)。
作者简介:马 滔(1992—),女,陕西宝鸡人,从事食品安全检测研究。E-mail:ch_matao@163.com。
通信作者:马小媛(1983—),女,江苏南京人,博士,副教授,从事食品安全检测研究。E-mail:maxy@jiangnan.edu.cn。
生物体系中的氧化与抗氧化系统失衡会导致氧化应激,具有抗氧化能力的物质能有效抵御氧化应激的有害损伤。食品中的抗氧化剂日益引起人们的关注,对饮食中潜在的抗氧化剂及其抗氧化能力实现简单、可靠、快速的检测变得尤为重要。传统的抗氧化能力检测方法主要包括清除生物体内活性氧/活性氮自由基、清除非生物体内稳定自由基和总还原能力检测等,如检测ROO·、H2O2、ONOO—清除能力等[1-4],这些检测方法大多基于化学试剂和化学反应,在实际应用中存在危害人体健康、破坏生态环境等问题而受到诸多限制。随着纳米科技的兴起与发展,纳米材料以其特有的物理、化学性质在生物学、化学、免疫学等领域展现出广阔的应用前景,纳米材料应用于食品功能评价正快速发展。Jiang等利用硒化镉量子点(CdSe QDs)的电化学发光效应研发出一种检测HO·清除能力的方法[5];Kim等于2005年提出一种利用包埋有辣根过氧化物酶的聚合物小球评价细胞内氧化应激水平的光学纳米传感方法[6]。
酚酸是非常重要的天然抗氧化剂,属苯丙素类化合物,多为对羟基苯甲酸和对羟基苯丙烯酸(肉桂酸)的衍生物,如没食子酸(C7H6O5)、咖啡酸(C9H8O4)、原儿茶酸(C7H6O)、阿魏酸(C10H10O4)、香草酸(C8H8O4)等,广泛存在于植物体内。研究表明,酚酸类成分具有抗血栓、抗动脉粥样硬化、抗肿瘤、抗病毒、抗菌保肝等多种生物活性。Soobrattee等采用Trolox等价抗氧化能力、铁离子还原抗氧化及次氯酸盐清除能力等抗氧化测定体系,对酚酸的抗氧化进行评定,结果表明,酚酸具有较强的抗氧化能力,是良好的抗氧化剂;对活性氧自由基具有清除作用,可用DPPH·法定性测定不同酚酸的抗氧化性能力[7]。
本研究采用没食子酸、咖啡酸、原儿茶酸、阿魏酸、香草酸等系列酚酸化合物及东方树叶绿茶、水溶C100这2种茶饮料诱导金纳米生长,利用金纳米颗粒独特的光学性质,产生规律性变化的紫外-可见-近红外吸收峰,根据吸收峰的变化来比较酚酸化合物及茶饮料的抗氧化能力,并与传统的清除DPPH·自由基检测方法进行较,以期建立一种基于金纳米材料检测抗氧化剂抗氧化能力的方法。
1 材料与方法
1.1 主要仪器
UV-1800PC分光光度计,日本岛津公司生产;DK-S22电热恒温水浴锅;BS124S分析天平;透射电子显微镜(TEM)。
1.2 试剂与材料
没食子酸、咖啡酸、原儿茶酸、阿魏酸、香草酸、十六烷基三甲基溴化铵(C19H42NBr)、氯金酸(HAuCl4)、柠檬酸钠(C6H5Na3O7)、水合磷酸二氢钠(NaH2PO4·H2O)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、维生素C(C6H8O6)、2,2-二苯基-1-苦基肼自由基(DPPH·),均购于阿拉丁试剂公司;康师傅东方树叶绿茶、农夫山泉水溶C100,均购于大型超市。
1.3 维生素C还原纳米金颗粒标准当量测定
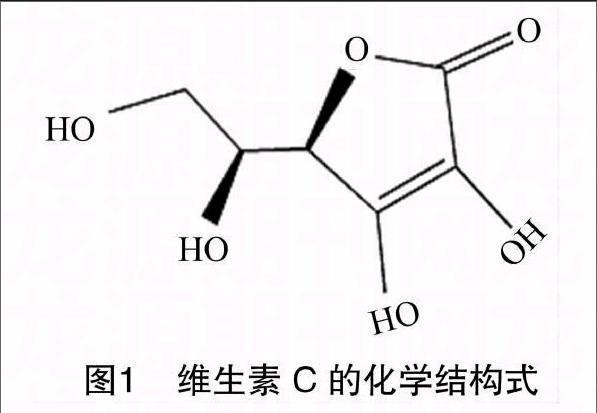
1.3.1 试验原理 维生素C(图1)能抗坏血病,广泛存在于新鲜水果蔬菜及许多生物中,作为一种高活性物质参与新陈代谢过程,是一种强抗氧化剂,能还原Au(Ⅲ)形成金纳米颗粒。由于金纳米颗粒大小及形貌的变化,使其局域表面等离激元共振吸收峰产生规律性变化。因此,可以选择维生素C作为标准样剂,并作为当量与其他物质反应结果进行比对。
1.3.2 试验步骤 准确称取维生素C标准品17.612 g,溶解定容至100 mL,摇匀,配制成1 mol/L维生素C标准液;将标准液分别稀释成0.000 1、0.001、0.01、0.1、1 mol/L的样液,分别取0.5 mL样液,加入到含有100 μL 10 mmol/L AuCl-4、600 μL 3.7 mmol/L CTAB、300 μL 0.2 mmol/L柠檬酸钠、3.5 mL 0.12 mol/L pH值为 8.0磷酸缓冲液中, 混匀; 45 ℃
水浴10 min,取出,放至室温,均质后测定350~700 nm 的紫外吸收光度。
1.4 酚酸类化合物还原纳米金颗粒
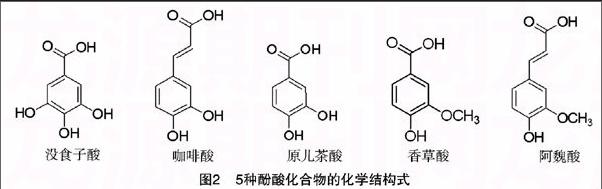
1.4.1 试验原理 酚酸化合物(图2)由于苯环上酚羟基的还原性,在溶液中不需要金种子的催化即能还原Au(Ⅲ)形成金纳米颗粒,其光学吸收强度与酚酸类物质的抗氧化能力呈正相关[8]。endprint
1.4.2 试验步骤 把100 μL 10 mmol/L HAuCl4、600 μL 3.7 mmol/L CTAB和300 μL 0.2 mmol/L柠檬酸钠连续加入到3.5 mL 0.12 mol/L 磷酸缓冲液(pH值为 8.0)中,混匀;取0.5 mL 0.01 mol/L试验样品加入混合液中,45 ℃ 水浴 10 min;将混合物迅速移出,冷却至室温,均质后测定350~700 nm的紫外吸光度[9]。以0.5 mL超纯水代替0.5 mL待测样品作为对照。
1.5 DPPH·自由基法测定酚酸类物质抗氧化性
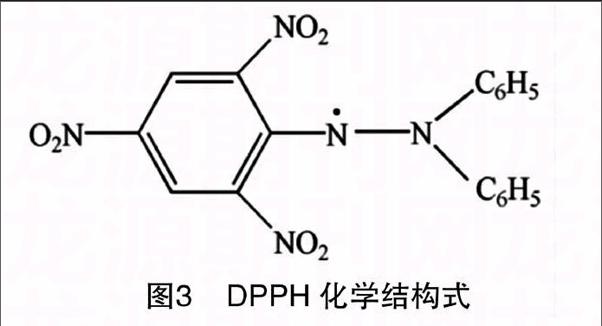
1.5.1 试验原理 DPPH·是一种商业化的非常稳定的自由基,含苯环结构(图3),其乙醇溶液显紫色,在515 nm处有强烈的光学吸收,且吸收峰位置相对稳定。抗氧化剂是一种常见的自由基清除剂,清除能力基于抗氧化剂结构上的特性,包括羟基中O—H 键解离能、抗氧化剂失去电子形成苯氧自由基的键共振解离能及芳环上取代基团的空间位阻效应。清除化学反应的方程式为:DPPH·+PheOH→DPPHH+[PheO(Ⅰ)、PhO(Ⅱ)、PhO(Ⅲ)…],其中,(Ⅰ)、(Ⅱ)、(Ⅲ)为不同的共振结构,并基于以下理论终止反应:DPPH·+DPPH·→DPPH-DPPH、DPPH·+PheO·→DPPH-PheO、PheO·+PheO·→PheO-PheO,从而决定各种抗氧化剂清除 DPPH·水平的大小[10]。
1.5.2 试验步骤 称取0.004 g DPPH·溶于100 mL无水乙醇中,得0.101 4 mmol/L的DPPH·乙醇溶液;分别取 0.05 mL 不同浓度的抗氧化剂待测物乙醇溶液加入到 3.95 mL 0.101 4 mmol/L DPPH·乙醇溶液中,用分光光度计每隔一段时间检测其UV-vis-NIR吸收光谱并记录,直到反应液的吸光度保持相对稳定、不再变化为止。
2 结果与分析
2.1 不同浓度维生素C诱导金纳米颗粒的生长
由图4可见,不同浓度维生素C与氯金酸反应后,在500~600 nm处出现强烈的吸收峰,并且随着浓度的增加,吸收峰强度越来越高,这说明维生素C的抗氧化性能力与吸收峰的峰值有相关性。维生素C具有较强的还原性,会诱导氯金酸溶液生成金纳米颗粒,并产生特殊光学效应。因待测液浓度均为0.01 mol/L,所以选择0.01 mol/L,此时维生素C诱导生成金纳米颗粒的最大吸光度作为标准单位,与其他待测液进行比较(图5)。
2.2 不同酚酸化合物诱导纳米金的生长
由图6可以看出,5种酚酸中,没食子酸紫外吸收峰强度最大,对应的反应溶液颜色也最深,呈深紫红色,其后依次为咖啡酸、原儿茶酸、香草酸和阿魏酸。在弱碱介质下,酚酸形成的相应苯氧自由基的亲核性会影响酚酸抗氧化能力,并通过共振或分子内氢键而稳定。羧酸基团是常见的吸电子基团,能通过降低芳香环的电子密度来稳定苯氧自由基;
—CHCH—COOH 连接在苯环上,通过共振提高苯氧自由
基的稳定性而提高供氢能力[11]。根据5种酚酸化合物的结构式可知,没食子含有3个酚羟基和1个羧基,其失电子后结构最为稳定;咖啡酸含2个酚羟基和1个—CHCH—COOH,原儿茶酸含2个酚羟基和1个羧基,其酚羟基数量均比没食子酸少,则失氢能力弱于没食子酸;香草酸和阿魏酸都只含有1个酚羟基,还原性最弱。把5种酚酸物质的最大吸光度与 0.01 mol/L 的维生素C进行比对,没食子酸相当于1.12倍维生素C,咖啡酸相当于0.76倍维生素C,香草酸相当于0456倍维生素C,阿魏酸相当于0.313倍维生素C。
由图8可见,没食子酸还原出的金纳米颗粒最多,其次是原儿茶酸,最后是阿魏酸。结合5种酚酸物质诱导金纳米颗粒的紫外光谱及结构分析,可知5种酚酸物质的抗氧化性能依次为:没食子酸>咖啡酸>原儿茶酸>香草酸>阿魏酸。
2.3 酚酸化合物对DPPH·清除能力的评价
由图9、图10可见,加入抗氧化待测物后的最初几分钟内,峰强度迅速降低,峰位置不变,这表明反应体系内 DPPH· 被部分清除,并且清除速率较快;随着反应的继续进行,峰强度降低的速率逐渐减慢,并保持相对稳定的水平。
以加入反应体系的抗氧化剂与DPPH·的相对量(摩尔比)为横坐标,以不同浓度抗氧化剂清除DPPH·后反应体系内的剩余DPPH·量作为纵坐标作曲线(图11-A);同样,以加入反应体系的抗氧化剂与DPPH·的相对量(摩尔比)为横坐标,以不同浓度抗氧化剂清除DPPH·后反应体系达到稳定水平所需要的时间作为纵坐标作曲线(图11-B)。取剩余量为50%时的浓度为IC50值,将抗氧化剂浓度为 IC50值时所对应的反应时间定义为TIC50,将DPPH·的清除能力定义为AE=1/(IC50TIC50)。AE和1/IC50可反映抗氧化剂清除DPPH·的能力,数值大小反映酚酸化合物清除DPPH·能力的强弱。
由表1可见, 没食子酸清除的DPPH·能力最强,其次是咖啡酸、原儿茶酸、水溶C100、东方树叶绿茶、香草酸,阿魏酸最弱。对DPPH·自由基清除能力的检测作为一种传统的抗氧化能力检测法,被广泛用于各种抗氧化剂抗氧化能力的表征,其中,DPPH·是一种人工合成、稳定的商业自由基,试验操作简单、数据可靠。试验结果表明,5种酚酸物质对DPPH·的清除能力与基于GNPs生长过程的纳米材料光学检测法所得结果一致。
2.4 实际样品诱导纳米金颗粒生长
水溶C100中含有维生素C,东方树叶绿茶中含茶多酚,2种物质均能够诱导金纳米颗粒生长。由图12、图13可见,以0.01 mol/L的维生素C作为当量,水溶C100相当于0.587倍
表1 5种酚酸物质和2种茶饮料清除DPPH·自由基的能力endprint
物质 IC50 1/IC50 TIC50
(min) AE
(mmol/mol) 反应情况
没食子酸 0.015 66.667 10.2 6 600.667 快,迅速
咖啡酸 0.126 7.937 13.4 999.938 快,较迅速
原儿茶酸 0.238 4.200 36.7 114.487 较快,中速
香草酸 48.439 0.020 6 44.1 0.468 慢,低速
阿魏酸 76.316 0.013 1 51.4 0.255 慢,低速
东方树叶 0.289 3.745 38.8 93.529 较快,中速
水溶C100 0.267 3.460 37.2 96.016 较快,中速
维生素C,东方树叶绿茶相当于0.567倍维生素C。由表1可见,根据AE值,2种茶饮料还原性从强到弱为水溶C100>东方树叶绿茶。
3 结论
本试验通过不同浓度的维生素C与氯金酸相互作用生成金纳米颗粒,采用分光光度法测定生成金纳米颗粒的吸光度,表明抗氧化剂的抗氧化性与吸光度之间存在着正相关关系。采用相同的方法,用5种不同的酚酸化合物和2种饮料与氯金酸相互作用,测定其吸光度,以表征7种不同物质的抗氧化能力,结果表明,酚酸化合物还原能力从强到弱依次为没食子酸>咖啡酸>原儿茶酸>香草酸>阿魏酸,2种茶饮料抗氧化能力从强到弱依次为水溶C100>东方树叶绿茶。通过与传统清除DPPH·水平评价抗氧化能力的方法相比,证实应用金纳米颗粒测定抗氧化剂抗氧化能力的方法可靠、准确、简单、快速,具有广阔的实际应用前景。
参考文献:
[1]Laguerre M,Lecomte J,Villeneuve P. Evaluation of the ability of antioxidants to counteract lipid oxidation:existing methods,new trends and challenges[J]. Progress in Lipid Research,2007,46(5):244-282.
[2]Roginsky V,Lissi E A. Review of methods to determine chain-breaking antioxidant activity in food[J]. Food Chemistry,2005,92(2):235-254.
[3]Pazdzioch-Czochra M,Widenska A. Spectrofluorimetric determination of hydrogen peroxide scavenging activity[J]. Analytica Chimica Acta,2002,452(2):177-184.
[4]Whiteman M,Halliwell B. Protection against peroxynitrite-dependent tyrosine nitration and alpha 1-antiproteinase inactivation by ascorbic acid. A comparison with other biological antioxidants[J]. Free Radical Research,1996,25(3):275-283.
[5]Jiang H,Ju H X. Electrochemiluminescence sensors for scavengers of hydroxyl radical based on its annihilation in CdSe quantum dots film/peroxide system[J]. Analytical Chemistry,2007,79(17):6690-6696.
[6]Kim S H,Kim B,Yadavalli V K,et al. Encapsulation of enzymes within polymer spheres to create optical nanosensors for oxidative stress[J]. Analytical Chemistry,2005,77(21):6828-6833.
[7]Soobrattee M A,Neergheen V S,Luximon-Ramma A,et al. Phenolics as potential antioxidant therapeutic agents:mechanism and actions[J]. Mutation Research,2005,579(1/2):200-213.
[8]Robbins R J. Phenolic acids in foods:an overview of analytical methodology[J]. Journal of Agricultural and Food Chemistry,2003,51(10):2866-2887.
[9]Ordoudi S A,Tsimidou M Z. Crocin bleaching assay(CBA)in structure-radical scavenging activity studies of selected phenolic compounds[J]. Journal of Agricultural and Food Chemistry,2006,54(25):9347-9356.
[10]Brand-Williams W,Cuvelier M E,Berset C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25-30.
[11]Cai Y Z,Luo Q,Corke H. Structure-radical scavenging activity relationships of phenolic compounds from traditional Chinese medicinal plants[J]. Life Sciences,2006,78(25):2872-2888.endprint

