菊花中绿原酸超声提取工艺与测定方法研究
司超+姚晓芹+贺学礼+楚建周


摘要:采用正交试验,考察提取显色条件对药用菊花中绿原酸提取与测定的影响。结果表明,菊花中绿原酸提取测定最优方法为用80%甲醇作提取剂,超声提取30 min,加0.02 mol/L FeCl3 0.5 mL进行显色反应,静置30 min后在分光光度计755 nm波长下测定吸光度,该方法简单、准确、灵敏、重复性强,可用于菊花中绿原酸的提取测定。
关键词:菊花;绿原酸;超声提取;分光光度法
中图分类号: R284.2 文献标志码: A
文章编号:1002-1302(2015)04-0264-03
收稿日期:2014-05-09
基金项目:国家自然科学基金(编号:31300321);河北省自然科学基金(编号:C2012201080);河北大学大学生科技创新项目(编号:2013080)。
作者简介:司 超(1985—),女,山东滕州人,硕士研究生,主要从事药用植物次生代谢研究。E-mail:sisi19851204@163.com。
通信作者:姚晓芹,博士,副教授,主要从事药用植物次生代谢、植物逆境生理研究。E-mail:yaoxiao301@126.com。
菊花为多年生菊科草本植物,以头状花序入药,是我国传统中药,主要功效有散风清热、平肝明目、解毒、降压等,主治风热感冒、头痛眩晕、目赤肿痛、明目昏花等症[1]。绿原酸是菊花主要的活性成分,它是植物体在有氧呼吸过程中合成的一种苯丙素类物质,具有清除自由基、抗菌消炎、抗病毒、降糖、降脂、保肝利胆等多种功效[2-3]。目前,提取药用植物中绿原酸采用的方法主要有超高压提取法、热回流法、溶剂浸提法、酶解法、微波辅助萃取法、超声提取法等[4-7]。绿原酸含量测定方法主要有高效液相色谱法、高效毛细管电泳法、紫外分光光度法等[8-10]。有学者利用可见分光光度法测定绿原酸含量,该方法主要是利用绿原酸能与FeCl3进行特殊的显色反应来测定植物中绿原酸含量,具有原理简单、仪器常见、成本低等优点[11]。笔者在前人研究的基础上对超声提取、显色条件进行深入研究,进一步完善采用可见分光光度法快速测定植物中绿原酸含量的方法。
1 材料与方法
1.1 仪器与试剂
主要仪器:722型可见分光光度计(上海舜宇恒平科学仪器有限公司),240W PS-40A型数控超声波清洗器(深圳市康洁洗净电器有限公司)。主要试剂:标准绿原酸(纯度95%,阿拉丁试剂上海有限公司)、FeCl3溶液、甲醇、乙醇。笔者所在实验室种植的怀菊,将菊花头状花序在105 ℃下杀青30 min,55~60 ℃下烘干至恒质量,粉碎、过筛,混匀备用。
1.2 超声波提取条件优化
1.2.1 提取溶剂 用60%甲醇、60%乙醇进行提取溶剂试验,比较不同提取剂对绿原酸提取效果的影响。取0.3 g干样,分别加入15 mL 60%甲醇、15 mL 60%乙醇溶液,超声提取30 min,过滤后用提取溶剂定容至25 mL刻度管内;取1 mL上述溶液加4 mL提取溶剂,置于10 mL刻度管中,加0.5 mL 0.02 mol/L FeCl3溶液(分别用60%甲醇、60%乙醇配制)振荡摇匀后静置60 min,用722型分光光度计于755 nm波长下进行比色,确定最佳提取溶剂。
1.2.2 提取容器 选择等容积的烧杯、锥形瓶、塑料瓶、试管进行试验,提取溶剂为60%甲醇溶液,提取方法、测定步骤同“1.2.1”节,比较提取容器对绿原酸提取效果的影响。
1.2.3 浸泡时间 用甲醇提取液分别浸泡样品0、3、6、12、18、24 h后进行超声提取,测定方法同“1.2.1”节,比较浸泡时间对绿原酸提取效果的影响。
1.2.4 提取时间 用甲醇提取液分别超声提取样品10、20、30、40、50、60 min,测定方法同“1.2.1”节,比较超声提取时间对绿原酸提取效果的影响。
1.2.5 提取次数 用甲醇提取液分别经超声波提取样品1、2、3、4次,每次时间10 min,每次加入最佳提取溶剂5 mL,提取完成后合并每次的提取液,过滤并定容,测定方法同“1.2.1”节,比较提取次数对绿原酸提取效果的影响。
1.2.6 提取溶剂浓度 分别用20%、40%、60%、80%、100%甲醇溶液提取样品,其他条件为已选出的最佳条件,测定方法同“1.2.1”节方法,比较不同浓度甲醇提取液对绿原酸提取效果的影响。
1.3 显色条件优化
配制0.01、0.02、0.03 mol/L FeCl3-甲醇显色溶液,显色时分别在样品液中加入0.5、1.0 mL进行试验,提取条件采用“1.2”节的优化条件。
1.4 正交试验
在提取、显色条件优化试验结果基础上设计正交试验,选出最优水平组合。选取对测定结果影响较大的2个因素,即提取剂浓度、显色剂用量进行正交试验。
1.5 标准溶液的配制
准确称取绿原酸对照品10 mg,加入最佳提取溶剂溶解并定容至50 mL,制成200 μg/mL标准液。在7个10 mL刻度管内分别加入0、1、2、3、4、5、6 mL标准贮备液,用80%甲醇稀释至标线,分别制成0、20、40、60、80、100、120 μg/mL标准液。按“1.3”节优化结果进行显色、测定。
2 结果与分析
2.1 超声波提取条件优化
2.1.1 提取溶剂对绿原酸提取效果的影响 绿原酸是由咖啡酸与奎尼酸形成的酯,分子结构中有酯键、不饱和双键、多元酚3个不稳定部分,可以利用甲醇、丙酮、乙醇等极性溶剂从植物中提取出来。笔者分别以甲醇、乙醇为提取溶剂进行试验,试验过程中发现,以乙醇为提取剂在显示过程中容易出现沉淀,因此下面其他优化试验都用甲醇作为提取溶剂。endprint
2.1.2 提取容器对绿原酸提取效果的影响 由表1可知,试管提取效果最佳,另外,利用试管作为提取容器操作更方便。因此,本试验选用试管作为提取容器。
表1 不同容器对绿原酸提取效果的影响
容器 D755nm
烧 杯 0.188±0.005b
锥形瓶 0.181±0.007ab
塑料瓶 0.189±0.009ab
试 管 0.211±0.004a
注:同列数据后标有不同小写字母表示差异显著(P<0.05)。下表同。
2.1.3 样品浸泡时间、提取时间、提取次数对绿原酸提取效果的影响 由表2至表4可知,浸泡时间、提取时间、提取次数3个因素对绿原酸提取没有显著影响,因此选择不浸泡,超声提取1次,提取时间为30 min。
2.1.4 提取溶剂浓度对绿原酸提取效果的影响 由表5可知,甲醇浓度对菊花中绿原酸的提取效果有显著影响。提取
表2 浸泡时间对绿原酸提取效果的影响
浸泡时间(h) D755 nm
24 0.157±0.009b
18 0.162±0.004ab
12 0.166±0.002ab
6 0.168±0.003ab
3 0.167±0.003ab
0 0.178±0.003a
表3 提取时间对绿原酸提取效果的影响
提取时间(min) D755 nm
60 0.213±0.002a
50 0.192±0.011a
40 0.195±0.008a
30 0.202±0.003a
20 0.184±0.010a
10 0.205±0.006a
表4 提取次数对绿原酸提取效果的影响
提取次数(次) D755 nm
4 0.189±0.002a
3 0.183±0.002a
2 0.163±0.004b
1 0.160±0.007b
液吸光度随甲醇浓度的增加而增大。当甲醇浓度≤60%时,提取液吸光度随着浓度的增加变化比较剧烈,当甲醇浓度>60%时,提取液吸光度变化比较平缓,并且80%、100%甲醇处理对绿原酸的提取效果差异不显著。
表5 提取溶剂浓度对绿原酸提取效果的影响
甲醇浓度(%) D755 nm
20 0.028±0.003d
40 0.078±0.006c
60 0.195±0.004b
80 0.218±0.000a
100 0.222±0.003a
2.2 显色条件优化
表6表明,当显色剂浓度为0.01 mol/L、用量为0.5 mL时,样品产生沉淀,这可能是因为FeCl3含量不足;当显色剂浓度为0.02 mol/L、用量为0.5 mL时,吸光度最大;当显色剂浓度为0.03 mol/L时,吸光度显著降低。
表6 显色剂浓度及用量对绿原酸提取效果的影响
显色剂浓度
(mol/L) 显色剂用量
(mL) D755 nm
0.01 0.5 0(沉淀)
1.0 0.165±0.004b
0.02 0.5 0.182±0.004a
1.0 0.101±0.002d
0.03 0.5 0.136±0.003c
1.0 0.077±0.001e
2.3 正交试验结果
选取对绿原酸提取、显色影响明显的因子进行正交试验。以提取剂浓度、0.02 mol/L显色剂FeCl3的用量为考察因素,设计正交试验 (表7、表8)。由此可知,最优水平组合为A2B2,即甲醇浓度80%,显色剂用量0.5 mL。
表7 正交试验因素水平
水平
因素
A:提取剂浓度(%) B:显色剂用量(mL)
1 60 0.25
2 80 0.50
3 100 0.75
4 1.00
表8 正交试验结果与极差分析
序号
因素水平
A:提取剂浓度 B:显色剂用量
吸光度
1 1 1 0(沉淀)
2 1 2 0.206±0.001d
3 1 3 0.170±0.002e
4 1 4 0.154±0.002f
5 2 1 0.269±0.004a
6 2 2 0.239±0.003b
7 2 3 0.224±0.002c
8 2 4 0.217±0.003c
9 3 1 0.240±0.004b
10 3 2 0.239±0.003b
11 3 3 0.240±0.004b
12 3 4 0.237±0.005b
k1 0.177 0.127
k2 0.316 0.171
k3 0.319 0.159
k4 0.152
极差R 0.142 0.044
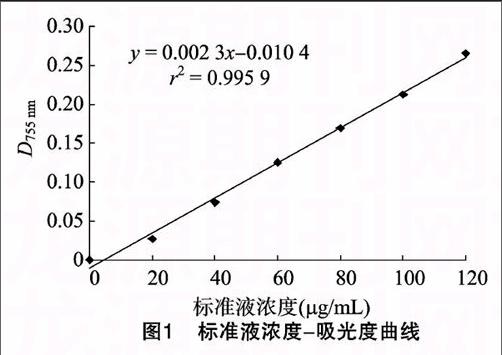
2.4 标准曲线
取不同浓度标准液5 mL,加入显色剂FeCl3-甲醇溶液0.25 mL充分振荡,静置30 min后于波长755 nm下比色,以80%甲醇加显色剂作参比调零。以吸光度为纵坐标、相对应的绿原酸浓度为横坐标绘制标准曲线,回归方程为y=0.002 3x-0.010 4,r2=0.995 9(图1)。endprint
2.5 加标回收率
称取菊花干样粉末6份,每份0.3 g,按正交试验筛选出的最优条件进行提取,取6支试管,分别加入提取液0.5 mL、60 μg/mL标液0.5 mL,定容至5 mL,加0.25 mL显色剂进行显色,利用分光光度分析加标率直接计算数学模型[12],得出平均回收率为100.83%。
2.6 精密度
对120 μg/mL标准溶液连续测定20次,测得样品中绿原酸吸光度RSD值为0.22%,符合相关规定,表明试验精密度很好。
2.7 重复性
称取5份样品,每份0.3 g,按照优化条件进行提取测定。经计算RSD值为1.10%,表明试验重复性符合有关规定。
3 结论
与常规提取方法相比,超声波提取法具有操作简单、溶剂用量少、提取时间短、对环境污染小、被提取活性物质不易被破坏、提取率较高等优点[13]。酚类物质与FeCl3发生显色反应,能够用来检验酚羟基的存在,并对绿原酸进行简单快速的定量分析[14]。本试验综合考虑了与测定相关的提取及显色因子,结果表明,菊花中绿原酸提取测定最优方法为用80%甲醇作提取剂,超声提取30 min,加0.02 mol/L FeCl3 0.5 mL 进行显色反应,静置30 min后,在可见分光光度计 755 nm 波长下测定吸光度。本方法成本低、简便易操作、精密度好、重复性强,可用于菊花中绿原酸的提取测定。
参考文献:
[1]江苏新医学院. 中药大辞典[M]. 上海:上海科学技术出版社,1979.
[2]李永霞. 湖北产不同品种菊花中绿原酸的含量测定[J]. 湖北中医杂志,2006,28(2):48-49.
[3]陈绍华,王亚琴,罗立新. 天然产物绿原酸的研究进展[J]. 食品科技,2008,33(2):195-199.
[4]秦 霞,靳学远,刘 红. 菊花中绿原酸的超高压提取工艺研究[J]. 湖北农业科学,2010,49(9):2215-2217.
[5]符 玲,毕跃峰,田新慧,等. 野菊花中绿原酸的不同提取工艺比较[J]. 郑州大学学报:医学版,2010,45(3):499-501.
[6]李跃中,纵 伟,董海丽. 超声辅助提取菊花中绿原酸的工艺研究[J]. 安徽农学通报,2008,14(9):194,56.
[7]凌伫怡,王 娟,沈平孃. 野菊花中绿原酸的微波辅助萃取研究[J]. 中草药,2008,39(1):60-62.
[8]刘 放,陈冰冰,吴小平. HPLC法测定菊花中绿原酸的含量[J]. 西北药学杂志,2010,25(5):350-352.
[9]乌 兰,张泽生. 金银花中绿原酸的提取及检测[J]. 食品科学,2005,26(6):130-134.
[10]易昌华,贺建华. 紫外分光光度法测定中草药提取物中绿原酸的含量[J]. 兽药与饲料添加剂,2004,9(1):24-25.
[11]徐寿昌. 有机化学[M]. 北京:高等教育出版社,1982.
[12]黄彩海,李合义,王彩金. 分光光度分析加标回收率直接计算的数学模型研究[J]. 中国环境监测,1999,15(1):46-47.
[13]童保云,马 文. 超声提取烟草中绿原酸的工艺研究[J]. 安徽化工,2009,35(5):18-20.
[14]张秋芳,刘 波,史 怀,等. 金银花中绿原酸的快速测定方法[J]. 福建医科大学学报,2006,40(4):398-401.endprint

