大豆幼苗中葡萄糖—6—磷酸脱氢酶对干旱胁迫的生理响应
王华华+黄俊骏+杨丽丹


摘要:以2种抗旱性不同的大豆品种(ZD11、YD24)为试验材料,用聚乙二醇(PEG)模拟干旱胁迫条件,探讨不同干旱胁迫条件下葡萄糖-6-磷酸脱氢酶(G6PDH)活性的动态变化及其在抗旱性中的可能作用。结果显示,干旱胁迫增强了2种大豆品种中G6PDH的活性,而且抗旱品种YD24比对照品种ZD11提高的幅度大,提示了G6PDH可能参与了大豆的抗旱性响应;进一步研究结果显示,G6PDH抑制剂处理进一步提高了干旱胁迫下大豆根中相对电导率、丙二醛含量;另外,G6PDH抑制剂处理进一步抑制了主根的生长以及侧根的数量。这些结果表明,干旱胁迫下G6PDH在增强大豆的抗旱性中可能起着重要的作用。
关键词:大豆;干旱胁迫;葡萄糖-6-磷酸脱氢酶;抗旱机制;抗旱性
中图分类号: S565.101;Q946.5 文献标志码: A
文章编号:1002-1302(2015)04-0102-03
收稿日期:2014-04-25
基金项目:国家自然科学基金(编号:U1204305);河南省基础与前沿技术研究项目(编号:132300410455);河南省教育厅科学技术研究重点项目(编号:13A180515);河南师范大学博士启动课题(编号:11126、11129)。
作者简介:王华华(1980—),男,湖北汉川人,博士,副教授,主要从事植物逆境生理研究。E-mail:hhwang04@163.com。
干旱是目前制约植物生长和农作物产量的主要逆境因素之一,已成为农作物生产上长期存在的主要非生物胁迫因素,严重影响了农作物的产量和质量[1]。在我国,尤其是干旱和半干旱地区,缺水问题一直是限制农业生产的最主要因素之一,即使是降水较多的地区也普遍存在季节性和非周期性干旱问题,因此了解干旱胁迫下作物的抗性有着重要的意义。戊糖磷酸途径(PPP)是葡萄糖降解的1个主要代谢途径,其产生的大量还原型辅酶Ⅱ(NADPH)可以为生物合成提供主要的还原力,其中间代谢物亦可为许多生物合成提供原料[2]。葡萄糖-6-磷酸脱氢酶(G6PDH,分类号EC1.1.1.49)是PPP的关键酶,也是限速酶,在植物中广泛存在。有研究表明,PPP参与了植物生长发育的调节和环境胁迫响应,如营养饥饿、盐胁迫、金属胁迫、病原菌侵染等[3-5]。虽然现有的研究结果表明,植物G6PDH参与了多种环境胁迫的应答,但是干旱胁迫下大豆中的G6PDH对干旱胁迫的响应及其调节作用仍然不清楚。本研究以2种抗旱性强弱不同的大豆品种(ZD11、YD24)为试验材料,探讨了干旱胁迫下G6PDH活性的动态变化过程及其在抗旱性中的可能作用,以期为进一步揭示干旱胁迫下大豆的抗旱机制以及培育抗旱品种提供线索。
1 材料与方法
1.1 供试材料
供试大豆(Glycine max)品种为抗旱性弱的周豆11(ZD11,对照)和抗旱性强的豫豆24(YD24),大豆种子由河南省周口市农业科学院提供。
1.2 材料培养
挑选大小一致的大豆种子,用5%次氯酸钠消毒15 min后,用自来水反复冲洗干净,放入水中浸泡2 h,使种子充分吸胀,然后将种子于恒温箱内25 ℃黑暗条件下萌发2 d。挑选萌发一致的大豆种子,将其种在放有蛭石的托盘内,并用1/4 Hoagland溶液浇灌。培养条件:温度25 ℃,14 h光周期,光照度150 μmol(m2·s),相对湿度控制在70%。
1.3 材料处理
用聚乙二醇(PEG)6000模拟干旱胁迫处理,将萌发后的种子取出、洗净后转移到盛有不同浓度PEG(0、3%、6%、9%、12%、15%)、25 mmol/L氨基葡萄糖-6-磷酸(GN6P)的溶液中进行不同处理。处理一定时间后收集大豆主根,用于各项指标的测定。
1.4 测定方法
处理完成后收集大豆幼苗的主根用于各项指标的测定。G6PDH提取及活性的测定参照Esposito等的方法[6],G6PDH的活性根据NADPH产生的速率来测定;相对电导率、丙二醛(MDA)含量测定参照Wang等的方法[7];主根长度、侧根数量的测定采用相机对处理后的大豆根部进行拍照记录,其中根长用ImageJ软件进行分析,每个处理至少分析30条根,所测指标均选用大豆的主根为试验材料,测定时至少重复3次,取平均值。
2 结果与分析
2.1 不同干旱胁迫水平对G6PDH活性的影响
如图1所示,用不同浓度PEG(0~15%)处理大豆24 h,随着PEG浓度的增加,2种大豆根中G6PDH活性均表现出先增加后降低的趋势,对照品种ZD11在9%PEG处理下达到最大值,与对照(PEG浓度为0)相比增加了82.7%;抗旱品种YD24在12%PEG处理下达到最大值,与对照(PEG浓度为0)相比增加了117.9%,且抗旱品种YD24的G6PDH活性始终比抗旱性较弱品种ZD11高。从表形上看,用15% PEG处理时,ZD11植株表现出明显的萎蔫现象,而YD24则无明显萎蔫现象。根据以上试验结果,后续试验选定中等胁迫程度(9% PEG)作为干旱胁迫处理的浓度。
为了进一步查明干旱胁迫下大豆根中G6PDH活性的动态变化过程,本试验检测了干旱胁迫下G6PDH活性变化的时间过程。如图2所示,在正常营养液培养条件下,2个大豆品种中的G6PDH活性差异并不明显(即处理开始时);但在干旱胁迫条件下,随着处理时间的延长,ZD11、YD24根中G6PDH活性均表现为先上升后下降,其中ZD11品种在处理36 h时达到最大值,与对照(处理开始时)相比增加了1238%;YD24品种则在处理48 h时达到最大值,与对照(处理开始时)相比增加了166.3%;随着处理时间的进一步延长,G6PDH活性有所下降,但仍比对照的高,且抗旱性品种YD24在各个时间点的G6PDH活性均要高于抗旱性较弱品种ZD11,表明在干旱条件下,抗旱性品种YD24可能通过提高G6PDH的活性来抵御干旱胁迫对大豆植株造成的伤害。
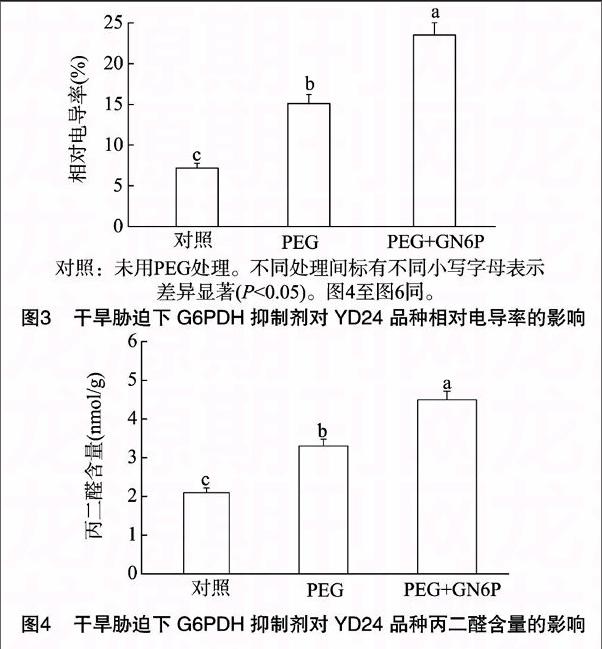
2.2 干旱胁迫下G6PDH抑制剂对相对电导率、丙二醛含量的影响
相对电导率、丙二醛含量是反映植物受伤害程度常用的
2个重要指标[8]。为了进一步证实干旱胁迫下大豆根中G6PDH活性的增加与植物抗旱性有关,本试验运用G6PDH抑制剂处理,检测干旱胁迫下YD24大豆品种中相对电导率、丙二醛含量的变化情况。如图3、图4所示,干旱胁迫(9% PEG)处理48 h明显提高了大豆根中相对电导率、丙二醛含量,分别比对照(未用PEG处理)增加了109.2%、57.1%;干旱胁迫条件下,用G6PDH抑制剂氨基葡萄糖-6-磷酸(GN6P)处理,使得大豆根中相对电导率、丙二醛含量均进一步明显提高,分别增加了55.6%、36.4%,说明抑制G6PDH活性会加剧大豆植株遭受干旱胁迫所造成的氧化伤害程度,表明大豆幼苗通过增加G6PDH活性来抵抗干旱胁迫环境,避免植株遭受严重的氧化伤害,从而达到增强植株对干旱耐受性的目的。
2.3 干旱胁迫下G6PDH抑制剂对主根生长、侧根数量的影响
根系是植物感受干旱胁迫信号的主要位点,土壤中水分的含量直接影响根系的发育[9]。为了进一步查明大豆根中G6PDH在植物抗旱性中的调节作用,本试验运用G6PDH抑制剂处理,检测了干旱胁迫下YD24大豆品种中主根长度和侧根数量的变化情况。如图5、图6所示,干旱胁迫(9% PEG)处理48 h明显抑制了主根生长、侧根数量,分别比对照降低了22.6%、30.3%;G6PDH抑制剂GN6P处理进一步抑制了干旱胁迫条件下主根生长和侧根数量,与干旱胁迫相比分别降低了47.9%、33.0%。这些结果表明,干旱胁迫下G6PDH参与调节了大豆根的生长发育过程。
3 讨论与结论
干旱胁迫条件会引起植物细胞质膜的损伤、细胞内容物的损伤、色素的破坏、自由基的增加等,最终导致细胞内的氧化还原平衡的变化,使细胞遭到氧化伤害。然而,为了维持细胞的氧化还原平衡及正常的生理生化状态,细胞会做出适应性反应,如细胞内超氧化物歧化酶、过氧化物酶、过氧化氢酶的活性增加以消除自由基,维持细胞内的氧化还原平衡;另外还会产生1种对干旱胁迫的适应性反应,就是增加还原力,还原力的产生离不开磷酸戊糖途径的主要调节酶G6PDH[10]。
本研究结果表明,随着干旱胁迫程度的增加和胁迫时间的延长,2种大豆品种根中G6PDH活性均表现出先增加后降低的趋势,可能是随着干旱胁迫程度加重,植物体受到的氧化伤害更严重,导致G6PDH活性开始下降,其维持细胞氧化还原能力的减弱不足以抵消氧化破坏的能力,植株就可能呈负增长状态。干旱胁迫下加入G6PDH抑制剂GN6P处理,大豆根中相对电导率、丙二醛含量均进一步增加也证明了这点。G6PDH被抑制可使得遭受干旱胁迫的植株氧化伤害程度加剧,表明G6PDH参与了大豆抗旱性的调节。
为了进一步探讨G6PDH在大豆抗旱性中的调节作用,本试验检测了G6PDH对大豆主根生长和侧根数量的影响。植物对环境特别是水分因子变化的响应主要通过根系进行,植物为了适应环境,提高竞争效率,吸收较多的养分和水分,根系表现出明显的可塑性[11]。由于根的伸长使植物从土壤中吸收到水分,因此根对干旱逆境的不同反应通常被认为是作物对干旱条件的适应性指标。Hoecker等认为,增加根长是增大根系吸收表面积的有效途径[12];然而Gullo等更加强调侧根的作用,植物的主根数基本固定,但侧根数量不受限制,水分胁迫条件下,植物可通过各级侧根的加速分生和分枝而进行补偿生长,提高根吸收表面积[13]。本试验发现,在干旱胁迫条件下,大豆主根生长和侧根数量均受到显著抑制,G6PDH抑制剂GN6P处理则进一步增加了这种抑制效果,表明G6PDH增强大豆的抗旱性可能是通过调节大豆根系的生长发育来实现的。然而,对于G6PDH调节根系发育的机理还有待进一步的深入研究。
参考文献:
[1]Chen T H,Murata N. Enhancement of tolerance of abiotic stress by metabolic engineering of betaines and other compatible solutes[J]. Current Opinion in Plant Biology,2002,5(3):250-257.
[2]Kruger N J,von Schaewen A. The oxidative pentose phosphate pathway:structure and organisation[J]. Current Opinion in Plant Biology,2003,6(3):236-246.
[3]Wang X M,Ma Y Y,Huang C H,et al. Glucose-6-phosphate dehydrogenase plays a central role in modulating reduced glutathione levels in reed callus under salt stress[J]. Planta,2008,227(3):611-623.
[4]Scharte J,Schn H,Tjaden Z,et al. Isoenzyme replacement of glucose-6-phosphate dehydrogenase in the cytosol improves stress tolerance in plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(19):8061-8066.
[5]Asai S,Yoshioka M,Nomura H,et al. A plastidic glucose-6-phosphate dehydrogenase is responsible for hypersensitive response cell death and reactive oxygen species production[J]. Journal of General Plant Pathology,2011,77(3):152-162.
[6]Esposito S,Carfagna S,Massaro G,et al.Glucose-6-phosphate dehydrogenase in barley roots:kinetic properties and localisation of the isoforms[J].Planta,2001,212(4):627-634.
[7]Wang H H,Liang W H,Huang J J. Putrescine mediates aluminum tolerance in red kidney bean by modulating aluminum-induced oxidative stress[J]. Crop Science,2013,53(5):2120-2128.
[8]Sharma S S,Dietz K J. The significance of amino acids and amino acid-derived molecules in plant responses and adaptation to heavy metal stress[J]. Journal of Experimental Botany,2006,57(4):711-726.
[9]Seo P J,Xiang F,Qiao M,et al. The MYB96 transcription factor mediates abscisic acid signaling during drought stress response in Arabidopsis[J]. Plant Physiology,2009,151(1):275-289.
[10]黄 骥,王建飞,张红生. 植物戊糖磷酸途径及其两个关键酶的研究进展[J]. 植物学通报,2004,21(2):139-145.
[11]Grime J P,Campbell B D,Mackey J. Root plasticity,nitrogen capture and competitive ability.Plant root growth:an ecological perspective[M]. Oxford:Blackwell Scientific Press,1991:381-397.
[12]Hoecker N,Keller B,Piepho H P,et al. Manifestation of heterosis during early corn maize (Zea mays L.) root development[J]. Theoretical and Applied Genetics,2006,112(3):421-429.
[13]Gullo M A L,Nardini A,Salleo S,et al. Changes in root hydraulic conductance (KR) of Olea oleaster seedlings following drought stress and irrigation[J]. New Phytologist,1998,140(1):25-31.

