Ca对K缺乏下棉花根系生长的影响及与根系K、Ca、Mg、Na含量的关系
胡泽彬+王素芳+张志勇+王清连


摘要:通过水培法,在K缺乏条件下增施Ca,探讨Ca对棉花根系生长的恢复作用及与根系K、Ca、Mg和Na含量的关系。与2.5 mmol/L Ca相比,当Ca增加到52.5 mmol/L时,K缺乏条件下(0.05 mmol/L)根系中Ca、K和Na含量均显著下降,而Mg含量没有显著变化;根系长度和表面积可以恢复到和K正常条件下(2.5 mmol/L)的根系总长度和总表面积,不同直径根系的总长度均被显著恢复,并且细根(直径≤0.2 mm)增长幅度为85%,远大于中根和粗根(直径﹥0.45 mm)增长幅度(各为28%)。
关键词:棉花;根系;Ca;K
中图分类号: S562.01 文献标志码: A
文章编号:1002-1302(2015)04-0092-02
收稿日期:2014-05-20
基金项目:国家自然科学基金(编号:31271648);河南省杰出青年基金(编号:114100510008)。
作者简介:胡泽彬(1990—),男,河南内黄人,硕士研究生,主要从事棉花生理研究。E-mail:987429690@qq.com。
通信作者:张志勇,博士,副教授,主要从事棉花生理研究。E-mail:z_zy123@163.com。
K是植物生长所必需的一种大量元素,K缺乏抑制植物根系的生长和发育[1-3]。但K缺乏抑制不同植物根系生长发育的情况不一样,在拟南芥上K缺乏抑制了侧根长度,而对主根长度和侧根密度没有影响[1-2],在大豆上抑制了侧根长度、主根长度和侧根密度[2],在棉花上抑制了侧根和主根长度,但对侧根密度没有影响[4],这可能与研究时的培养条件、K缺乏程度等有关。Ca是植物正常生长所必需的大量元素之一,是植物生长和发育的关键调节元素[5]。Ca在细胞壁伸展、细胞膜稳定及功能方面发挥着十分重要的作用,并且Ca作为第二信使在细胞质的许多生化过程中发挥作用[6]。Ca可以减少Na的吸收,而提高K和Ca的吸收,从而缓解盐对植物生长的负面作用。因此,当植物面临盐胁迫时,Ca是一种十分重要的矿质营养[7]。但是,在K缺乏条件下,增加Ca对棉花根系生长及其K和Na的含量影响尚未见报道。因此,本研究在K缺乏条件下增施Ca,探讨该条件下Ca对棉花根系生长的影响及与根系K、Ca、Mg和Na含量的关系。
1 材料与方法
1.1 材料与培养条件
供试材料为国审棉品种百棉1号(河南科技学院培育)。培养室培养条件:光照/黑暗时间为14 h/10 h,光照度为 350 μmol/(m2·s),昼/夜温度为(30~33) ℃/(23~26) ℃。
挑选饱满的棉花种子,用9%的双氧水消毒30 min后,用去离子水将种子冲洗干净,置于装有湿润沙子的盆钵中萌发,上面用塑料薄膜覆盖,并打少量孔以利通气,待子叶长出后,揭除薄膜,喷清水保持湿润,萌发1 d后从盆钵将萌发的幼苗转移到调整好的营养液中。盛放营养液的容器规格:长×宽×高为20 cm×13 cm×15 cm,容器的外层用铝箔纸包裹,其上有钻孔泡沫定植板,棉花幼苗用海绵包茎固定于泡沫板的孔洞中。待移栽后,在水培条件下培养,每天连续通气。营养液组成为:2.5 mmol/L Ca(NO3)2,1 mmol/L MgSO4,0.5 mmol/L NaH2PO4,0.2 μmol/L CuSO4,1 μmol/L ZnSO4,01 mmol/L EDTAFeNa,0.02 mmol/L H3BO3,5 nmol/L (NH4)6Mo7O24,1 μmol/L MnSO4,以及不同浓度的KCl和CaCl2。K处理设2个水平:0.05、2.5 mmol/L KCl;2个K浓度下,Ca处理设3个水平:2.5、12.5、52.5 mmol/L CaCl2。
1.2 棉花幼苗干质量、根系形态、根系矿质元素含量测定
处理7 d后,选择大小、长势基本一致的幼苗,用于棉花幼苗根干质量、根系形态、矿质元素含量的测定。将整株幼苗的根系剪下,分散置于根系扫描盘中,利用根系扫描分析仪透扫,用根系分析软件(WinRhizo pro 2007)分析其根系总长、表面积、体积等。根据根系直径,将根系分为细根(直径≤0.2 mm)、中根(0.2﹤直径≤0.45 mm)和粗根(直径>0.45 mm)[3]。扫描后的根系在恒温烘箱中70 ℃下烘干后称质量。
将烘干后的棉花幼苗根系样品放入研钵中研磨,称取约0.1 g左右研磨后的棉花幼苗根系样品于样品瓶中,加入 10 mL 盐酸加盖拧紧,浸泡5 h后放置于振荡器上振荡(转速为150 r/min)30 min,过滤提取上清液。采用PE 2280原子吸收分光光度计测定溶液中K、Ca、Mg、Na的含量。
1.3 试验设计和统计分析
以培养盒为单位,1盒为1个重复。每处理设5次重复,每盆8株。每个处理取样重复6次。所有数据采用统计软件SAS 8.0 的SNK多重比较法进行方差分析。
2 结果与分析
2.1 不同K供应水平下Ca对棉花幼苗根系生长的影响
如表1所示,在低K供应水平下,和对照相比,10 mmol/L CaCl2处理对棉花幼苗根系干物质量以及根系总长度、表面积和体积无显著影响,50 mmol/L CaCl2处理显著增加了棉花幼苗根系干物质量以及根系总长度、表面积和体积;在高K供应水平下,和对照相比,10 mmol/L和50 mmol/L CaCl2处理对棉花幼苗根系干物质量以及根系总长度、表面积和体积均无显著影响。
表1 不同K水平下Ca对棉花幼苗根系干质量、总长度、表面积、总体积的影响
CaCl2
(mmol/L)
0.05 mmol/L KCl 2.5 mmol/L KCl
干质量
(mg) 总长度
(cm) 表面积
(cm2) 体积
(cm3) 干质量
(mg) 总长度
(cm) 表面积
(cm2) 体积
(cm3)
2.5 30.9b 451.5b 49.b 0.43b 40.6a 636.3a 63.7a 0.51a
12.5 27.9b 457.1b 49.b 0.42b 37.6a 679.7a 70.1a 0.58a
52.5 39.2a 660.7a 68.8a 0.57a 38.3a 697.9a 68.1a 0.53a
注:同列数据后不同小写字母表示差异显著(P<0.05)。下同。
2.2 不同K供应水平下Ca对棉花幼苗不同直径根系生长的影响
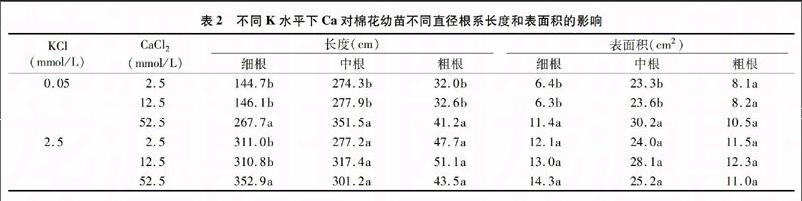
如表2所示,和对照以及10 mmol/L CaCl2相比,在低K供应水平下,50 mmol/L CaCl2处理显著促进了细根和中根的根长度和根表面积,显著促进了粗根长度,而对粗根表面积的增加则不显著;在高K供应水平下,50 mmol/L CaCl2处理显著促进了细根长度,而对细根表面积以及中根和粗根的长度及表面积则无显著影响。
表2 不同K水平下Ca对棉花幼苗不同直径根系长度和表面积的影响
KCl
(mmol/L) CaCl2
(mmol/L)
长度(cm) 表面积(cm2)
细根 中根 粗根 细根 中根 粗根
0.05 2.5 144.7b 274.3b 32.0b 6.4b 23.3b 8.1a
12.5 146.1b 277.9b 32.6b 6.3b 23.6b 8.2a
52.5 267.7a 351.5a 41.2a 11.4a 30.2a 10.5a
2.5 2.5 311.0b 277.2a 47.7a 12.1a 24.0a 11.5a
12.5 310.8b 317.4a 51.1a 13.0a 28.1a 12.3a
52.5 352.9a 301.2a 43.5a 14.3a 25.2a 11.0a
2.3 不同K供应水平下Ca对棉花幼苗根系中矿质元素K、Ca、 Mg、Na含量的影响
如表3所示,在低K供应水平下,和对照相比,50 mmol/L CaCl2处理显著降低了根系中K、Na和Ca的含量而对Mg含量无显著影响;在高K供应水平下,和对照相比,50 mmol/L CaCl2处理显著增加了根系矿质元素Ca的含量而对Mg、K、Na的含量影响不显著。
表3 不同K水平下Ca对棉花幼苗根系矿质元素含量的影响
CaCl2
(mmol/L)
0.05 mmol/L KCl 2.5 mmol/L KCl
K(mg/g) Ca(mg/g) Mg(mg/g) Na(mg/g) K(mg/g) Ca(mg/g) Mg(mg/g) Na(mg/g)
2.5 12.9a 87.8a 18.4a 23.2a 50.8a 61.7b 8.4a 4.9a
12.5 9.9b 82.3ab 20.5a 20.4ab 53.1a 62.2b 9.3a 5.1a
52.5 10.3b 73.0b 20.6a 18.8b 51.0a 81.9a 9.4a 4.1a
3 讨论
K缺乏对植物根系生长的影响在一定程度上可以因其他因素而得到恢复。K缺乏抑制了棉花侧根的发生,但冠菌素可以恢复侧根的发生,恢复程度达95%,同时当停止冠菌素处理后12 d时,根系总长度和总表面积显著增加[4]。K缺乏对根系生长的抑制也可以得到生长素类物质萘乙酸的恢复[4]。K缺乏对大豆根系生长的抑制可以得到低浓度Si和Na元素的缓解,但前者的缓解作用明显优于后者[2]。本试验中Ca增加到52.5 mmol/L时,K缺乏条件下的根系长度和表面积可以恢复到和K正常条件下的根系总长度和总表面积(表1)。缺K对棉花不同直径根系的抑制程度中,以对细根的抑制幅度最大(表2),这和前期研究结果[3]一致。不同直径根系的总长度均被显著恢复,并且细根增长幅度为85%,远大于中根和粗根增长幅度(各为28%)。
Ca和K、Na、Mg在植物吸收方面存在明显的竞争[7-9]。但是,Ca增加到52.5 mmol/L时,在高K条件下,根系中Ca含量显著升高,但对K、Na和Mg含量无显著影响;在低K条件下,根系中Ca、K和Na含量均显著下降,而对Mg没有显著影响。
参考文献:
[1]Shin R,Schachtman D P. Hydrogen peroxide mediates plant root cell response to nutrient deprivation[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(23):8827-8832.
[2]Miao B H,Han X G,Zhang W H. The ameliorative effect of silicon on soybean seedlings grown in potassium-deficient medium[J]. Annals of Botany,2010,105(6):967-973.
[3]张志勇,王清连,李召虎,等. 缺钾对棉花幼苗根系生长的影响及其生理机制[J]. 作物学报,2009,35(4):718-723.
[4]Zhang Z Y,Yang F Q,Li L,et al. Coronatine-induced lateral-root formation in cotton(Gossypium hirsutum)seedlings under potassium-sufficient and-deficient conditions in relation to auxin[J]. Journal of Plant Nutrition and soil Science,2009,172:435-444.
[5]Hepler P K. Calcium:a central regulator of plant growth and development[J]. The Plant Cell,2005,17(8):2142-2155.
[6]Palta J P. Role of Calcium in plant responses to stresses:linking basic research to the solution of practical problems[J]. HortScience,1996,31(1):51-57.
[7]Rengel Z. The role of calcium in salt toxicity[J]. Plant,Cell & Environment,1992,15(6):625-632.
[8]Garcia M,Daverede C,Gallego P,et al. Effect of various potassium-calcium ratios on cation nutrition of grape grown hydroponically[J]. Journal of Plant Nutrition,1999,22(3):417-425.
[9]Demiral M A,Koseoglu A T. Effect of potassium on yield,fruit quality,and chemical composition of greenhouse-grown galia melon[J]. Journal of Plant Nutrition,2005,28(1):93-100.

