人脐带间充质干细胞对肝癌细胞增殖性及凋亡的影响
廖卫滔 肖 佳 郑 刚 夏鸿彬 何成宜 周少朋 陈志英
人脐带间充质干细胞对肝癌细胞增殖性及凋亡的影响
廖卫滔 肖 佳 郑 刚 夏鸿彬 何成宜 周少朋 陈志英
目的 探讨人脐带间充质干细胞(human umbilical cord mesenchyma cell, MSC)对肝细胞性肝癌(hepatocellular carcinoma, HCC)癌细胞增殖和凋亡的影响,为HCC的治疗提供新的思路。方法 取50%覆盖率的MSC培养皿,换上新鲜的DMEM/F-12培养基,待其培养至100%的覆盖率后收集培养基备用,即为MSC条件培养基。用新鲜DMEM/F-12培养基加上等量的MSC条件培养基的混合培养基培养HepG2人类肝癌细胞株24、48和72h,使用MTT法测定HepG2细胞的增殖活性、通过Hoechest33342和PI双染色后在荧光倒置显微镜下观察计数以测定HepG2细胞的凋亡、用Transwell侵袭实验和黏附实验测定HepG2细胞侵袭能力以及通过Western blot法检测凋亡相关信号通路蛋白的表达。结果 混合培养基培养HepG2细胞24h后,对其生长和凋亡及侵袭黏附能力没有显著影响(P>0.05)。但是培养延长到48h和72h后,HepG2细胞的活性、增殖能力、侵袭能力和黏附能力都受到显著的抑制,这些变化伴随着细胞分裂相关因子Ki-67、PCNA和组蛋白H3磷酸化水平下调,以及细胞凋亡执行者caspase-3的激活和抗凋亡蛋白Bcl-2的抑制。结论 体外间接共培养实验表明,人脐带间充质干细胞具有抑制肝脏肿瘤细胞增殖及促进其凋亡的作用。
人脐带间充质干细胞 肝癌 增殖 凋亡 侵袭
肝癌是全世界常见的恶性肿瘤,它可分为原发性肝癌和转移性肝癌,而肝癌又以原发性肝癌中的肝细胞肝癌(HCC)最为常见。手术切除是目前根治原发性肝癌的首选治疗手段,因为原发性肝癌手术切除后复发率很高,所以术后一般辅以放化疗治疗。肝移植是根治原发性肝癌的有效方法,但是目前肝脏来源过少、费用高以及免疫排斥反应等问题存在阻碍肝移植的广泛开展。
近年来间充质干细胞(mesenchymal stem cell, MSC)被广泛用于肿瘤方面的研究,Studeny等[1]发现供体MSC主要在肿瘤部位聚集。Beckermann等[2]发现MSC主要在胰腺癌肿瘤组织中聚集。MSC的这一特性现在被称为肿瘤趋向性(tumor tropism)。很多研究表明当MSC在肿瘤组织聚集并与肿瘤细胞接触后,它可能通过以下机制发挥抑制肿瘤的效应:①在白血病模型中,MSC通过分泌dickkopf-1(DKK-1)蛋白反向调控Wnt通路抑制肿瘤细胞的增殖[3];②在卡波西肉瘤模型中,研究者发现MSC通过抑制PI3K/Akt 通路阻止肿瘤细胞的增殖[4];③另外一系列体外实验发现MSC不单可以抑制肿瘤细胞的增殖,也可以促进其凋亡。Qiao等[5]发现在有MSC存在的情况下,肝癌细胞c-myc、Bcl-2和PCNA的表达水平均呈下降趋势,导致增殖活性降低,凋亡水平增加。MSC还可以诱导并提高细胞周期抑制蛋白p21的活性,使得肿瘤细胞阻滞于G0/G1期[6]。在一项大鼠HCC模型研究中发现注射MSC直接抑制肿瘤组织的生长,改善了肝脏组织表观和功能[7]。本研究将着重探讨来源于人类脐带的MSC对于肝癌细胞系HepG2的增殖及凋亡的影响。
材料与方法
1.材料:(1)HepG2细胞:购自美国ATCC公司。HepG2细胞是使用DMEM/F-12完全培养基并放置37℃、5% CO2培养箱中进行培养。DMEM/F-12完全培养基是在DMEM/F12培养基溶液中加入10%的FBS,1%的双抗(100×)配制而成。(2)人脐带间充质干细胞(MSC)的分离和培养:人脐带由深圳市南山医院提供;脐带是按伦理要求经过家属填写《捐赠同意书》后获得。分离后首先浸泡在0.9%的NaCl溶液中,分离间充质组织并离心。随后在含1mg/ml的Ⅰ型胶原酶和双抗的HBSS缓冲液中培养消化24h。完成后在DMEM/F-12培养基中长期培养。(3)试剂:DMEM/F-12完全培养基购自美国Hyclone公司的中国代理上海玉博生物科技有限公司;胎牛血清和双抗(青霉素和链霉素)购自美国Gibco公司的中国代理上海玉博生物科技有限公司;MTT、PI(碘化丙啶)、Hoechest 33342购自上海碧云天公司;Ki67(鼠抗)、PCNA(鼠抗)、Survivin(兔抗)、Bcl-2(兔抗)和caspase-3抗体(兔抗)购自美国Cell Signaling公司中国代理上海川翔生物科技有限公司;BCA蛋白定量试剂购自美国Bio-Rad公司中国代理上海拜力生物科技有限公司; transwell迁移实验的细胞24孔培养板、BD Matrigel、结晶紫染液购自上海前尘生物科技有限公司;细胞黏附实验所需纤维连接蛋白购自Sigma-Aldrich公司;组蛋白H3磷酸化ELISA试剂盒购自艾美捷科技有限公司;4%多聚甲醛固定液购自广州市行知生物科技有限公司;DAPI购自上海市上海鲁汶生物科技有限公司。
2.HepG2细胞和hUCMSCs的培养:单独培养时均是使用DMEM/F-12完全培养基(加入10%胎牛血清)并放置37℃、5% CO2培养箱中进行培养。
3.条件培养基的收集:当hUCMSCs培养至50%覆盖率时,换上新鲜的DMEM/F-12培养基,待其培养至100%的密度后收集该培养基即为MSC条件培养基。
4.hUCMSCs与HepG2的共培养实验:培养人类肝癌细胞系HepG2至60%密度,然后将其培养基换成新鲜DMEM/F-12培养基加上等量的MSC条件培养基的混合培养基,继续培养HepG2细胞24、48和72h。在该3个时间节点收取细胞进行生物化学和分子生物学分析。
5.细胞活性测定:共培养实验完成后,在培养基中加入终浓度为0.5mg/ml的MTT,然后将细胞放至细胞培养箱中培养2h。之后在每孔内加入1ml DMSO进行溶解、混匀,吸取150μl至96孔细胞培养板内,在酶标仪上以570nm波长读板。
6.细胞凋亡比例测定:共培养实验完成后,在每孔内加入5μg/ml的Hoechest 33342和5μg/ml的PI,混匀后放至细胞培养箱中培养20min,然后在荧光倒置显微镜下观察计数。
7.Ki-67免疫组化测定:共培养实验完成后,按照常规方法进行Ki-67的荧光免疫组化染色,使用5μg/ml的Hoechest 33342进行复染,在荧光倒置显微镜下观察。
8.癌细胞体外侵袭能力测定:制备好Matrigel的transwell 培养板后,在培养板下室加入500μl 条件培养基,上室种植密度为1×105个/毫升的HepG2细胞200μl、37℃、5% CO2分别培养24、48和72h。在相应时间点取出后PBS洗2遍,用棉球擦去上室表面细胞,4℃甲醇固定15min;再用PBS洗2遍,DAPI染色1min室温下染色1min后荧光显微镜观察计数。侵袭抑制率(%) =(1-实验组侵袭细胞数/对照组侵袭细胞数)×100%。
9.癌细胞体外黏附实验:HepG2细胞首先使用无血清的DMEM(包含0.2%胰酶抑制物)清洗1遍,然后重悬于培养基中。随后吸取100μl重悬细胞加入已经包被有10μg/ml 纤维连接蛋白的96孔板中,用1μg/ml的BSA封闭。该板在37℃培养指定时间后,用PBS洗去未黏附的细胞,然后用MTT测定已经黏附的细胞比例。
10. Western blot法检测:共培养实验完成后,提取每孔细胞总蛋白,经过定量后进行常规Western blot法检测增殖和凋亡相关通路蛋白表达量的变化。
11.组蛋白H3磷酸化检测:组蛋白H3磷酸化的水平是衡量细胞增殖能力的重要指标之一。笔者利用不同时间点HepG2细胞总蛋白进行ELISA实验,测量各组细胞内组蛋白H3磷酸化的水平。
12.统计学方法:每个处理时间组为4个重复。结果采用SPSS 11.0 软件进行统计分析。采用方差分析,两两比较时采用SNK法,以P<0.05为差异有统计学意义。
结 果
1.细胞活性测定结果:使用MSC条件培养基处理HepG2细胞24h后,处理组的细胞活性(106.5%±1.0%)明显高于对照组(100.0%±1.0%)(P=0.000)。但是,处理48h后,实验组(88.9%±1.2%)明显低于对照组(100.0%±1.0%)(P=0.000);72h后实验组HepG2细胞的细胞活性进一步下降(80.6%±1.0%),与对照组相比,差异有统计学意义(100.0%±1.0%)(P=0.000,图1A)。
2.凋亡比例测定结果:使用MSC条件培养基处理HepG2细胞24h后,处理组与对照组凋亡率差异有统计学意义(图1B);培养48h和72h后,处理组的凋亡率都明显高于对照组(图1B)。
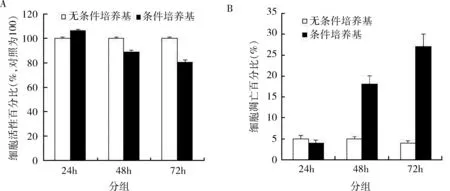
图1 细胞活性测定结果
3.癌细胞侵袭和黏附能力测定:体外侵袭和黏附能力是癌细胞成瘤性的重要指标。笔者发现,24h的MSC条件培养基处理对于HepG2的侵袭能力没有显著影响(P>0.05)。但是,随着处理时间的增加,48h和72h处理组的侵袭能力相比起对照组显著下降,提示MSC条件培养基可以有效抑制HepG2的转移能力(图2)。此外,24h的MSC条件培养基处理对于HepG2的黏附能力只有少量的影响。但是当处理时间达到48或者72h后,MSC条件培养基处理显著降低了HepG2的体外黏附水平(P=0.000,图3)。
4.细胞增殖通路测定:为了检测影响HepG2细胞增殖的分子标志物,笔者进行了Ki-67蛋白的免疫组化实验。结果发现,24hMSC条件培养基处理HepG2细胞并未造成细胞内Ki-67表达量的明显下降。和细胞活性的结果一样,48和72h处理组的单个细胞内Ki-67表达量相较于对照组出现了显著的下降(P=0.000),提示MSC条件培养基可能通过下调胞内Ki-67的表达影响HepG2的活性。另外细胞内组蛋白H3的磷酸化水平的变化也进一步验证了Ki-67的定量结果(图4)。
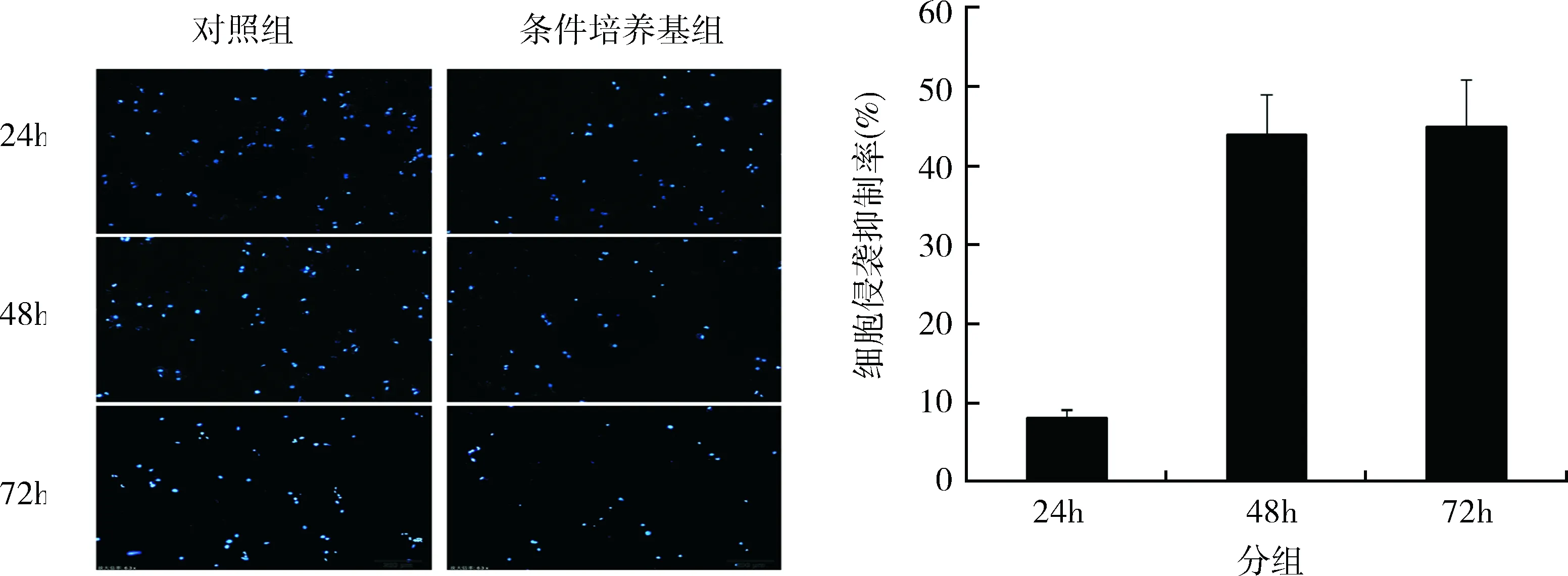
图2 凋亡比例测定结果
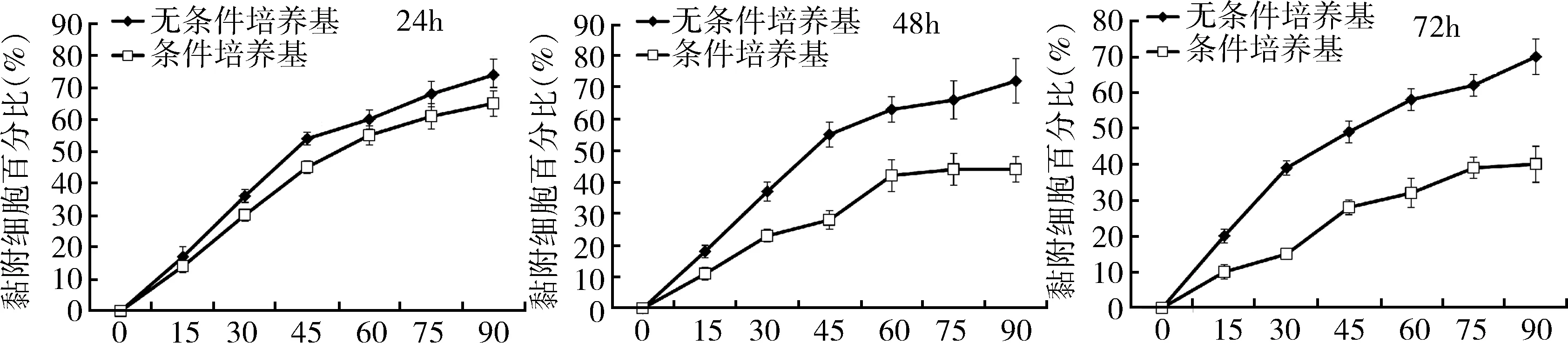
图3 癌细胞侵袭和黏附能力测定
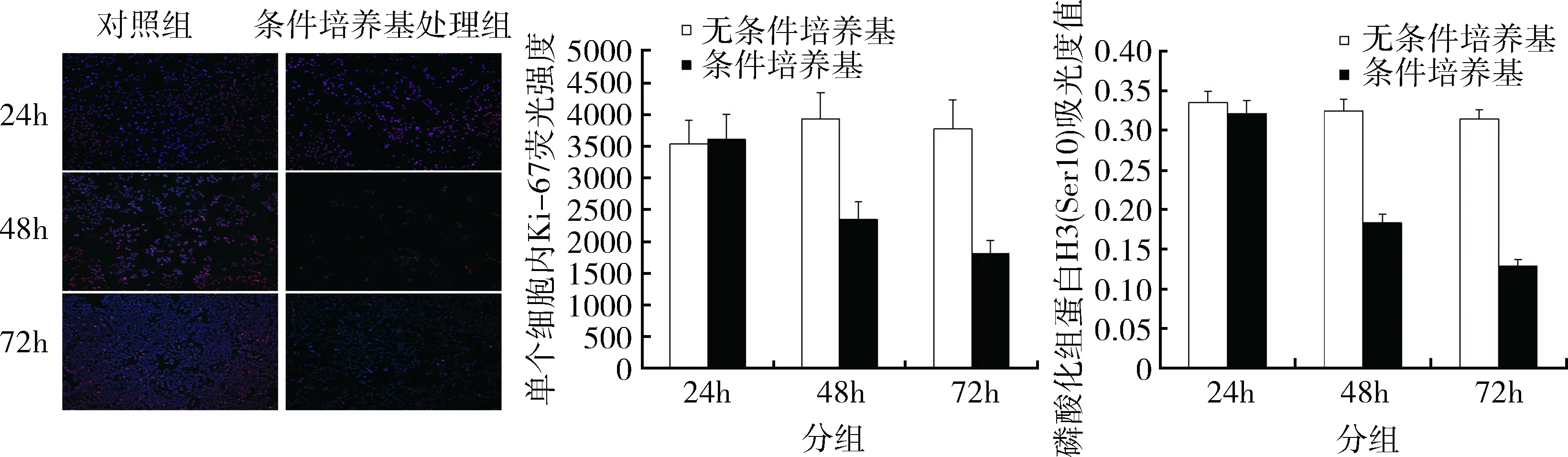
图4 细胞增殖通路测定
5.信号转导通路测定:为了进一步研究MSC条件培养基引起HepG2细胞生长阻滞和凋亡的影响,笔者在两条通路中各挑选了两个关键基因进行蛋白表达变化的分析。在48和72h这两个时间点上,MSC条件培养基的处理大幅降低了细胞增殖关键蛋白PCNA和survivin的表达量,但是大幅增加了细胞凋亡的标志物——激活的caspase-3的表达量。此外,细胞内抗凋亡标志蛋白Bcl-2的表达水平被MSC条件培养基处理显著抑制(图5)。
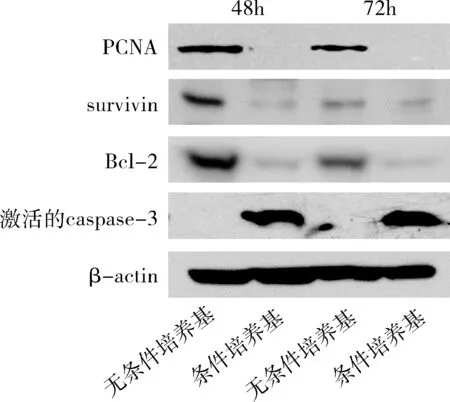
图5 信号转导通路测定
讨 论
干细胞能否治疗终末肝脏疾病(如肝硬化和肝癌)是当前再生医学研究的热点。已有的报道指出,虽然MSC对于急性肝损伤有较明显的保护作用,但是其很难填补和再生已经纤维化(或硬化)的肝脏组织。对于肝癌,有关MSC进行临床治疗的研究报道不多。不同的研究表明,MSC对HCC和其他肿瘤有不同,有时甚至是截然相反的作用。在HCC中,一般认为MSC既能抑制也可以促进HCC的病理发生[8]。而新的研究认为,骨髓MSC主要促进部分肿瘤的生长和转移[9]。究其原因,很可能不同来源的MSC分泌不同的细胞因子和其他信号分子发挥旁分泌的作用,而不同的肿瘤的表面表达不同的受体,从而表现出复杂的生理和病理结果[10]。所以进一步了解各种MSC与不同肿瘤相互作用的分子机制,找出适合的MSC-特异肿瘤的配对,能够帮助在临床治疗中诱导有效的肿瘤抑制作用而避免促进作用。
在本研究中,笔者通过体外间接共培养实验研究发现,培养过人脐带间充质干细胞的培养基可以起到抑制肿瘤细胞的生长、侵袭和黏附,并促进其凋亡的作用,表明人脐带间充质干细胞可能具有抑制肿瘤生长和其成瘤性的作用。这种作用是具有时间特异性的,即处理24h之内未见明显的抑制效果,需要将处理时间延长至48h或72h后才能发挥作用。同时,笔者还分析了MSC条件培养基发挥这些作用的分子层面的影响。首先,MSC条件培养基通过下调细胞内Ki-67、PCNA和组蛋白H3的磷酸化的水平抑制HepG2的增殖。其次,通过激活caspase-3和抑制Bcl-2来促进细胞凋亡。
综上所述,人脐带间充质干细胞具有抑制肝脏肿瘤细胞增殖、促进其凋亡的作用。值得注意的是,MSC由50%密度增殖到100%密度的时间较短(常规培养条件24~36h便可完成)。在如此短的时间内产生的条件培养基就能够显著抑制HepG2细胞的成瘤性,说明MSC在生长过程中很有可能快速分泌一些抑癌物质。近期研究发现,DKK-1可能是MSC分泌的最重要的抗肿瘤分子之一[11]。DKK-1是Wnt通路的直接抑制分子,直接作用的主要受体Wnt通路细胞膜上的受体之一——LRP6。除了白血病,亦有报道指出MSC分泌的DKK-1可以通过抑制Wnt通路减缓乳腺癌细胞的生长[12]。鉴于MSC还可以分泌一些促进肿瘤生长的旁分泌因子,例如白介素6等,MSC在动物模型和临床研究中对于HCC生长的分子影响机制还需要进一步研究。
1 Studeny M, Marini FC, Champlin RE,etal. Bone marrow-derived mesenchymal stem cells as vehicles for interferon-beta delivery into tumors[J]. Cancer Res, 2002, 62(13):3603-3608
2 Beckermann BM, Kallifatidis G, Groth A,etal. VEGF expression by mesenchymal stem cells contributes to angiogenesis in pancreatic carcinoma[J]. Br J Cancer,2008, 99(4):622-631
3 Zhu Y, Sun Z, Han Q,etal. Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1[J]. Leukemia,2009, 23(5):925-933
4 Khakoo AY, Pati S, Anderson SA,etal. Human mesenchymal stem cells exert potent antitumorigenic effects in a model of Kaposi′s sarcoma[J]. J Exp Med,2006, 203(5):1235-1247
5 Qiao L, Xu Z, Zhao T,etal. Suppression of tumorigenesis by human mesenchymal stem cells in a hepatoma model[J]. Cell Res,2008, 18(4):500-507
6 Lu YR, Yuan Y, Wang XJ,etal. The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo[J]. Cancer Biol Ther, 2008, 7(2):245-251
7 Abdel aziz MT, El Asmar MF, Atta HM,etal. Efficacy of mesenchymal stem cells in suppression of hepatocarcinorigenesis in rats: possible role of Wnt signaling[J]. J Exp Clin Cancer Res,2011, 30:49
8 Li ZK, He CY, Xiao J,etal. Treating end-stage liver diseases with mesenchymal stem cells: an oak is not felled at one stroke [J]. OA Tissue Engineering,2013, 1(1):3
9 Zhan J, Li Y, Yu J,etal. Culture medium of bone marrow-derived human mesenchymal stem cells effects lymphatic endothelial cells and tumor lymph vessel formation.[J]. Oncol Lett, 2015, 9(3):1221-1226
10 Räsänen K, Herlyn M. Paracrine signaling between carcinoma cells and mesenchymal stem cells generates cancer stem cell niche via epithelial-mesenchymal transition[J]. Cancer Discov,2012, 2(9):775-777
11 Chan JK, Lam PY. Human mesenchymal stem cells and their paracrine factors for the treatment of brain tumors [J]. Cancer Gene Ther,2013, 20(10):539-543
12 Qiao L, Xu ZL, Zhao TJ,etal. Dkk-1 secreted by mesenchymal stem cells inhibits growth of breast cancer cells via depression of Wnt signalling[J]. Cancer Lett, 2008, 269(1):67-77
(修回日期:2015-02-13)
Effects of Human Umbilical Cord Mesenchymal Stem Cell on the Proliferation of Apoptosis of Hepatoma Cells.
LiaoWeitao,XiaoJia,ZhengGang,etal.
LaboratoryforGeneandCellTherapy,ShenzhenInstituteofAdvancedTechnology,ChineseAcademyofSciences,Guangdong518055,China
Objective To examine the effects of human umbilical cord mesenchymal stem cell (MSC) on the proliferation of apoptosis of hepatoma cells and to provide novel therapeutic strategy for liver cancer. Methods Culture of MSC with 50% confluence was replaced with fresh DMEM/F-12 medium. When the confluence reached 100%, all culture used DMEM/F-12 was considered as the conditioning medium. This kind of medium was mixed with fresh DMEM/F-12 at 1∶1 to treat human hepatoma cell line HepG2for 24, 48 and 72 hours. Cellual viability was measured by MTT assay, apoptosis was quantified by Hoechst33342/PI co-staining, cell invasion ability and adhesion ability were measured by transwell assay and in vitro adhesion assay, respectively. Change of key signaling components were studied by Western blot. Results Conditioning medium showed no significant impact on the proliferation, apoptosis and invasion of HepG2after 24-hour incubation (P> 0.05). However, when treatment during was extended to 48 and 72 hours, the proliferation and invasion were significantly inhibited by the conditioning medium while cellular apoptosis was invoked. These were accompanied by the down-regulation of Ki-67, PCNA and histone H3 phosphorylation. Cleaved caspase-3 was increased while the expression of anti-apoptotic protein Bcl-2 was inhibited. Conclusion Human umbilical cord mesenchymal stem cell was capable of inhibiting proliferation and invasion, as well as promoting apoptosis of human hepatoma cells in vitro.
Human umbilical cord mesenchymal stem cell;Liver cancer;Proliferation; Apoptosis;;Invasion
518055 中国科学院深圳先进技术研究院基因和细胞治疗技术研究室(廖卫滔、郑刚、夏鸿彬、何成宜、陈志英);519000 珠海,中山大学附属第五人民医院麻醉科(廖卫滔、周少朋);510632 广州,暨南大学生命科学与技术学院免疫生物学系(肖佳)
周少朋,电子信箱: zsp005@163.com;陈志英,电子信箱: zy.chen1@siat.ac.cn
R735
A DOI 10.11969/j.issn.1673-548X.2015.10.026
2015-02-09)

