新辅助治疗在局部晚期结直肠癌治疗中的疗效观察
陈正权,王麦建,王建立,程家平,曾庆良
( 遵义医学院附属医院 胃肠外科,贵州 遵义 563099)
临床经验交流
新辅助治疗在局部晚期结直肠癌治疗中的疗效观察
陈正权,王麦建,王建立,程家平,曾庆良
( 遵义医学院附属医院 胃肠外科,贵州 遵义 563099)
目的 探讨新辅助治疗在局部晚期结直肠癌治疗中的临床疗效及安全性。方法 选取具有可比性局部晚期结直肠癌患者92例随机分为实验组与对照组各46例行前瞻性研究,实验组新辅助治疗后再行手术,对照组直接行手术。观察新辅助治疗后肿瘤缩小情况,比较术中肿瘤切除、保肛率及术后近期并发症。结果 新辅助治疗总有效率65.2%,治疗后CT/MRI显示52.2%患者肿瘤明显缩小,差异有统计学意义(P<0.01);实验组肿瘤切除率及保肛率分别为73.9%及76.9%,大于对照组的43.5%及22.2%(P<0.05);术后并发症两组无差异(P>0.05)。结论 新辅助治疗能缩小局部晚期结直肠癌肿瘤体积,提高肿瘤切除率及保肛率,未增加术后并发症;该新辅助治疗方案是有效、安全的。
新辅助治疗;结直肠癌;临床疗效;安全性
结直肠癌的发病率及死亡率有逐年上升趋势,目前我国发病率占人恶性肿瘤第4~6位,死亡率居第2~4位[ 1-2 ]。现仍多采用以手术为主,术后再进行放、化疗等综合治疗方法,对局部晚期结直肠癌患者多采取非手术或姑息手术治疗。新辅助治疗可以降低部分结直肠癌患者的肿瘤分期,提高手术切除率及低位直肠癌保肛率、降低肿瘤局部复发率[3]。针对国内外对局部晚期结直肠癌新辅助放疗剂量及放疗后手术间隔时间对手术治疗的影响及其并发症仍有不同程度争议[4],为进一步明确新辅助治疗在局部晚期结直肠癌患者治疗的有效性和安全性,我科对46例实验组局部晚期结直肠癌患者进行新辅助治疗,就其临床疗效及安全性分析总结如下。
1 资料与方法
1.1 一般资料 对2010年2月至2013年12月的局部晚期结直肠癌患者中选取92例随机分为实验组及对照组各46例。入选标准为两组患者在本次治疗前均未进行放疗或化疗,血常规、肝肾功能等均无异常,排除其他较严重内科疾病。实验组新辅助治疗前充分向患者家属履行告知义务,并签署知情同意书。两组患者在性别,年龄,病灶大小,肿瘤分布、分期及病理类型等一般资料比较无统计学意义(见表1)。
1.2 治疗方法 实验组:采用新辅助治疗+手术+术后放化疗,具体方案如下:①新辅助放疗:采用6MV-X 线,总放疗剂量为: 95%PTV 50Gy,2.0Gy/次,1次/日,5次/周。②新辅助化疗:化疗与放疗同步进行,采用FolFox6方案:即5-FU(5-氟尿嘧啶)300 mg/m2iv d1+5-FU 2.2~2.4g/m2微量泵入46~48 h;L-OHP(奥沙利铂)85 mg/m2静滴,2 h,d1;亚叶酸钙(CF)200 mg/ m2静滴,2h,d1-6;3周重复。化疗期间予对症、止吐、保肝、扶正等治疗;如白细胞低于3.0×109/L,给予G-CSF(粒细胞集落刺激因子)升白细胞。③评估:放疗结束及化疗2个周期后观察患者症状、体征,复查腹部或盆腔CT/MRI评估治疗效果,根据体查及影像学情况决定手术。④手术:新辅助治疗结束,休息2周实施手术。手术方式采用根治性切除、姑息切除或单纯造瘘等。直肠癌根据肿瘤距肛门距离不同采用Dixon术或Miles术,如不能根治切除则采用姑息切除+乙状结肠单口造瘘术,如不能切除则单纯乙状结肠双口造瘘;左半结肠癌如能根治则行根治术,不能根治则姑息切除或单纯横结肠造瘘术;右半结肠癌行右半结肠癌根治术、姑息切除或短路手术。⑤术后放疗:术中如肿瘤不能完全切除或不能切除则术后继续放疗,放疗总剂量50Gy,2.0Gy/次,1次/日,5次/周。⑥术后化疗:化疗方案同术前FolFox6方案,共6疗程;
对照组:采用手术+术后放、化疗:方法同实验组。
1.3 观察及评价指标
1.3.1 新辅助治疗前后观察患者临床症状、体征、CEA、CT或MRI等了解肿瘤降期情况。对肿瘤新辅助治疗后疗效客观评价采用WHO的标准[5],分为完全缓解(CR),即治疗后临床上不能检出肿瘤;部分缓解(PR),治疗后肿瘤缩小超过30%,无肿瘤进展及无新增病灶;病变稳定(SD),新辅助治疗后肿瘤无变化;病变进展(PD),治疗后肿瘤直径增加超过25%,出现新病灶。实验组有效率=实验组完全缓解+部分缓解/实验组总例数×100%。
1.3.2 手术治疗后观察指标 ①观察两组患者手术切除率及保肛率;②观察两组患者术后切口感染、切口不愈合、放射性肠炎、造瘘口坏死、吻合口瘘等并发症情况。
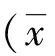
2 结果
2.1 一般资料 实验组男30例,女16例,年龄41~74岁,平均年龄(56.3±6.7)岁,肿瘤分期为Ⅲ期;肿瘤分布为右半结肠癌6例,左半结肠癌2例,直肠癌38例(其中肿瘤距肛门位置>7 cm12例,5~7 cm13例,<5 cm13例);病理类型为印戒细胞癌4例,腺癌42例。对照组男32例,女14例;年龄40~71岁,平均年龄(55.8±7.3)岁,肿瘤分期为Ⅲ期;肿瘤分布为右半结肠癌6例,左半结肠癌4例,直肠癌36例(其中肿瘤距肛门位置>7 cm14例,5~7 cm9例,<5 cm13例);病理类型为印戒细胞癌3例,腺癌43例。两组患者一般资料比较差异无统计学意义(P>0.05),具可比性(见表1)。
2.2 实验组新辅助治疗结果 46例患者均能耐受新辅助治疗,无患者退出。治疗后CR 0例 、PR 30例、SD 15例,PD 1例,总有效率达65.2%(30/46)。新辅助治疗前、后查CT/MRI显示有52.2%(24/46)患者肿瘤明显缩小(P<0.01,见表2)。
表1 两组患者一般临床资料比较(n=46)

组别性别男女年龄(岁)病灶大小(mm)肿瘤分期病灶分布(例)右半左半直肠>7cm5~7cm<5cm病例类型(例)腺癌印戒细胞癌实验组301656.3±6.752.28±18.30Ⅲ62121313424对照组321455.8±7.351.36±17.78Ⅲ6414913433t/ 20.1980.3420.245- 1.548 0.155P0.6560.7330.807- 0.818 0.649
表2 新辅助治疗前后患者CT/MRI肿瘤大小情况(n=24)

新辅助治疗组肿瘤大小(mm)治疗前52.28±18.30治疗后24.17±12.58t6.201PP<0.01
2.3 手术治疗情况比较 实验组手术切除率73.9%(34/46例)明显大于对照组的43.5%(20/46例)(P<0.01),见表3。
2.4 术中保肛情况比较 实验组及对照组肿瘤距肛门5~7cm低位直肠癌患者保肛率分别为76.9%(10/13例)及22.2%(2/9例),采用Fisher确切概率法分析结果提示,实验组保肛率明显高于对照组(P<0.05,见表4)。
2.5 术后近期并发症发生情况比较 两组患者术后近期并发症发生情况比较无差异(P>0.05,见表5)。
表3 两组患者手术治疗情况比较(n=46)

分组切除未切除实验组3412对照组2026 28.788P0.003
表4 两组患者术中保肛情况比较

分组例数保肛成功保肛未成功实验组13103对照组927P0.027
表5 两组患者术后近期并发症比较(n=46)

组别切口感染切口不愈合放射性肠炎造瘘口坏死吻合口瘘实验组60022对照组40011 20.449--0.3450.345P0.503--0.5570.557
3 讨论
结直肠癌的发病率及死亡率有逐年上升趋势[6]。局部晚期结直肠癌患者由于手术根治率低及低位直肠癌保肛率低,术后复发率高,疗效差,对患者生活质量造成严重影响。随着新辅助治疗在临床的开展及应用,这类患者的治疗及疗效都有了明显改善。报道认为[7],术前新辅助化疗可使结直肠癌患者的原发肿瘤及转移病灶缩小,降低肿瘤临床分期。Adam等[8]对1104例无法手术切除的晚期肝转移结直肠癌患者经新辅助化疗后138例(12.5%)转为可切除并手术治疗,术后5年生存率达33%,10年生存率达23%。放疗能降低癌组织活性,减少术中的医源性播散,能缩小肿瘤体积,降低术前肿瘤分期,从而提高手术根治率及低位直肠癌保肛率,能降低术后肿瘤局部复发率[9 ];还可减少手术后标本切缘的阳性率,提高术后患者的无瘤生存率[10 ]。Cao等[11 ]报道103 例接受新辅助治疗的局部晚期直肠癌患者的资料发现有9.7%患者术后病理得到完全缓解,保肛成功率达57.3%,术后3年生存率达66.3%,其中无病生存率达59.5%,认为新辅助放化疗能有效提高患者的保肛率及延长术后生存期。Rodel等[12 ]对110例局部晚期结直肠癌患者新辅助治疗的结果也充分肯定了新辅助治疗的可行性,指出新辅助治疗能提高局部晚期直肠癌的保肛率,降低局部复发率、提高患者生活质量及延长生存期。因此,局部晚期结直肠癌进行新辅助治疗在临床上逐步开展,新辅助治疗在局部晚期结直肠癌治疗中的地位也得到提高[13 ],但分析国内外对新辅助治疗在局部晚期结直肠癌患者中开展的经验、疗效、并发症和具体治疗方案时发现,在放疗剂量应用与疗效及并发症方面仍然存在争议[4],新辅助治疗放疗剂量、疗程及放疗后休息时间等目前尚无统一标准[14]。
结合我院实际情况,我们对这部分局部晚期结直肠癌患者进行新辅助治疗,并与未进行新辅助治疗直接采取手术治疗的患者进行比较分析,探讨这类新辅助治疗患者在统一放疗剂量下的疗效和并发症,为今后安全、有效开展该工作提供临床依据。在本研究中,两组患者一般临床资料比较具可比性(P>0.05,见表1)。实验组临床症状、体征及新辅助治疗后CT/MRI等的缓解情况表明,总有效率为65.2%,复查CT/MRI有24例患者肿瘤明显缩小,达52.2%(24/46例)(P<0.01,见表2),且未见患者肿瘤明显进展;实验组手术切除34例明显高于对照组20例(P<0.01,见表3),结果显示,新辅助放化疗降低部分患者肿瘤分期,提高了病灶切除率。对距离肛门5~7cm的低位直肠癌患者作为保肛对象的手术治疗结果可见,实验组保肛成功达76.9%(10/13例),明显高于对照组22.2%(2/9例)(P<0.05,见表4),结果表明,新辅助治疗可增加低位直肠癌保肛率。对两组患者术后近期并发症分析结果显示未增加患者术后近期并发症(P>0.05,见表5)。
综上所述,我们所采用的新辅助治疗方案可缩小部分患者的肿瘤病灶,提高手术切除率和低位直肠癌的保肛率;而未增加患者的术后近期并发症,故我们所采用的放疗剂量是有效、安全的。在本研究中,还需进一步观察患者术后局部复发率、3年生存率、5年生存率及无瘤生存率等,但是新辅助治疗所带来的有效性及安全性的益处,目前已得到公认,在本研究中所采用的方法,更是对患者术后近期疗效有了明显的提高,是有效、安全的,对患者的生活质量也有了明显改善,值得临床进一步推广和应用。
[1] Siegl R,Desantis C,Jemal A, et al.Coloretal cancer statistics [J].CA Cancer J Clin,2014,64:104-117.
[2] 董宁玲,白松.老年人早期大肠癌诊断及治疗[J].中国老年保健医学杂志,2014,12(1):80-82.
[3] 张贝克,白松.大肠癌治疗进展[J].中国老年保健医学,2013,11(1):42-45.
[4] 代志军,陆王锋,康华峰,等.进展期大肠癌新辅助治疗研究现状[J].国际外科学杂志,2012,39(7):436-438.
[5] Mirakhorli M, Rahman S A, Abdullah S, et al. Multidrug resistance protein 2 genetic polymorphism and colorectal cancer recurrence in patients receiving adjuvant FOLFOX-4 chemotherapy[J]. Mol Med Rep, 2013,7(2):613-617.
[6] 谢光洪,赵逵.结肠癌肿瘤干细胞标志物研究进展[J].遵义医学院学报,2013,36(5):491-494.
[7] 吕国利,白松,王晓斌,等.大肠癌新辅助化疗进展[J].中国老年保健医学,2011,9(6):68-70.
[8] Adam R,Pascal D G,Valeanu A,et al.Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy,a moded to predict long—term survival[J].Ann Surg,2004,240(4):644-658.
[9] Korkeila E,Jaakkola P M,Syrjanen K,et al.Preoperative radiaotherapy downregulates the nuclear expression of hy—poxia—inducible factor一1 alpha in rectal cancer[J].Scand J Gastroenterol,2010,45(3):340-348.
[10] Nanji S, Cleary S, Ryan P, et al. Up-front hepatic resection for metastatic colorectal cancer results in favorable long term survival[J]. Ann Surg Oncol, 2013, 20(1): 295-304.
[11] Cao W G,Zhao R,Xi W O,et al. Evaluation of preoperative radiotherapy or chemoradiotherapy in sphincter preservation for locally advanced middle-low rectal cancer[J].Chinese Journal of Oncology,2007,29( 3) : 225-227.
[12] Rodel C,Liersch T,Hermann R M,et al.Multicenter phase Ⅱ trial of chemoradiation with oxaliplatin for rectal cancer[J].J Clin Oncol,2007,25(1):110-117.
[13] Srkalovic G, Miranda R A, Maier M, et al.Neoad juvant chem oradiation for rectal cancer: A 5-year institutional experience at sparrow hospital[J].J Clin Oncol, 2007, 25( Suppl):14601.
[14] 王丽莎. 局部晚期直肠癌新辅助治疗及其敏感性预测的研究进展[J].中国癌症杂志,2010,20(12):946-948.
[收稿2014-11-06;修回2014-12-10]
(编辑:王福军)
The clinical efficacy of neo-adjuvant therapy in the patients with locally advanced colorectal cancer
ChenZhengquan,WangMaijian,WangJianli,ChengJiaping,ZengQingliang
(Department of Gastrointestinal Surgery,The Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563099,China )
Objective To Study the clinical efficay of neoadjuvant therapy in the treatment of locally advanced colorectal cancer.Methods Select 92 comparable patients with locally advanced colorectal cancer, divide them into two groups: the experimental group and the comparison group, each of them consists 46 patients, and then conduct prospective study. Conduct operative treatment after neoadjuvant therapy in the experimental group, and conduct operative treatment first in the comparison group. Observe the tumor regression after neoadjuvant therapy, and compare tumor resection during operation, rate of anal preservation and recent complications after operation.Results Total effective rate of neoadjuvant therapy is 65.2%, after treatment CT/MRI shows that tumors of 52.2% patients shrink significantly, and the discrepancies have statistical significances (P<0.01); Rates of tumor resection and anal preservation are 73.9% and 76.9% respectively, which are higher than those of the comparison group, 43.5% and 22.2%,(P<0.05); There are no discrepancies on postoperative complications of the two groups (P>0.05).Conclusion Neoadjuvant therapy could reduce the tumor volume of locally advanced colorectal cancer, and improve the rates of tumor resection and anal preservation without increasing the rate of complications.This neoadjuvant therapy is effective and safe.
neoadjuvant therapy;colorectal cancer;clinical effect;safety
曾庆良,男,教授,硕士生导师,研究方向:大肠肿瘤,E-mail:1164311591@qq.com。
R735.3
B
1000-2715(2015)01-0088-04

