青海省某奶牛场顽固性乳房炎主要病原菌的分离鉴定与耐药性研究
林 杰,王旭荣,杨志强,王 磊,张景艳,孔晓军,王学智,秦 哲,王孝武,李建喜
(中国农业科学院兰州畜牧与兽药研究所,农业部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,甘肃兰州730050)
目前奶牛乳房炎仍然是制约奶牛产业健康持续发展的主要疾病之一,给奶牛养殖业造成巨大的经济损失。国家奶牛产业体系疾病控制研究室2011年至2014年的临床调查结果显示,因顽固性乳房炎淘汰的病牛占疾病淘汰病牛的40%~65%。引起奶牛乳房炎发生的病因很多,但病原菌仍然是最重要的原因之一,以链球菌属、葡萄球菌属和肠杆菌属为主,但是,不同地区病原菌种属之间也存在一定差异,需要结合病原菌分型进行流行病学调查。同时随着奶牛养殖行业的发展,致病菌的类型和优势菌群也发生了一定变化,增加了奶牛乳房炎的防治难度。
2014年6月青海省某奶牛场出现多头顽固性乳房炎的病例,为了明确此次引起奶牛乳房炎的病原菌,并制定确实有效的防控方案。本课题组无菌采集15份病牛乳样,进行了细菌分离鉴定、病原菌分型和药物敏感性试验。具体分析和结果如下。
1 材料与方法
1.1 材料
1.1.1 样品采集 2014年6月青海省某奶牛场出现多头顽固性乳房炎的病例,久治不愈。主要临床表现为奶牛乳区红肿,触感硬实,每头病牛的乳区均出现不同程度的萎缩,有的乳区萎缩严重;乳样主要呈絮状、凝块或浓稠的奶油状,个别乳样为水样泛黄,部分奶样为血乳。随机选择部分顽固性乳房炎病牛,对患病乳区分别采集乳样,共采集15份病牛乳样。具体采集方法如下:先用温水清洗乳房,然后依次用新洁尔灭、750mL/L酒精消毒乳头。每个乳头弃去初始2 把~3 把奶,后以无菌操作方法分别采集每个乳室的乳样于乳样采集管中,做好标记,加入生物冰袋使乳样温度保持在2 ℃~15 ℃冷藏带回实验室。
1.1.2 试剂 营养肉汤、血琼脂营养基础,广东环凯微生物科技有限公司产品;革兰染液,南京建成科技有限公司产品;Bacterial DNA Kit,OMEGA BIOTEK 公 司 产 品;16SrDNA Bacterial Identification PCR Kit宝生物工程(大连)有限公司产品;细菌微量生化鉴定管(兔血浆),青岛高科技工业园海博生物技术有限公司产品。
1.1.3 药敏纸片 青霉素G(10 单位/片)、头孢氨苄(30μg/片)、阿 米 卡 星(30μg/片)、卡 那 霉 素(30 μg/片)、四环素(30μg/片)、强力霉素(30μg/片)、红霉素(15μg/片)、诺 氟 沙 星(10μg/片)、氧 氟 沙 星(5μg/片)、环 丙 沙 星(5μg/片)、新 生 霉 素(30μg/片)、复方新诺明(23.75/1.225/片)、呋喃妥因(300 μg/片)、氯霉素(30μg/片)、头孢噻吩(30μg/片)、甲氧苄啶(5μg/片)、恩诺沙星(5μg/片),杭州微生物试剂有限公司产品。
1.2 方法
1.2.1 细菌分离与纯化 将待检乳样摇匀,无菌操作,用接种环取2 环~3 环乳汁样品间断划线接种于血琼脂平板上,分别在有氧、厌氧2 种培养条件下,37 ℃恒温培养18h~24h,观察细菌生长情况。对培养18h~24h 无细菌生长的血琼脂平板接种乳,继续培养至48h。挑取细菌菌落进行涂片、革兰染色、镜检。挑取典型单菌落进行纯化培养,细菌纯化后保存备用,进一步鉴定。
1.2.2 鉴定方法 采取本实验室建立的奶牛乳房炎乳汁中病原菌分离鉴定程序进行鉴定,其中葡萄球菌属采用细菌形态观察、革兰染色镜检、血浆凝固酶试验和16SrDNA 序列分析相结合的方法进行鉴定;非链球菌属的其他革兰阳性菌采用细菌形态观察、革兰染色镜检和16SrDNA 序列检测进行鉴定。
1.2.3 16SrDNA 序列分析 按照试剂盒操作说明提取被检细菌的DNA 并以此DNA 为模板,用16 S rDNA Bacterial Identification PCR Kit中的Forward Primer和Reverse Primer扩增16SrDNA 片段,而后进行核酸凝胶电泳。扩增片段由北京六合华大基因科技股份有限公司测序,通过NCBI(http://ncbi.nlm.nih.gov/)的在线Blast软件对获取的序列进行搜索比对,并确定细菌种属。
1.2.4 金黄色葡萄球菌荚膜多糖分型 金黄色葡萄球菌分型参照文献[1]进行,荚膜多糖5型扩增基因片段长度为361bp,荚膜多糖8型扩增的基因片段长度为173bp。
1.2.5 药敏试验 药敏试验参考《CLSI的抗菌药物敏感性试验执行标准2013》,采用Kirby-Bauer(K-B)纸片扩散法,测定分离菌株对抗菌药物的敏感性。每株菌3个重复,用游标卡尺测量抑菌圈直径,取3个重复的平均值。参照美国临床实验室标准化协会(CLSI,2013)推荐标准进行判定,通过抑菌圈直径大小判定病原菌对药物的敏感性,分为耐药(R)、中度敏感(I)和高度敏感(S)。
2 结果
2.1 细菌分离鉴定结果
被检乳样15份,其中6份乳样检出细菌,细菌检出率40%。分离得到13株细菌,其中10株细菌菌落表面光滑,圆形凸起,周围有溶血圈,革兰阳性菌,排列成葡萄状,血浆凝固酶阳性,疑是金黄色葡萄球菌,编号为S1~S10;1株血浆凝固酶阴性葡萄球菌编号为CNS1;2株多形态的革兰阳性杆菌,编号为A1、A2(表1)。
2.2 16SrDNA 序列分析结果
以提取的细菌DNA 为模板,用16SrDNA 细菌鉴定PCR 试剂盒扩增16SrDNA 片段,片段长度500bp左右(图1)。获得片段序列在GenBank中进行Blast搜索比对,菌株S1~S10 均与金黄色葡萄球菌(基因登录号为CP006838.1、CP006630.1、CP007447.1、AB681718.1、KF999668.1、CP007659.1、CP007539.1、CP003045.1)的16SrDNA 同源性为99%以上,故分离株S1~S10的鉴定结果均为金黄色葡萄球菌;CNS1 与表皮葡萄球菌(基因登录号为AY030342.1)的16SrDNA 同源性为99%以上,确定CNS1 为表皮葡萄球菌;A1、A2均与化脓隐秘杆菌(基因登录号为GU372928、NR121796.1)16SrDNA 同源性为99%以上,故A1、A2鉴定为化脓隐秘杆菌(表1)。
2.3 金黄色葡萄球菌荚膜多糖分型结果
参照文献,以分离菌株S1~S10 的细菌DNA为模板,进行荚膜多糖基因扩增,所分离金黄色葡萄球菌均扩增出361bp的片段(图2),故分离株金黄色葡萄球菌S1~S10均为荚膜多糖5型。
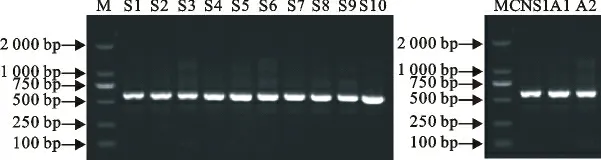
图1 分离菌的16SrDNA PCR 扩增Fig.1 PCR products of 16SrDNA of isolates

表1 细菌分离鉴定结果Table 1 Isolation and identification of bacteria

图2 S1~S10金黄色葡萄球菌荚膜多糖基因PCR 扩增Fig.2 PCR products of capsular polysaccharides of S.aureus S1-S10isolates
2.4 药敏试验结果
金黄色葡萄球菌对阿米卡星、卡那霉素、四环素、强力霉素、氟哌酸、氧氟沙星、环丙沙星、新生霉素、复方新诺明、氯霉素、头孢噻吩、甲氧苄氨嘧啶和恩诺沙星均敏感,而对青霉素G、红霉素、头孢氨苄和呋喃妥因耐药率分别为100%、90%、10%和10%(图3);表皮葡萄球菌对青霉素G、复方新诺明和甲氧苄氨嘧啶耐药,而对其他14种抗菌药物敏感;化脓隐秘杆菌对四环素和甲氧苄氨嘧啶耐药,对强力霉素和复方新诺明中度敏感,对其他13种抗菌药物敏感。

图3 金黄色葡萄球菌体外抑菌试验结果Fig.3 Sensitivity tests of Staphylococcus aureus to antimicrobials
3 讨论
此次青海省某奶牛场发生顽固性乳房炎,久治不愈,根据实验室检测分析,是由金黄色葡萄球菌、化脓隐秘杆菌、表皮葡萄球菌混合感染造成的。此次发病较为严重,但经实验室检测,乳样的细菌检出率为40%,结合临床现场调查,笔者认为此次细菌检出率低是因为患病后牛场已多次使用抗菌药物治疗,治疗效果不佳才进行样品检测,而一般进行乳房炎的病原检测,采样是在治疗前进行的,由于抗菌药物的使用造成细菌分离难度加大甚至分离不到。此次分离到的细菌以荚膜多糖5型金黄色葡萄球菌为主要病原。有研究表明,金黄色葡萄球菌引起的乳房炎多为慢性病例而且容易复发,难以自愈[2],而且由于金黄色葡萄球菌感染时间长,未及时治愈,巨噬细胞在乳腺部位对抗病原菌会逐渐引起乳腺组织的纤维化并使乳腺丧失泌乳功能,此次病例中乳区出现硬实、乳腺萎缩临床症状可能与金黄色葡萄球菌感染时间长有关。本次采集的乳样有血乳,推测是与分离的化脓隐秘杆菌有关,化脓隐秘杆菌可以产生外毒素PLO,能够溶解多种动物的红细胞、免疫细胞[3]。此外乳样中分离出表皮葡萄球菌,可能与该牛场乳房炎病例久治不愈有关,作为凝固酶阴性葡萄球菌,属条件致病菌,可作为耐药基因的储藏场所,形成生物被膜和毒力因子,引起的奶牛乳房炎反复发作难以治愈[4],大量报道也证实了凝固酶阴性葡萄球菌耐药性问题已经不容忽视[5-8]。
有研究表明金黄色葡萄球菌具有高度异质性[9],且 分 型 复 杂,有 多 种 分 型 方 法[10-11],荚 膜 多 糖是金黄色葡萄球菌的主要致病因子之一,所以荚膜多糖分型是主要的分型方法之一。本试验采用PCR方法确定此次分离的10株金黄色葡萄球菌均为荚膜多糖5型。而郭宇等对内蒙古地区9个牛场的乳房炎病原菌进行研究,结果发现造成奶牛乳房炎的金黄色葡萄球菌以荚膜多糖8型为主(72.41%)[12];王登峰等[13]研究发现新疆部分地区奶牛乳房炎源金黄色葡萄球菌以336型为主(64.96%);荚膜多糖5型和8型分别占10.26%和13.68%。张燕等[14]研究来自四川、山东、湖北、陕西和上海等地共462 株人源金黄色葡萄球菌,发现荚膜多糖8 型为主占70.9%。Verdier I等[1]对从多国收集的195 株人源金黄色葡萄球菌进行研究,结果为荚膜多糖5型占42%,8型占45%由此可见,金黄色葡萄球菌荚膜多糖优势型别在不同地域和不同物种之间的分布有一定差异。金黄色葡萄球菌的分型研究可为该病原的流行病学提供数据,为其致病机制和疫苗研制奠定基础[15]。
化脓隐秘杆菌是奶牛子宫内膜炎的主要病原菌之一[16-17]。但目前关于该菌引起乳房炎的报道和研究较少。此次从顽固性乳房炎病例样品中分离出化脓隐秘杆菌,笔者推测可能与该奶牛场奶牛子宫内膜炎的发生有一定关系,因为从奶牛场的临床调查发现,该场子宫内膜炎的病例较多,而且治疗效果一般,通过细菌分离鉴定分析发现,化脓隐秘杆菌是造成该场子宫内膜炎的主要病原菌之一,该结果在另文中报道。
此次顽固性乳房炎是由3种病原菌混合感染造成的,而且与子宫内膜炎的发生有一定的相关性,结合牛场的环境卫生管理调查,建议该场加强环境卫生管理工作。而且此次分离的病原菌的药物敏感性不同,故而治疗困难,后建议使用恩诺沙星治疗病牛并加强隐性乳房炎的筛查与防治,病情得到了控制。
[1] Verdier I,Durand G,Bes M,et al.Identification of the capsular polysaccharides in Staphylococcus aureus clinical isolates by PCR and agglutination tests[J].JCM,2007,45(3):725-729.
[2] Thomas J,Simon F.奶牛疾病学[M].赵德明,沈建忠,译.北京:中国农业大学出版社,2009:328-329.
[3] 田 凯,王秋霞,郭文洁,等.化脓隐秘杆菌溶血素的研究进展[J].中国兽医杂志,2010,46(12):65-67.
[4] 朱娇玲.苦参碱对表皮葡萄球菌生物被膜形成的影响研究[D].宁夏银川:宁夏大学,2014.
[5] Tremblay Y D N,Caron V,Blondeau A,et al.Biofilm formation by coagulase-negative staphylococci:Impact on the efficacy of antimicrobials and disinfectants commonly used on dairy farms[J].Vet Microblol,2014,172(3-4):511-518.
[6] Virdis S,Scarano C,Cossu F,et al.Antibiotic resistance in Staphylococcusaureusand coagulase negative staphylococci isolated from goats with subclinical mastitis[J].Vet Med Inter,2010,doi:10.4061/2010/517060.
[7] Sergine E,Sabine L,Cathy C,et al.Low occurrence of safety hazards in coagulase negative staphylococci isolated from fermented foodstuffs[J].Int J Food Microblol,2010,139(1-2):87-95.
[8] 王旭荣,李建喜,杨志强.2012年奶牛乳房炎防治技术研究进展[J].中国畜牧杂志,2013,49(24):35-40.
[9] Lindsay J A,Holden M T G.Understanding the rise of the su-Perbug:investigation of the evolution and genomic variation of Staphylococcus aureus[J].Funct Gen,2006,6(3):186-201.
[10] 周长卿,王 珂,胡俊杰,等.青海地区奶牛乳房炎金黄色葡萄球菌的基因型分析[J].动物医学进展,2014,35(2):11-16.
[11] Jagielski T,Puacz E,Lisowski A,et al.Short communication:Antimicrobial susceptibility profiling and genotyping of Staphylococcus aureus isolates from bovine mastitis in Poland[J].J Dairy Sci,2014,97(10):6122-6128.
[12] 郭 宇,刘秀丽,张爱荣,等.奶牛乳房炎金黄色葡萄球菌荚膜多糖主要血清型的鉴定[J].黑龙江畜牧兽医,2011,5(9):16-19.
[13] 王登峰,吴建勇,杨学云,等.新疆部分地区奶牛乳房炎金黄色葡萄球菌荚膜多糖分型的研究[J].中国预防兽医学报,2011,33(7):574-576.
[14] 张 燕,吴泓舟,易红彬,等.金黄色葡萄球菌荚膜分型血清研制及初步应用[J].微生物学免疫学进展,2004,32(2):7-9.
[15] 高 潮.奶牛隐性乳房炎病原微生物区系分析及金黄色葡萄球菌基因分型[D].安徽合肥:合肥工业大学生物与食品工程学院,2013:11-12.
[16] 李宏胜,杨 峰,王旭荣,等.兰州地区部分奶牛场子宫内膜炎病原菌分离鉴定及抗生素耐药性研究[J].中国畜牧兽医,2014,41(1):222-226.
[17] 王孝武,王旭荣,杨志强,等.奶牛子宫内膜炎研究进展[J].动物医学进展,2014,35(7):98-102.

