激光共聚焦近红外荧光扫描系统光学设计
罗刚银,王弼陡,缪 鹏,王 磊,王钟周,钱 庆,钱 俊
(中国科学院 苏州生物医学工程技术研究所,中科院生物医学检验技术重点实验室,中国 江苏215163)
激光共聚焦近红外荧光扫描系统光学设计
罗刚银,王弼陡,缪 鹏,王 磊,王钟周,钱 庆,钱 俊
(中国科学院 苏州生物医学工程技术研究所,中科院生物医学检验技术重点实验室,中国 江苏215163)
为了实现对近红外荧光的高分辨率扫描,设计了工作在近红外光谱区的激光共聚焦光学系统。采用结构简单的凹凸双透镜物镜实现了照明光路和发射光路的设计,并采用Zemax软件进行了光学设计和仿真。实验表明:照明光路的聚焦弥散斑小于1 μm,照明针孔处的聚焦光斑小于40 μm,满足照明针孔的尺寸要求;发射针孔处的聚焦光斑小于10 μm,满足探测针孔尺寸要求;同时照明光路和发射光路的MTF曲线的截止频率都分别满足其衍射极限分辨率的要求,照明光路在全视场空间分辨率420 lp/mm处MTF>0.08,发射光路在全视场空间频率400 lp/mm处MTF>0.07。
光学设计;近红外荧光扫描;激光共聚焦;Zemax
引言
荧光标记技术是指利用一些能发射荧光的物质(如荧光探针,荧光染料等)共价结合或物理吸附在所要研究样本的某个基团(如蛋白分子等)上,然后利用荧光扫描仪等仪器检测其荧光特性来提供被研究对象的内部结构信息(如抗原抗体分布、浓度等)。用于荧光标记的荧光物质有很多,而其中的近红外荧光染料(near infrared fluorescence, NIR)具有独特的优点。近红外荧光染料的发射波长为700 nm~1 200 nm,在该范围内生物分子自身荧光较弱,可避免背景干扰而获得较高的分析灵敏度。近红外荧光具有较强的穿透能力,能够实现样本的深层检测,近红外荧光对样本造成的光损伤较低,也有利于实现活体检测[1]。
激光诱导荧光技术(laser induced fluorescence, LIF)是常见的荧光检测技术,而激光共聚焦扫描技术(confocal laser scanning, CLS)是共聚焦技术与LIF技术相结合的产物。LIF技术和CLS技术都采用激光作为发射荧光的激发光源,但是LIF技术中照明激光和发射荧光不通过同一物镜,激光往往对样本进行斜射照明,是场光源,可用于普通的荧光显微镜;而CLS技术中照明激光和发射荧光通过同一物镜,激光往往对样本进行垂直照明,是点光源[2],可用于激光共聚焦显微镜。相对于LIF技术,CLS技术具有更高的分辨率[3],并且可以实现深度荧光扫描。
本文根据CLS技术的工作原理,针对近红外荧光染料的光谱需求,设计了近红外荧光扫描光学系统,并采用Zemax软件对光学设计进行了优化。
1 激光共聚焦工作原理
CLS技术是利用照明针孔对照明光源的空间滤波和整形作用,形成点光源对样品进行照射,而点光源具有发散小、能量集中等优点,有利于对样品中的荧光物质进行高效激发,这也避免了场光源照射时样品中每一点的荧光激发都会受到邻近点的衍射或散射光干扰的问题。同时,CLS技术还利用样品中的点光源照射点与探测针孔的共轭关系来实现有用荧光的抗干扰、高精度探测,即只有在焦平面上的点光源照射点所发出的荧光能够通过探测针孔被光电探测元件所接收,而焦平面以外的干扰荧光和散射光不能通过探测针孔。可见,CLS光学系统中的照明针孔和探测针孔共同聚焦于样品中的点光源照明点,从而实现样品中的激发荧光的高分辨率探测。
CLS光学系统主要由照明光源、照明光滤光片、照明光聚焦透镜组、照明针孔、准直透镜组、二向色镜、物镜、发射光滤光片、发射光聚焦透镜组、探测针孔、光电探测元件等构成,如图1所示。
图1中,LASER为用作照明光源的激光器,F1为照明光滤光片,F2为发射光滤光片,L1为照明光聚焦透镜组,L2为准直透镜组,L3为物镜,L4为发射光聚焦透镜组,A1为照明针孔,A2为探测针孔,D1为用于照明光和发射光分离的二向色镜,PMT为用于光电探测的光电倍增管。按照功能划分,CLS光学系统包括照明光路和发射光路两部分,其中照明光路包括的光学元件有LASER、F1、A1、L1、L2、L3、D1,而发射光路包括的光学元件有L3、L4、D1、F2、A2、PMT。
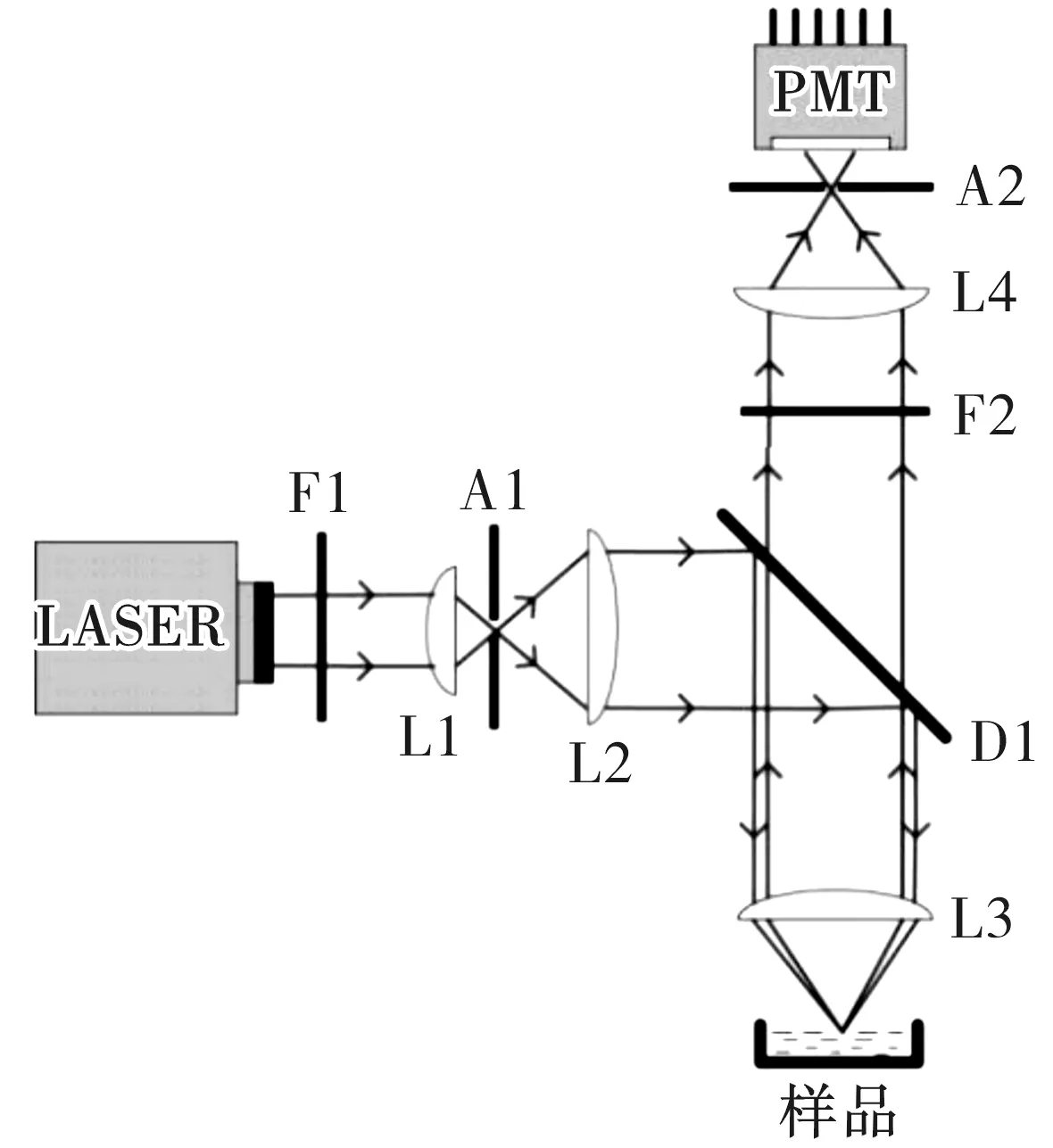
图1 激光共聚焦工作原理图Fig.1 Principle diagram of confocal laser scanning
2 光学系统的设计指标
CLS光学系统的照明光源是方向性、单色性很好的激光,采用平行入射的方式进入光学系统,因此在光学设计时只需校正轴上点,即0视场的球差。具体的设计任务要求如下:
1) 视场角w=0°,入瞳直径为8 mm,只校正轴上点球差。
2) 工作于近红外波段,其中照明激光光源的波长为780 nm,发射荧光的波长为820 nm。
3) CLS光学系统常用的照明针孔和探测针孔的尺寸范围为50 μm ~300 μm,因此照明光聚焦透镜组L1和发射光聚焦透镜组L2的焦点弥散斑应该小于50 μm。
4) CLS光学系统的共聚焦焦点的几何弥散斑直径小于1 μm。
5) 镜头结构尽量简单。
3 具体光学设计过程
3.1 物镜(L3)光学设计
考虑到单透镜很难校正球差,因此采用凹凸双透镜结构[4]来设计CLS系统的物镜L3,设置入瞳直径为8 mm,角度视场为0视场,波长为780 nm,F数=1/2。考虑选择一种类似于双胶合透镜的结构,先简单将所有的半径设置为20 mm,所有的厚度设置为6 mm,两块透镜分别选择高反射率的玻璃SF59(n=1.95)和ZF14(n=1.92),如表1所示。初始结构的像差曲线、点列图和MTF曲线分别如图2、图3和图4所示,由以上图示可见,该初始结构的像差很大,由MTF曲线也可看出该初始结构的成像质量很差,因此需要校正像差。

表1 物镜初始结构参数
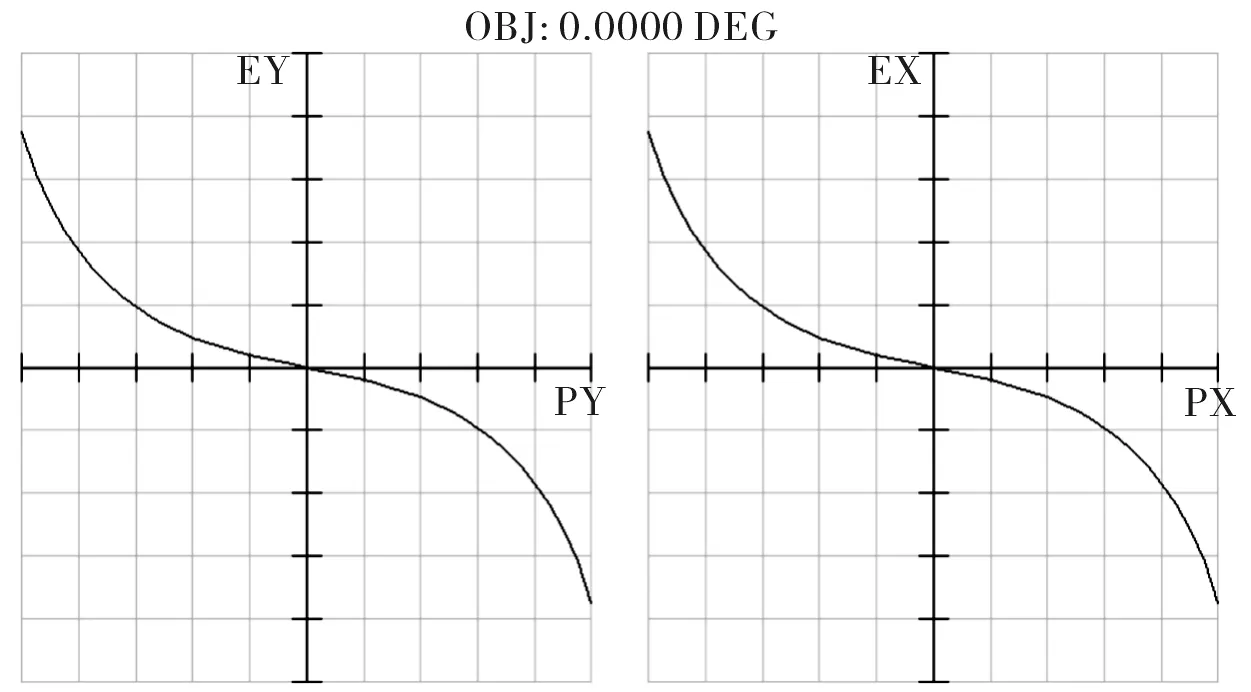
图2 初始结构的像差曲线Fig.2 Ray fan of initial structure
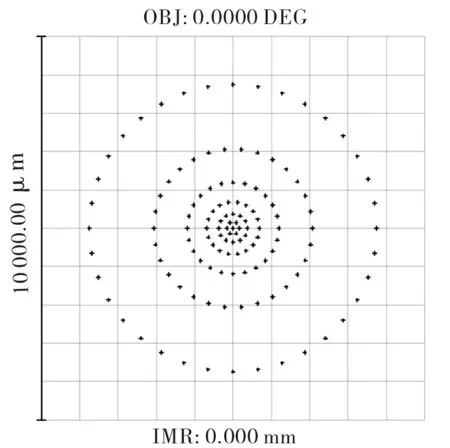
图3 初始结构的点列图Fig.3 Spot diagram of initial structure
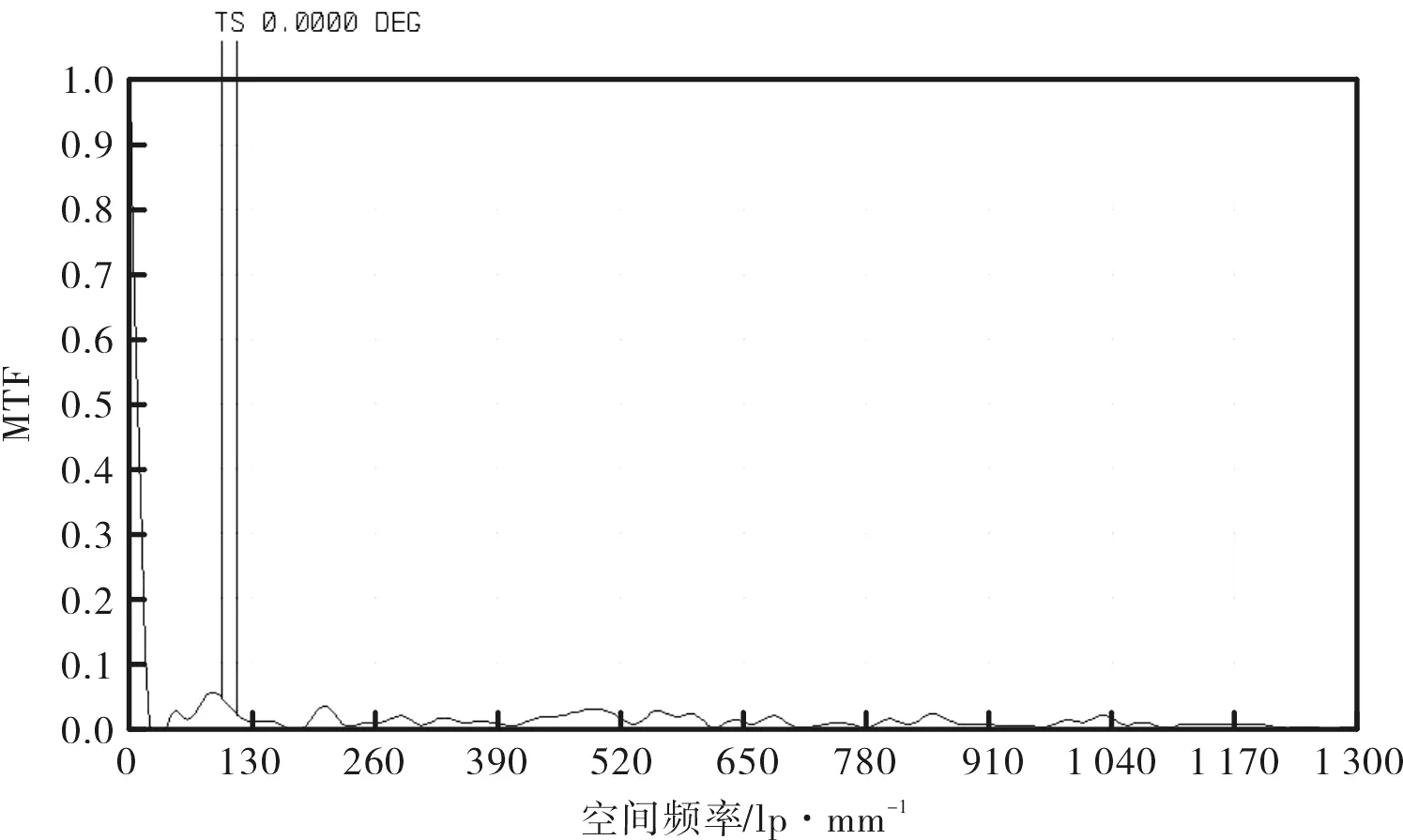
图4 初始结构的MTF曲线Fig.4 MTF curves of initial structure
由于本物镜只校正轴上点球差,因此通过设置优化函数进行球差校正,从而得到所需的物镜结构。优化函数的具体设置如下:
1) 设置优化函数为“RMS(均方根)+Spot Radius(像点尺寸)+Centroid(质心点)”。
2) 设置玻璃厚度边界条件为“Min=1,Max=8”。
3) 设置空气间隔边界条件为“Min=1,Max=16”。
4) 增加LONA和SPHA优化操作数,设置“Target=0,Weight=1”。
5) 将第1、2、3面镜的r值设置为变量,通过选择最后一面镜的r值的Slove Type类型F Number值为1/2来限制物镜的F数。
6) 将4个面镜的d值都设置为变量。
首先采用“Optimization”进行自动优化,然后选择“Hammer Optimization”进一步锤形优化[5]。优化后的凹凸双透镜物镜的结构参数如表2所示,其三维图、像差曲线、点列图分别如图5、图6和图7所示。由图5~图7可见,设计的凹凸双透镜物镜的像差很小,光学弥散斑的直径小于1 μm。
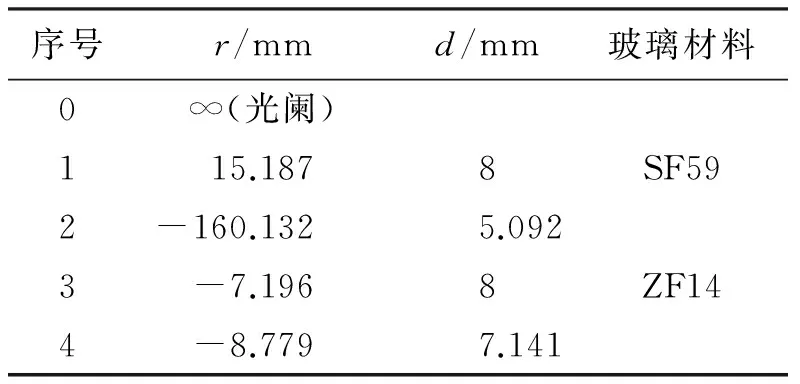
表2 优化后的物镜结构参数
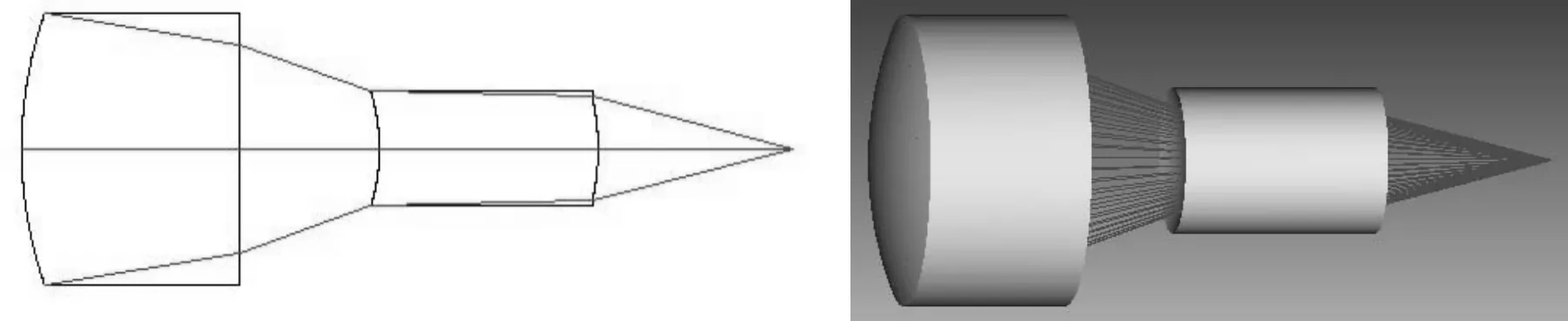
图5 优化后物镜的三维图与渲染图Fig.5 3D layout and shaded model of optimized objective
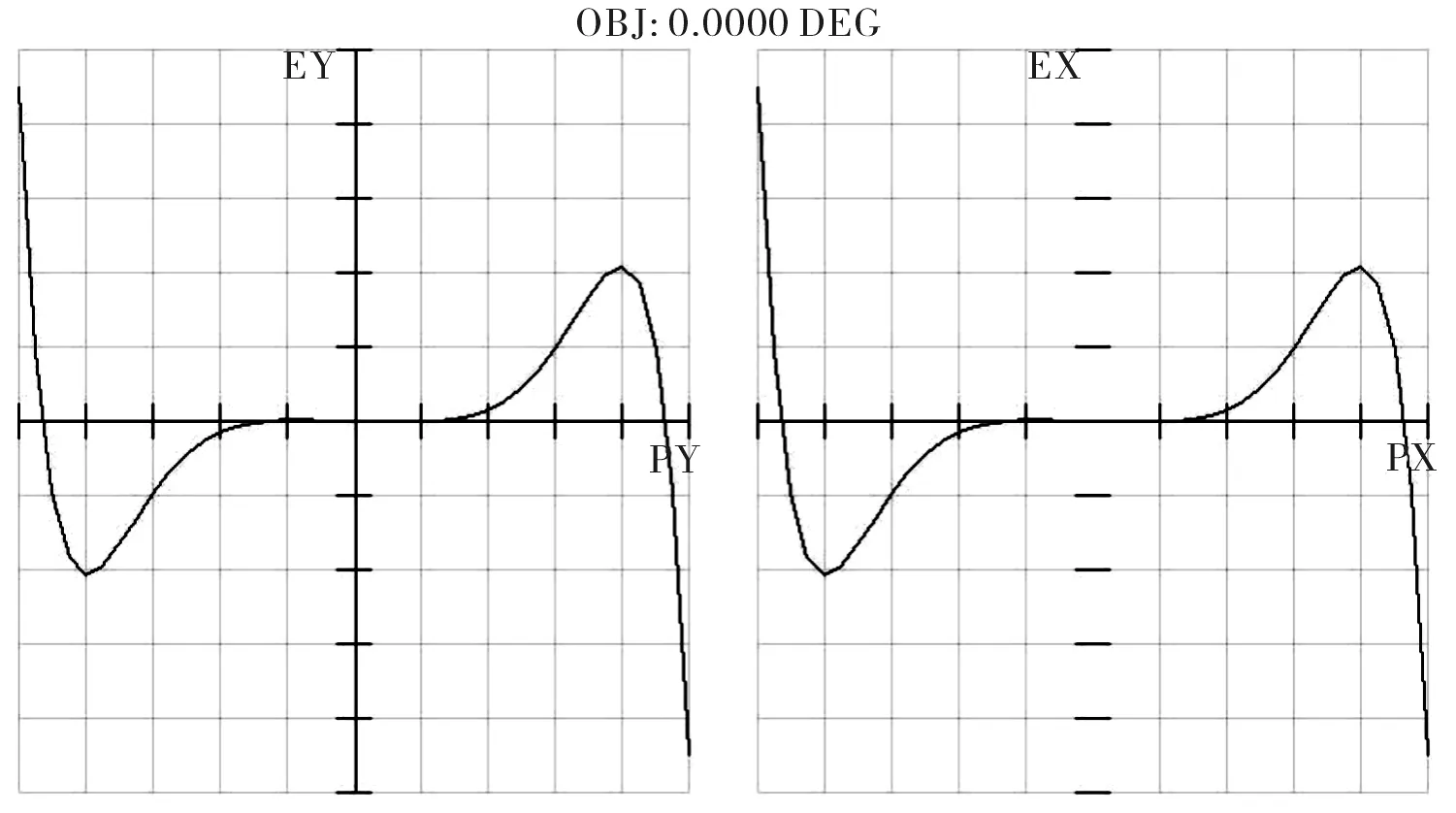
图6 优化后物镜的像差曲线Fig.6 Ray fan of optimized objective
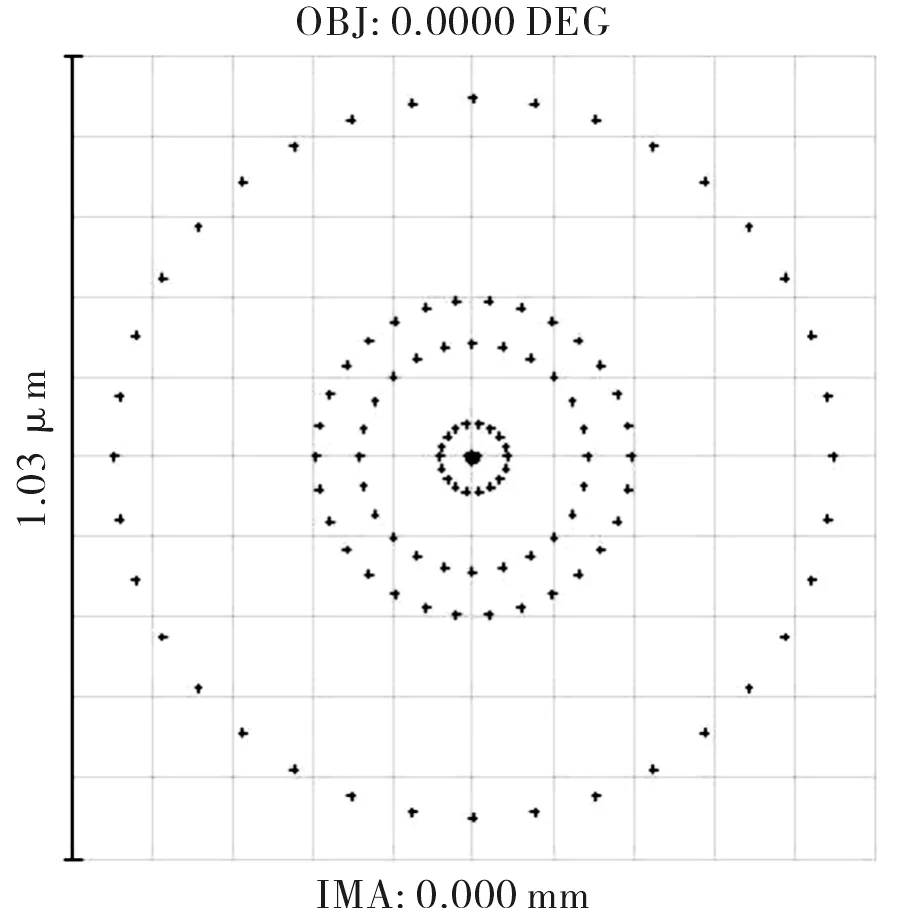
图7 优化后物镜的点列图Fig.7 Spot diagram of optimized objective
物镜的数值孔径表征物镜的聚光能力,是物镜的重要性质之一,增强物镜的聚光能力可提高物镜的分辨率。数值孔径NA的计算公式如下:
NA=n·sinθ
(1)
式中:n为物镜与观察对象之间介质的折射率;如空气的折射率为1;θ为物镜的孔径半角,计算得该物镜的数值孔径值为0.24。
数值孔径NA是显微镜物镜最主要的光学特性,它决定了物镜的衍射分辨率δ[6]的大小,其计算公式为
(2)
该物镜的工作波长为780 nm,因此其衍射分辨率为1.98 μm。优化后的物镜的MTF曲线如图8所示,可见其在全视场空间频率N=1/δ=504 lp/mm处的MTF>0.1[7],因此具有极高的分辨率。
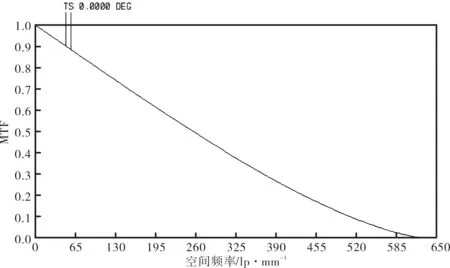
图8 优化后物镜的MTF曲线Fig.8 MTF curves of optimized objective
由于该物镜只是照明光路和发射光路的一部分,还需要分别和照明光路、发射光路一起校正球差,因此该物镜的参数结构在照明光路和发射光路的设计过程中还会继续做调整。
1.2 照明光路(F1、A1、L1、L2、L3)设计
为了简化光路,选择单凸透镜设计照明光聚焦透镜组L1,玻璃材料依然选择SF59。单凸透镜结构参数如表3所示,其三维图与渲染图如图9所示,点列图如图10所示。该照明光聚焦透镜组L1的会聚光斑的点列图小于40 μm,因此完全满足目前激光共聚焦常用照明针孔直径为50 μm~300 μm的实际应用需求。同时,由于所采用单凸透镜的第2面镜为平面,因此也进一步降低了该透镜的加工和安装要求。
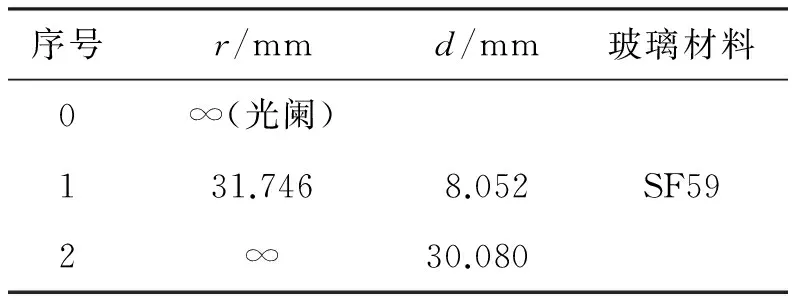
表3 单凸透镜结构参数
图9 单凸透镜的三维图与渲染图Fig.9 3D layout and shaded model of single convex lens
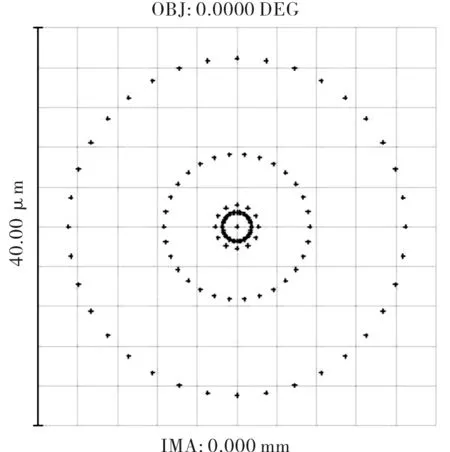
图10 单凸透镜的点列图Fig.10 Spot diagram of single convex lens
同样,采用单凸透镜设计准直透镜组L2,其初始结构与表3相同,并添加二向色镜的反光面和物镜L3,得到照明光路的初始结构。为进一步优化该照明光路,保持照明光聚焦透镜组L1的光学结构固定不变,设置准直透镜组L2的凸面(第4面)和物镜L3的4个面(第6、7、8、9面)的r值为变量,设置L2的玻璃厚度d值为变量,同时设置L3的玻璃厚度d值和空气间隔d值为变量。先采用“Optimization”进行自动优化,然后选择“Hammer Optimization”进一步锤形优化,通过改变r值、d值的方法来优化照明光路结构,优化后的照明光路结构参数如表4所示,其三维图和渲染图如图11所示。
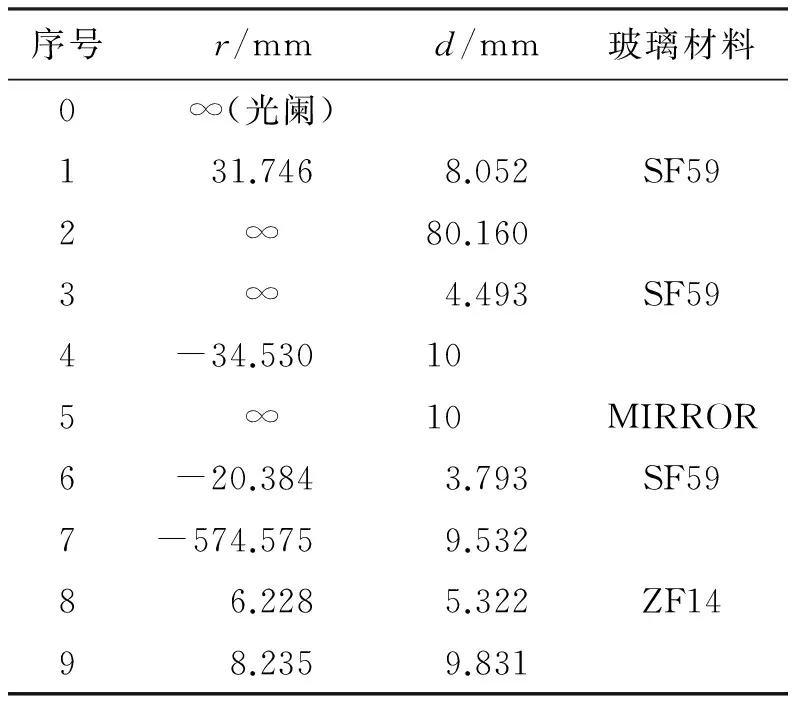
表4 优化后的照明光路结构参数
图11 照明光路的三维图与渲染图Fig.11 3D layout and shaded model of lighting lens
优化后的照明光路的像差曲线、点列图、MTF曲线分别如图12、图13和图14所示。由图12~图14可见该照明光路的弥散斑尺寸小于1 μm。另外,物镜L3的参数结构在照明光路像差校正的过程中已经重新调整,其数值孔径为0.2,工作波长为780 nm,由公式(2)计算可得照明光路的衍射分辨率为2.38 μm,因此由图13可知,其在全视场空间频率N=1/δ=420 lp/mm处的MTF>0.08[7],因此该照明光路具有极高的点光源分辨率。
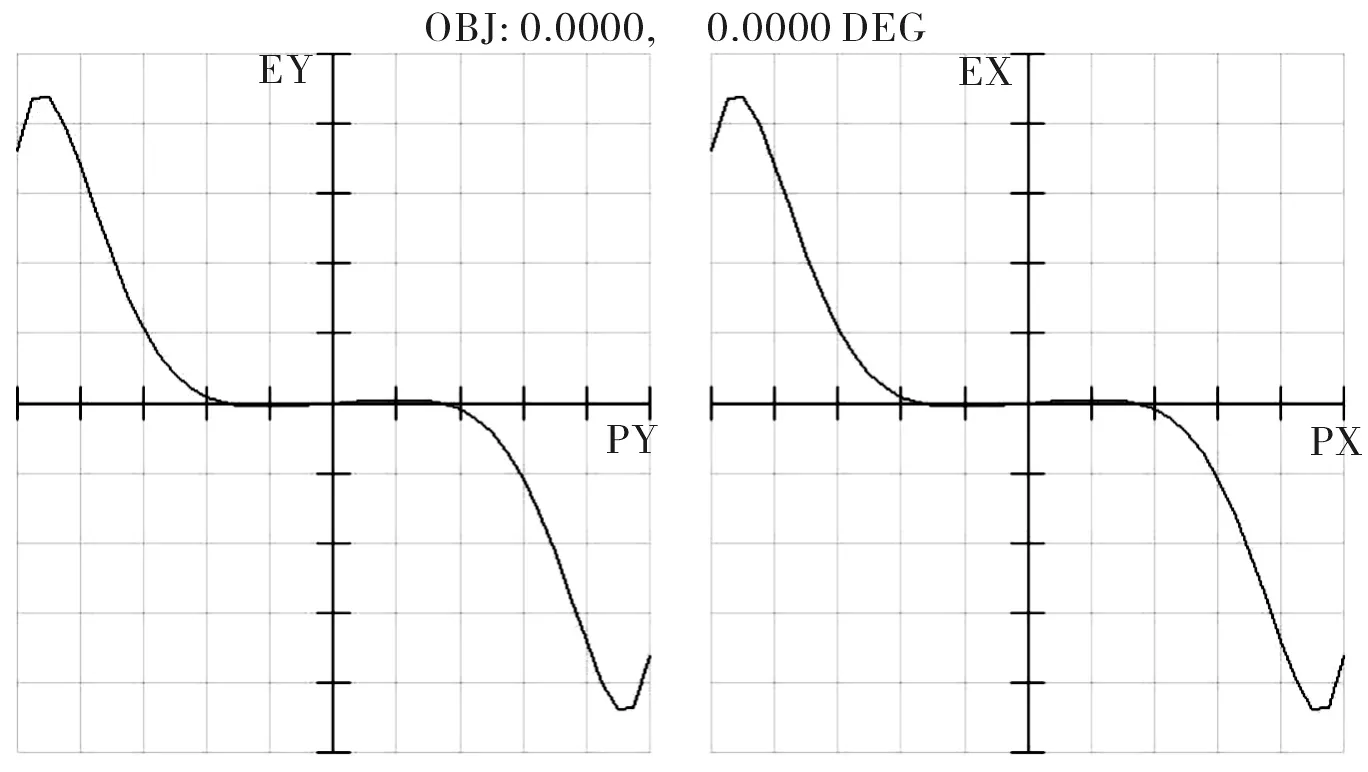
图12 照明光路的像差曲线Fig.12 Ray fan of lighting lens
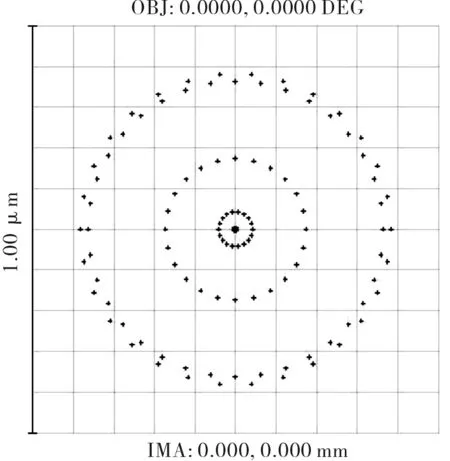
图13 照明光路的点列图Fig.13 Spot diagram of lighting lens
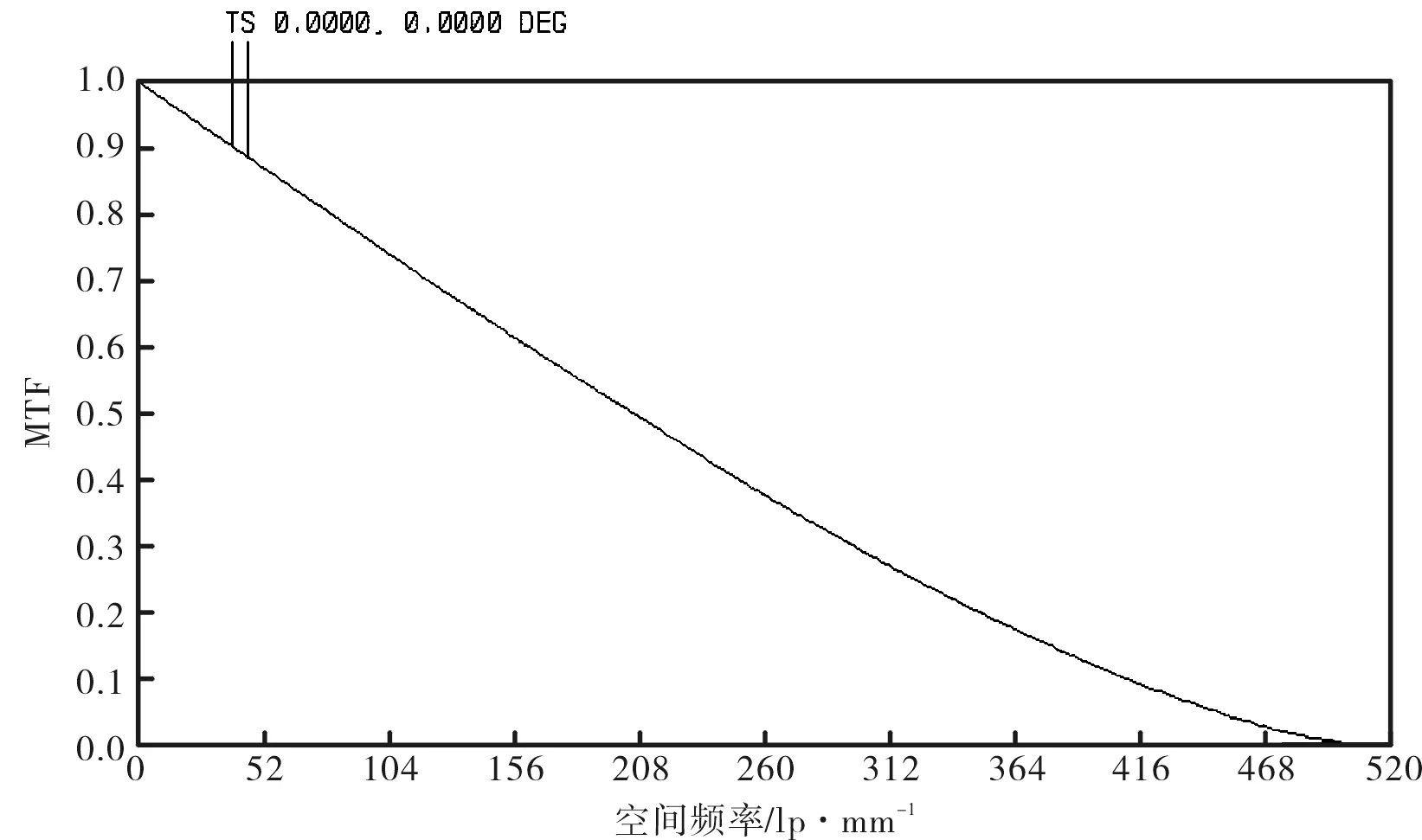
图14 照明光路的MTF曲线Fig.14 MTF curve of lighting lens
1.3 发射光路设计
为了简化光路,同样选择凹凸双透镜设计发射光聚焦透镜组L4,其初始结构与物镜L3相同,并添加物镜L3和二向色镜的折射面,选择二向色镜D1和发射光滤光片F2的玻璃材质为BK7,设置物方数值孔径为0.2,得到其发射光路的初始结构。为进一步优化该发射光路,设置发射光聚焦透镜组L4的4个面(第9、10、11、12面)的r值为变量,设置L4的两块玻璃厚度d值和空气间隔d值为变量,同时设置L4的两块玻璃材料为变量(选择Slove Type类型为Substitute)。首先采用“Optimization”进行自动优化,然后选择“Hammer Optimization”进一步锤形优化,通过改变r值、d值和玻璃材料的方法来优化发射光路结构,优化后的发射光路结构参数如表5所示,其三维图和渲染图如图15所示。
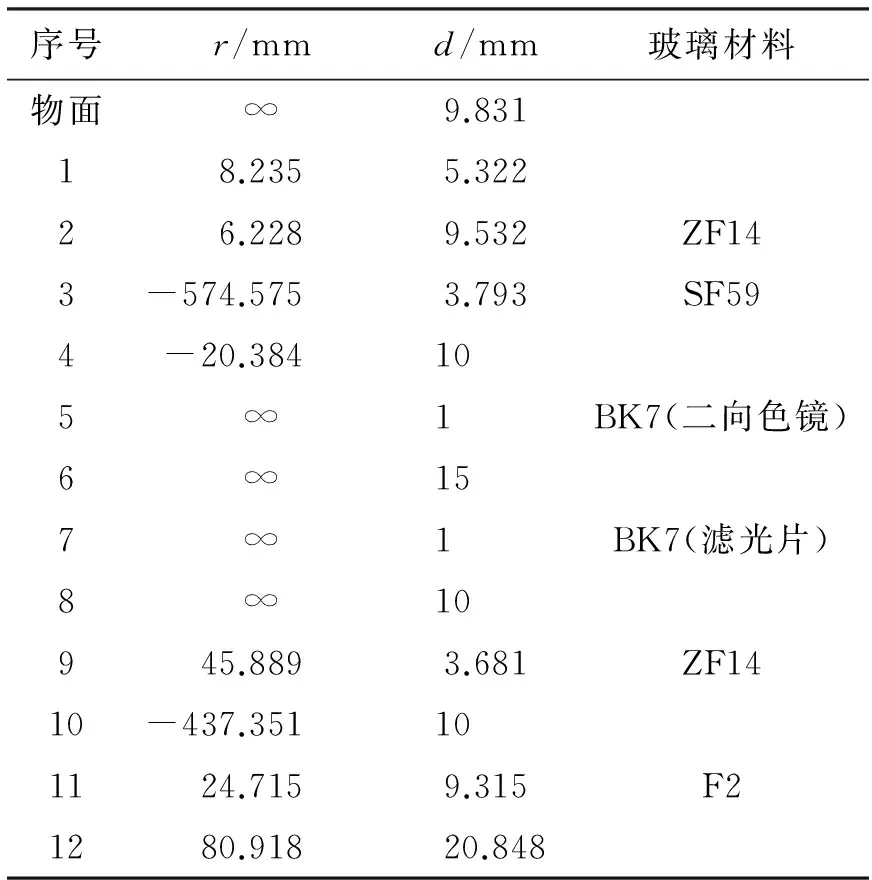
表5 优化后的发射光路结构

图15 发射光路的三维图与渲染图Fig.15 3D layout and shaded model of emission lens
优化后的发射光路的点列图、MTF曲线分别如图16和图17所示。可见该发射光路的弥散斑尺寸小于10 μm,完全满足目前激光共聚焦常用探测针孔直径为50 μm~300 μm的实际应用需求。同时,由于物镜L3的数值孔径为0.2,发射光路工作波长为820 nm,由公式(2)计算可得发射光路的衍射分辨率为2.5 μm,由图16可知,其在全视场空间频率N=1/δ=400 lp/mm处的MTF>0.07[7],因此该发射光路具有极高的光学传输效率。
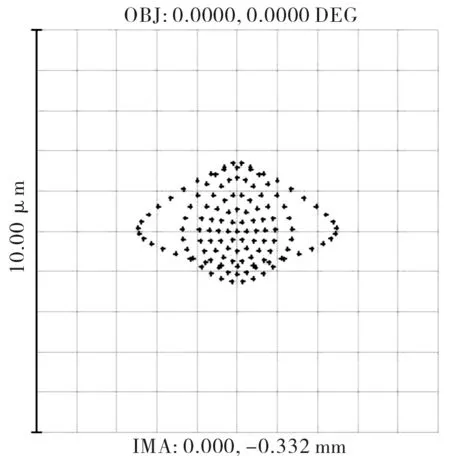
图16 发射光路的点列图Fig.16 Spot diagram of emission lens
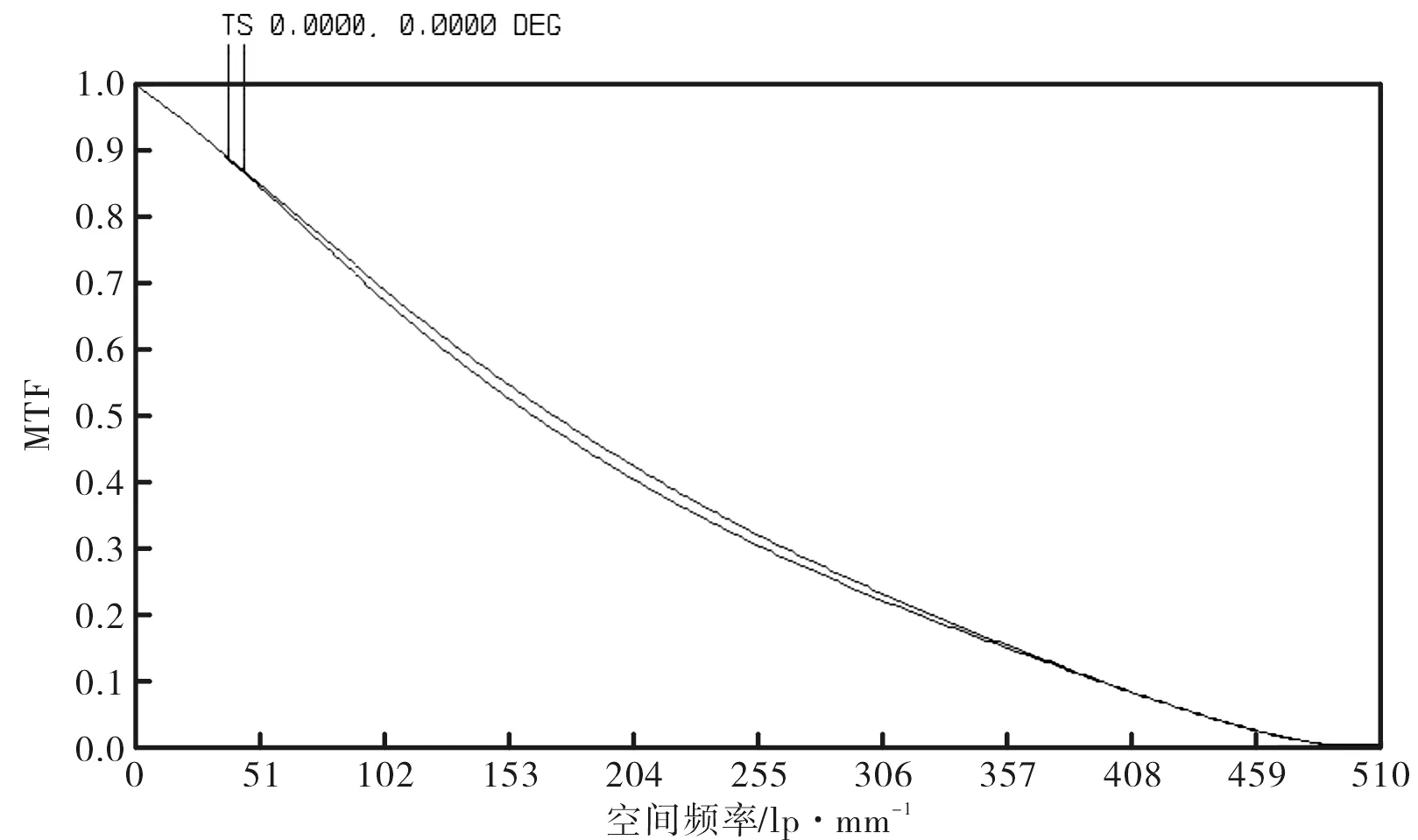
图17 发射光路的MTF曲线Fig.17 MTF curves of emission lens
4 结论
本文采用激光共聚焦原理设计了近红外荧光扫描系统,采用结构简单的凹凸双透镜物镜实现了照明光路和发射光路的设计。其中,照明光路的聚焦弥散斑小于1 μm;照明针孔处的聚焦光斑尺寸小于40 μm,满足照明针孔的尺寸要求;发射针孔处的聚焦光斑小于10 μm,满足探测针孔尺寸要求;同时照明光路和发射光路的MTF曲线的截止频率都分别满足其衍射极限分辨率的要求,具有较高的光学传输效率。因此,该光学系统具有结构简单、工作于近红外光谱区、分辨率高的优点,可满足生物芯片、基因 芯片等对激光共聚焦近红外荧光扫描系统的需求。另外,本光学系统中物镜的数值孔径较小,因此还可以采用较为复杂的显微物镜来进一步提高系统的数值孔径,从而进一步提高激光共聚焦光学系统的光学分辨率和荧光探测效率。
[1] Duan Xia.Synthesis and application of NIR fluorescence dye for biological analysis[D].Jinan:Shandong Normal University,2009. 段霞.用于生物分析的近红外荧光染料的合成与应用[D].济南:山东师范大学,2009.
[2] Huo Xia,Lyu Jianxun,Yang Rendong,et al.Comparison of laser xcanning confocal microscope with light microscope[J].Acta Laser Blology Sinica,2001,10(2):76-79. 霍霞,吕建勋,杨仁东,等.激光共聚焦显微镜与光学显微镜之比较[J]. 激光生物学报,2001,10(1):76-79.
[3] Hu Maohai,Yang Xiao-chun.High-speed laser scanning control system for confocal microscopy[J].Journal of Applied Optics,2011,32(4):797-800. 胡茂海,杨晓春.共聚焦显微镜激光高速扫描控制系统设计及实现[J].应用光学,2011,32(4):797-800.
[4] Fan Yingjuan,Zhang Yanjun..Design of He-Ne laser beam focusing lens based on Zemax[J]. Journal of Applied Optics,2010,31(6):1032-1035. 范应娟,张艳军.基于Zemax的He-Ne激光光束聚焦物镜的设计[D]. 应用光学,2010,31(6):1032-1035.
[5] Lin Xiaoyang.Super manual of ZEMAX optical design[M].Beijing:Posts & Telecom Press,2014. 林晓阳.ZEMAX光学设计超级学习手册[M].北京:人民邮电出版社,2014.
[6] Liu Jun,Gao Ming.Optic design[M].Xi’an:Xi’an University of Electronic Technology Press,2006. 刘钧,高明.光学设计[M].西安:西安电子科技大学出版社,2006.
[7] Xiao Zexin.System and application of optical mechanical and electrical integration[M].Guangzhou:South China University of Technology Press,2011. 萧泽新.光机电一体化系统及应用[M].广州:华南理工大学出版社, 2011.
Optical design of near infrared fluorescence confocal laser scanning system
Luo Gangyin,Wang Bidou,Miao Peng,Wang Lei,Wang Zhongzhou,Qian Qing,Qian Jun
(CAS Key Lab of Bio-Medical Diagnostics,Suzhou Institute of Biomedical Engineering and Technology,CAS,Suzhou 215163, China)
In order to realize the high resolution scanning for near infrared fluorescence,a laser scanning confocal optical system was designed which worked in the near infrared region.The lighting lens,and emission lens were realized based on simple concave lens and convex lens.The software Zemax was used for the optical design and simulation. Simulation results shows that the focal spot’s size of lighting lens is less than 1 μm, and the focal spot’s size is less than 40 μm at the lighting pinhole position, which meets the lighting pinhole’s requirement.The focal spot’s size is less than 10 μm at the emission pinhole position, which meets the emission pinhole’s requirement.In addition,the cutoff frequency of the lighting lens and emission lens meets the diffraction limit resolution requirement respectively. Therefore, it has high optical transmission efficiency.
optical design;near infrared fluorescence scanning;confocal laser scanning;Zemax
1002-2082(2015)01-0029-06
2014-08-25;
2014-09-18
中科院苏州生物医学工程技术研究所“一三五”规划重大突破资助项目(Y052031205);苏州市应用基础研究计划资助项目(SYG201128)
罗刚银(1984-),男,四川德阳人,助理研究员,主要从事生物光谱仪器方面的研究。E-mail:luogy1237@sina.com
TN24;TH703
A
10.5768/JAO201536.0101006

