血液透析患者心脏病变及超声检查在其诊断中的应用
李 川 综述 龚德华 审校
·血液净化·
血液透析患者心脏病变及超声检查在其诊断中的应用
李 川 综述 龚德华 审校
维持性血液透析(MHD)患者死亡率高,心血管疾病死因约占50%,其中心源性猝死又占心血管死因的50%左右。超声心动图可有助于早期发现心脏结构、功能异常,以利于早期干预、改善预后,但其成像质量受操作者技术、经验和患者自身声窗条件影响很大,导致常规二维超声心动图参数的准确性和重复性差;MHD患者的血流动力学和容量状态受透析的影响,从而影响心脏超声检查准确性。新的超声成像技术,如三维超声、组织多普勒和斑点追踪技术等,能够提供更多检查参数和更准确的诊断信息,可帮助临床进一步了解MHD患者心脏结构、功能的病理生理变化。
血液透析 超声心动图 心血管疾病
维持性血液透析(MHD)患者死亡率居高不下,主要死因是心血管疾病,其中心源性猝死占心血管死因的50%左右,尽早发现、及时干预很重要。超声检查操作简单、易普及,虽受操作者技术、经验和患者声窗条件(如肥胖、胸廓畸形等)限制,但对MHD患者心脏病变的诊断价值不可替代。本文就超声检查在MHD患者心脏病变中的应用及研究方向进行综述。
MHD患者常见心脏病变
MHD患者常见的心脏结构异常包括心肌肥厚、心室容积异常、瓣膜病变、心房容积异常及心脏收缩、舒张功能异常。超声可直接测量心室壁厚度、室腔内径及局部血流运动情况,并动态观察参数变化,推算左心室质量(LVM)、心室射血分数(EF)等指标,来判断心脏病变。一些新技术,如三维超声、组织多普勒显像(TDI)和斑点追踪超声显像(STI),可测量组织运动速度、E′、A′等参数,为发现更敏感、特异诊断指标创造条件。
心脏结构病变及超声诊断
左心室结构异常 MHD患者左心室肥厚(LVH) 最常见。LVH与肾功能负相关,约70%患者进入透析时伴LVH,是心脏对反复容量、压力超负荷适应性结构重塑的结果;而一些非血流动力学因素(如慢性肾脏病矿物质与骨异常、肾素-血管紧张素-醛固酮系统活化、尿毒症毒素等)也促进心肌细胞肥大。LVH是透析患者死亡和心血管事件发生的危险因素。控制容量和代谢、增加透析频率及肾移植可改善LVH,甚至改善预后。如London等[1]发现控制血压、纠正贫血使平均LVM下降[(290±80)gvs(264±86)g,P<0.01],5年死亡率下降28%。
LVH诊断指标包括: LVM经体表面积(BSA)标化得到左心室质量指数(LVMI)、相对室壁厚度(RWT)和左心室质量-容积比(M/V)。通过这些指标还可区分LVH是扩张性还是向心性肥大。MHD患者向心性肥大更常见,可能与慢性高血压发病率高、循环后负荷增加有关。433例尿毒症心肌病患者,左心室容积(LVV)正常(≤90 ml/m2),LVMI增加(>120 g/m2)和M/V增加(>2.2 g/ml)是透析后2年死亡率独立预测因素(校正RR 3.29和2.24),而LVV升高(>120 ml/m2)和M/V降低(M/V <1.8 g/ml)的死亡风险更高(校正RR 17.14 和4.27)[2]。
超声的缺点是精度差,尤其是透析患者普遍(约30%)存在心室重构、左室形态不规则[3];透析会引起循环容量变化,研究发现透析前后LVMI和收缩末期内径(LVESD)分别相差26.2~36.1 g/m2和4~4.8 mm[4-5]。因此,报告需注明超声检查和HD时间关系。
描划左心室截面轮廓,可直接测量面积(二维)增加准确性,包括面积-长度法、去顶椭球体法、双平面Simpson法及多内径法。前两种方法以绝对规则几何体为模型;双平面Simpson法要求尽量探查到左心尖最顶部,才能准确测算。多内径法可重复性差、耗时。
计算LVMI时,BSA因MHD患者肌肉、脂肪量及水肿程度变化,甚至截肢、骨骼畸形的影响而出现误差。可用身高替代。Zoccali等[6]研究,身高、BSA标化的LVMI都是心血管和全因死亡率的独立预测因素,但前者统计学模型拟合度更好。
测量本身也有误差。RWT不受BSA影响,但室壁厚度不均,重复性差;此外,如果患者透析超滤后即行检查,此时左心室舒张末期容积(LVEDV)最小,RWT增加,表现为向心性肥大;而透析前,容量负荷最高,LVEDV又会偏大。
目前左心室结构病变诊断金标准是心脏MRI,而三维超声是与之最接近的超声诊断学方法。通过超双平面、多方向上各截面的加合来实现对左心室的成像,与MRI相似,可直接测量LVV,降低操作技术的影响。当然,成像质量亦会受到患者声窗条件影响。且采图时需屏气,患者难以配合。目前三维超声尚未广泛应用于终末期肾病(ESRD)患者。
左心房结构异常 左心房容积(LAV)增大间接反映心室舒张功能障碍。LAV可用直径、截面积或容积来表示。直径法简单,误差大,重复性差;面积法误差稍小,但也是采集二维数据;左心房容量是通过双平面Simpson法进行计算,也应用BSA或身高2.7标化。
左心房增大可预测透析患者死亡率和心血管事件发生率。Tripepi等[7]报道与健康对照组进行年龄、性别匹配后,透析患者的LAV/身高2.7明显升高(12 ml/m2.7vs7.5 ml/m2.7,P<0.001);在校正LVH和LVEF后仍可独立预测全因死亡率(每升高1 ml/m2.7的HR 1.05; 95%CI 1.01~1.09;P=0.03),这与其他研究结论一致[7-10]。 Tripepi等[11]研究发现校正基线LAV和LV功能和质量异常后,LAV每升高1 ml/(m2.7·年)是心血管事件独立预测因素 (P=0.001) 。因此,LAV是心血管病变的非特异、强预测指标。
心脏瓣膜钙化 通常将瓣膜处>1 mm强回声影定义为钙化灶,但易漏诊。电子束CT和多层螺旋CT更精确,可定量钙化程度及钙化密度,却不易普及。
MHD患者二尖瓣钙化发生率为19%~84%[12]。Braun 等[13]发现MHD患者心脏瓣膜钙化发病率>50%,且随访1年后进一步升高。危险因素包括高龄、高磷血症、钙磷乘积升高和炎症。贾凤玉等[14]观察了144例MHD患者,超声查心脏瓣膜钙化发生率34.25%,独立危险因素包括高龄和长透析龄;与螺旋CT冠脉钙化评分(Agaston法)比较,超声有良好特异度和灵敏度(ROC-AUC 0.837,95%CI 0.791~0.883,P<0.001)
既往研究早已明确超声心动图显示的二尖瓣钙化,心脏死亡率和心血管事件发生率升高相关,是不良预后的预测指标[15-16]。
心脏功能病变及超声诊断
左心室收缩功能障碍
EF下降 MHD患者左心室收缩功能障碍发生率15%~28%。相关危险因素包括缺血性心脏病、容量超负荷和贫血等[17]。
左心室收缩功能下降是ESRD患者慢性心力衰竭和死亡的预测因素[18]。一项研究显示,开始透析后第一个月内行心脏超声检查, 基线EF≤50%者占13%。随访7年(中位时间)后,发现EF下降是心血管疾病死亡的独立危险因素[19]。一项腹膜透析研究中,EF每下降1%,心源性猝死发生风险升高6%(P=0.004)[20]。
实际上EF仅反映心室射血效率,无法直接反映心肌纤维收缩能力下降。如向心性的LVH,RWT增厚而LVV减小,此时即使心肌纤维收缩能力减弱,每搏输出量减少,但由于LVEDV也小,其EF可能正常。
EF正常的亚临床型收缩功能障碍 临床上,EF正常的收缩功能障碍在MHD患者中亦常见。如左心室射血分数≥50%者,5年心源性猝死发生风险高达28%[21],提示这部分患者同样存在心脏病变。心室收缩有纵向、径向及环向扭曲(扭转)3种收缩方式(图1)。借助于后出现的TDI和STI技术发现,EF正常也可能存在心肌收缩方式异常,并与不良预后相关。
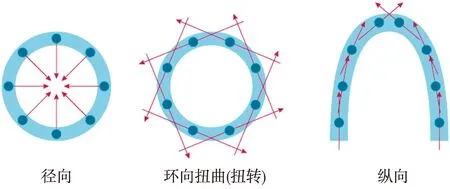
图1 心肌运动的三种方式
TDI可滤除高速血流信号,捕捉低速心肌组织的多普勒频移,将心肌运动呈现为多普勒图像,定量探测心肌和瓣环的运动情况(E′和A′),还可检测纵向和径向室壁运动。其对左心室纵向收缩的检测敏感度高,可诊断EF正常的亚临床左心室功能障碍。缺点是准确性受探查声波方向与室壁运动方向间夹角影响,且不能区分被动运动(传导和牵拉)和主动运动(收缩和舒张)。
STI基本原理是:先在心室壁二维声像图中选定感兴趣区,分析软件根据组织灰阶自动逐帧追踪心肌组织图像像素斑点在心动周期内的位置、位移,并与第一帧图像比较,计算各节段心肌的变形,可追踪特定心肌纤维的运动轨迹。与多普勒效应无关,不依赖角度,优于TDI。能定量描述三个维度形变。主要缺点是至少要获得连续3个规律的心动周期高质量图像,因此声窗条件差、心律失常、图像采集帧频低(帧频≥70帧/s才能实时反映正常心率状态下的心肌运动)时,检查技术难度大。Yan等[22]利用STI检查LVEF均>60%的慢性肾脏病(CKD)患者心脏功能,提示左心室三个方向应变率(即心室壁形变发生速度,等于单位长度纤维缩短速度)均异常。因此EF稳定CKD患者也会出现心肌应变能力下降。
STI还可检测左心室收缩的同步性。一项145例CKD患者的研究中,54%有左室收缩不同步[23]。单次透析治疗后,其中50%患者病情加重,尤其在LVMI低和心肌收缩速率高者中更明显。存在左心室收缩不同步者(平均LVEF 48%±12%)2年死亡率更高[24]。
此外,左心室局部收缩功能障碍也影响预后。单次透析治疗前、中、后三次心脏超声检查发现,透析诱导的左心室局部收缩功能障碍发生率达27%,且半数在透析开始后1h内发生;随访16.4个月(中位时间)发现这类患者死亡率高[25]。且透析中出现室壁运动异常者,1年后LVEF较基线下降,因此有人提出“反复出现透析诱导心肌抑顿可导致心肌纤维化和永久性收缩功能障碍”的假说[26]。
左心室舒张功能障碍 舒张功能障碍表现为心肌顺应性下降和左心室舒张不足,心室充盈压升高,左心房增大。相关危险因素老年、高血压、糖尿病、左心室肥大、心脏冠脉疾病和渗出性心肌炎均是ESRD常见并发症。透析患者心脏舒张功能障碍发病率高达48%~73%[27]。
影响心脏舒张功能的因素非常复杂,常需要结合多种超声心动图测量方法综合分析(图2)
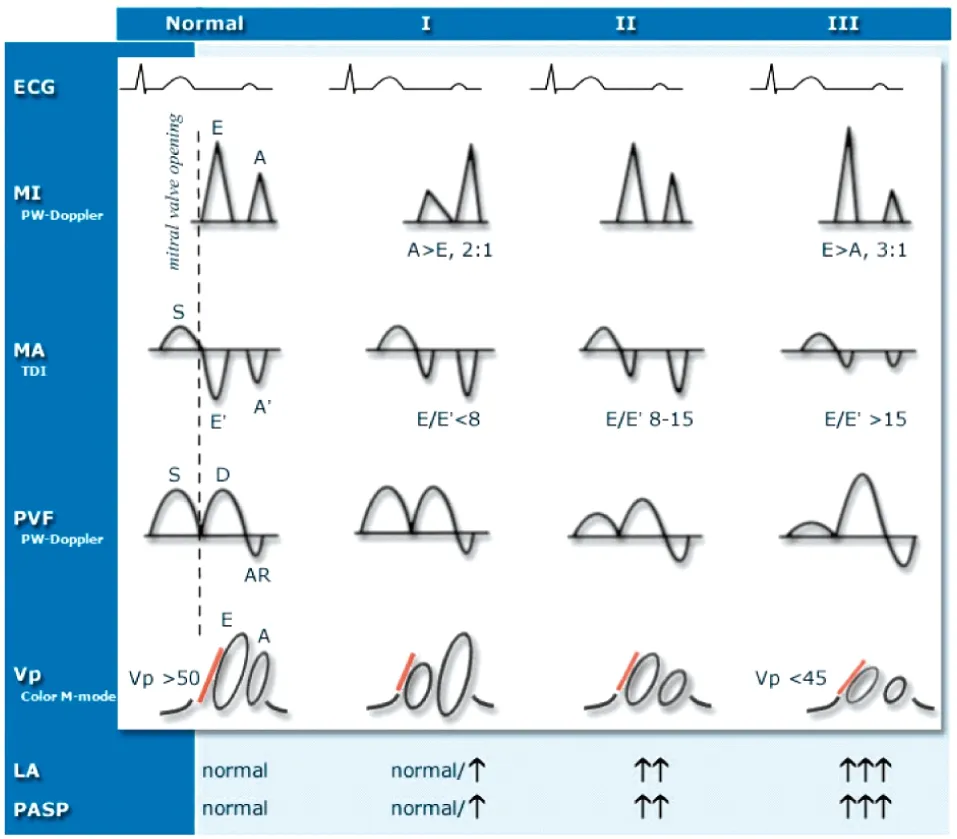
图2 判断心脏舒张功能异常的各项指标[29]Ⅰ:早期心肌松弛能力受损; Ⅱ:中度舒张功能障碍(假性正常);Ⅲ:左心室充盈障碍 (左心室顺应性下降),ECG:心电图; MI:二尖瓣血流速度; MA:二尖瓣环运动速度;PVF:肺静脉血流速度;Vp:舒张早期血流播散速度; LA:左心房;PASP:肺动脉收缩压
彩色多普勒血流频谱(CDFI-PW)测二尖瓣血流速度是反映舒张功能的主要指标之一。临床上采用左心室舒张充盈早期的二尖瓣跨瓣峰值血流速度(E)与心房收缩期跨瓣峰值血流速度(A)的比值(E/A),来判断舒张功能。正常心室主动舒张的跨瓣血流速高于心房收缩产生的血流速,E/A>1;舒张功能障碍时,心室充盈跨瓣血流速降低,出现E/A<1;但容量负荷过重且充盈压很高时,即使舒张功能障碍,E也会被动升高,出现二尖瓣E/A比值正常的假象。从而低估心脏舒张功能不全的发生率。
TDI提供了更敏感、特异的诊断信息,因二尖瓣环TDI-PW比传统CDFI-PW受前负荷影响更小。CDFI舒张早期跨二尖瓣血流峰值速度(E)和TDI舒张早期二尖瓣环扩张峰值速度(E′)比值,E/E′,与左心室充盈压正相关。而E/E′和E′/A′(TDI心房收缩期二尖瓣环扩张峰值速度)均能鉴别E/A假性正常化现象(图2)。已通过TDI证明即将开始透析患者的右心室功能不全发生率很高[28]。但缺少前瞻性研究证实这类患者是否容易出现充血性心力衰竭。
二维应变超声心动图的技术基础是STI,通过测量心肌应变率(SR)来反映舒张功能。应变(Strain)是心肌在一个心动周期内变形程度,S=ΔL/L0=(L-L0)/L0(L0为基础长度,L为形变后长度),负值为心肌缩短,正值为伸长。以一个心动周期的时间(x轴)对S(y轴)作图,即应变曲线。SR即心肌发生应变的速度,对应曲线上的斜率(单位:s-1)。SR变负为收缩开始,变正为收缩已结束。Wang等[30]研究显示E(cm·s-1)/SRIVR(等容舒张期应变率)(s-1)≥236 cm时,提示出现舒张功能下降。77例无症状透析患者,STI检查结果显示LVEF稳定者中48%存在舒张功能障碍[31]。由于入选患者透析均超过1年,因此实际透析人群中舒张功能障碍发生率更高。
研究已表明,单纯舒张功能障碍或合并其他临床及超声心动图参数异常是心血管不良终点和死亡率的风险预测指标[32-33]。一项队列研究纳入129例MHD患者,舒张功能障碍占73%,随访17±7个月后,舒张功能进一步下降和患者死亡率升高相关(P=0.012),并且是心血管事件预测指标(HR 2.2;CI 1.1~4.3;P=0.021)[34]。在另一组平均估算的肾小球滤过率18.8±7.0 ml/(min·1.73m2)的CKD患者中,62%接受透析治疗,随访至少2.4年后,心肌组织舒张速度是预后的独立预测因素(HR 0.8,P=0.05)[35]。
小结:大多数将MHD患者心血管事件作为监测指标或观察终点的研究,均以常规二维超声心动图为参考。但在MHD人群中,对异常指标的理解应与总体相区别。MHD患者容量、营养状态波动大,检测重复性差;LVMI和LVEF等常规二维超声诊断指标的测量和计算存在误差。因此建议患者应在非透析日、达到干体重时进行心脏超声检查;而LVMI等检测指标应通过身高2.7来校正。一些新型超声技术更精确,诊断指标更多元,有利于提高早期心脏结构/功能诊断敏感度和特异度。但目前相关研究大多局限于心血管疾病人群,在MHD患者中应用的研究不足。
目前尚无关于MHD患者超声心动图检查频率的统一建议。但至少应在诱导透析前安排一次常规二维超声心动图检查,以便与随访检查结果对比,及时发现心脏结构、功能变化,提早干预。笔者建议每年在非透析日、达干体重时至少安排一次超声心动图检查,协助评估患者容量状态、发现心脏潜在结构和功能病变。
1 London GM,Pannier B,Guerin AP,et al.Alterations of left ventricular hypertrophy in and survival of patients receiving hemodialysis:follow-up of an interventional study.J Am Soc Nephrol,2001,12(12):2759-2767.
2 Foley RN,Parfrey PS,Harnett JD,et al.The prognostic importance of left ventricular geometry in uremic cardiomyopathy.J Am Soc Nephrol,1995,5(12):2024-2031.
3 Wang H,Liu J,Yao XD,et al.Multidirectional myocardial systolic function in hemodialysis patients with preserved left ventricular ejection fraction and different left ventricular geometry.Nephrol Dial Transplant,2012,27(12):4422-4429.
4 Harnett JD,Murphy B,Collingwood P,et al.The reliability and validity of echocardiographic measurement of left ventricular mass index in hemodialysis patients.Nephron,1993,65(2):212-214.
5 Martin LC,Barretti P,Cornejo IV,et al.Influence of fluid volume variations on the calculated value of the left ventricular mass measured by echocardiogram in patients submitted to hemodialysis.Ren Fail,2003,25(1):43-53.
6 Zoccali C,Benedetto FA,Mallamaci F,et al.Prognostic impact of the indexation of left ventricular mass in patients undergoing dialysis.J Am Soc Nephrol,2001,12(12):2768-2774.
7 Tripepi G,Benedetto FA,Mallamaci F,et al.Left atrial volume in end-stage renal disease:a prospective cohort study.J Hypertens.2006; 24(6):1173- 1180.
8 Kim SJ,Han SH,Park JT,et al.Left atrial volume is an independent predictor of mortality in CAPD patients.Nephrol Dial Transplant,2011,26(11):3732-3739.
9 Ozdogan O,Kayikcioglu M,Asci G,et al.Left atrial volume predicts mortality in low-risk dialysis population on long term low-salt diet.Am Heart J,2010,159(6):1089-1094.
10 Patel RK,Jardine AG,Mark PB,et al.Association of left atrial volume with mortality among ESRD patients with left ventricular hypertrophy referred for kidney transplantation.Am J Kidney Dis,2010,55(6):1088-1096.
11 Tripepi G,Benedetto FA,Mallamaci F,et al.Left atrial volume monitoring and cardiovascular risk in patients with end-stage renal disease:a prospective cohort study.J Am Soc Nephrol,2007,18(4):1316-1322.
12 Wang A.Vascular and valvular calcification in chronic peritoneal dialysis patients.Int J Nephrol,2011,2011:198045.
13 Braun J,Oldendorf M,Moshage W,et al.Electron beam computed tomography in the evaluation of cardiac calcifications in chronic dialysis patients.Am J Kidney Dis,1996,27(3):394-401.
14 贾凤玉,徐斌,龚德华,等.维持性血液透析患者心血管钙化的发生率及分布特点.肾脏病与透析肾移植杂志,2014,23(5):401-406.
15 Sharma R,Pellerin D,Gaze DC,et al.Mitral annular calcification predicts mortality and coronary artery disease in end stage renal disease.Atherosclerosis,2007,191(2):348-354.
16 Bellasi A,Ferramosca E,Ratti C,Block G,Raggi P.Cardiac valve calcification is a marker of vascular disease in prevalent hemodialysis patients.J Nephrol,2012,25(2):211-218.
17 Dyadyk OI,Bagriy AE,Yarovaya NF.Disorders of left ventricular structure and function in chronic uremia:how often,why and what to do with it? Eur J Heart Fail,1999,1(4):327- 336.
18 Foley RN,Parfrey PS,Kent GM,et al.Serial change in echocardiographic parameters and cardiac failure in end-stage renal disease.J Am Soc Nephrol,2000,11(5):912-916.
19 Yamada S,Ishii H,Takahashi H,et al.Prognostic value of reduced left ventricular ejection fraction at start of hemodialysis therapy on cardiovascular and all-cause mortality in end-stage renal disease patients.Clin J Am Soc Nephrol,2010,5(10):1793-1798.
20 Wang AY,Lam CW,Chan IH,et al.Sudden cardiac death in end-stage renal disease patients:a 5-year prospective analysis.Hypertension,2010,56(2):210-216.
21 Mangrum JM,Lin D,Dimarco P,et al.Prognostic value of left ventricular systolic function in renal dialysis patients.Heart Rhythm,2006,V3N1(Suppl):s154.
22 Yan P,Li H,Hao C,et al.2D-Speckle tracking echocardiography contributes to early identification of impaired left ventricular myocardial function in patients with chronic kidney disease.Nephron Clin Pract,2011,118(3):232-240.
23 Hayashi SY,Nowak J,Lindholm B,et al.Left ventricular mechanical dyssynchrony in patients with different stages of chronic kidney disease and the effects of hemodialysis.Hemodial Int,2013,17(3):346-358.
24 AlJaroudi W,Aggarwal H,Venkataraman R,et al.Impact of left ventricular dyssynchrony by phase analysis on cardiovascular outcomes in patients with endstage renal disease.J Nucl Cardiol,2010,17(6):1058-1064.
25 Assa S,Hummel YM,Voors AA,et al.Hemodialysisinduced regional left ventricular systolic dysfunction:prevalence, patient and dialysis treatment-related factors,and prognostic significance.Clin J Am Soc Nephrol.2012;7(10):1615-1623.
26 Burton JO,Jefferies HJ,Selby NM,et al.Hemodialysis- induced cardiac injury:determinants and associated outcomes.Clin J Am Soc Nephrol,2009,4(5):914-920.
27 Park M,Hsu CY,Li Y,et al.Associations between kidney function and subclinical cardiac abnormalities in CKD.J Am Soc Nephrol,2012,23(10):1725-1734.
28 Said K,Hassan M,Baligh E,et al.Ventricular function in patients with end-stage renal disease starting dialysis therapy:a tissue Doppler imaging study.Echocardiography,2012,29(9):1054-1059.
29 Mereles D.Cardiac function and PA pressure.Echobasics,http://www.echobasics.de/diastole-en.html
30 Wang J,Khoury DS,Thohan V,et al.Global diastolic strain rate for the assessment of left ventricular relaxation and filling pressures.Circulation,2007,115(11):1376-1383.
31 de Bie MK,Ajmone Marsan N,Gaasbeek A,et al.Left ventricular diastolic dysfunction in dialysis patients assessed by novel speckle tracking strain rate analysis:prevalence and determinants.Int J Nephrol,2012,2012:963504.
32 Wang AY,Wang M,Lam CW, t al.Left ventricular filling pressure by Doppler echocardiography in patients with end-stage renal disease.Hypertension,2008,52(1):107-114.
33 Sharma R,Pellerin D,Gaze DC,et al.Mitral peak Doppler E-wave to peak mitral annulus velocity ratio is an accurate estimate of left ventricular filling pressure and predicts mortality in end-stage renal disease.J Am Soc Echocardiogr,2006,19(3):266-273.
34 Barberato SH,Bucharles SG,Sousa AM,et al.Prevalence and prognostic impact of diastolic dysfunction in patients with chronic kidney disease on hemodialysis.Arq Bras Cardiol,2010,94(4):457-462.
35 Rakhit DJ,Zhang XH,Leano R,et al.Prognostic role of subclinical left ventricular abnormalities and impact of transplantation in chronic kidney disease.Am Heart J,2007,153(4):656-664.
(本文编辑 律 舟)
南京军区南京总医院国家肾脏疾病临床研究中心进修医生招生简章
医学进修教育是医学教育的重要组成部分,其目的是使基层卫生技术人员通过进修学习更新知识、补充本学科、本专业发展的前沿知识与理论,以提高其专业理论水平和工作能力。我科历来重视进修生的培训教育工作,作为首批国家肾脏疾病临床研究中心,担负着培养各级医卫人员业务技术水平的重任。我们热忱欢迎各兄弟医院的同仁来我院进修学习。
一、招生专业及进修条件
目前我中心招收五个专业的进修医生:(1)肾脏病临床;(2)血液净化;(3)重症肾脏病(肾科ICU)、(4)肾脏病理;(5)肾脏移植。
进修生接受基本条件如下:
1.思想端正,自觉遵守医院规章制度,工作积极上进,对肾脏病专业兴趣浓厚。
2.具备正规医学院校本科毕业学历、医师资格证、医师执业证书以及两年以上临床工作经验。
3.进修生结业后授予国家肾脏疾病临床中心培训合格证书及医院的进修结业证。
4.各专业进修时间要求:(1)肾脏病临床:申请时间为6个月或1年,申请半年者全安排在内科病房,申请1年的可选择以下三种模式:1年内科病房;9个月内科病房+3个月监护病房;9个月内科病房+3个月血液透析,申请时请注明。(2)血液净化:进修时间分3个月或6个月。(3)重症肾脏病(肾科ICU):进修时间不短于6个月。(4)肾脏病理:申请进修时间为6个 月或1年,不接收6个月以下的进修。(5)肾脏移植:进修时间不短于6个月。
二、录取及入学时间
每年招收两期,报到时间为每年的3月和9月,具体报道时间以进修录取通知为准。进修期限为6个月或1年。
三、招生程序
1.邮寄纸质版进修申请表(加盖医院公章)。 邮寄地址:江苏省南京市中山东路305号南京军区南京总医院医务部教学办(收) 邮政编码:210016;(请采用EMS邮寄,其他快递可能丢失) 联系电话:025-80861371 注:进修表格在研究所网站(www.njszb.com)或医院网站(www.njzy666.com)下载。
2.填表时请以本人实际情况逐项填写完整,不得漏项。
3.如符合招生条件,我科招生小组将择优录取。确定人选后,由医务部教学办通知进修人员所在单位,发放录取通知书。
Cardiovascular changes and the diagnosis using ultrasonography in patients with hemodialysis
LIChuan,GONGDehua
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
The mortality of hemodialysis patients is high. Cardiovascular disease accounts for almost half of it, one of the most common cause is sudden cardiac death. Early detection of abnormalities in cardiac structure and function may be important. Echocardiography provides invaluable information on cardiac morphology and function. However, the limitation of it is that image quality can vary depending on the operator’s experience and the patient’s acoustic window. The hemodialysis patients undergo regular hemodynamic changes, that also may affect echocardiographic findings. An understanding of the prognostic significance and interpretation of echocardiographic results in this setting is important for patient care. There are some emerging techniques in echocardiographic imaging that can provide more detailed and accurate information compared with conventional 2-dimensional echocardiography. Use of these novel tools may further our understanding of the pathophysiology of cardiac disease in patients undergoing hemodialysis.
hemodialysis echocardiography cardiovascular disease
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2015-08-04

