低氧诱导因子-1α在喹啉酸诱导的PC12细胞损伤中的作用
李永金,杨开勇,张 谊,陈月芳,端礼荣,黄晓佳
(江苏大学医学院 1.药理学系、2.基础医学与预防医学实验中心,江苏 镇江 212013)
低氧诱导因子-1α在喹啉酸诱导的PC12细胞损伤中的作用
李永金1,杨开勇1,张 谊1,陈月芳2,端礼荣2,黄晓佳1
(江苏大学医学院 1.药理学系、2.基础医学与预防医学实验中心,江苏 镇江 212013)
目的 探讨低氧诱导因子-1(hypoxia inducible factor-1α,HIF-1α)在喹啉酸诱导大鼠肾上腺嗜铬细胞瘤PC12细胞损伤中的作用。方法 用不同浓度的喹啉酸(2.5,5和10 mmol·L-1)处理PC12细胞24 h诱导细胞损伤,采用噻唑蓝还原法和乳酸脱氢酶漏出率检测法测定细胞损伤程度,采用丙二醛和超氧化物歧化酶试剂盒检测细胞内氧自由基水平,Hoechst 33258单荧光染色法观察细胞凋亡,免疫荧光染色法检测HIF-1α在细胞内的表达,免疫印迹法检测细胞HIF-1α、蛋白激酶B(Akt)、磷酸化Akt(phosphorylated-Akt,p-Akt)、淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)和 Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的表达。结果 喹啉酸可剂量依赖性地诱导PC12细胞损伤,导致细胞内氧自由基增多和细胞凋亡。同时,喹啉酸可使PC12细胞HIF-1α表达上调并聚集于核内;p-Akt表达增加,Bax/Bcl-2表达比例增加。结论 HIF-1α和Akt介导了喹啉酸诱导PC12的细胞凋亡;此外,氧化应激过程也可能参与了细胞损伤。
喹啉酸;PC12细胞;细胞损伤;细胞凋亡;HIF-1α;信号通路;氧化应激
许多神经系统疾病,如脑缺血、阿尔茨海默病、帕金森病等的发生、发展过程,均与兴奋性神经递质,如谷氨酸,毒性损伤有关。喹啉酸(quinolinic acid,QA)是一种内源性谷氨酸受体亚型N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid receptor,NMDA)受体激动剂,可诱导神经细胞损伤;其在大脑中含量大量增加是引起神经元损伤的一个重要原因[1],因此被广泛用于制作神经细胞损伤模型。
在神经元损伤过程中,有多种因子参与了细胞的死亡过程,其中低氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)受到了广泛的关注。HIF-1广泛存在于哺乳动物细胞内,是目前发现的一种能感受细胞氧分压的调控蛋白。HIF-1由氧敏感的HIF-1α和组成性表达的HIF-1β两个亚基组成,其中HIF-1α是主要的活性亚基[2]。在常氧下,细胞HIF-1α通过泛素-蛋白酶系统被迅速降解,在胞质中几乎检测不到;在低氧下,HIF-1α变得稳定,继而通过其核定位信号转移至细胞核,与HIF-1β结合形成异二聚体HIF-1[2-3]。HIF-1通过作用于靶基因上的低氧反应元件调控基因的表达,参与血管形成、糖代谢、细胞存活和增殖等过程[2-3]。在缺血性或出血性脑损伤后,大鼠脑组织HIF-1α表达明显提高[4-5];而离体培养的细胞经缺氧缺糖处理后,HIF-1α表达也明显提高,且出现细胞核内聚集[6],表明HIF-1调节了神经细胞的损伤过程。但HIF-1α是否调节神经细胞兴奋性损伤,其作用的分子机制目前仍不明确。
本实验选用大鼠肾上腺嗜铬细胞瘤PC12细胞作为实验对象,以不同浓度QA进行损伤,以模拟神经细胞兴奋性毒性损伤,探讨HIF-1α在PC12细胞损伤过程中的作用及其信号通路,为证实HIF-1α及其信号通路参与神经元兴奋性损伤提供依据。
1 材料与方法
1.1 材料大鼠肾上腺嗜铬细胞瘤PC12细胞株来自于中国科学院上海细胞库;DMEM培养基和胰蛋白酶均购自美国Gibco公司;新生牛血清购自杭州四季青生物工程材料有限公司。QA购自美国Sigma公司;乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malonic dialdehyde,MDA)检测试剂盒均均购自苏州科铭生物公司。噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)购自美国Amresco公司;Hoechst 33258购自美国Sigma公司。兔抗B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)单克隆抗体购自美国Cell Signaling Technology公司;兔抗HIF-1α、蛋白激酶B(Akt)、磷酸化Akt(p-Akt)、Bcl-2相关X蛋白(bcl-2 associated X protein,Bax)多克隆抗体均购自美国ImmunoWay公司;鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体购自上海康城生物有限公司;辣根过氧化物酶或荧光基团标记的二抗均购自北京康为世纪公司;底物化学发光试剂购自美国Millipore公司。其余试剂均为国产分析纯。
1.2 细胞培养及药物处理将PC12细胞用含10%新生牛血清、1×105U·L-1青霉素、100 mg·L-1链霉素的高糖DMEM培养基培养,置于含5%CO2和95%空气的37℃培养箱中,每2 d换液1次,4 d传代1次,取对数生长期细胞进行实验。
将PC12细胞以5×104mL-1密度接种于96孔或24孔板,置于培养箱中培养24 h后,加入不同浓度的QA(终浓度分别为2.5、5、10 mmol·L- 1)处理24 h。对照组细胞中加入相同体积PBS。
1.3 细胞存活率检测以MTT还原法检测细胞存活率。药物处理结束后,培养板每孔中加入MTT(终浓度为0.5 g·L-1),37℃反应4 h,吸去上清后每孔加入100 μL二甲基亚砜,振荡5 min,置酶标仪上于490 nm处测定各孔吸光度值。
此外,以细胞LDH漏出率检测法检测细胞死亡率,按照LDH试剂盒说明书进行操作并计算各组胞内LDH的含量。
1.4 细胞内氧自由基含量检测实验分组同上,按照SOD和MDA检测试剂盒说明书进行操作,计算各组的胞内SOD和MDA含量。
1.5 细胞形态学检测在PC12细胞经不同浓度QA处理后,于普通光学倒置显微镜下观察细胞形态并拍照,观察细胞形态变化。
工科院校教师专业化发展思想的缺失,直接给新教师培训带来三大“灾难”:学校领导不重视,职能部门不积极,二级教学单位不主动;新教师培训过程形式化、表面化,违背“教学知识、教学技能、教学能力”逐层递进发展规律;新教师培训评价的“教学性”弱化,培训效果不理想,培训目标达成度低。
1.6 细胞凋亡检测将PC12细胞接种于玻璃片上,经药物处理后弃去培养液,经PBS洗涤后,用冰甲醇固定细胞10 min。吸去固定液,用PBS洗涤后加入Hoechst 33258 染色液(终浓度为10 mg·L-1)于室温下反应5 min,在荧光显微镜下观察并拍照。凋亡细胞表现为细胞核皱缩,荧光亮度增加。
1.7 细胞内HIF-1α的表达定位检测将PC12细胞接种于玻璃片上,经药物处理后固定细胞,以0.3% Triton X-100透化10 min,羊血清封闭30 min后,滴加抗HIF-1α抗体(1 ∶300),4℃反应过夜;PBS洗涤后加入Cy3标记的二抗(1 ∶600)室温下避光反应1 h,加入Hoechst 33258染色液室温下反应5 min染细胞核,用50%甘油封片,置荧光显微镜下观察。
1.8 细胞HIF-1α、Akt、p-Akt、Bax、Bcl-2蛋白的表达检测细胞经不同浓度QA处理后,收集细胞,提取总蛋白并测定蛋白浓度。将30 μg蛋白进行SDS-PAGE电泳、转膜并封闭后,加入抗HIF-1α(1 ∶1 000)、Akt(1 ∶1 000)、p-Akt(1 ∶1 000)、Bax(1 ∶1 000)、Bcl-2(1 ∶1 000)和GAPDH(1 ∶7 000)抗体于4℃反应过夜。洗涤后,将膜和相应二抗(1 ∶5 000)在室温下反应1 h,以底物化学发光试剂显色后并以凝胶成像系统(ChampGel 5000,北京赛智创业科技有限公司)进行扫描,以Image J软件分析各条带灰度值。以GAPDH条带灰度值作参照,进行半定量分析。

2 结果
2.1 不同浓度QA对PC12细胞存活率的作用MTT还原法检测实验结果表明,如Fig 1A所示,PC12细胞经不同浓度QA(2.5~10 mmol·L-1)处理24 h,细胞存活率逐渐降低,2.5 mmol·L-1QA即可引起细胞出现明显损伤。经计算,QA引起PC12细胞损伤的50%抑制浓度(IC50)为8.7 mmol·L-1。此外,如Fig 1B所示,LDH漏出率实验结果也表明,QA(2.5~10 mmol·L-1)可剂量依赖性地引起PC12细胞损伤。
2.2 不同浓度QA损伤后PC12细胞内SOD和MDA水平变化机体在正常状态下存在氧化与抗氧化的平衡体系,内源性抗氧化酶如SOD可清除氧自由基,保护细胞免受损伤[7]。当机体抗氧化体系能力减弱时,过量氧自由基可攻击生物膜而引发脂质过氧化反应,导致过氧化产物如MDA大量产生[8],因而SOD活性降低和MDA含量增加均提示氧自由基水平的增加,亦可间接反映了细胞损伤的程度。在本实验中,采用SOD和MDA检测法评价细胞内氧自由基水平。如Fig 2所示,PC12细胞经不同浓度QA(2.5~10 mmol·L-1)处理24 h后,随着QA的浓度增大,细胞内SOD含量明显下降,而MDA的含量明显增加。
2.3 不同浓度QA对PC12细胞的形态影响如Fig 3所示,对照组PC12细胞形态完整,胞体饱满,立体感强,周围有光晕,突起明显。经5 mmol·L-1QA损伤24 h后,PC12细胞突起明显减少并出现死亡;而10 mmol·L-1QA可引起细胞透光率下降,胞体明显皱缩,轴突变短变少,并导致大量细胞死亡。2.5 mmol·L-1QA对PC12细胞形态无明显作用。
2.4 不同浓度QA对PC12细胞凋亡的影响荧光染料Hoechst 33258能少许透过正常细胞膜,使正常细胞产生低强度蓝色荧光;而凋亡细胞由于膜通透性增强,进入细胞内的染料比正常细胞多,故荧光强度明显增加。如Fig 4所示,经不同浓度QA(2.5~10 mmol·L-1)处理24 h后,对照组细胞核呈现均匀弥散荧光,5 mmol·L-1QA可导致细胞呈现细胞核浓缩碎裂,出现凋亡小体;10 mmol·L-1QA则可导致大量细胞出现凋亡。
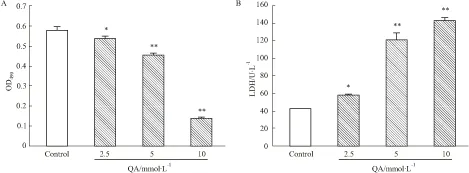
Fig 1 Treatment with QA decreased viability in PC12 cells ±s, n=5)
After the treatment with QA for 24 h, the viability of PC12 cells was significantly decreased.*P<0.05,**P<0.01vscontrol.
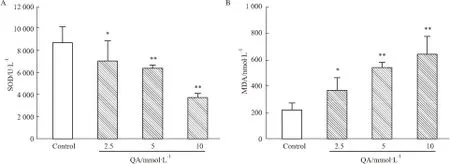
Fig 2 QA increased intracellular levels of SOD and MDA in PC12 ±s, n=5)
After the challenge with QA for 24 h, the intracellular SOD levels were decreased and the MDA levels were increased.*P<0.05,**P<0.01vscontrol.
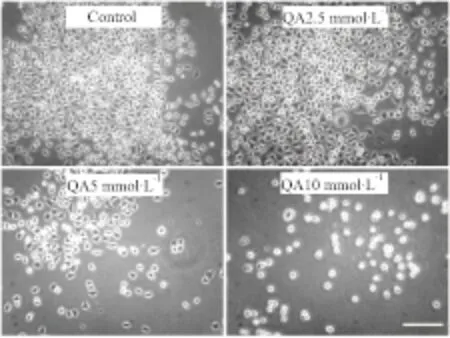
Fig 3 QA decreased number of cellular process and cell viability in PC12 cells
Morphological analysis showed that PC12 cells exhibited decreased the number of cellular process and cell viability after the treatment with QA for 24 h. Scale Bar = 50 μm.
2.5 不同浓度QA对PC12细胞HIF-1α表达定位的影响在细胞处于不同状态下,HIF-1α的表达位置和表达量也出现变化,进而导致其功能的变化。本实验采用荧光免疫组化实验检测HIF-1α在细胞内的表达定位。如Fig 5所示,在对照组细胞中,HIF-1α几乎不表达;2.5 mmol·L-1QA处理24 h后,PC12细胞HIF-1α出现低表达;5 mmol·L-1QA则可明显诱导细胞核内HIF-1α聚集;而10 mmol·L-1QA处理使细胞核内HIF-1α表达明显提高。
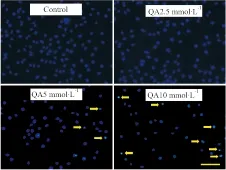
Fig 4 QA enhanced cell apoptosis in PC12 cells
After the treatment with QA for 24 h, PC12 cells underwent cell apoptosis. Scale Bar = 50 μm.

Fig 5 QA induced nucleic accumulation of HIF-1α in PC12 cells
PC12 cells exhibited nucleic HIF-1α accumulation after the treatment with QA for 24 h. Scale Bar = 20 μm.
2.6 不同浓度QA对PC12细胞HIF-1α、p-Akt、Akt、Bcl-2、Bax蛋白表达的作用在细胞出现损伤过程中,Akt发挥了重要作用,其被激活(磷酸化)后会启动细胞凋亡途径,造成细胞凋亡相关蛋白Bax/Bcl-2表达比例出现增高,进而导致细胞凋亡。本实验中,通过Western blot方法检测HIF-1α、p-Akt、Bax、Bcl-2蛋白质的表达变化。如Fig 6所示,经不同浓度QA(2.5~10 mmol·L-1)处理24 h后,PC12细胞p-Akt表达明显增加,而Akt表达无明显变化。同时,QA(2.5~10 mmol·L-1)可引起Bax和Bcl-2表达出现变化,导致Bax/Bcl-2表达比值明显增加。
3 讨论
本实验结果显示,QA(2.5~10 mmol·L-1)可剂量依赖性地引起大鼠PC12细胞损伤,导致细胞内氧自由基水平升高,出现凋亡。此外,QA也诱导了PC12细胞HIF-1α高表达和细胞核聚集、Akt磷酸化、Bax/Bcl-2表达比例上调。这些结果表明,QA可通过激活HIF-1α及Akt,进而启动细胞凋亡程序,导致PC12细胞发生凋亡。

Fig 6 QA increased expressions of HIF-1α,p-Akt
After the challenge with QA in PC12 cells for 24 h, the expressions of HIF-1α,Akt,p-Akt,Bcl-2 and Bax were analyzed by immunoblotting. QA induced the expressions of HIF-1α, p-Akt and increased the relative expression of Bax/Bcl-2.*P<0.05,**P<0.01vscontrol.
兴奋性神经毒性是许多神经系统疾病的共同基础,其中谷氨酸受体所介导的兴奋性毒性尤其重要。QA可持续激动神经元膜上NMDA受体,导致钙离子内流使细胞钙超载,引起细胞损伤[9];又可刺激抑制星形胶质细胞对谷氨酸的再摄取,加重神经损伤[10, 11]。同时,QA也可引起活性氧大量释放,导致神经组织氧化损伤,如QA可引起大鼠脑组织大量产生活性氧,导致脂质过氧化损伤;而NMDA受体拮抗剂MK-801可减少活性氧产生,起到神经保护作用[12-13]。本实验中,不同浓度QA作用24 h可明显引起PC12细胞存活率减低,LDH漏出增加,突起减少,胞体变圆。此外,QA可引起细胞SOD和MDA水平变化,提示细胞损伤可能与细胞内氧自由基水平增加有关。
此外,在神经细胞损伤过程中,HIF-1α及其信号通路发挥了重要作用。离体培养的大鼠神经元经缺血样损伤后,HIF-1α表达明显增加,并集中于核内,过表达HIF-1α可导致细胞死亡[14]。动物经受各种脑损伤如缺血性损伤、撞击性脑外伤后,脑组织HIF-1α表达上调,HIF-1α抑制剂如2-甲氧雌甾二醇则具有明显的保护作用[14-15],表明HIF-1α可能参与了神经损伤。但另一些证据却表明HIF-1α参与了神经细胞对损伤的适应过程,与野生型小鼠相比,神经元特异性HIF-1α基因敲除小鼠对缺氧更加敏感,神经细胞损伤更为严重[16];HIF-1α抑制剂可减弱低氧预处理引起的星形胶质细胞对氧化损伤的适应作用[17]。这些不一致的实验结果提示在神经细胞损伤过程中,HIF-1α可能具有双向适应性调节作用:HIF-1α轻度或中度诱导表达可促进细胞适应损伤,而过量表达则导致细胞死亡[18-19]。本实验结果表明,5~10 mmol·L-1QA作用24 h可明显诱导PC12细胞HIF-1α表达,且呈现剂量依赖性,表明HIF-1α信号通路可能参与了PC12细胞损伤过程。同时,HIF-1α的活化受到多种分子的调控,如活性氧可通过激活一些细胞内信号,继而磷酸化HIF-1α的641和643位的丝氨酸位点,使其稳定停留于细胞核内发挥其促基因转录的作用[20-21];Akt也可通过调节其下游分子如叉头样转录因子O4(forkhead transcription factor O4,FOXO4)、糖原合成酶3β(the glycogen synthase kinase 3 β,GSK3β)等导致HIF-1α的稳定[22-23]。本实验结果表明,QA可引起PC12细胞内活性氧水平升高和Akt的活化,进而导致HIF-1α表达上调,提示ROS/Akt/HIF-1α可能参与了细胞的损伤过程。
荧光染色实验结果证实,PC12细胞损伤后表现出体积缩小,细胞核皱缩等典型凋亡表现,表明QA可诱导细胞出现了凋亡性死亡。细胞凋亡是一种复杂的生化过程,有许多蛋白质参与了这一过程,包括Bax和Bcl-2。Bax是一种凋亡前体蛋白,可刺激细胞色素C释放和含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)的激活,诱导细胞发生凋亡;而Bcl-2可抑制细胞色素C的释放,是一种抗凋亡蛋白[24-25]。细胞Bax表达增加或Bcl-2表达减低均提示细胞进入凋亡状态,Bax/Bcl-2比值是一种重要的凋亡生化指标[26]。已有研究表明,HIF-1α的上调也可引起Bax/Bcl-2比值上升,进而发生细胞凋亡[27];抑制HIF-1α的表达则可减少Bax/Bcl-2比值[28]。与以上结果相一致,本实验中PC12细胞经QA处理后HIF-1α表达上调,Bax/Bcl-2表达比值增加,确认QA可通过稳定HIF-1α表达,继而上调Bax/Bcl-2表达比例。
综上所述,本研究以大鼠PC12细胞作为实验对象,证明QA可剂量性导致细胞出现凋亡,同时诱导HIF-1α高表达,Akt磷酸化,表明Akt/HIF-1α信号通路可能参与了该损伤过程。该结果提示,HIF-1α参与了神经兴奋毒性,抑制HIF-1α及其下游信号通路可能具有抑制兴奋性神经细胞损伤的作用。此外,QA也可能通过上调细胞内氧自由基水平引起了HIF-1α的活化,其可能分子机制将会在下一步的实验中得到研究。
[1] 朱丽霞, 董 志, 周歧新, 等. 粉防己碱对喹啉酸致海马神经元损伤的保护作用[J]. 中国药理学通报, 2005, 21(6):718-20.
[1] Zhu L X, Dong Z, Zhou Q X, et al. Protective effect of Tet on cytotoxicity-induced by Qinolinic acid in cultured hippocampal neurons of new-born rats [J].ChinPharmacolBull, 2005, 21(6):718-20.
[2] Semenza G L. Targeting HIF-1 for cancer therapy [J].NatRevCancer, 2003, 3(10): 721-32.
[3] 姚 娟, 马慧萍, 杨 燕, 等. 缺氧环境对PC12细胞损伤及HIF-1 mRNA表达水平的影响[J]. 中国药理学通报, 2011, 27(2):162-6.
[3] Yao J, Ma H P, Yang Y, et al. Anoxic injury and HIF-1 mRNA expression changes after hypoxia in PC12 cell [J].ChinPharmacolBull, 2011, 27(2):162-6.
[4] Dong Y, Li Y, Feng D, et al. Protective effect of HIF-1alpha against hippocampal apoptosis and cognitive dysfunction in an experimental rat model of subarachnoid hemorrhage [J].BrainRes, 2013, 1517: 114-21.
[5] Fang L Q, Xu H, Sun Y, et al. Induction of inducible nitric oxide synthase by isoflurane post-conditioning via hypoxia inducible factor-1alpha during tolerance against ischemic neuronal injury [J].BrainRes, 2012, 1451: 1-9.
[6] Jin J, Kang H M, Jung J, et al. Related expressional change of HIF-1alpha to the neuroprotective activity of exendin-4 in transient global ischemia [J].Neuroreport, 2014, 25(1): 65-70.
[7] Tanno M, Kuno A, Yano T, et al. Induction of manganese superoxide dismutase by nuclear translocation and activation of SIRT1 promotes cell survival in chronic heart failure [J].JBiolChem, 2010, 285(11): 8375-82.
[8] Mestre-Alfaro A, Ferrer M D, Banquells M, et al. Body temperature modulates the antioxidant and acute immune responses to exercise [J].FreeRadicRes, 2012, 46(6): 799-808.
[9] Pierozan P, Zamoner A, Soska A K, et al. Signaling mechanisms downstream of quinolinic acid targeting the cytoskeleton of rat striatal neurons and astrocytes [J].ExpNeurol, 2012, 233(1): 391-9.
[10] Torres F V, Da Silva Filho M, Antunes C, et al. Electrophysiological effects of guanosine and MK-801 in a quinolinic acid-induced seizure model [J].ExpNeurol, 2010, 221(2): 296-306.
[11] Tavares R G, Schmidt a P, Tasca C I, et al. Quinolinic acid-induced seizures stimulate glutamate uptake into synaptic vesicles from rat brain: effects prevented by guanine-based purines [J].NeurochemRes, 2008, 33(1): 97-102.
[12] Dobrachinski F, Bastos L L, Bridi J C, et al. Cooperation of non-effective concentration of glutamatergic system modulators and antioxidant against oxidative stress induced by quinolinic acid [J].NeurochemRes, 2012, 37(9): 1993-2003.
[13] Muller a C, Maharaj H, Maharaj D S, et al. Aciclovir protects against quinolinic-acid-induced oxidative neurotoxicity [J].JPharmPharmacol, 2005, 57(7): 883-8.
[14] Cheng Y L, Park J S, Manzanero S, et al. Evidence that collaboration between HIF-1alpha and Notch-1 promotes neuronal cell death in ischemic stroke [J].NeurobiolDis, 2014, 62: 286-95.
[15] Schaible E V, Windschugl J, Bobkiewicz W, et al. 2-Methoxyestradiol confers neuroprotection and inhibits a maladaptive HIF-1alpha response after traumatic brain injury in mice [J].JNeurochem, 2014, 129(6): 940-54.
[16] Sheldon R A, Osredkar D, Lee C L, et al. HIF-1 alpha-deficient mice have increased brain injury after neonatal hypoxia-ischemia [J].DevNeurosci, 2009, 31(5): 452-8.
[17] Chu P W, Beart P M, Jones N M. Preconditioning protects against oxidative injury involving hypoxia-inducible factor-1 and vascular endothelial growth factor in cultured astrocytes [J].EurJPharmacol, 2010, 633(1-3): 24-32.
[18] Fan X, Heijnen C J, Van Der Kooij M A, et al. The role and regulation of hypoxia-inducible factor-1alpha expression in brain development and neonatal hypoxic-ischemic brain injury [J].BrainResRev, 2009, 62(1): 99-108.
[19] Singh N, Sharma G, Mishra V. Hypoxia inducible factor-1: its potential role in cerebral ischemia [J].CellMolNeurobiol, 2012, 32(4): 491-507.
[20] Mylonis I, Chachami G, Samiotaki M, et al. Identification of MAPK phosphorylation sites and their role in the localization and activity of hypoxia-inducible factor-1α [J].JBiolChem, 2006, 281(44):33095-106.
[21] Zhou Q, Liu L Z, Fu B, et al. Reactive oxygen species regulate insulin-induced VEGF and HIF-1α expression through the activation of p70S6K1 in human prostate cancer cells [J].Carcinogenesis, 2007, 28(1): 28-37.
[22] Tang T T, Lasky L A. The forkhead transcription factor FOXO4 induces the down-regulation of hypoxia-inducible factor 1α by a von Hippel-Lindau protein-independent mechanism [J].JBiolChem, 2003, 278(32): 30125-35.
[23] Monttet D, Dumont V, Deccache Y, et al. Regulation of hypoxia-inducible factor-1α protein level during hypoxic conditions by the phosphatidylinositol 3-kinase/Akt/glycogen synthase kinase 3β pathway in HepG2 cells [J].JBiolChem, 2003, 278(33): 31277-85.
[24] Antonsson B, Conti F, Ciavatta A, et al. Inhibition of Bax channel-forming activity by Bcl-2 [J].Science, 1997, 277(5324): 370-2.
[25] Martinou J C, Youle R J. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics [J].DevCell, 2011, 21(1): 92-101.
[26] Shi L, Chen J, Yang J, et al. MiR-21 protected human glioblastoma U87MG cells from chemotherapeutic drug temozolomide induced apoptosis by decreasing Bax/Bcl-2 ratio and caspase-3 activity [J].BrainRes, 2010, 1352: 255-64.
[27] Naldini A, Morena E, Pucci A, et al. Hypoxia affects dendritic cell survival: role of the hypoxia-inducible factor-1α and lipopolysaccharide [J].JCellPhysiol, 2012, 227(2):587-95.
[28] Menrad H, Werno C, Schmid T, et al. Roles of hypoxia-inducible factor-1alpha (HIF-1alpha) versus HIF-2alpha in the survival of hepatocellular tumor spheroids [J].Hepatology, 2010, 51(6):2183-92.
Role of HIF-1α in quinolinic acid-induced injury in PC12 cells
LI Yong-jin1, YANG Kai-yong1, ZHANG Yi1, CHEN Yue-fang2, DUAN Li-rong2, HUANG Xiao-jia1
(1.DeptofPharmacology,SchoolofMedicine,Jiangsu212013,China;2.ExperimentalCenterofBasicandPreventiveMedicine,SchoolofMedicine,JiangsuUniversity,ZhenjiangJiangsu212013,China)
Aim To investigate the role of HIF-1α in PC12 cell injury induced by quinolinic acid. Methods PC12 cells were treated with quinolinic acid at the doses of 2.5, 5 and 10 mmol·L-1, the cell viability was determined by MTT reduction assay and LDH assay, the intracellular levels of oxygen species was measured by assessing SOD and MDA levels, cell apoptosis was determined by Hoechst 33258 staining, the intracellular distribution of HIF-1α was examined by HIF-1α immunostaining, and the expressions of HIF-1α,Akt,p-Akt,Bcl-2 and Bax were determined by immunoblotting analysis. Results Quinolinic acid induced cell injury in PC12 cells in a dose-dependent manner, and potentiated oxygen radical production and cell apoptosis. In addition, quinolinic acid enhanced HIF-1α expression and accumulation in nuclei. The p-Akt expression and Bax/Bcl-2 ratio was increased by quinolinc acid in PC12 cells. Conclusions HIF-1α and Akt mediate qunolinc acid-induced cell apoptosis in PC12 cells. And cellular oxidative stress may contribute to the injury as well.
quinolinic acid; PC12 cells; cell injury; cell apoptosis; HIF-1α; signaling pathway; oxidative stress
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.019.html
2014-11-17,
2015-01-08
国家自然科学基金资助项目(No 81300059);江苏大学高级人才基金项目(No 08JDG005,11JDG092)
李永金(1968-),男,博士,副教授,硕士生导师,研究方向:神经药理学,E-mail: lyj3600@163.com; 黄晓佳(1980-),男,博士,副教授,研究方向:神经药理学,通讯作者,Tel: 0511- 88791201,E-mail:harold1980@163.com
10.3969/j.issn.1001-1978.2015.04.011
A
1001-1978(2015)04-0493-07
R-332;R329.25;R338.1;R977.6

