3-甲基-4-硝基酚对公鸡睾丸早期发育的影响
徐伟风,朴元国,李延森,李春梅
南京农业大学动物科技学院,南京 210095
3-甲基-4-硝基酚对公鸡睾丸早期发育的影响
徐伟风,朴元国,李延森,李春梅*
南京农业大学动物科技学院,南京 210095
研究环境内分泌干扰物3-甲基-4-硝基酚(3-methyl-4-nitrophenol,PNMC)对公鸡睾丸早期发育的影响。48只1 d龄白羽公鸡随机分成3个组,分别为对照组、10和100 mg·L-1PNMC处理组,连续饮水42 d。检测公鸡的生长性能、睾丸重量和指数、睾丸的结构变化、血清激素水平和睾丸中CYP17A1及其相关基因的表达情况。结果显示:与对照组相比,10 mg·L-1PNMC处理组显著降低公鸡的生长性能;睾丸重量和睾丸指数均无显著性变化;睾丸细精管生精细胞均有不同程度的空泡兼或脱落;血清孕酮和雌二醇水平均无显著性差异,睾酮水平随饮水中PNMC浓度的升高呈递减的趋势;公鸡睾丸中CYP17A1、HSD3B2和CYP19A1有升高的趋势,HSD17B4在10 mg·L-1PNMC组呈降低的趋势,在100 mg·L-1PNMC组呈升高的趋势。结果表明:饮水中添加10 mg·L-1PNMC显著影响了公鸡的生长性能;饮水中添加100 mg·L-1PNMC引起公鸡睾丸细精管生精细胞变性、坏死,造成结构病理损伤,从而对生殖系统造成损伤。
3-甲基-4-硝基酚;睾丸;公鸡;生殖损伤
环境内分泌干扰物是一类通过干扰生物体内调节发育过程的天然激素的合成、分泌、运输、结合、反应和代谢等过程,从而对生物体生殖、神经和免疫系统等功能产生影响的外源性化学物质[1]。3-甲基-4-硝基酚(3-methyl-4-nirophenol,PNMC),系苯酚衍生物,是一种重要的化工原料,广泛应用于生产杀虫剂、除草剂、染料、医药等行业,常常在生产和使用过程中被释放到环境中,它们难以降解,在环境中可长期残留,对土壤、水体和大气造成严重的污染,已被美国环境保护局和我国列为“优先控制污染物”之一。最近研究发现柴油车尾气中也含有PNMC,约1 kg尾气颗粒中PNMC含量可以高达28 mg[2],而且PNMC是有机磷杀虫剂——杀螟松的水解产物[3]。环境中各种来源的PNMC可以通过呼吸道、消化道以及皮肤等途径进入机体内部,严重威胁着人类及动物的健康。我们的前期研究发现PNMC具有雌激素和抗雄激素的作用[4-5],能够引起精囊、前列腺以及阴茎头重量显著降低,扰乱雄性大鼠肾上腺皮质类固醇激素的分泌[6]。
目前,关于PNMC作用机制的相关研究在大鼠[7-8]、小鼠[9]、鹌鹑[10]等动物上已有报道,但是,PNMC对家禽生殖的影响仍处于空白。因此,本试验以白羽公鸡为研究对象,在饮水中添加不同浓度的PNMC,研究PNMC对白羽公鸡的生长性能、睾丸指数、睾丸组织结构变化、血清激素水平和睾丸中CYP17A1及相关基因表达的影响,为今后研究PNMC对家禽的影响提供试验依据。
1 材料与方法(Materials and methods)
1.1 试验动物
1 d龄健康白羽公鸡48只(南京青龙山实验动物研究所提供)。
1.2 主要试剂
3-甲基-4-硝基酚(3-methyl-4-nitrophenol,PNMC,纯度99.9%,成都科隆化学品有限公司),电解多维(四川天红牧业有限公司),多聚甲醛(上海凌峰化学试剂有限公司),动物切片石蜡(熔点60~62 ℃,上海国药集团化学试剂有限公司),HE(苏木精-伊红)染液(南京建成生物科技有限公司),反转录试剂盒(大连宝生物工程有限公司),PCR定量试剂盒(上海皓嘉科技发展有限公司),雌二醇试剂盒(北京北方生物技术研究所),孕酮和睾酮试剂盒(南京建成生物科技有限公司)。
1.3 主要试验仪器
石蜡切片机Leica RM2235和烘片机Leica HI1220(上海徕卡仪器有限公司),光学显微镜Nikon YS100和倒置显微镜(日本Nikon株式会社),酶标仪(美国Thermo公司),5417R型台式冷冻高速离心机(德国Eppendorf公司),低温冷冻离心机J2-MI型(德国Beckman公司),Real-time PCR仪(美国Bio-rad公司)。
1.4 动物分组与处理
试验为单因素试验设计。将48只1 d龄健康白羽公鸡随机分为3个处理组,每个处理组设4个重复,每个重复4只鸡,试验期为42 d。试验基础日粮采用玉米-豆粕型日粮,分1~21 d和21~42 d两阶段进行饲养,日粮组成和营养水平见表1。对照组饮水中不添加PNMC,试验组分别向饮水中添加10 mg·L-1和100 mg·L-1的PNMC。试验阶段采用笼养,24 h光照,并且确保鸡群能够自由饮水和采食,对照组与试验组采用相同的免疫程序进行免疫以及相同的饲养管理方式进行饲养。
1.5 测定指标与方法
1.5.1 生长性能
从初生重开始记录,于每周对所有鸡只进行称重(称重前12 h断料),按重复记录饲料采食量和剩余采食量,根据体重和采食量,计算各阶段平均日增重(ADG)、平均日采食量(ADFI)、料重比(F/G)。
1.5.2 睾丸重量与睾丸指数
试验结束后,采用颈部割喉法处死鸡只,剥离、取出睾丸并准确地除去表面的脂肪和结缔组织,称重前用滤纸吸干血水后称重并详细记录每只鸡的睾丸重量,计算睾丸指数。

表1 基础饲粮组成以及营养水平(干物质基础)Table 1 Composition and nutrient levels of basal diet (dry mass basis)
注:1) 每kg饲粮提供的微量元素为Fe 80 mg,Cu 8.0 mg,Zn 65 mg,Mn 110 mg,I 1.1 mg,Se 0.3 mg;
2) 每kg饲粮提供的维生素为VA 24 mg,VD3 6 mg,VE 20 mg,VK 1.3 mg,VB12.2 mg,VB28 mg,VB340 mg,VB64 mg,VB120.013 mg,VH 0.04 mg;叶酸1 mg,杆菌肽锌30 mg,胆碱400 mg,泛酸钙10 mg;
3) 营养水平为计算值。
Note: 1) One kg of the diet provides trace elements: Fe 80 mg,Cu 8.0 mg,Zn 65 mg,Mn 110 mg,I 1.1 mg,Se 0.3 mg;
2) One kg of the diet provides Vitamins: VA 24 mg,VD36 mg,VE 20 mg,VK 1.3 mg,VB12.2 mg,VB28 mg,VB340 mg,VB64 mg,VB120.013 mg,VH 0.04 mg; Folic acid 1 mg,bacitracin zinc 30 mg,choline 400 mg,calcium pantothenate 10 mg;
3) Nutrient levels are calculated values.
1.5.3 睾丸组织结构观察
试验结束后,试验公鸡采血后屠宰,分离睾丸,取部分样品放入福尔马林溶液中固定,用石蜡包埋处理,切片为5 μm,进行HE染色,观察睾丸组织结构变化。
1.5.4 血清激素水平
试验结束后,采用颈部割喉法处死鸡只,收集血液,3 500 r·min-1离心15 min,吸取上清液,-20 ℃保存。采用试剂盒测定血清睾酮(testosterone)、孕酮(progesterone)和雌二醇(estradiol)的含量。
1.5.5 睾丸组织总RNA的提取和定量测定
按照Trizol说明书提取睾丸组织的总RNA,提取的RNA保存于-70 ℃超低温冰箱中,或立即用于反转录。反转录时,按照Takara Prime Script ® RT reagent Kit反转录试剂盒说明书,取上述纯化的总RNA 2.0 μg 加入2×RT Buffer 10 μL、20×RT Enzyme Mix 1 μL、Nuclease-free H2O补足至20 μL,置于PCR仪内37 ℃15 min,95 ℃反转录灭活15 s,反应结束后所得cDNA用于定量PCR。按照TakaraSYBR® Premix Ex TaqTM定量试剂盒说明书,依次往定量PCR管加入下列试剂(20 μL体系):H2O 3.4 μL、引物(10 μmol·L-1)各0.2 μL、模板1 μL、ROX Reference Dye 0.2 μL、SYBR Premix Ex Taq 5 μL,混匀离心后在Real-time PCR仪上反应检测,反应程序如下:95 ℃变性10 min,95 ℃ 15 s,60 ℃ 45 s,重复45个循环;反应结束绘制熔解曲线。利用2-△△Ct法对基因表达进行相对定量,下表为试验中所用引物序列,见表2。
1.6 数据统计分析
数据采用SPSS16.0软件进行统计分析。用单因素ANOVA法分析差异性,若差异显著则用LSD法进行多重比较(当P <0.05时即被认为差异显著),试验数据用平均值±标准误(Mean±SEM)表示。
2 结果(Results)
2.1 PNMC对公鸡生长性能的影响
PNMC对公鸡生长性能的影响见表3。与对照组相比,10 mg·L-1组的全期平均日增重显著降低(P<0.05),全期平均日采食量和全期料重比却有极显著的上升(P<0.01);与对照组相比,100 mg·L-1组在1~21 d时平均日采食量和料重比极显著的增加(P<0.01),其他各个时期的平均日增重、平均日采食量和料重比都无显著性差异(P>0.05)。
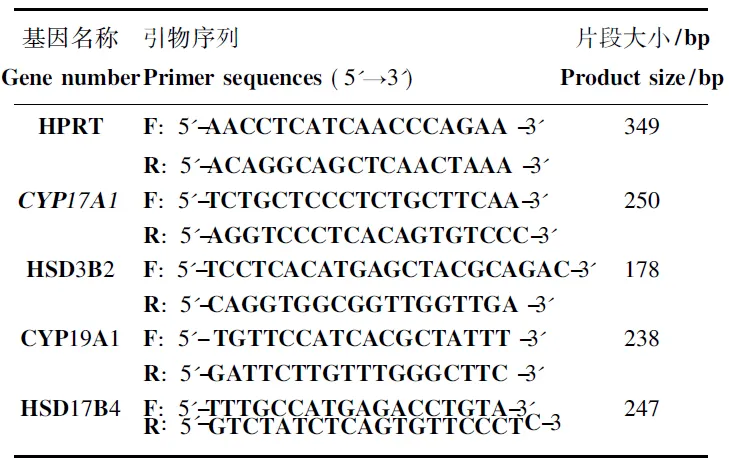
表2 Real-time PCR所用引物Table 2 Primers for real-time PCR analyses
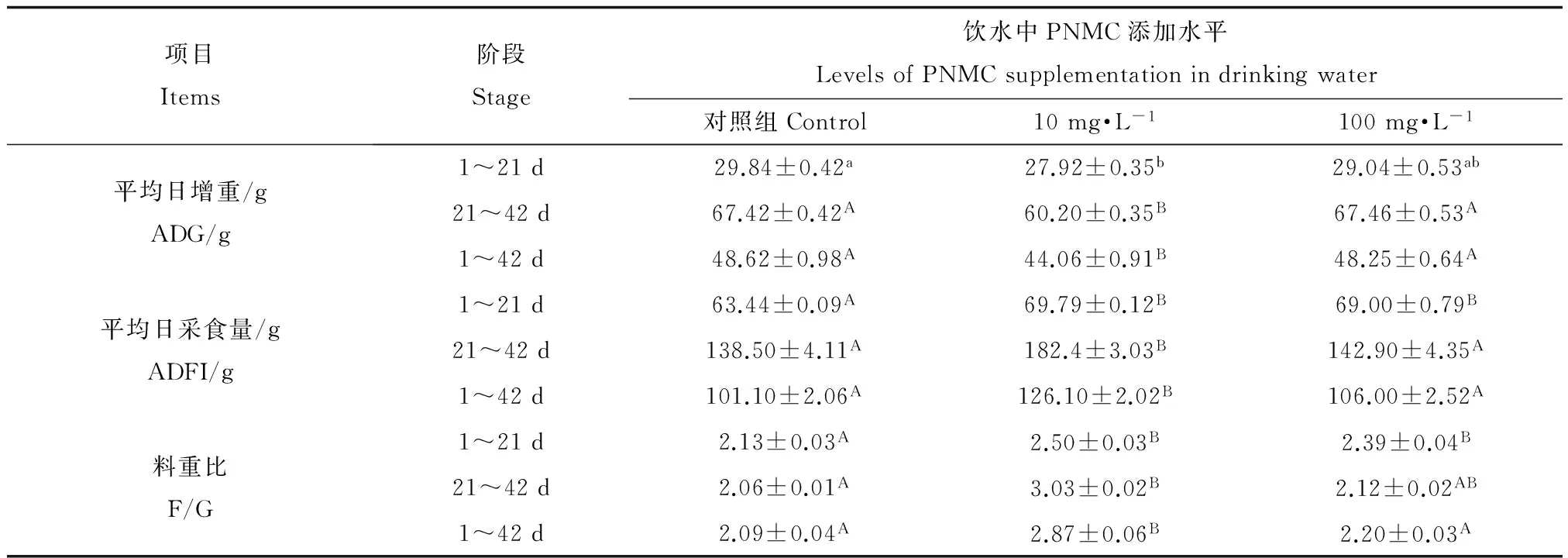
表3 3-甲基-4-硝基酚(PNMC)对公鸡生长性能的影响Table 3 Effects of 3-methyl-4-nitrophenol (PNMC) on growth performance of roosters
注:同行数据肩标小写字母不同表示差异显著(P <0.05),大写字母不同表示差异极显著(P<0.01)。
Note: In the same row,values with different small letter superscripts mean the difference is significantly at 0.05,and values with different capital letter superscripts mean the difference is significantly at 0.01.
2.2 PNMC对公鸡体重和睾丸重量的影响
对照组和PNMC处理组公鸡生长正常。与对照组相比,10 mg·L-1组体重极显著降低(P<0.01),100 mg·L-1组体重下降,但差异不显著(P>0.05)。睾丸重量和睾丸指数均无显著性差异(P>0.05),见表4。
2.3 PNMC对公鸡睾丸组织结构的影响
图1为各组公鸡睾丸组织的HE染色图。从图中可以看到,对照组公鸡睾丸组织间质细胞、支持细胞、生精细胞均清晰可见,排列整齐、均匀分布、紧凑有序,形态正常(图1A)。与对照组相比,PNMC组(图1B、图1C)呈现不同程度的病理形态学变化:10 mg·L-1组部分睾丸组织体积缩小,排列不够紧凑并出现轻微的空泡化(图1B);100 mg·L-1组细精管细胞排列疏松存在严重的脱落趋势(图1C)。
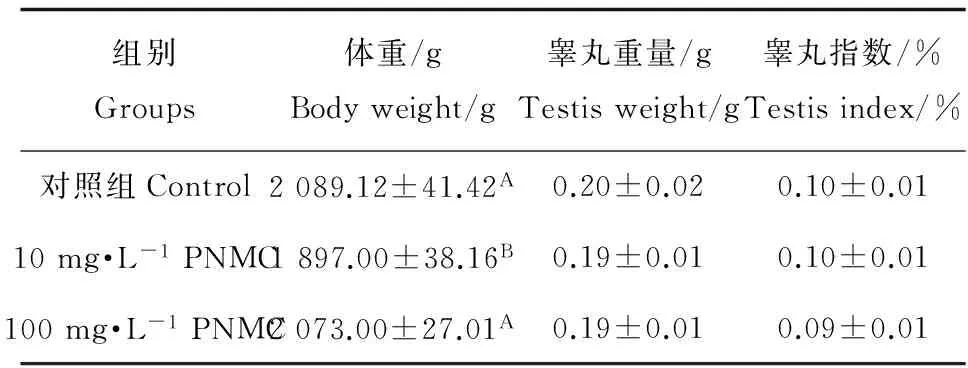
表4 PNMC对公鸡体重、睾丸重及睾丸指数影响Table 4 Effects of PNMC on the body weight,testicle weight and testicle index of roosters
注: 同列数据肩标大写字母不同表示差异极显著(P<0.01)。
Note: In the same column,values with different capital letter superscripts mean the difference is significantly at 0.01.
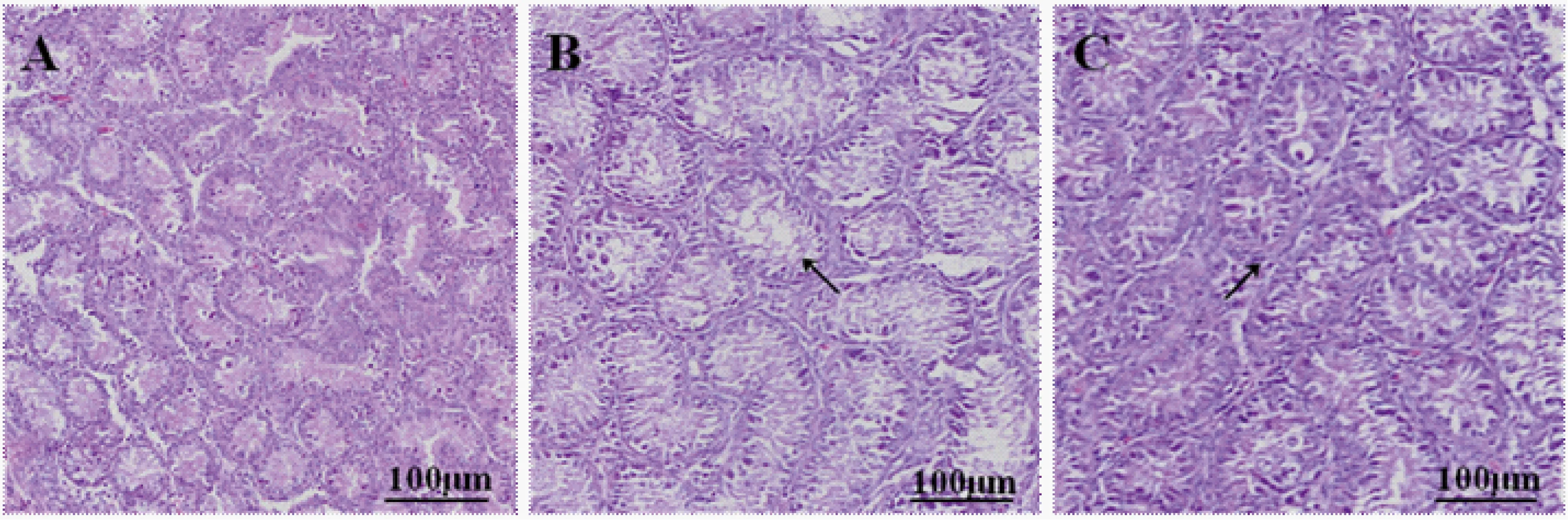
图1 PNMC处理对公鸡睾丸组织结构的影响(A)对照组; (B)10 mg·L-1 PNMC组; (C)100 mg·L-1 PNMC组
2.4 PNMC对公鸡血清激素水平的影响
与对照组相比,PNMC处理组中血清孕酮和雌二醇水平均无显著性差异(P>0.05),睾酮水平随饮水中PNMC浓度的升高呈递减的趋势,但差异不显著(P>0.05),见表5。

表5 PNMC对公鸡血清激素水平的影响Table 5 Effects of PNMC on serum hormone levels of roosters
2.5 PNMC对公鸡睾丸组织类固醇激素合成相关酶的基因表达的影响
图2为各组公鸡睾丸组织中CYP17A1、HSD3B2、CYP19A1和HSD17B4 mRNA相对表达量的变化。与对照组相比,10 mg·L-1组的CYP17A1(图4A)、HSD3B2(图4B)和CYP19A1(图4C)有升高的趋势,但差异不显著(P>0.05),HSD17B4(图4D)呈降低的趋势(P>0.05);CYP17A1(图4A)、HSD3B2(图4B)、CYP19A1(图4C)和HSD17B4(图4D)在100 mg·L-1组均有升高趋势,但差异不显著(P>0.05)。
3 讨论(Discussion)
3.1 PNMC对公鸡生长性能及睾丸重量的影响
饮水中分别添加浓度为10 mg·L-1和100 mg·L-1PNMC,不会引起急性中毒症状。浓度为10 mg·L-1时显著影响公鸡的生长性能,而浓度为100 mg·L-1时无显著影响,这一结果与岳卓等[7]、Li等[11]的研究不同。分析其原因,可能PNMC对公鸡生长性能的影响不存在浓度依赖性,当浓度为10 mg·L-1PNMC进入动物消化道后,可能改变消化道内环境,降低了动物对养分的消化吸收能力,从而引起生长性能的降低;而浓度为100 mg·L-1时无显著影响,可能与给药方式、试验动物、处理时间等有关,但具体作用机制尚不清楚。在睾丸重量和睾丸指数方面,如果睾丸指数变小,表明睾丸可能出现萎缩和退行性变化;如果睾丸指数变大,表明睾丸可能出现水肿、充血和增生等病变[12]。浓度为10 mg·L-1和100 mg·L-1PNMC没有引起公鸡睾丸重量和睾丸指数发生显著性变化,说明PNMC在本试验剂量下对公鸡生殖器官的生长没有显著影响。

图2 PNMC处理对公鸡睾丸组织类固醇激素合成相关酶的基因表达的影响
3.2 PNMC对公鸡睾丸组织结构变化的影响
饮水中添加不同浓度的PNMC对公鸡睾丸有不同程度的损伤。这与前人报道一致,如岳卓等[7]的研究表明对照组大鼠睾丸曲细精管内支持细胞和各级生精细胞排列紧密、有序,精细胞整齐密集;PNMC处理(皮下注射)可导致大鼠睾丸组织均有不同程度的损伤,主要表现为曲细精管内大量生精细胞坏死,细胞核固缩凝聚,并出现形成空泡样结构。布同良等[13]研究表明100 mg·kg-1的PNMC腹腔注射可引起小鼠睾丸的局部严重损伤,表现为曲细精管的损伤,生精上皮中生殖细胞量显著减少。上述研究表明PNMC可能是阻碍生精细胞在减数分裂前后的分化与增殖,使其发育成精子细胞和精子的数量减少。
3.3 PNMC对血清激素水平和睾丸组织类固醇激素合成相关酶的基因表达的影响
作为汽车尾气颗粒物中成分之一的PNMC可抑制成年小鼠[14]、大鼠[15]以及未成年大鼠精子的生成[16]。饮水中添加10 mg·L-1和100 mg·L-1PNMC时,睾酮的含量虽无显著性减少,但呈降低的趋势。这与他人的研究结果一致,如岳卓等[9]报道,PNMC处理(经口灌胃)会导致曲细精管内睾酮含量降低,最终导致精子生成障碍。同时Li等[17]研究表明PNMC肌肉注射可以使成年雄性鹌鹑的睾酮分泌下降,并影响睾丸功能,但机制尚不清楚。近来研究表明,生理剂量的孕激素可以促进雄激素依赖的雄性性行为表现,这在Young等[18]的实验中已得到证实。与10 mg·L-1PNMC组相比,饮水中添加100 mg·L-1PNMC时,雌二醇的含量呈降低的趋势,肉鸡血清中孕酮的含量有升高的趋势。这一结果与Li等[19]报道类似,100 mg·kg-1PNMC组肌肉注射显著降低了雌二醇的含量,显著增加了孕酮的含量。说明饮水中添加PNMC能够在一定程度上影响血清激素水平的变化,导致内分泌功能紊乱,从而对生殖系统造成损伤。
性腺发育受到下丘脑-垂体-性腺信号通路的调节和控制,激素在信息传递中起重要作用,也成为环境内分泌干扰物作用的主要靶点[20]。细胞色素P450系列酶参与了类固醇激素的合成过程[21]。CYP11A1和HSD3B2在胆固醇转化成孕酮的生化过程中不可或缺,CYP17和HSD17B在孕酮转化成睾酮的过程中扮演着重要的角色,而CYP19在睾酮进一步转化成雌二醇的过程中发挥重要的作用[22-23]。其中,由CYP17基因编码的细胞色素P450 17α-羟化酶(17α-hydroxylase)、17,20-裂解酶(17,20-lyase)能参与睾丸中胆固醇转化为睾酮的过程,调控睾丸性激素合成的总量[24]。P450芳香化酶(P450arom)是调节脊椎动物体内雌激素形成的关键酶,广泛分布于脊椎动物的脑和性腺等器官组织中[25]。鱼类CYP19A基因编码性腺中的P450arom,主要分布于卵巢[26],在睾丸间质细胞中有少量表达,调控原始精原细胞的增殖[27]。本试验研究发现CYP19A1基因的表达量在PNMC处理组公鸡睾丸组织中有增加趋势,这一结果与Hatef等[28]的报道类似。因此,我们推测PNMC对公鸡睾丸功能的影响可能是通过提高CYP19A1基因表达加速了睾酮向雌激素的转化,使血清中睾酮含量减少,增强雌激素效应。CYP17A1、HSD3B2和HSD17B4基因表达无明显的变化,可能是由于这些基因位于上游,但具体作用机制还有待于进一步研究。
综上所述,在公鸡早期发育过程中,饮水中添加10 mg·L-1PNMC时可显著影响肉鸡的生长性能,并且这种影响不具有浓度依赖性;饮水中添加100 mg·L-1PNMC时公鸡血清睾酮的生成减少,睾丸细精管生精细胞变性、坏死,造成结构变化,引起睾丸功能损伤。而PNMC通过影响公鸡睾丸组织类固醇激素合成相关酶的表达而干扰激素分泌的作用机制还有待进一步的研究。
[1] 宋美艳,张永辉,朴元国,等.4-硝基酚对大鼠肝脏的毒性及氧化损伤[J].生态毒理学报,2014,9(3): 495-502
Song M Y,Zhang Y H,Piao Y G,et al.Toxic effects and oxidative damage of 4-nitrophenol on rat liver [J].Asian Journal of Ecotoxicology,2014,9(3): 495-502 (in Chinese)
[2] Mori Y,Kamta K,Toda N,et al.Isolation of nitrophenols from diesel exhaust particles(DEP)as vasodilatation compounds [J].Biological & Pharmaceutical Bulletin,2003,28(3): 394-395
[3] Zayed S M,Mahdy F.Decomposition of 14C-fenitrothion under the influence of UV and sunlight under tropical and subtropical conditions [J].Chemosphere,2008,7(9): 1653-1659
[4] Furuta C,Li C,Taneda S,et al.Immunohistological study for estrogenic activities of nitrophenols in diesel exhaust particles [J].Endocrine,2005,27(1): 33-36
[5] Taneda S,Mori Y,Kamata K,et al.Estrogenic and anti-androgenic activity of nitrophenols in diesel exhaust particles(DEP) [J].Biological & Pharmaceutical Bulletin,2004,27(6): 835-837
[6] Li C M,Li X Z,Suzuki A K,et al.Effects of exposure to nanoparticle-rich diesel exhaust on adrenocortical function in adult male mice [J].Toxicology Letters,2012,209(3):277-281
[7] 岳卓,佘锐萍,田纪景,等.3-甲基-4-硝基酚对大鼠睾丸组织的损伤作用[J].动物医学进展,2010,31(S): 66-69Yue Z,She R P,Tian J J,et al.Study on toxic effect of 3-methly-4-nitrophenol on SD rat testis [J].Progress in Veterinary Medicine,2010,31(S): 66-69 (in Chinese)
[8] 岳卓,佘锐萍,叶楠,等.3-甲基-4-硝基酚对大鼠肠道粘膜免疫的影响[C].第二届中国兽医临床大会论文集 (下册),2010: 1567-1570
[9] 岳卓,佘锐萍,朱金凤,等.3-甲基-4-硝基酚对雄性小鼠生殖毒性的研究[J].中国动物检疫,2011,28(6): 50-52
Yue Z,She R P,Zhu J F,et al.Study on the reproductive toxicity of 3-methly-4-nitrophenol in male mice [J].Journal of Chinese Animal Quarantine,2011,28(6): 50-52 (in Chinese)
[10] Li C M,Taneda S,Suzuki A K,et al.Anti-androgenic activity of 3-methyl-4-nitrophenol in diesel exhaust particles [J].European Journal of Pharmacology,2006,543: 194-199
[11] Li C M,Takahashi S,Taneda S,et al.Effects of 3-methyl-4-nitrophenol in diesel exhaust particles on the regulation of reproductive function in immature female Japanese quail (Coturnix japonica) [J].Journal of Reproduction and Development,2007,53: 673-678
[12] 沈建忠.动物毒理学[M].北京: 中国农业出版社,2002: 107-108
[13] 布同良,米玉玲,曾卫东,等.3-甲基-4-硝基酚引起的睾丸氧化损伤及其修复的研究 [J].畜牧与兽医,2012,12(4): 48-51
Bu T L,Mi Y L,Zeng W D,et al.Oxidative damage induced by 3-methyl-4-nitrophenol and its repair in testis [J].Animal Husbandry & Veterinary Medicine,2012,12(4): 48-51 (in Chinese)
[14] Yoshida S,Sagai M,Oshio S,et al.Exposure to diesel exhaust affects the male reproductive system of mice [J].International Journal of Andrology,1999,22: 307-315
[15] Tsukue N,Toda N,Tsubone H,et al.Diesel exhaust (DE) affects the regulation of testicular function in male Fischer 344 rats [J].Toxicology Environment Health,2001,63: 115-126
[16] Watanabe N,Oonuki Y.Inhalation of diesel engine exhaust affects spermatogenesis in growing male rats [J].Environmental Health Perspectives,1999,107: 539-544
[17] Li C M,Takahashi S,Taneda S,et al.Impairment of testicular function in adult male Japanese quail (Coturnix japonica) after a single administration of 3-methyl-4-nitrophenol in diesel exhaust particles [J].Journal of Endocrindogy,2006,189: 555-564
[18] Young L J,Greenberg N,Crews D.The effects of progesterone on sexual behavior in male green anolelizards (Anoliscarolinensis) [J].Hormones Behavior,1991,25(4): 477-488
[19] Li C M,Takahashi S,Taneda S,et al.Effects of 3-methyl-4-nitrophenol on the reproductive toxicology in female Japanese quail (Coturnix japonica) [J].Biological & Pharmaceutical Bulletin,2008,31(11): 2158-2161
[20] Kallivretaki E,Eggen R,Neuhauss S,et al.Aromatase in zebrafish: A potential target for endocrine disrupting chemicials [J].Marine Enviromental Research,2006,62:S187-S190
[21] 云丹,刘晓丽,程乐华,等.双酚A对斑马鱼精巢性激素生成酶基因表达的影响[J].生态毒理学报,2014,9(1): 81-89
Yun D,Liu X L,Cheng L H,et al.Alterations in the mRNAs of enzymes responsible for sex steroidogenesis in the testis of zebrafish exposed to bisphenol-A [J].Asian Journal of Ecotoxicology,2014,9(1): 81-89 (in Chinese)
[22] 高连连,蔡德培.环境内分泌干扰物对性激素合成相关酶基因调控网络的不良影响[J].国际儿科学杂志,2012,39(5): 521-524
Gao L L,Cai D P.The effect of environmental endocrine disruptors on gene regulative networks related to steroidogenesis [J].International Journal of Pediatrics,2012,39(5): 521-524 (in Chinese)
[23] Hu M C,Chiang E,Tong S K,et al.Regulation of steroidogenesis in transgenic mice and zebrafish [J].Molecular and Cellular Endocrinology,2001,171(1-2): 130-139
[24] Schulz R W,Vischer H F,Cavaco J E B,et al.Gonadotropins,their receptors,and the regulation of tesicular functions in fish [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2001,129B: 407-417
[25] 王慧,李霞,张育辉.CYP19基因表达与芳香化酶活性调控因子的研究进展[J].中国组织化学与细胞化学杂志,2010,19(3): 109-113
Wang H,Li X,Zhang Y H.Research progress of factors regulating CYP19 gene expression and aromatase activity [J].Chinese Journal of Histochemistry and Cytochemistry,2010,19(3): 109-113 (in Chinese)
[26] Tong S K,Chung B C.Analysis of zebra fish cyp19 promoters [J].Journal of Steroid Biochemistry & Molecular Biology,2003,86: 381-386
[27] Schulz R W,de Franca L R,Lareyre J J,et al.Spermatogenesis in fish [J].General and Comparative Endocrinology,2010,165: 390-411
[28] Hatef A,Zare A,Alavi S M,et al.Modulations in androgen and estrogen mediating genes and testicular response in male goldfish exposed to bisphenol A [J].Enviromental Toxicology and Chemistry,2012,31(9): 2069-2077
◆
Effects of 3-methyl-4-nitrophenol on the Early Development of Rooster Testes
Xu Weifeng,PiaoYuanguo,Li Yansen,Li Chunmei*
College of Animal Science and Technology,Nanjing Agricultural University,Nanjing 210095,China
25 December 2014 accepted 4 February 2015
To investigate the effects of 3-methyl-4-nitrophenol (PNMC),a major component of diesel exhaust particles,on the early development of the rooster testes,forty-eight white roosters(1-d-old) were randomly divided into three groups and supplemented with PNMC in drinking water in different doses (0,10,100 mg·L-1)for 42 days.Growth performance,testes weight and index,the morphological changes of testes,serum hormone levels and the expression levels of the testicular CYP17A1 and related genes were assessed.The results showed that the growth performance was significantly reduced in the 10 mg·L-1PNMC-treated group compared with the control group.The values of testes weight and index showed no significant change among 3 groups.The increased vacuolation were observed in the spermatogenic cells of the seminiferous tubules in the 10 mg·L-1PNMC-treated group.There was no significant difference in serum progesterone,estradiol and testosterone levels.The expression levels of the testicular CYP17A1,HSD3B2 and CYP19A1 in the 10 mg·L-1PNMC-treated group was higher than those of the control group.The expression level of the testicular HSD17B4 was lower in the 10 mg·L-1PNMC-treated group and higher in the 100 mg·L-1PNMC group when comparing with that of the control group.In conclusion,the supplementation of 10 mg·L-1PNMC in drinking water affected the growth performance whereas supplementation of 100 mg·L-1PNMC caused the cell degeneration and necrosis in the seminiferous tubules and triggered the structural changes.Therefore our results indicate that early exposure to PNMC resulting in the damages in the reproductive system of rooster.
3-methyl-4-nitrophenol; testes; rooster; reproductive damage
江苏省自然基金面上项目(BK20131315);“十二五”国家科技支撑计划(2012BAD39B02)
徐伟风(1990-),女,硕士研究生,研究方向为环境毒理学,E-mail:2013105059@njau.edu.cn;
*通讯作者(Corresponding author),E-mail: chunmeili@njau.edu.cn
10.7524/AJE.1673-5897.20141225001
2014-12-25 录用日期:2015-02-04
1673-5897(2015)4-146-08
X171.5
A
李春梅(1974-),女,博士,教授,博士生导师。主要研究方向动物环境生理与营养毒理学。
徐伟风,朴元国,李延森,等.3-甲基-4-硝基酚对公鸡睾丸早期发育的影响[J].生态毒理学报,2015,10(4): 146-153
Xu W F,Piao Y G,Li Y S,et al.Effects of 3-methyl-4-nitrophenol on the early development of rooster testes [J].Asian Journal of Ecotoxicology,2015,10(4): 146-153 (in Chinese)

