环境浓度下磺胺混合物对秀丽线虫(Caenorhabditiselegans)生长、饮食、抗氧化酶及其调控基因表达水平的影响
梁爽,于振洋,尹大强
同济大学环境科学与工程学院 长江水环境教育部重点实验室,上海 200092
环境浓度下磺胺混合物对秀丽线虫(Caenorhabditiselegans)生长、饮食、抗氧化酶及其调控基因表达水平的影响
梁爽,于振洋*,尹大强
同济大学环境科学与工程学院 长江水环境教育部重点实验室,上海 200092
磺胺类药物在环境中的普遍残留引起了人们对其潜在效应的担忧。因为磺胺混合物的效应不能通过单个物质效应进行准确预测,所以需要针对混合物效应开展深入研究。将秀丽线虫暴露于4种常用磺胺药物(磺胺嘧啶、磺胺吡啶、磺胺甲噁唑和磺胺甲嘧啶)组成的、环境浓度水平(0.01 mg·L-1)的混合物后,对生长调控基因dbl-1和egl-4,饮食调控基因eat-2和eat-18,过氧化氢酶(CAT)编码基因ctl-2和ctl-3,寿命调控基因sir-2,以及凋亡调控基因ced-4的表达水平进行检测。暴露组与空白对照组的结果比较表明,秀丽线虫dbl-1表达水平没有显著变化(下调3%),egl-4表达下调18%,解释了生长的抑制效应(抑制率为15.6%)。eat-2和eat-18的表达水平下调幅度相似,介于20%~22%之间,该幅度高于饮食的抑制效应(10.7%)。ctl-2和ctl-3的表达水平上调,分别比空白对照组高101%与66%,该幅度显著小于0.01 mg·L-1磺胺混合物暴露对CAT活性的刺激效应(比空白对照组高789.5%)。此外,sir-2的表达水平没有显著变化,与线虫寿命没有受到显著影响相一致。同时,ced-4表达上调32%,预示凋亡水平的显著增加。egl-4、eat-2、ctl-2和ced-4基因表达水平的显著变化分别表明磺胺混合物对β转化生长因子(TGF-β),烟酰乙酰胆碱受体(nAChR)、抗氧化系统以及细胞凋亡等多个方面的产生影响。
磺胺混合物;秀丽线虫;β转化生长因子;烟酰乙酰胆碱受体;过氧化氢酶;凋亡;环境浓度
磺胺类抗生素普遍用于治疗养殖动物,并占据了当今抗生素用量中的较大比例。然而,由于人类对该类药物的滥用、动物体内的不完全代谢以及污水处理环节中的不完全处理导致这些抗生素在各种环境媒介中普遍残留[1]。为了评价磺胺抗生素的环境风险,学者们逐步展开该类抗生素对非靶生物的毒性研究。据报道,磺胺抗生素可抑制甲壳虫的运动和生殖[2-3],影响线虫的生长和运动行为[4],并且能够影响斑马鱼胚胎的同步运动、心跳以及孵化等生长发育过程[5]。然而,实际环境中的磺胺类污染物多以混合物形态存在[1],因此单个物质的效应研究并不能够直接表征这一类药物的环境效应。
鉴于环境中污染物混合物的普遍存在性,近来对磺胺混合物效应的关注不断增加[6]。研究表明,磺胺及其前驱物(甲氧苄氨嘧啶)对海洋发光菌会产生急性拮抗抑制效应[7]。含有磺胺嘧啶、磺胺吡啶、磺胺甲噁唑、磺胺甲嘧啶的混合物对线虫的死亡会产生协同效应,对倒退运动和体长的抑制效应呈现拮抗效应[8]。这些基于受试生物表观指标毒性作用的研究表明磺胺抗生素混合物效应不能够简单地通过单个物质的毒性进行预测,需要继续开展混合物效应研究,并需利用分子水平指标(如基因表达水平等)对表观效应予以阐述。
秀丽线虫(Caenorhabditis elegans)的生长、饮食等多种指标可广泛用于各种化学物质的毒性研究[9-10]。而且,秀丽线虫也适合进行基因表达水平的检测,该指标不仅可以作为新的生物标志物,而且也可以用于阐明毒性机理[11]。在生长调控基因中,egl-4在β转化生长因子(TGF-β)的上游发挥作用,调控器官功能和细胞体积[12];同时,dbl-1通过TGF-β的Sma/Mab途径发挥作用,这是秀丽线虫身体大小的主要调控途径[13]eat-2参与到烟碱乙酰胆碱受体(nAChR)途径中发挥作用[14],eat-18与烟碱受体相关[15],这2种基因通过调控咽喉泵动调节饮食行为。与此同时,环境生物的抗氧化能力,例如过氧化氢酶(CAT),能够指示其在环境胁迫存在下的响应与适应能力。秀丽线虫体内ctl-2编码的CTL-2蛋白主要在肠上皮细胞的过氧化物酶体中表达[16],ctl-3编码的CTL-3主要在咽喉肌肉以及神经细胞体中表达(http://www.wormbase.org)。通过对ctl-2与ctl-3基因表达水平的检测,还能够指示该抗氧化响应的潜在位点。此外,一个生物体的寿命和凋亡能够表征其在多变环境中的适应性和生存能力,线虫体内的sir-2和ced-4分别参与调控寿命[17]和凋亡[18]。然而,目前尚没有证据表明上述基因能够对磺胺混合物有所响应,其中机理需进一步研究。
本研究将秀丽线虫(C.elegans)暴露于环境浓度水平[1]的4种常用磺胺组成的混合物,然后进行dbl-1、egl-4、eat-2、eat-18、ctl-2、ctl-3、sir-2和ced-4的表达水平,并且进行线虫生长和饮食的检测,从而将基因表达水平结果与表观效应相关联。本研究的发现能够为磺胺混合物效应提供基因表达水平的生物标志物,且能为研究磺胺对非靶生物的毒性机制提供依据。
1 材料与方法(Materials and methods)
1.1 磺胺抗生素
含有磺胺嘧啶(SD,CAS RN: 68-35-9,C10H10N4O2S,≥99.0%,Sigma Aldrich,USA)、磺胺吡啶(SP,144-83-2,C11H11N3O2S,≥99.0%,Sigma Aldrich,USA)、磺胺甲噁唑(SMX,723-46-6,C10H11N3O3S,≥98.0%,Sigma Aldrich,USA)和磺胺甲嘧啶(SMZ,57-68-1,C12H14N4O2S,≥99.0%,Sigma Aldrich,USA)的混合物通过含有体积分数为1%的二甲亚砜(DMSO,Amresco,USA)的钾溶液(0.051 mol·L-1NaCl与0.032 mol·L-1KCl)[19-20]进行配制。每个磺胺抗生素的浓度都为25.0 mg·L-1,磺胺混合物的总浓度是100.0 mg·L-1。环境水平0.01 mg·L-1浓度[21-22]。
1.2 线虫培养
在线虫生长培养基(NGM)上,以尿嘧啶缺陷型大肠杆菌(Escherichia coli OP50)作为秀丽线虫(C.elegans,N2,野生型)的食物进行培养[23]。采用新鲜配制的次氯酸钠溶液(质量分数为1% NaClO/0.5 mol·L-1NaOH)杀死成熟线虫获得同步化的虫卵并在20 °C继续培养36 h从而获得L3线虫[24-25]。在线虫用于暴露前,线虫在钾溶液中禁食2 h从而排空内脏中的食物[26]。
1.3 实验设计
所有暴露实验在20 ℃具盖的透明24孔板中进行。每个浓度和空白对照(含1% DMSO的钾溶液)都有6个孔作为平行实验组。每个孔含有500 μL磺胺或空白溶液,200 μL钾溶液(含有500只线虫),以及300 μL大肠杆菌OP50菌液。所有暴露溶液中,DMSO的最终浓度都低于0.5%(体积分数)从而减少助溶剂的毒性效应[19,27]。大肠杆菌OP50菌液的获得途径如下:将37 ℃、在Lysogeny broth (LB)培养基中培养过夜的大肠杆菌OP50菌液转移至15 mL离心管中,在4 000 g、20 ℃离心5 min,弃上清液,加入无菌钾溶液,采用移液器、配合无菌枪头进行吹打、重悬、稀释,使1 mL大肠杆菌OP50菌液在570 nm处的吸光度值(OD570)为1.0;然后将大肠杆菌OP50与磺胺或空白溶液中(体积比1:1)平衡24 h后[28],即可用于线虫暴露实验。线虫暴露72 h后,将每个孔中的线虫采集到离心管中,经过30 min沉淀后,使用10 mL钾溶液进行冲洗;再次经过30 min沉淀后,得到的线虫可用于生长、生化指标以及特定基因表达水平的检测。
1.4 饮食与生长效应检测
线虫饮食和生长在72 h暴露后进行。饮食通过食物的减少进行定量[28-29]。在暴露的开始和结束对每一个孔的OD570进行检测。含有线虫的孔中吸光度值的变化(ΔOD)通过不含线虫孔中的ΔOD进行矫正,以减少大肠杆菌自身的死亡或生长的影响。每一个暴露浓度和空白对照都有6个孔作为重复。线虫的生长通过线虫的体长进行表征,体长通过测量显微拍照所得线虫图像中身体中线的折线长度来获得数据[4]。每个处理组有至少15条线虫作为重复。
1.5 生化指标检测
将线虫采用磷酸钾缓冲液(PBS,pH 6.0)冲洗、收集到1.5 mL离心管中,均分为2份,一份用于生化指标检测,一份用于特定基因表达水平的检测。生化指标的检测方法如下:(1)将离心管在5 000g、4 ℃条件下离心5 min,弃上清液;(2)使用研磨棒进行冰浴研磨,在用200 μL冰浴中的PBS冲洗研磨棒后,将离心管在5 000 g、4 ℃条件下离心5 min;(3)将上清液分装3份,其中的2份采用酶联免疫试剂盒(R&D Systems,Inc.,USA)分别测定总蛋白质含量(TP)与过氧化氢(CAT)含量[28],剩余1份备用。每个样品中的CAT含量,表达为相对同一个样品的TP的百分比,通过该表达形式可消除样品之间生物量不同引起的差异[28]。每个处理组的样品检测3次。
1.6 基因表达定量分析
dbl-1、egl-4、eat-2、eat-18、ctl-2、ctl-3、sir-2和ced-4的表达水平按照改进的Offermann的方法进行检测[30],引物序列列于表1中。通过TRIzol剂提取线虫样品总RNA,在厂家(M-MLV,Promega)说明书指导下进行cDNA的合成。随后,总cDNA样品用于实时聚合酶链式反应(RT-PCR),该反应采用SYBR Green Master Mix作为染色剂、利用Applied Biosystems 7900HT Fast Real-Time PCR System(USA)进行检测。随后,目标基因表达采用2-ΔΔCT方法进行定量[31]。计算公式如公式(1)所示,其中CT代表循环次数;x代表目标基因,例如dbl-1等;GPD-2作为内源参照基因;i代表处理组;0代表空白。空白对照组的基因表达归一为1,基因表达数值大于1时表明基因表达上调,小于1时表明基因表达下调。
2-ΔΔCT=2-((CTx-CTGPD-2)i-(CTx-CTGPD-2)0)
(1)

表1 秀丽线虫所选基因的引物模板序列Table 1 The template strand sequence for the primer pairs of the chosen genes in Caenorhabditis elegans
1.7 数据处理与统计分析
所有的数据都表达为相对空白对照组中同一指标的百分比(percentage of control,POC)[22],表达式如公式(2)所示,其中A0代表空白对照组中同一指标的平均数值,A代表暴露组中同一指标的数值。通过该方法,空白对照组中所有指标的POC数值都归一为100%,POC低于100%表明抑制效应(减少或基因表达的下调,POC高于100%表明刺激效应(基因表达上调)。每一个浓度组中的POC数值都进行正态分布检测[4],并采用平均值 ± 标准误差的形式在图中进行表达。采用Origin Pro 8.5(Origin Lab Corp.,USA)在浓度组与空白对照组之间进行方差分析(ANOVA),P < 0.05作为显著性差异的判断标准。每次实验均可得出相似的结果,本文中的图表源自一次代表性实验结果。
(2)
2 结果与讨论(Results and discussion)
2.1 秀丽线虫生长基因表达下调与生长抑制相一致
暴露于0.01 mg·L-1磺胺混合物72 h后,秀丽线虫生长调控基因dbl-1和egl-4表达水平的变化如图1(Fig.1)所示。dbl-1和egl-4表达水平的POC数值分别为97%和82%。因为该数值低于100%,说明2个基因表达水平下调,与空白对照相比,下调水平分别为3%和18%(P < 0.5),egl-4受到磺胺混合物的影响高于dbl-1(P < 0.05)。与此同时,磺胺混合物对线虫生长的效应如图2(Fig.2)所示。线虫生长的POC数值小于100%,表现为抑制效应,并且该抑制效应随着暴露浓度的增加而增强。在0.01 mg·L-1,POC数值为84.4%,相对空白的抑制率为15.6%。生长的抑制效应与egl-4的下调水平更为接近,与dbl-1的下调水平相差较远。该比较结果进一步说明egl-4在磺胺混合物暴露中受到更大的影响。
egl-4在TGF-β通路的上游发挥作用,dbl-1通过TGF-β中的Sma/Mab通路发挥作用[13]。基因表达水平与生长抑制效应之间的比较结果表明,磺胺混合物产生毒性效应的途径很可能是通过TGF-β通路,但是并不是通过TGF-β通路中Sma/Mab通路产生效应。同时,egl-4的表达还会影响肠胃、皮下组织以及肌肉的体积,并且影响肠胃和肌肉中的细胞大小[12]。因此,磺胺混合物对线虫生长的抑制效应可能源自这些器官和细胞尺寸的变化。而且,egl-4能够编码一种依赖环鸟苷酸(cGMP)的蛋白激酶,在感觉神经元的TGF-β下游发挥作用,调控秀丽线虫对摄入食物的响应[32]以及行为过程[33]。秀丽线虫的EGL-4变异体还表现出嗅觉适应性损伤[34]。因此本研究发现的egl-4表达的下调,还可能扰乱线虫的饮食以及对环境变化的适应性。因此,egl-4基因表达水平可以作为评价磺胺环境风险的生物标志物。

图1 磺胺混合物(0.01 mg·L-1)暴露72 h后秀丽线虫dbl-1、egl-4、eat-2、eat-18、ctl-2、ctl-3、sir-2和ced-4等基因的表达水平
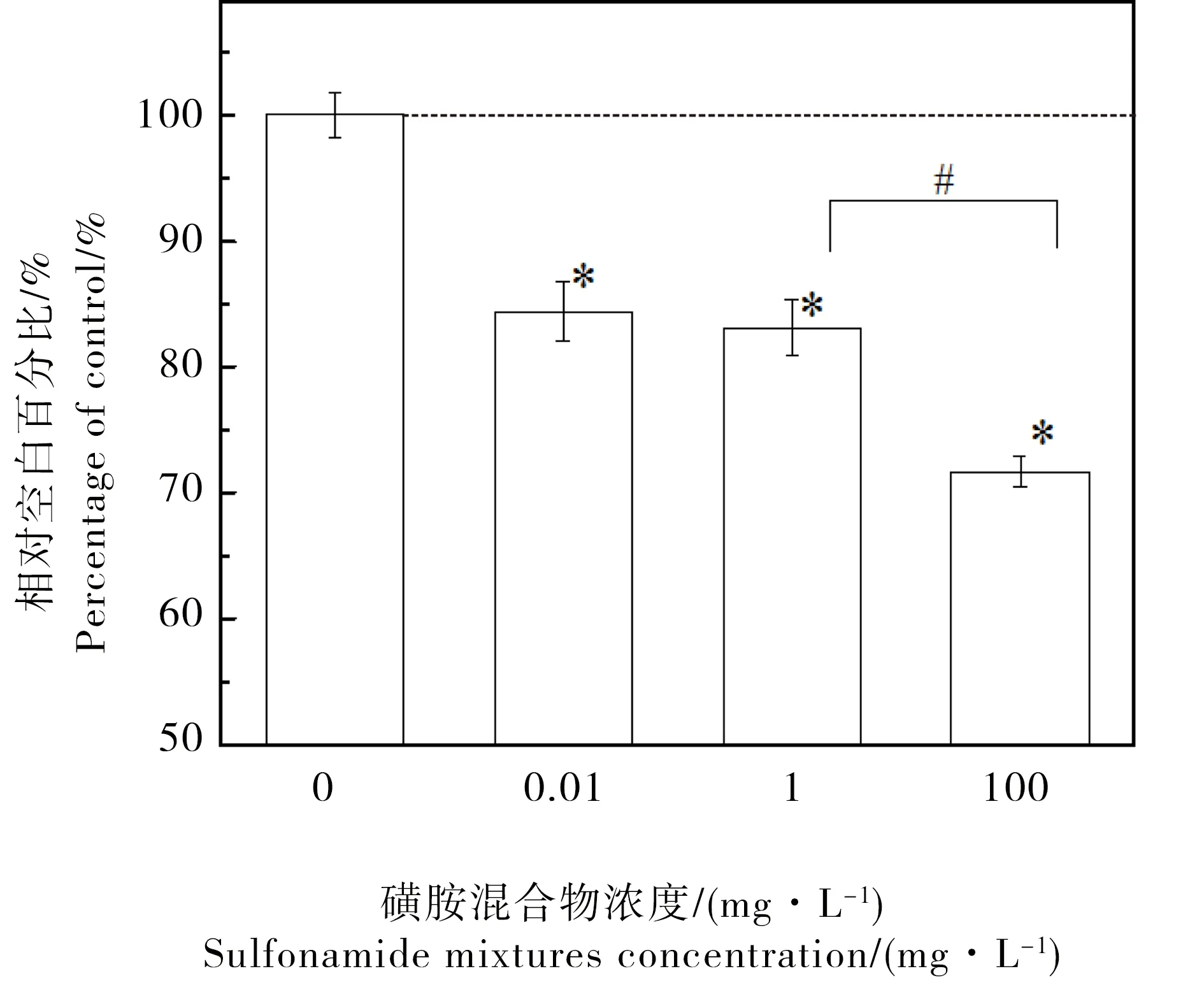
图2 磺胺混合物暴露72 h后秀丽线虫生长抑制效应
2.2 秀丽线虫饮食基因表达下调与饮食减少相一致
秀丽线虫暴露于0.01 mg·L-1磺胺混合物72 h后,饮食调控基因eat-2和eat-18的表达水平如图1(Fig.1)所示。eat-2和eat-18的POC数值分别为78%和80%(P < 0.5)。相应地,2种基因表现出的下调水平分别为22%和20%,2种基因表达水平的变化不具有显著性差异。与此同时,磺胺混合物对线虫饮食的效应如图3(Fig.3)所示。线虫饮食受到磺胺混合物的抑制效应,并且该抑制效应表现出对暴露浓度的依赖性。相对空白组线虫,暴露于0.01 mg·L-1磺胺混合物的线虫饮食表现出10.7%的抑制效应。该抑制效应水平明显低于eat-2和eat-18基因的下调水平,这种差异可能是因为eat-2与eat-18存在基因相互作用[35]。

图3 磺胺混合物暴露72 h后秀丽线虫饮食抑制效应
eat-2和eat-18的下调水平相似。值得注意的是,eat-2通过nAChR机制发挥作用[14],该作用使eat-2表达水平的变化具有指示人类健康影响的作用。nAChR机制在脊椎动物和无脊椎动物的兴奋性突触中发挥重要作用[14],nAChR功能状态的变化能够导致不正常的肌肉萎缩[36]。近期的研究还在致力于根据nAChR机制针对阿兹海默症、镇痛和消炎等开展新型治疗方法的探索[37]。因此,采用eat-2基因表达水平作为生物标志物,能够为判断现有药物和新型治疗对非靶生物的效应提供关键信息。
2.3 秀丽线虫抗氧化基因上调与抗氧化物含量升高相一致
0.01 mg·L-1磺胺混合物对秀丽线虫过氧化氢酶(CAT)调控基因表达水平的效应如图1所示。CAT调控基因ctl-2、ctl-3表达水平的POC数值分别为201%、166%(P< 0.05),即2种基因的表达水平均高于空白对照组,上调水平分别为101%与66%,并且2种基因的上调水平不具有显著性差异。与此同时,磺胺混合物对线虫CAT的效应如图4所示。线虫的CAT受到磺胺混合物的刺激效应影响,并且该刺激效应随着暴露浓度的增加而增强。其中,暴露于0.01 mg·L-1磺胺混合物的线虫CAT表现出高出空白对照789.5%的刺激效应,该刺激效应的水平远高于ctl-2和ctl-3基因的上调水平。
研究表明,ctl-2编码的CTL-2蛋白主要在肠上皮细胞的过氧化物酶体中表达[16],ctl-3编码的CTL-3主要表达在咽喉肌肉以及神经细胞体中(http://www.wormbase.org)。磺胺混合物对ctl-2和ctl-3基因的调控水平均为上调,而且上调水平相似,该结果表明磺胺混合物诱发秀丽线虫的抗氧化应激反应位点同时存在于肠胃细胞、咽喉肌肉以及神经细胞中。CAT调控基因的表达上调水平显著低于CAT表现出的刺激水平,可能由于相应的mRNA存在时间较短所致。因为ctl-2表达水平略高,而且其占据线虫总CAT活性的绝大部分(约80%)[16],因此,ctl-2基因表达水平可以作为后续环境效应监测的生物标志物。
2.4 寿命与凋亡相关基因的表达变化
因为寿命对于判断生物体是否适应环境变化具有重要作用,本研究还检测了寿命调控基因sir-2[17]的表达水平,结果如图1所示。sir-2基因表达水平没有受到磺胺混合物暴露的显著影响,该结果与磺胺混合物没有显著影响线虫寿命的结果(数据未列出)相一致。本研究的结果表明磺胺混合物没有对sir-2的表达产生影响,sir-2不适宜用于作为生物标志物。
凋亡是表征生物体对环境变化适应性的另一关键指标,因此本研究还检测了线虫体内促进凋亡的基因ced-4的表达水平[18]。因为POC数值大于100%,ced-4的表达为上调,该上调比空白高32%(P < 0.5,图1)。ced-4的显著上调可能有2个原因。其一,线虫全部细胞在磺胺混合物暴露中都表现出凋亡程度的增加;其二,线虫体内某一部分组织器官表现出显著调亡,例如生殖器官。研究表明,ced-4的mRNA主要在胚胎发生期间表达,大多数细胞程序性死亡都发生在该期间[38]。并且,本研究中线虫开始暴露时的时间为孵化后36 h,随后的72 h暴露时间,涵盖了精子、卵子、受精卵/胚胎形成的全部过程[39],此生物过程可能为磺胺混合物毒性效应提供了靶目标,从而解释了ced-4表达的显著上调,但是该解释依然需要通过进一步的AO吖啶橙染色予以确认。凋亡基因表达上调导致的细胞死亡(apoptosis,cell loss)增多将促使秀丽线虫寿命减少[40],同时抗氧化能力的增加能够促进寿命延长[41-42],从而导致了本研究中秀丽线虫寿命没有显著变化的结果,但是该推测也需进一步深入研究。本研究结果不仅说明ced-4表达水平具有良好生物标志物的潜质,而且也为后续毒性机理研究提供了方向。

图4 磺胺混合物暴露72 h对秀丽线虫过氧化氢酶(CAT)刺激效应
综上,暴露于环境浓度水平的磺胺混合物后,秀丽线虫特定基因的表达水平表现出差异。生长调控基因dbl-1和egl-4表现为下调,而且egl-4下调水平显著强于dbl-1,并与生长抑制效应表现出更好的相似性。饮食调控基因eat-2和eat-18表现出相似的下调水平,而且这些下调水平显著高于饮食的抑制效应。过氧化氢酶(CAT)调控基因ctl-2、ctl-3表达上调,但是上调水平显著低于CAT表现出的刺激水平。同时,凋亡调控基因ced-4的表达显著上调。研究结果推荐egl-4、eat-2、ctl-2和ced-4的表达水平作为潜在的生物标志物。
[1] Wang N,Guo X,Xu J,et al.Pollution characteristics and environmental risk assessment of typical veterinary antibiotics in livestock farms in Southeastern China [J].Journal of Environmental Science and Health,Part B,2014,49: 468-479
[2] Wollenberger L,Halling-Sørensen B,Kusk K O.Acute and chronic toxicity of veterinary antibiotics to Daphnia magna [J].Chemosphere,2000,40(7): 723-730
[3] Park S,Choi K.Hazard assessment of commonly used agricultural antibiotics on aquatic ecosystems [J].Ecotoxicology,2008,17(6): 526-538
[4] Yu Z Y,Jiang L,Yin D Q.Behavior toxicity to Caenorhabditis elegans transferred to the progeny after exposure to sulfamethoxazole at environmentally relevant concentration [J].Journal of Environmental Sciences - China,2011,23(2): 294-300
[5] Lin T,Chen Y Q,Chen W.Impact of toxicological properties of sulfonamides on the growth of zebrafish embryos in the water [J].Environmental Toxicology and Pharmacology,2013,36: 1068-1076
[7] Zou X M,Lin Z F,Deng Z Q,et al.The joint effects of sulfonamides and their potentiator on Photobacterium phosphoreum: Differences between the acute and chronic mixture toxicity mechanisms [J].Chemosphere,2012,86(1): 30-35
[8] Yu Z Y,Yin D Q,Deng H P.The combinational effects between sulfonamides and metals on nematode Caenorhabditis elegans [J].Ecotoxicology and Environmental Safety,2014,11: 66-71
[9] Leung M C K,Williams P L,Benedetto A,et al.Caenorhabditis elegans: An emerging model in biomedical and environmental toxicology [J].Toxicological Science,2008,106(1): 5-28
[10] Rice J R,Boyd W A,Chandra D,et al.Comparison of the toxicity of fluoridation compounds in the nematode Caenorhabditis elegans [J].Environmental Toxicology and Chemistry,2014,33(1): 82-88
[11] Schettino T,Caricato R,Calisi A,et al.Biomarker approach in marine monitoring and assessment: New Insights and perspectives [J].Open Environmental Sciences,2012,6: 20-27
[12] Hirose T,Nakano Y,Nagamatsu Y,et al.Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C.elegans [J].Development,2003,130(6): 1089-1099
[13] Savage-Dunn C.TGF-β signaling [M]// WormBook,ed.The C.elegans Research Community.2005,DOI: 10.1895/wormbook.1.22.1
[14] Lansdell S J,Millar N S.The influence of nicotinic receptor subunit composition upon agonist,α-bungarotoxin and insecticide (imidacloprid) binding affinity [J].Neuropharmacology,2000,39: 671-679
[15] McKay J P,Raizen D M,Gottschalk A,et al.eat-2 and eat-18 are required for nicotinic neurotransmission in the Caenorhabditis elegans pharynx [J].Genetics,2004,166(1): 161-169
[16] Petriv O I,Rachubinski R A.Lack of peroxisomal catalase causes a progeric phenotype in Caenorhabditis elegans [J].Journal of Biological Chemistry,2004,279: 19996-20001
[17] Kenyon C J.The genetics of ageing [J].Nature,2010,464: 504-512
[18] Seshagiri S,Miller L K.Caenorhabditis elegans CED-4 stimulates CED-3 processing and CED-3-induced apoptosis [J].Current Biology,1997,7(7): 455-460
[19] Williams P L,Dusenbery D B.Aquatic toxicity testing using the nematode,Caenorhabditis elegans [J].Environmental Toxicology and Chemistry,1990,9: 1285-1290
[20] Yu Z Y,Chen X X,Zhang J,et al.Transgenerational effects of heavy metals on L3 larva of Caenorhabditis elegans with greater behavior and growth inhibitions in the progeny [J].Ecotoxicology and Environmental Safety,2013,88C: 178-184
[21] Hewitt E F,Lukulay P,Galushko S.Implementation of a rapid and automated high performance liquid chromatography method development strategy for pharmaceutical drug candidates [J].Journal of Chromatography A,2006,1107(1-2): 79-87
[22] Yu Z Y,Zhang J,Chen X X,et al.Inhibitions on the behavior and growth of the nematode progeny after prenatal exposure to sulfonamides at environmental concentrations [J].Journal of Hazardous Material,2013,250-251: 198-203
[23] Brenner S.The genetics of Caenorhabditis elegans [J].Genetics,1974,77(1): 71-94
[24] Emmons S,Klass M,Hirsch D.An analysis of the constancy of DNA sequences during development and evolution of the nematode Caenorhabditis elegans [J].Proceedings of the National Academy of Sciences of the United States of America,1979,76: 1333-1337
[25] Van Gilst M R,Hadjivassiliou H,Yamamoto K R.A Caenorhabditis elegans nutrient response system partially dependent on nuclear receptor NHR-49 [J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(38): 13496-13501
[26] Reinke S N,Hu X,Sykes B D,et al.Caenorhabditis elegans diet significantly affects metabolic profile,mitochondrial DNA levels,lifespan and brood size [J].Molecular Genetics and Metabolism,2010,100: 274-282
[27] Mukai D,Matsuda N,Yoshioka Y,et al.Potential anthelmintics: Polyphenols from the tea plant Camellia sinensis L.are lethally toxic to Caenorhabditis elegans [J].Journal of Natural Medicines,2008,62(2): 155-159
[28] Yu Z Y,Zhang J,Yin D Q.Toxic and recovery effects of copper on Caenorhabditis elegans by various food-borne and water-borne pathways [J].Chemosphere,2012,87(11): 1361-1367
[29] Boyd W A,Cole R D,Anderson G L,et al.The effects of metals and food availability on the behavior of Caenorhabditis elegans [J].Environmental Toxicology and Chemistry,2003,22(12): 3049-3055
[30] Offermann K,Matthäi A,Ahlf W.Assessing the importance of dietborne cadmium and particle characteristics on bioavailability and bioaccumulation in the nematodes Caenorhabditis elegans [J].Environmental Toxicology and Chemistry,2009,28(6): 1149-1158
[31] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J].Method,2001,25(4): 402-408
[32] You Y J,Kim J,Raizen D M,et al.Insulin,cGMP,and TGF-β signals regulate food intake and quiescence in C.elegans: A model for satiety [J].Cell Metabolism,2008,7(3): 249-257
[33] Fujiwara M,Sengupta P,McIntire S L.Regulation of body size and behavioral state of C.elegans by sensory perception and the EGL-4 cGMP-dependent protein kinase [J].Neuron,2002,36(6): 1091-1102
[34] L'Etoile N D,Coburn C M,Eastham J,et al.The cyclic GMP-dependent protein kinase EGL-4 regulates olfactory adaptation in C.elegans [J].Neuron,2002,36(6): 1079-1089
[35] Avery L,You Y J.C.elegans feeding [M]// WormBook,ed.The C.elegans Research Community,WormBook.2012,DOI: 10.1895/wormbook.1.150.1 (http://www.wormbook.org.)
[36] Bouzat C,Barrantes F J.Inherited and experimentally induced changes in gating kinetics of muscle nicotinic acetylcholine receptor [J].Journal of Molecular Neuroscience,1999,13(1-2): 1-16
[37] Hurst R,Rollema H,Bertrand D.Nicotinic acetylcholine receptors: From basic science to therapeutics [J].Pharmacology & Therapeutics,2013,137: 22-54
[38] Yuan J,Horvitz H R.The Caenorhabditis elegans cell death gene ced-4 encodes a novel protein and is expressed during the period of extensive programmed cell death [J].Development,1992,116: 309-320
[39] Hill R,Egydio de Carvalho C,Salogiannis J,et al.Genetic flexibility in the convergent evolution of hermaphroditism in Caenorhabditis nematodes [J].Developmental Cell,2006,10(4): 531-538
[40] Bratic I,Trifunovic A.Mitochondrial energy metabolism and ageing [J].Biochimica et Biophysica Acta,2010,1797: 961-967
[41] Baumeister R,Schaffitzel E,Hertweck M.Endocrine signaling in Caenorhabditis elegans controls stress response and longevity [J].Journal of Endocrinology,2006,190: 191-202
[42] Shibamura A,Ikeda T,Nishikawa Y.A method for oral administration of hydrophilic substances to Caenorhabditis elegans: Effects of oral supplementation with antioxidants on the nematode lifespan [J].Mechanisms of Ageing and Development,2009,130: 652-655
◆
Effects of Sulfonamide Mixtures at Environmental Concentrations on Growth,Feeding,Catalase Activity and the Gene Expression Levels ofCaenorhabditiselegans
Liang Shuang,Yu Zhenyang*,Yin Daqiang
Key Laboratory of Yangtze River Water Environment,Ministry of Education,College of Environmental Science and Engineering,Tongji University,Shanghai 200092,China
28 March 2015 accepted 17 July 2015
The ubiquitous existence of sulfonamide residues in environments is drawing attentions on their potential effects.Previously,mixture effects of sulfonamides were falsely predicted by simply combining the individual effects.Accordingly,direct investigations on sulfonamide mixture effects are needed.Here,Caenorhabditis elegans was exposed to mixtures containing four commonly used sulfonamides (sulfadiazine,sulfapyridine,sulfamethaxozale and sulfamethazine) at environmental relevant concentration of 0.01 mg·L-1.The expression levels of growth regulating genes (dbl-1 and egl-4),feeding regulating genes (eat-2 and eat-18),catalase (CAT) encoding genes (ctl-2 and ctl-3),lifespan regulating gene (sir-2) and apoptosis regulating gene (ced-4) were analyzed.Compared with the control,dbl-1 expressions in exposure to sulfonamide mixture were not significantly influenced with a slight down-regulation by 3%.Meanwhile,egl-4 expressions were down-regulated by 18%,explaining inhibitions on growth which was 15.6% lower than the control.Both eat-2 and eat-18 expressions were down-regulated by 20%~22%,greater than the inhibition on feeding (10.7% lower than the control).ctl-2 and ctl-3 expressions were up-regulated by 101% and 66% higher than the control,respectively.The up-regulation levels were significantly lower than the CAT stimulations which were 789.5% higher than the control.sir-2 expression was not significantly influenced as well as the lifespan.In addition,ced-4 expression was up-regulated by 32%,indicating increases in apoptosis.The results of egl-4,eat-2,ctl-2 and ced-4 indicated that the involvement of transforming growth factor β (TGF-β) pathway,nicotinic acetylcholine receptor (nAChR),antioxidant responses and apoptosis in the sulfonamide mixture effects,respectively.
sulfonamide mixture; Caenorhabditis elegans; TGF-β; nAChR; CAT; apoptosis; environmental concentration
国家自然科学基金(No.21307095,No.51278353);中央高校基本科研业务费专项资金(No.2013KJ015);瑞典研究委员会项目(D0691301)
梁爽(1990-),女,学士,研究方向为毒理学,E-mail: liang6897@qq.com;
*通讯作者(Corresponding author),E-mail: yuzhenyang3227@163.com
10.7524/AJE.1673-5897.20150328010
2015-03-28 录用日期:2015-07-17
1673-5897(2015)4-088-08
X171.5
A
于振洋(1984—),男,博士,助理研究员,主要从事污染物毒性效应与机理、化学品生态与健康风险的研究。
梁爽,于振洋,尹大强.环境浓度下磺胺混合物对秀丽线虫(Caenorhabditis elegans)生长、饮食、抗氧化酶及其调控基因表达水平的影响[J].生态毒理学报,2015,10(4): 88-95
Liang S,Yu Z Y,Yi D Q.Effects of sulfonamide mixtures at environmental concentrations on growth,feeding,catalase activity and the gene expression levels of Caenorhabditis elegans [J].Asian Journal of Ecotoxicology,2015,10(4): 88-95 (in Chinese)

