饵料加标研究二甲苯麝香在鱼体内的蓄积和清除能力
王绿平,赵华清,周忠良,殷浩文,*
1. 上海市检测中心生物与安全实验室,上海 201203 2. 华东师范大学生命科学学院,上海 200062
饵料加标研究二甲苯麝香在鱼体内的蓄积和清除能力
王绿平1,2,赵华清1,周忠良2,殷浩文1,*
1. 上海市检测中心生物与安全实验室,上海 201203 2. 华东师范大学生命科学学院,上海 200062
二甲苯麝香(musk xylene, MX)是一种人造麝香,具有强烈的麝香气,可用作化妆品香精和皂用香精等的定香剂。由于其持续不断地输入环境,它们在水、土壤、大气中的浓度逐渐升高,并且在动物和人体组织中产生了蓄积,其蓄积效应相当于有机氯农药(organochlorine pesticides, OCPs)等持久性有机污染物,因而研究MX在鱼体内的蓄积特征是十分必要的。本文用含浓度为50 mg·kg-1和100 mg·kg-1的MX的饵料投喂斑马鱼(Danio rerio)和稀有鮈鲫(Gobiocypris rarus)14 d,继而进入为期28 d的清除实验。通过快速溶剂萃取(accelerated solvent extraction, ASE)、凝胶渗透色谱(gel permeation chromatography, GPC)、气相色谱-质谱联用法(gas chromatography-mass spectrometry, GC-MS)测定斑马鱼和稀有鮈鲫体内MX的浓度,继而评估鱼对MX的清除能力。结果表明,饵料中MX浓度越高,鱼体内MX的蓄积水平越高,100 mg·kg-1浓度组的蓄积水平为50 mg·kg-1浓度组的蓄积水平的2~3倍。在整个试验阶段的不同时间点分析鱼的体重和脂肪与鱼体内MX浓度的关系,数据显示,MX在鱼体内的蓄积水平与鱼的体重存在正线性关系,而与鱼体内脂肪含量的关系还有待进一步研究。经28 d的清除,鱼体内的MX残留量接近于零,说明斑马鱼和稀有鮈鲫对MX的清除能力较强。
二甲苯麝香;斑马鱼;稀有鮈鲫;摄食暴露生物蓄积;气相色谱-质谱串联法;清除速率常数;同化率;摄食生物放大因子
二甲苯麝香(1-tert-butyl-3,5-dimethyl-2,4,6-trinitrobenzene),是一种常见的人工合成硝基麝香[1]。因其具有与天然麝香提取物相似的芳香特性,被广泛应用于化妆品、洗涤剂、食品添加剂和身体护理产品等,普遍存在于环境中[2-3]。在地表水、生活污水,以及水产养殖的淡水鱼、贻贝(Mytilus edulis)、河虾(Macrobranchium nipponense)、虹鳟(Oncorhynchus mykiss)中检测到二甲苯麝香[4]。
化学物质通过多个途径在鱼体内蓄积,其中包括皮肤、鳃或消化系统,重要的暴露途径是水体和食物链。暴露途径的重要性与化学物质的水溶解度以及鱼类所处的生态位有着密切关系。随着化学物质的水溶解度降低,正辛醇/水系数增大,其通过食物链进入鱼体的可能性随之提高[5-7]。二甲苯麝香具有极性较小、亲脂憎水性较强(log Kow=4.9,水溶解度为0.15 mg·L-1)和在环境中不易降解的的理化特征[8]。有文献表明进入生物体内的人工合成麝香的重要途径是食物链[9]。由于MX的特殊用途,有关MX在鱼体内的分布和蓄积的研究较少。
斑马鱼是一种国际公认的模式实验鱼,具有世代周期短、繁殖率高、胚胎透明、易于观察等优点,已广泛地应用于生态毒理学研究领域。稀有鮈鲫是我国特有的一种小型鲤科鱼类,是我国环境保护部的《化学品测试方法》和国家标准《化学品稀有鮈鲫急性毒性试验》(GB/T29763-2013)推荐的受试生物。目前,稀有鮈鲫正越来越多地应用于化学品急性和亚急性毒性的生态毒理学研究领域,但鲜有文献报道稀有鮈鲫用于研究化学品在鱼体内的蓄积和清除能力的研究。本文研究旨在通过饵料加标以摄食暴露的方式研究斑马鱼和稀有鮈鲫体内的二甲苯麝香蓄积和清除能力。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
CHRiST冻干机(北京博劢行仪器有限公司),ASE200型快速溶剂萃取仪(戴安中国有限公司),AccuPrep MPSTM凝胶渗透色谱仪(美国J2 Scientific公司),Quattro micro GC型气相色谱串联质谱仪(美国Waters公司),Tissuelyser-48多样品组织研磨机(上海净信实验科技研究部),AL204型电子分析天平(梅特勒-托利多仪器(上海)有限公司),MultivapTM118氮气蒸发系统(Organomation Associates, Jnc公司),JL-360DTH型超声波清洗器(上海吉理科学仪器有限公司),Forma-86C ULT型冷冻冰箱(Thermo Electron Corporation公司),WT600-2J型蠕动泵驱动器(保定兰格恒流泵有限公司),带温控的水浴槽。HI98128型手持式pH计(HANNA©instruments),Thermo 3 Star溶氧仪(Thermo Electron Corporation公司)。
丙酮(分析纯)、正己烷(色谱纯)、异辛烷(分析纯)、乙酸乙酯(分析纯)、环己烷(色谱纯)均购于sigma-aldrich西格玛奥德里奇(上海)贸易有限公司,无水硫酸钠(分析纯,上海国药集团化学试剂有限公司),二甲苯麝香标准溶液(100 mg·L-1in acetonitrile)购自sigma-aldrich西格玛奥德里奇(上海)贸易有限公司,二甲苯麝香(1-tert-butyl-3,5-dimethyl-2,4,6-trinitrobenzol, MX)购自上海天王化工原料有限公司,纯度>99%。
1.2 稀释水
经活性炭过滤、紫外灭菌的自来水,并在储水箱中24 h连续曝气,恒温(23±2) ℃。水的硬度为145 mg CaCO3·L-1;pH 6.90~7.09;溶解氧浓度大于90%空气饱和值(air saturation value, ASV。
1.3 饲料商品
卤虫薄片饲料(O.S.I Marine Lab.Inc.),主要成分为鱼粉、小麦粉、卤虫、虾粉、浓缩鱼蛋白、胡萝卜素、干圆酵母、鱼油、天然人工色素、卵磷脂和各种维生素,其中粗蛋白含量≥48%,粗脂肪含量≥7%。
1.4 试验鱼种
试验鱼种为斑马鱼和稀有鮈鲫,且处于同一年龄阶段。在试验开始前,试验鱼在试验条件下驯养2周,每次投饵量为鱼湿重的1.5%,一天投喂2次。试验过程中,根据试验鱼的数量和体重的变化,修正投喂量。
1.5 实验方法
1.5.1 试验设计
斑马鱼和稀有鮈鲫的对照组和2个处理组均未设置平行组。斑马鱼和稀有鮈鲫的对照组,试验鱼总尾数均为150尾,斑马鱼和稀有鮈鲫的各处理组,试验鱼的总尾数均为250尾。2个处理组的饵料中二甲苯麝香的配制浓度分别为50.0 mg·kg-1(处理组1),100 mg·kg-1(处理组2)。
1.5.2 饵料制备
将一定量的MX溶解在丙酮中,分别配制成100 mg·L-1和200 mg·L-1的MX母液。称取一定量研磨后的饵料(粉末状),往其中添加相同体积不同浓度的MX母液,分别配制成50.0 mg·kg-1和100 mg·kg-1的试验饵料。经搅拌均匀后,放置于通风橱,室温干燥过夜。饵料加标完成后,分别在0 d、3 d、5 d、7 d和14 d取样,测定饵料中MX的实测浓度,分析其在饵料中的稳定性和均一性,以确定加标饵料的更新周期。对照组饵料按处理组的加标方式处理,不同之处是丙酮中不含MX。加标饵料置于4 ℃冷藏储存,直至使用。
1.5.3 试验鱼的选择
选择在试验条件下驯养、无疾病或明显畸形的斑马鱼鱼龄3月,体重(0.336±0.05) g (mean±SD,下同),体长(3.5±0.5) cm和稀有鮈鲫鱼龄3月,体重(0.524±0.09) g,体长(3.0±1) cm,来源于中国科学院水生生物研究所。鱼体重相似,最小的不低于最大的体重的2/3。试验开始时,试验鱼随机地从驯养鱼群中选择,称重后转入试验容器中。
1.5.4 试验程序
MX的摄食暴露生物蓄积试验分2个阶段:吸收阶段(加标饵料)和清除阶段(清洁饵料)。吸收阶段持续时间为14 d,清除阶段持续时间为28 d[10]。试验开始时,对照组斑马鱼和稀有鮈鲫的承载量分别为0.072 g鱼·(d·L)-1和0.112 g鱼·(d·L)-1,处理组1和处理组2的斑马鱼和稀有鮈鲫的承载量分别为0.120 g鱼·(d·L)-1和0.187 g鱼·(d·L)-1;光照周期为14 h:10 h;水中溶解氧浓度平均值为90%ASV,温度为(23.2±0.4) ℃(mean+SD),pH值为(7.36±0.23) (mean+SD)。实验装置为流水系统,试验容器为不锈钢桶(高60 cm,直径60 cm,有效容积140 L),流速为500 mL·min-1,每天试验用水更新700 L。
吸收阶段,处理组的斑马鱼和稀有鮈鲫分别投喂加标饵料,对照组的鱼投喂清洁饵料,每天2次。清除阶段,处理组和对照组的鱼均投喂清洁饵料,投饵量和频率与吸收阶段一致。每次鱼的摄食率均为平均鱼湿重的1.5%。
在试验开始前和试验结束时,空白对照组和处理组的鱼均随机取20尾用于体重分析,以及在每个取样点均对所取的鱼样逐条测量体重。
整个试验期间,在吸收阶段第3天和第13天,清除阶段第3、5、7、9、13、20、28天,从空白对照组和各处理组中分别采集鱼样6尾。为了确保肠道内没有饵料残留,吸收阶段第3天和第13天取鱼样时,试验鱼第2次进食后30 min后,分别在对照组和每个处理组的容器中随机取鱼样,迅速放入对应的盛有清洁水的小型玻璃容器中。大约5 h后,再投喂清洁饵料(不含二甲苯麝香)。于次日上午安乐死之后逐条称重和测定二甲苯麝香浓度。吸收阶段的第13天对应清除阶段的第1天。
试验开始前对试验用水进行目标物的检测分析。试验过程中每周对水样中目标物测定一次。在整个试验过程中,水的质量参数(温度、流速、溶解氧、硬度、碱度和pH)没有明显的改变。
1.6 化学分析方法
使用气相色谱-串联质谱方法定量分析水、饵料和鱼体中的二甲苯麝香浓度,饵料和鱼样的前处理方法均选用快速溶剂萃取(ASE)法和凝胶渗透色谱(GPC)法,萃取溶剂为正己烷,凝胶渗透色谱流动相为乙酸乙酯/环己烷(1:1,V/V)。水样的前处理方法为液液萃取,萃取溶剂为正己烷。具体的仪器方法和分析条件见参考文献[11-12]。
1.7 数据处理
当化合物的BMFk的实地测量值缺乏或不存在时,实验室测定值可被认为是此化合物生物蓄积的一个关键指标。计算BMFk值,首先需获得同化率(受试物在肠道的吸收,α),同时还要知道清除阶段开始时鱼体内样品的浓度(C0,d)、(总体)清除速率常数(k2)、饵料中受试物的浓度(Cfood)、摄食率(I)和吸收阶段持续时间(t)。鱼体内样品浓度的自然对数(ln(浓度)与清楚阶段持续时间之间的线性关系的斜率为k2,截距为C0,d。如果有必要做生长校正和脂肪校正,需计算生长校正清除速率常数(k2g)和脂肪校正因子(Lc),从而计算出生长校正生物放大因子(BMFg)和脂肪校正生物放大因子(BMFL)[10]。
1.7.1 动态摄食生物放大因子(BMFK)计算
式中:α,同化率;C0,清除阶段零时鱼体内样品的浓度,mg·kg-1;k2,总体清除速率常数(非生长纠正),d-1;I,摄食率,g饵料/g鱼/天;Cfood,试验饵料中样品的浓度,mg·kg-1;t,吸收阶段持续时间,d;鱼体内样品浓度的自然对数(ln(浓度))与清除阶段持续时间之间的线性关系的斜率为k2,截距为C0,d。
1.7.2 生长和脂肪-校正动态生物放大因子(BMFg,BMFL)计算
k2g=k2-kg
式中:Lc,脂肪校正因子;Lfish,鱼体内平均脂肪含量,%;Lfood,饵料中平均脂肪含量,%。
1.7.3 统计分析
根据各个取样时间点的饵料和鱼体内MX的浓度,绘制ln(浓度)-时间曲线图,用线性回归分析,得出回归方程,方程的斜率即为k2。同时,对不同取样时间点的鱼体重量和脂肪含量进行线性回归分析,得出kg。用t-检验方法分析试验开始时和试验结束时鱼的体重,判断在整个试验期间鱼体重的增加对鱼体内MX的浓度是否存在生长稀释效应。
2 结果与讨论(Results and discussion)
2.1 饵料分析
对照饵料未检测到二甲苯麝香,加标饵料中MX实测平均浓度分别为48.1 mg·kg-1和95.1 mg·kg-1。平均加标回收率分别为87.3 %和90.2 %。吸收阶段开始和结束时,饵料中平均脂肪含量分别为20.5 %和20.8 %。
2.2 饵料中MX的稳定性和均一性
加标饵料中MX的稳定性和均一性的结果分别见下表1和表2。表中MX的实测平均浓度为5个平行值的平均数,浓度变化百分比为第3、5、7、14天所取饵料中MX的实测浓度值与0 d饵料中MX的实测浓度值的差异。从表中可以看出,0 d~7 d内饵料中MX的浓度变化范围均在±20%的范围内。因此可判定7 d内饵料中的MX浓度稳定。吸收阶段,试验饵料每7 d更新1次。每次取样所测的5个平行组之间的数值的标准偏差和变异系数(CV)基本小于10,说明配制饵料中MX分布比较均匀。
2.3 MX对斑马鱼和稀有鮈鲫的生长影响
试验期间,水质参数(温度、流水、溶解氧、硬度和pH)没有明显的变化。试验用水中未检出MX。在整个试验阶段,空白对照组和处理组的斑马鱼和稀有鮈鲫均正常和健康,并且无死亡。
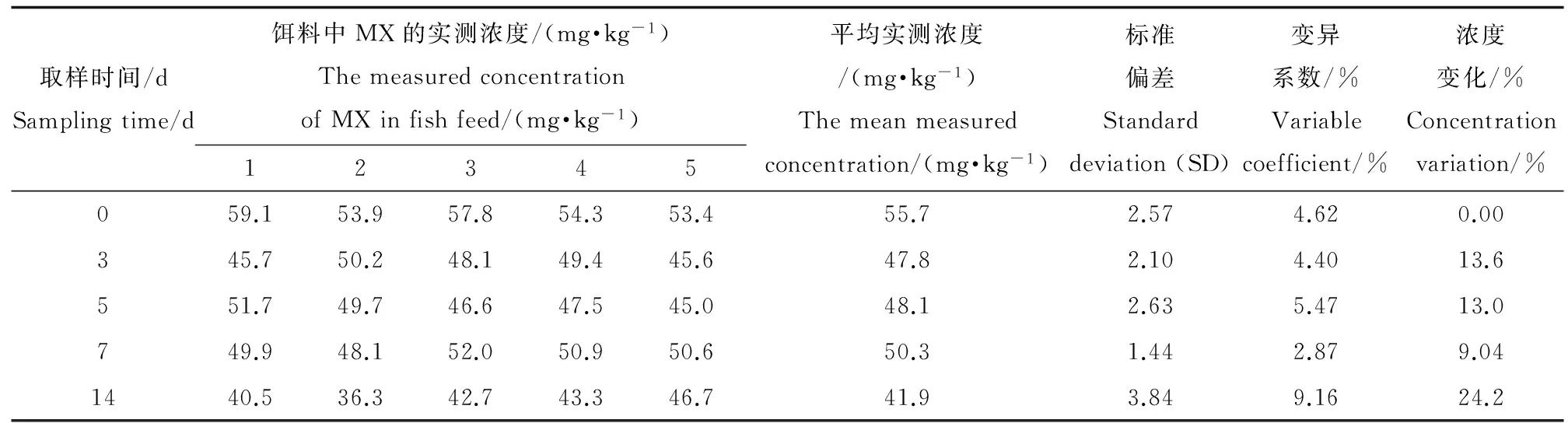
表1 饵料中MX(配制浓度为50.0 mg·kg-1)的实测浓度及变化率Table 1 The measured concentration and variation of MX in fish feed (50 mg·kg-1 preparation concentration)
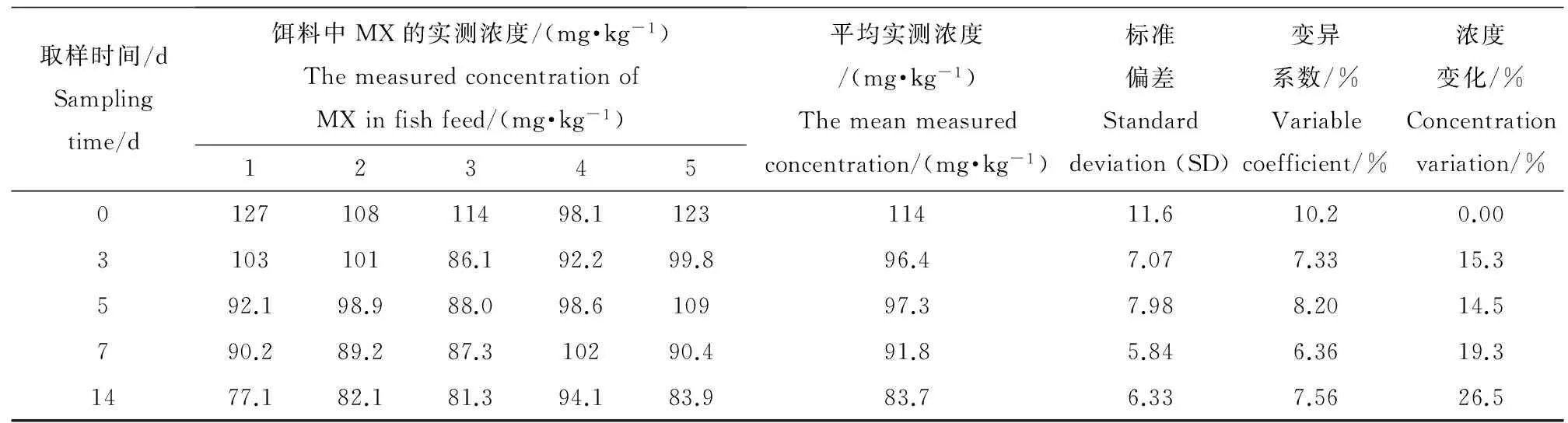
表2 饵料中MX(配制浓度为100 mg·kg-1)的实测浓度及变化率Table 2 The measured concentration and variation of MX in fish feed (100 mg·kg-1 preparation concentration)
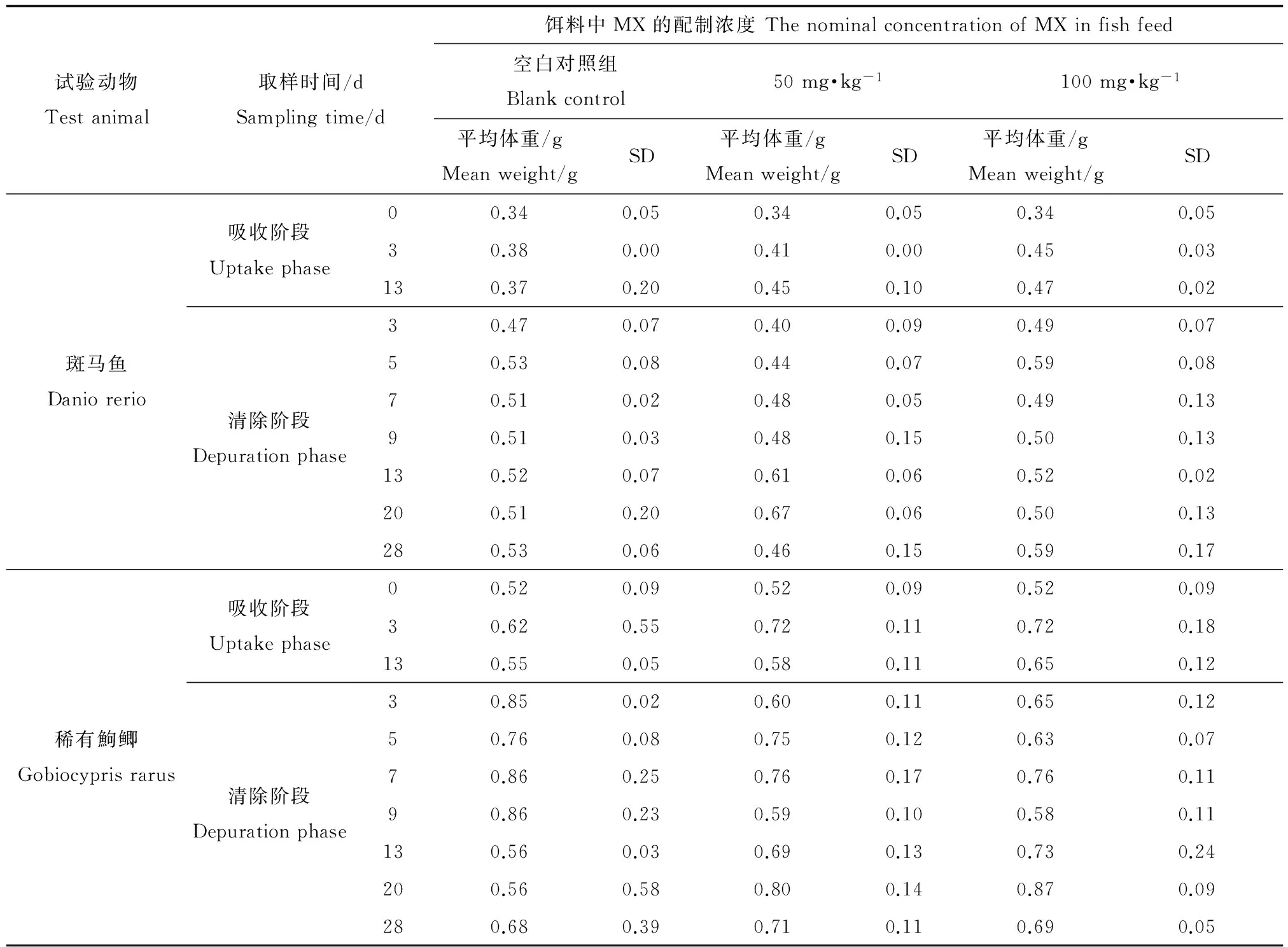
表3 试验期间不同时间的鱼的体重值Table 3 The weight of fishes during test
表3中显示在整个试验阶段内空白对照组和处理组的试验鱼的体重呈增加的趋势,而且处理组的斑马鱼和稀有鮈鲫分别与相对应的空白对照组相比较,没有明显的差异(P>0.05)。因此,MX对斑马鱼和稀有鮈鲫的生长没有抑制作用。
在试验开始前、吸收阶段结束时以及清除阶段结束时,分别从2种鱼的各个试验组中取5尾鱼检测鱼体内的脂肪平均浓度(w/w),测定随着试验进展,斑马鱼和稀有鮈鲫体内脂肪含量的变化趋势,从而推断斑马鱼和稀有鮈鲫对MX的蓄积程度与其体内脂肪含量之间的关系。
由表4可知,在整个试验过程中,2种鱼体内的脂肪含量总体呈增加趋势。试验结束时,空白对照组和所有处理组斑马鱼体内脂肪含量与试验开始时斑马鱼体内脂肪含量相比较,分别增加了93.5%、55.8%和57.0%,空白对照组和所有处理组稀有鮈鲫体,则脂肪含量分别增加了18.4%、19.3%和15.8%。Nakata等[13]报道的研究表明,MX浓度与脂肪含量有关,且脂肪含量越高,MX浓度越大。本研究可能是由于试验取样的频率少和样本数量不多,试验鱼体内MX的浓度与脂肪含量的相关性并不明显。因而,还有待进一步的研究。
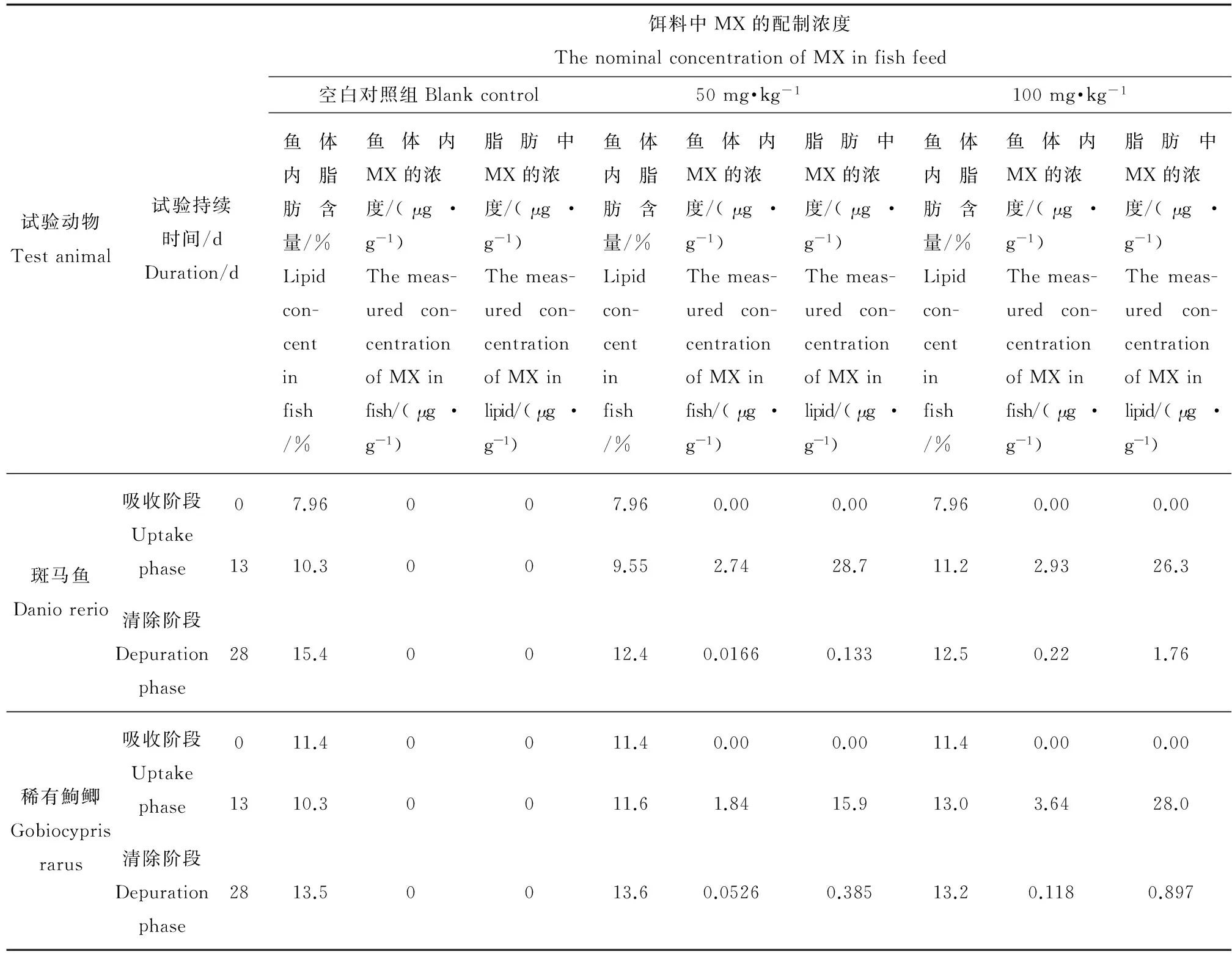
表4 鱼体内脂肪含量及脂肪中MX的浓度Table 4 The content of fat in fish and the concentration of MX in fat
2.4 MX在斑马鱼和稀有鮈鲫体内的蓄积
整个试验过程中,不同取样时间点试验鱼体内检测到的MX的平均浓度(n=3)和时间的关系分别如见下图1、2、3、4。从图中显示斑马鱼和稀有鮈鲫暴露于不同剂量的饵料后,其对MX的蓄积及清除趋势相似。对照组鱼体内均未检测到MX。在所有样品的分析过程中均加入了空白鱼样加标准样品回收率试验以控制分析质量,其回收率范围在80.3%~125%,平均回收率为97.5%。以ln(鱼体内MX的浓度)对清除时间作图,得出鱼体内MX的总体清除速率常数k2(k2=斜率),斑马鱼和稀有鮈鲫体内MX的总体清除速率见图5~8。
从图1~4中可以看出,在吸收阶段中,鱼体内MX的含量均呈上升趋势,100 mg·kg-1浓度组的蓄积量比50 mg·kg-1度的蓄积量要高,大约成2~3倍关系,表明斑马鱼和稀有鮈鲫对MX的蓄积程度与饵料中MX的浓度剂量有关。有研究证明,用含有MX(其含量分别为1.0 μg·kg-1和10 μg·kg-1)的饵料喂养鱼140 d后,在鱼体内未有MX检出[14]。这也说明MX在鱼体内蓄积是摄入、生物转化和排泄等作用的综合竞争结果。低剂量的暴露,MX在鱼体内可能是以生物转化和排泄作用为主导,因而未能在体内产生蓄积。而本次研究的暴露剂量明显超出了鱼体内的生物转化和排泄作用的能力,并随着暴露剂量的增加,鱼体内MX的蓄积浓度而随之上升。清除阶段,鱼体内的MX的含量总体呈下降趋势,50 mg·kg-1和100 mg·kg-1浓度组的斑马鱼体内MX的残留量分别下降了99.4%和94.4%;稀有鮈鲫体内MX的残留量也分别下降了97.1%和96.8%。不同暴露浓度的斑马鱼体内达到50%清除率需要的时间(t50)分别为3.80 d(50.0 mg·kg-1)和6.73 d(100 mg·kg-1);稀有鮈鲫体内则分别为5.46 d(50.0 mg·kg-1)和5.66 d(100 mg·kg-1)。
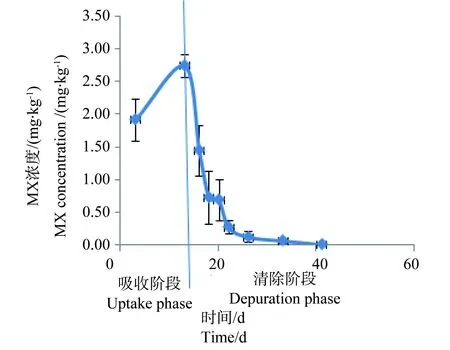
图1 50 mg·kg-1 处理组斑马鱼体内 MX的浓度与时间的关系Fig. 1 Relationship between the concentration of MX in Danio rerio and time for 50 mg·kg-1 group
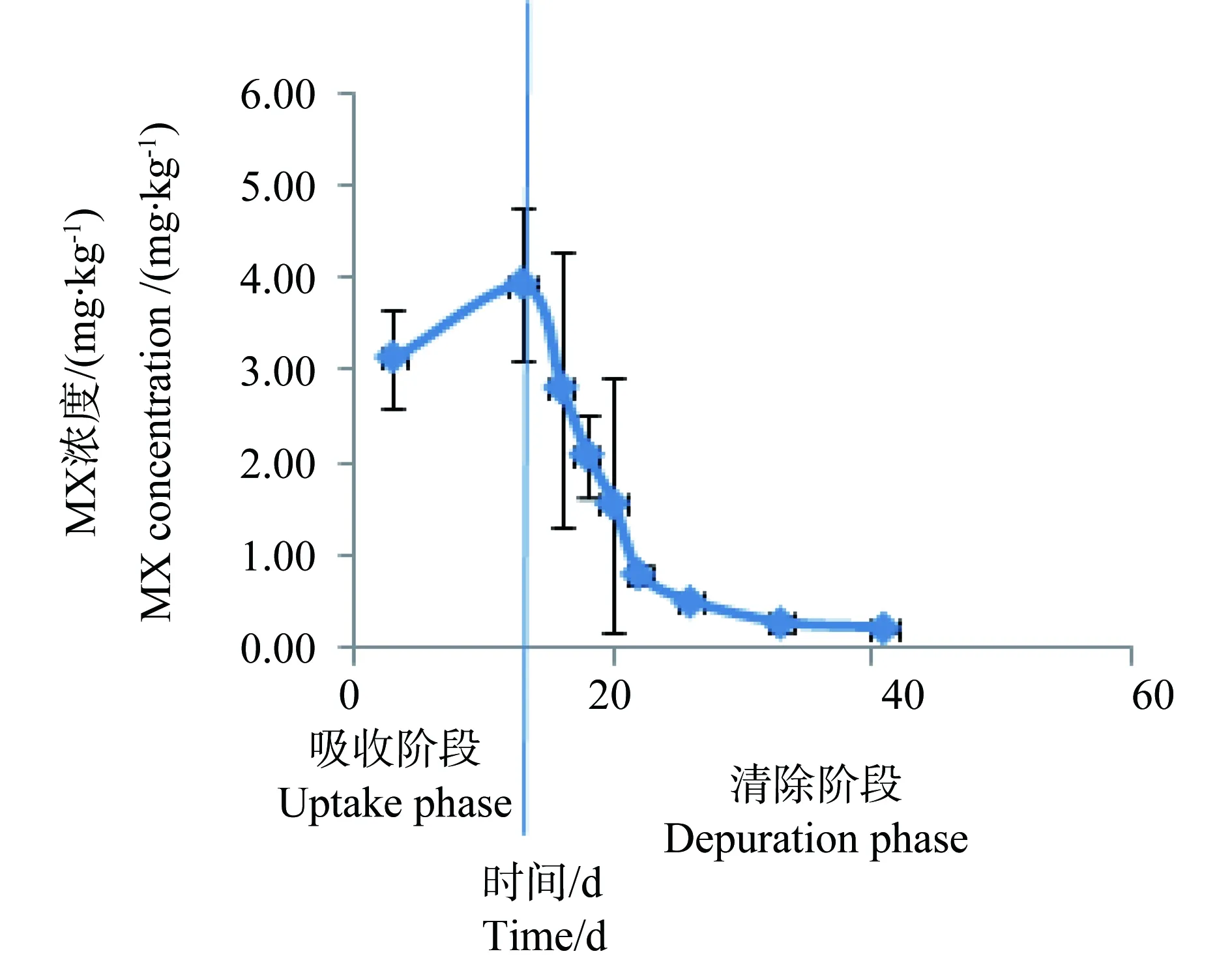
图2 100 mg·kg-1 处理组斑马鱼体内 MX的浓度与时间的关系Fig. 2 Relationship between the concentration of MX in Danio rerio and time for 100 mg·kg-1 group
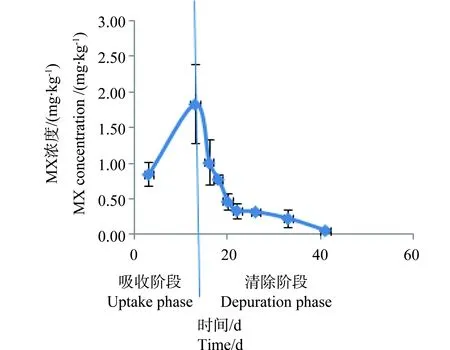
图3 50 mg·kg-1 处理组稀有鮈鲫体内 MX的浓度与时间的关系Fig. 3 Relationship between the concentration of MX in Gobiocypris rarus and time for 50 mg·kg-1 group
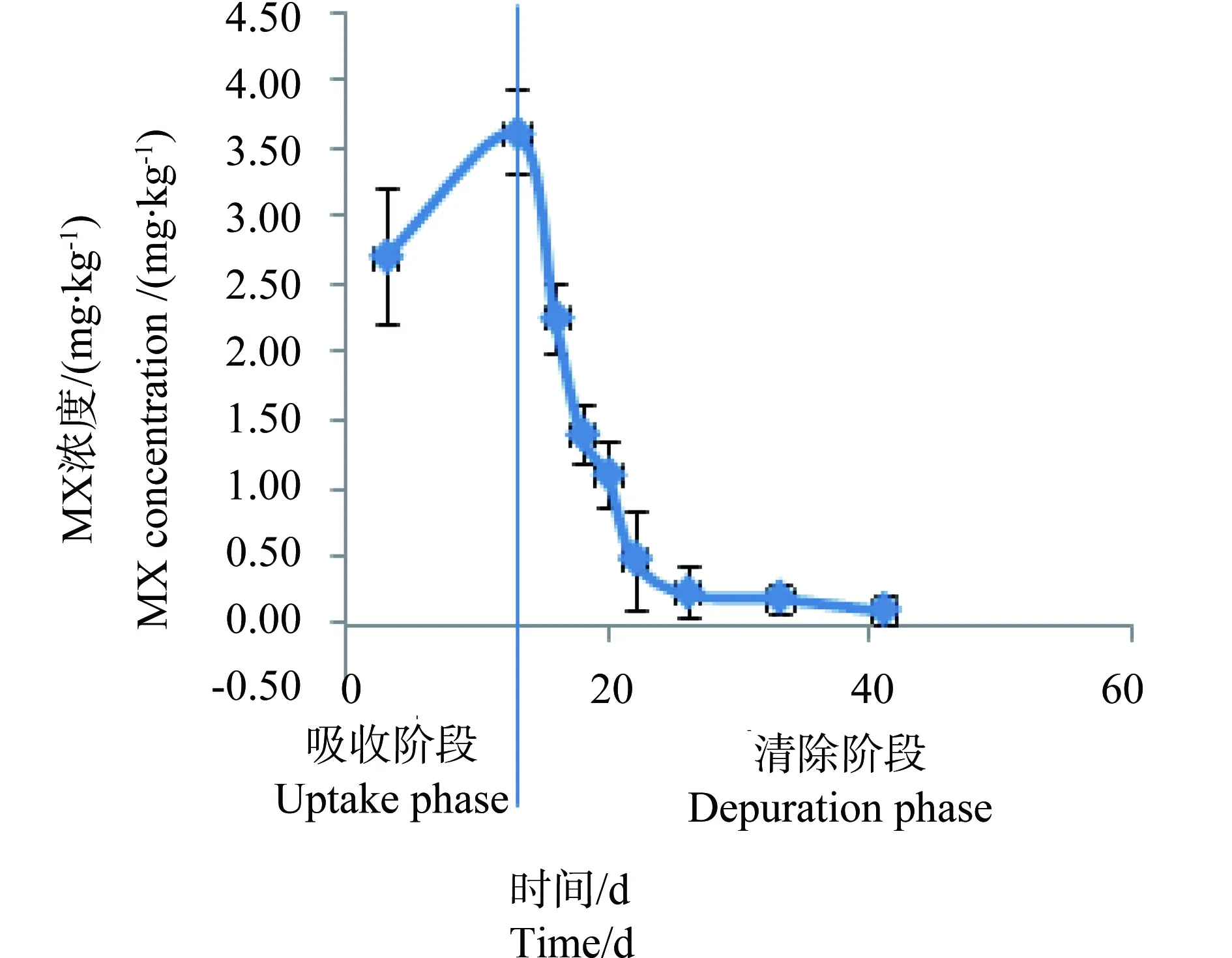
图4 100 mg·kg-1 处理组稀有鮈鲫体内 MX的浓度与时间的关系Fig. 4 Relationship between the concentration of MX in Gobiocypris rarus and time for 100 mg·kg-1group
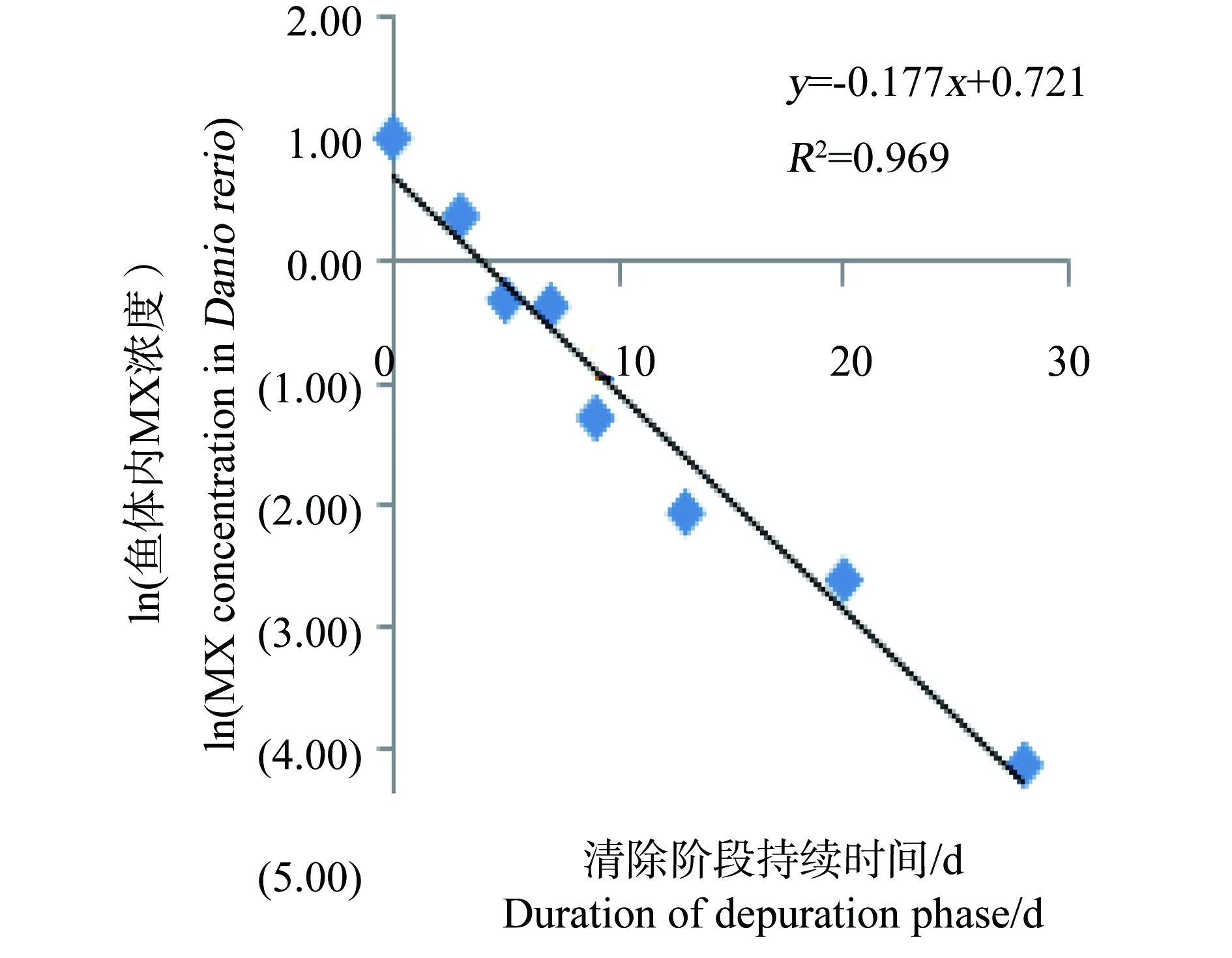
图5 50 mg·kg-1 浓度组ln(斑马鱼体内 MX的浓度)与时间的关系Fig. 5 Relationship between ln(the concentration of MX in Danio rerio) and time for 50 mg·kg-1 group
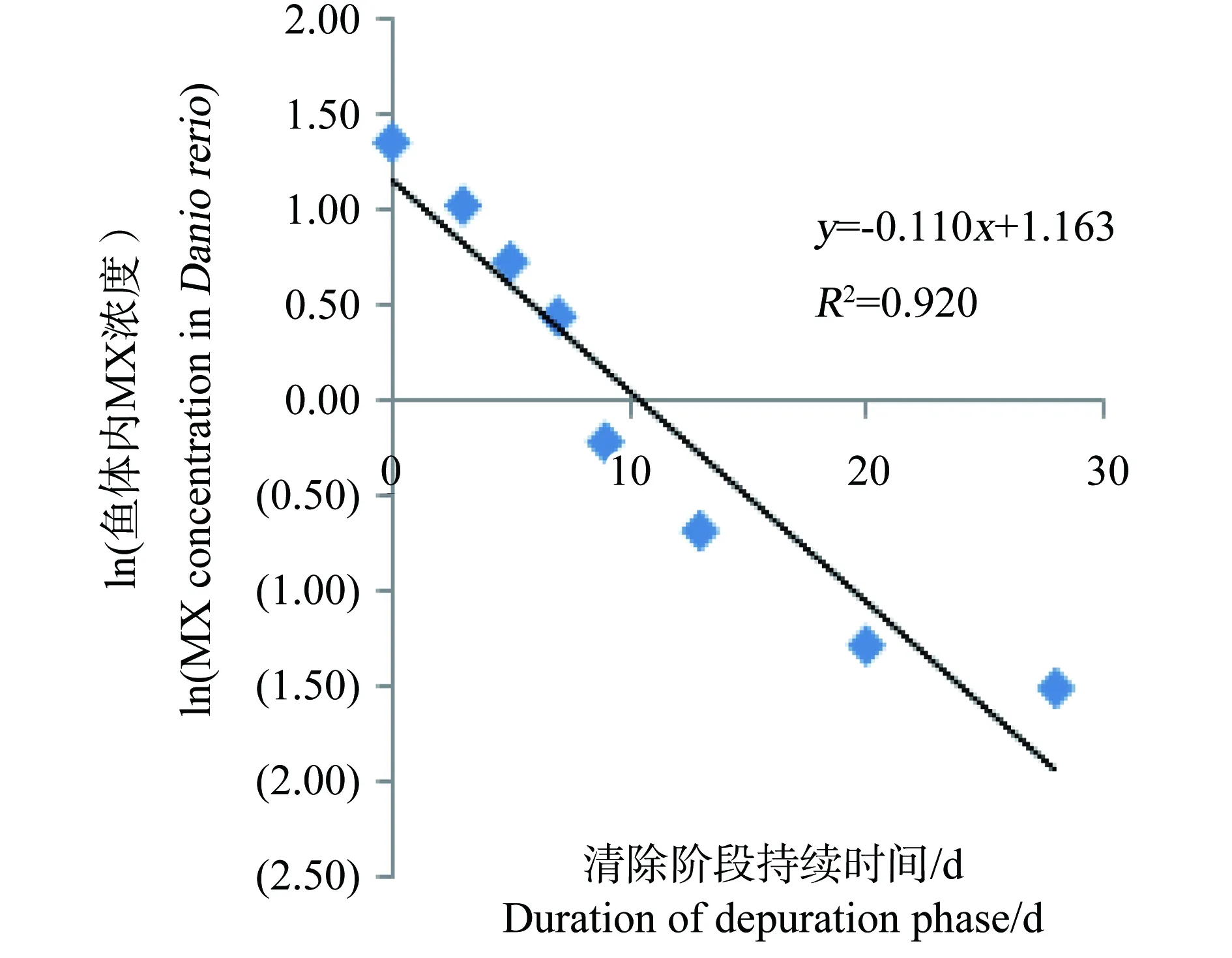
图6 100 mg·kg-1 浓度组ln(斑马鱼体内 MX的浓度)与时间的关系Fig. 6 Relationship between ln(the concentration of MX in Danio rerio) and time for 100 mg·kg-1 group
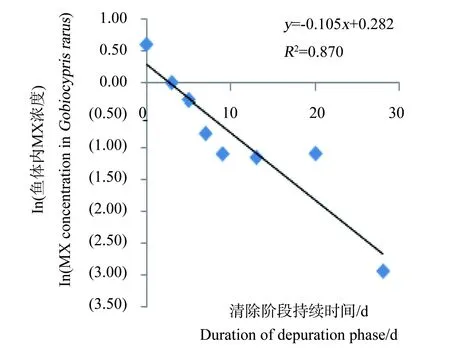
图7 50 mg·kg-1 浓度组ln(稀有鮈鲫体内 MX的浓度)与时间的关系Fig. 7 Relationship between ln(the concentration of MX in Gobiocypris rarus) and time for 50 mg·kg-1 group
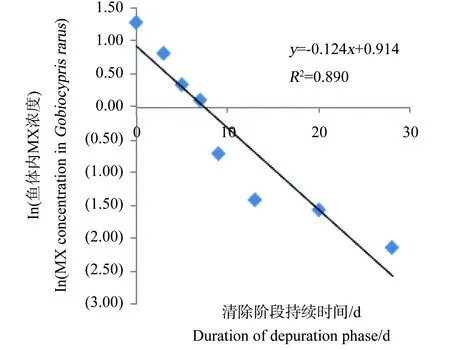
图8 100 mg·kg-1 浓度组ln(稀有鮈鲫体内 MX的浓度)与时间的关系Fig. 8 Relationship between ln(the concentration of MX in Gobiocypris rarus) and time for 100 mg·kg-1 group
表5列出了斑马鱼和稀有鮈鲫对MX的k2、k2g、α、Lc、BMFk、BMFg和BMFL值。两种鱼种同属于小型鱼种,对相同剂量MX暴露后的清除速率和食物链上的生物放大程度相似。英国和威尔士的环境局(代表Defra)联合荷兰(RIVM)和德国(UBA)的多个实验室曾开展一次摄食暴露的鱼类蓄积比对试验[15]。所用试验生物分别为虹鳟(Oncorhynchus mykiss)和鲤鱼(Cyprinus carpio)。该比对结果显示,MX在鱼体内的清除速率在0.062~0.459范围内,BMF值均小于1。本文所得斑马鱼和稀有鮈鲫的k2值和BMF值均在此范围内。说明稀有鮈鲫对二甲苯麝香在体内的中清除速率和生物放大因子与国际公认的模式实验鱼斑马鱼、虹鳟和鲤鱼相似。
通过摄食暴露方法,研究了MX在斑马鱼和稀有鮈鲫体内的生物蓄积水平及对MX的清除能力。结果显示,不同的MX饵料暴露剂量,鱼体内MX蓄积程度亦不同;随着暴露剂量的增加,鱼体内MX的浓度随之而上升。在整个试验过程中,2种鱼的体重和鱼体内脂肪含量均呈上升趋势,鱼体内MX的浓度与鱼体内脂肪含量之间没有明显的相关性,有待进一步研究。经清除阶段,斑马鱼和稀有鮈鲫的清除速率系数分别为0.111~0.177和0.105~0.124,体内达到50%清除率需要的时间(t50)分别为3.80~6.73 d和5.46~5.66 d,2种鱼对MX的清除能力均很强。斑马鱼和稀有鮈鲫生物放大因子均小于1,2种鱼在食物链中对MX均无生物放大作用。稀有鮈鲫与斑马鱼同属鲤科的小型鱼种,本次研究结果丰富了稀有鮈鲫在化学品经摄食暴露(食物链途径)的生物蓄积试验的数据库。
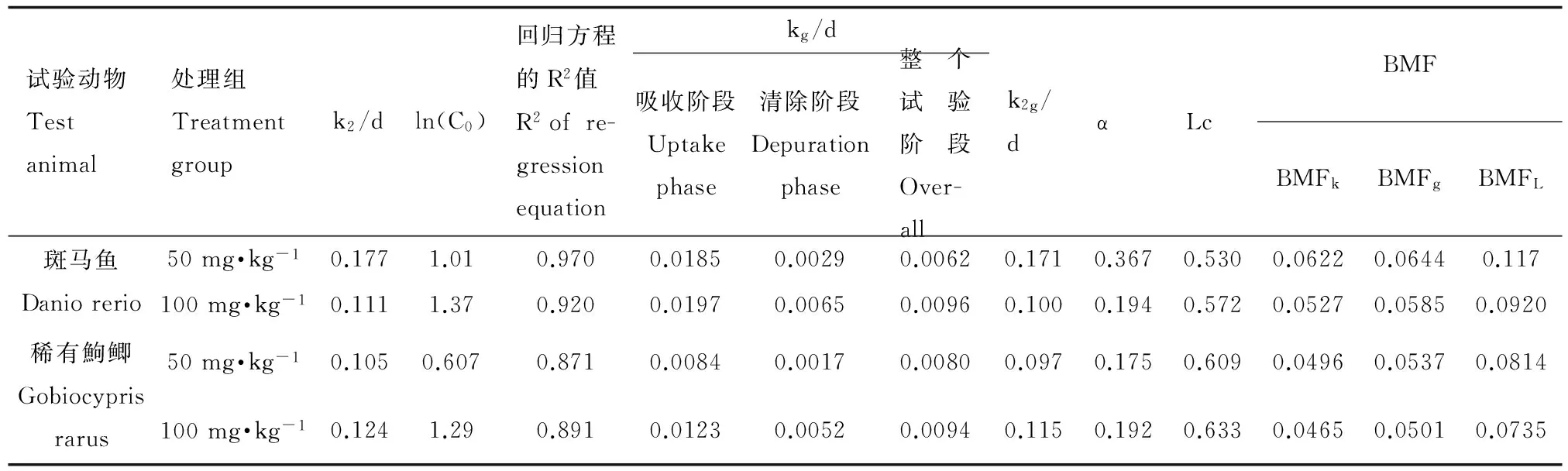
表5 整个试验不同阶段的K2、Kg、K2g、α、Lc、BMFk、BMFg和BMFL值Table 5 The K2, Kg, K2g, α and Lc, BMF of different stages during the whole test
致谢:感谢上海市检测中心生物与安全实验室赵华清老师的帮助和支持。
[1] Della Torre C, Monti M, Focardi S, et al. Time-dependent modulation of cyp1a gene transcription and EROD activity by musk xylene in PLHC-1 and RTG-2 fish cell lines [J]. Toxicology in Vitro, 2011, 25(8): 1575-1580
[2] López-Nogueroles M, Chisvert A, Salvador A, et al. Dispersive liquid-liquid microextraction followed by gas chromatography-mass spectrometry for the determination of nitro musks in surface water and wastewater samples [J]. Talanta, 2011, 85: 1990-1995
[3] 谢压杰, 颜巧蓉. 二甲苯麝香的生物与环境效应及其人工合成[J]. 嘉兴学院学报, 2009, 21(6): 13-17
Xie Y J, Yan Q R. Environmental & ecological effect of musk xylene and its synthesis [J]. Journal of Jiaxing University, 2009, 21(6): 13-17 (in Chinese)
[4] Mottaleb M A, Brumley W C, Pyle S M, et al. Determination of a bound musk xylene metabolite in carp hemoglobin as a biomarker of exposure by gas chromatography-mass spectrometry using selected ion monitoring [J]. Journal of Analytical Toxicology, 2004, 28(7): 581-586
[5] Suter-Eichenberger R. Musk xylene (MX): Bioaccumulation, enzyme induction and developmental toxicity Diss. ETH No. 13183. [R]. Zürich, 1999, 10.3929/ethz-a-003836664
[6] Bruggeman W A, Opperhuizen A, Wijbenga A. Bioaccumulation of super-lipophilic chemicals in fish [J]. Toxicological Environmental Chemistry, 1984, 7: 173-189
[7] Muir D C G, Marshall W K, Webster G R B. Bioaccumulation of PCDDs by fish: Effects of molecular structure and water chemistry [J]. Chemosphere, 1985, 14: 829-833
[8] 丁立平, 蔡春平, 林永辉, 等. 多重吸附同步净化-气相质谱-质谱联用法测定水产品中痕量的二甲苯麝香和酮麝香[J]. 色谱, 2014, 32(3): 309-313
Ding L P, Cai C P, Lin Y H, et al. Determination of trace musk xylene and musk ketone in aquatic products by multiple adsorption synchronous purification-gas chromatography-mass spectrometry [J]. Chinese Journal of Chromatography, 2014, 32(3): 309-313 (in Chinese)
[9] Nichols J W, Fitzsimmons P N, Whiteman F W. A physiologically based toxicokinetic model for dietary uptake of hydrophobic organic substances by fish: II. Stimulation of chronic exposure scenarios [J]. Toxicological Science, 2004, 77: 219-229
[10] OECD. OECD Guidelines for Testing of Chemicals. Test No. 305 Bioaccumulation in Fish: Aqueous and Dietary Exposure [S]. Paris: OECD, 2012, DOI: 10.1787/9789264185296-en
[11] 王绿平, 殷浩文, 周忠良, 等. 斑马鱼和稀有鮈鲫体内二甲苯麝香的分析方法研究[J]. 环境与职业医学, 2013, 30(12): 935-938
Wang L P, Yin H W, Zhou Z L, et al. Analytical methodology for musk xylene in zebrafish and rare gudgeon [J]. 环境与职业医学, 2013, 30(12): 935-938 (in Chinese)
[12] Dionex中国有限公司应用研究中心. AN321用加速溶剂萃取(ASE)技术测定各种食品中的游离脂肪[Z]. 2002
[13] Nakata H, Sasaki H, Takemura A. Bioaccumulation, temporal trend, and geographical distribution of synthetic musks in the marine environment [J]. Environmental Science & Technology, 2007, 41: 2216-2222
[14] OECD. Draft validation report of a ring test for the OECD 305 dietary exposure bioaccumulation fish test [R]. Paris: OECD, 2011
[15] OECD. OECD Environment, Health and Safety Publications Series on Testing and Assessment NO.175. Validation report of a ring test for the OECD 305 dietary exposure bioaccumulation fish test (part Ⅰ) with additional report including comparative analysis of trout and carp results (part Ⅱ) [R]. Paris: OECD, 2012
◆
《生态毒理学电子教案》介紹
《生态毒理学电子教案》(李君灵、孟紫强编制)最近由高等教育出版社和高等教育电子音像出版社出版,该教案与教育部审批的普通高等教育“十一五”国家级规划教材《生态毒理学》(孟紫强主编, 高等教育出版社2009年出版)相配套。该教材可供普通高等学校生态类、环境类、资源类专业本科生使用,也可供相关专业的学生和科研工作者及管理人员学习参考。为了满足教学需要,特编制电子教案奉献给大家。教案重点突出、条理分明,同时增加了许多新的图片,使理论教学更生动形象和易于理解。此外,还吸纳了教材出版以来在生态毒理学科研和教学方面取得的新知识、新成果。对于采纳本《生态毒理学》作为教材的单位可以获得免费赠送。
Analysis of the Dietary Exposure Bioaccumulation and Depuration of MX-Spiked Feed in Fish
Wang Lvping1,2, Zhao Huaqing1, Zhou Zhongliang2, Yin Haowen1,*
1. Bioassay and Safety Assessment Laboratory, Shanghai Academy of Public Measurement, Shanghai 201203, China 2. Academy of Life Sciences, East China Normal University, Shanghai 200062, China
4 August 2014 accepted 21 November 2014
Musk xylene (MX) is a synthetic musk fragrance ingredient with strong odor characteristics used as fixative principally in cosmetics and soaps. Because of its continuous input to environment, the concentrations of MX was increasing in water, soil and air, and concentrated in animals and human tissues. Its accumulative effect was equivalent to that of persistent organic pollutants such as organo-chlorine pesticides (OCPs). It was necessary to study the bioaccumulation of MX in fishes. Zebrafish (Danio rerio) and rare minnow (Gobiocypris rarus) were fed with MX-containing chow (0, 50 and 100 mg MX/kg fish feed) for 14 days followed by 28 days of clean food. The concentrations of MX in zebrafish and rare minnow were measured by accelerated solvent extraction (ASE), gel permeation chromatography (GPC) and gas chromatography-mass spectrometry (GC-MS), and then the depuration ability of fish to MX was evaluated. The more MX content in diets, the higher MX concentration was found in fishes, e.g., the MX in fishes of 100 mg·kg-1was two or three times as high as that of 50 mg·kg-1. A positive linear relationship was observed between the MX concentration in fishes and body weight of fishes, however, the body fat content was not related to the MX concentration in fishes. After depuration for 28 days, the levels of MX in fishes were close to zero, implying that zebrafish and rare minnow have a strong ability to depurate MX.
musk xylene; Danio rerio; Gobiocypris rarus; dietary exposure bioaccumulation; gas chromatography-mass spectrometry series method; depuration rate constant; assimilation; dietary biomagnification factor (BMFk)
环保公益性行业科研专项(No.201309028)
王绿平(1986-),女,硕士,研究方向为水生生态毒理学,E-mail: lvping_wang@139.com
*通讯作者(Corresponding author), E-mail: yinhaowen@126.com
10.7524/AJE.1673-5897.20140804001
2014-08-04 录用日期:2014-11-21
1673-5897(2015)2-454-10
X171.5
A
殷浩文(1959-),男,教授级高工,中国毒理学会理事,上海市建委环境生态学学科带头人,环境与职业健康杂志常务编委。研究方向为生态毒理学及生物检测技术、生态风险评价。三次获上海市科技进步一等奖、一次三等奖。
王绿平, 赵华清, 周忠良, 等. 饵料加标研究二甲苯麝香在鱼体内的蓄积和清除能力[J]. 生态毒理学报, 2015, 10(2): 454-463
Wang L P, Zhao H Q, Zhou Z L, et al. Analysis of the dietary exposure bioaccumulation and depuration of MX-spiked feed in fish [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 454-463 (in Chinese)

