全氟化合物对水生植物的生态效应研究Ⅰ—典型城市河道全氟化合物的暴露水平及植物富集特征
蒋曌泽,王铁宇,张晓军,孔潇潇,李奇锋,孟晶,朱朝云
1. 牡丹江师范学院生命科学与技术学院,牡丹江 157012 2. 中国科学院生态环境研究中心 城市与区域生态国家重点实验室,北京 100085 3. 中国科学院大学,北京 100049
全氟化合物对水生植物的生态效应研究Ⅰ—典型城市河道全氟化合物的暴露水平及植物富集特征
蒋曌泽1,2,王铁宇2,*,张晓军1,#,孔潇潇1,2,李奇锋2,3,孟晶2,3,朱朝云2,3
1. 牡丹江师范学院生命科学与技术学院,牡丹江 157012 2. 中国科学院生态环境研究中心 城市与区域生态国家重点实验室,北京 100085 3. 中国科学院大学,北京 100049
全氟化合物(perfluorinated compounds, PFCs)近年来得到国内外广泛关注,针对工业源排放区域的环境暴露、来源解析以及动物层面的生态效应有较多研究,但对于普遍存在于非工业源(生活源)的城市河道PFCs暴露及水生植物富集等研究较为缺乏。本研究选择位于北京北部东西贯通的城市河道——清河水体为对象,分析结果表明,清河水体中12种目标PFCs均有检出(总量最高为65.45 ng·L-1),并以全氟丁烷磺酸盐(perfluorobutane sulfonate, PFBS)为主(最高达45.63 ng·L-1);6种水生植物(篦齿眼子菜、黑藻、金鱼藻、芦苇、菖蒲及水葱)的富集物质均以全氟辛烷磺酸盐(perfluorooctane sulfonate, PFOS)和全氟辛酸(perfluorooctanoic acid, PFOA)为主,沉水植物中金鱼藻对于PFOS的蓄积效果优于黑藻及篦齿眼子菜,挺水植物中根部PFCs含量高于茎叶,根部PFOA及PFOS含量高于茎叶,但全氟丁酸(perfluorobutanoic acid, PFBA)含量茎叶则高于根部。整体来看,尽管芦苇、菖蒲和水葱3种挺水植物尚不能作为PFCs的超富集植物,但其根部对PFCs均有显著的吸收效果,具有一定的生态修复潜质;沉水植物中金鱼藻是北方自然河道的优势物种,且对PFOS具有显著的富集效应,因此有必要进一步探索其PFCs生物指示和生态修复功能。
全氟化合物;水生植物;富集特征;生态效应;城市河道
全氟化合物(perfluorinated compounds, PFCs)是一类在环境中广泛存在的持久性有机污染物(persistent organic pollutants, POPs),并在人体、食品以及野生动物等均有检出[1-2]。河流是PFCs迁移进入环境的重要载体,自2009年以来全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)及其盐类列入斯德哥尔摩公约后,PFCs工业污水的排放与污染备受关注[3-4],但生活污水排放的相关研究尚不足。已有研究表明,城市污水中短链PFCs含量普遍高于长链[5],谢双蔚等[6]也模拟估算了城市污水中PFOS含量,证明污水处理厂是其重要来源及影响因素,而我国现有污水处理工艺尚没有针对处理这类物质的设计[7]。城市作为人口集聚和活动密集的地区,城市河道成为纳污的重要载体,城市河道中生活污水带来的PFCs污染问题及其潜在风险不容忽视。
位于北京北部的清河水体东西贯穿,西接京密引水渠,流经圆明园、奥林匹克森林公园,东至温榆河,是奥体景观龙形水系的重要水源。经人工改造,河道主体基本硬化加固,已成为北京市重要的纳污水体。清河水来源主要是两个污水处理厂的再生水,因其水源不足导致清河水体自净能力下降[8]。河道干流较多生活污染物排污口,长期作为北京市的排污渠道直接收纳城市排放的生活污水。统计结果表明,清河干流水质基本为Ⅴ类,但水质变化较大,以有机污染为主,部分河段有恶臭气味,夏季出现富营养化现象。在城市河道中,水生植物不仅发挥着调节水质、固定泥沙的作用,更起到景观绿化[9-12]、修复人为影响等诸多作用[13]。已有的关于PFCs的报道对植物的关注相对较少,张鸿等[14]验证了利用典型植物监测环境中有机氟污染物的可行性, García-Valcárcel等[15]曾研究双雄雀麦在培养液中对PFCs的吸收,温蓓等[16]和关月等[17]对小麦进行了人工控制土壤培养和液体培养,研究其对PFCs的吸收和转移,然而针对水生植物的仍较为匮乏。本文以城市河道为对象,通过系统采样,分析城市河道中水生植物的PFCs暴露水平,探索主要水生植物的富集特征,以期为城市河道PFCs污染治理以及生态效应等相关研究提供科学依据。
1 材料与方法(Materials and methods)
1.1 样品采集
沿清河河道均匀布设14个采样点,于2013年10月采集表层水、沉积物以及水生植物样品,采集点均距离河岸2 m以上。
水样经采集后用聚丙烯塑料瓶保存,并放入-20 ℃冰箱冷冻待处理。沉积物样品经冷冻干燥后研磨,过2 mm尼龙筛,装入双层聚丙烯塑料袋中保存。植物样在采集后立即用自来水冲洗挑拣干净,去离子水冲洗3遍,干燥后使用研钵及植物粉碎机进行处理,并分类保存。
1.2 主要仪器与试剂
主要仪器和耗材:高效液相色谱(Anilent 1200型,美国)/质谱(SCIEX 3000型,美国)联用仪(HPLC/MS-MS)。
SPE小柱:Oasis WAX(Waters公司),Spelco Florisi SPE(Supelco公司),Supelco ENVI-Carb(Supelco公司)。
主要试剂:
12种PFCs标准物分别为:全氟丁酸(perfluorobutanoic acid, PFBA)、全氟戊酸(perfluoropentanoic acid, PFPeA)、全氟己酸(perfluorohexanoic acid, PFHxA)、全氟丁基磺酸(perfluorobutane sulfonate, PFBS)、全氟庚酸(perfluoroheptanoic acid, PFHpA)、全氟辛酸(perfluorooctanoic acid, PFOA)、全氟己基磺酸(perfluorohexane sulfonate, PFHxS)、全氟壬酸(perfluorononanoic acid, PFNA)、全氟癸酸(perfluorodecanoic acid, PFDA)、全氟辛基磺酸(perfluorooctane sulfonate, PFOS)、全氟十一酸(perfluoroundecanoate, PFUdA)、全氟十二酸(perfluorododecanoic acid, PFDoA)。9种PFCs质量标记物分别为13C4PFBA、13C4PFHxA、13C4PFOA、13C4PFNA、13C4PFDA、13C4PFUdA、13C2PFDoA、18O2PFHxS和13C4PFOS。PFCs标准物和质量标记物纯度均>98%( Wellington实验室,加拿大)。
甲醇、乙腈、甲基叔丁基醚(MTBE)均为色谱级(美国J.T.Baker),四丁基硫酸氢铵(TBAHS),醋酸铵(~98%),分析级碳酸钠,分析级碳酸氢钠。
1.3 样品预处理
水样前处理:水样采用Oasis®WAX固相萃取柱进行萃取:取400 mL的水样,加入5 ng内标,通过由4 mL氨水甲醇溶液(0.10%),4 mL甲醇,4 mL蒸馏水依次清洗过的OasisR WAX柱,保持样液以1滴每秒的速度过柱。然后用4 mL的醋酸铵缓冲液(25 mmol·L-1,pH=4)冲洗,待柱内干燥后,用4 mL甲醇、4 mL的氨水甲醇溶液(0.10%)洗脱待测物质,洗脱液收集后用高纯氮气吹至1 mL。并用0.2 μm的尼龙滤膜过滤,收集待上机[18]。
沉积物处理:称取2 g样品于50 mL聚丙烯离心管中,加入5 ng内标,2 mL氢氧化钠乙腈溶液(100 mmoL·L-1,8∶2/乙腈:超纯水),超声处理30 min,加入20 mL乙腈,250 r·min-1震荡30 min后加入0.1 mL盐酸(2 mol·L-1)离心15 min,转移上清液。以上步骤用乙腈重复一次,上清液氮吹至1 mL。氮吹后的样液经过由1 mL甲醇冲洗3次的ENVI-Carb,并用甲醇冲洗小柱3次,速度控制在1滴每秒,收集样液并用超纯水定容至100 mL。其余步骤与水样处理方式相同,用0.2 μm的尼龙滤膜过滤,收集待上机[19]。
植物样品处理:称取1 g干燥的植物样于50 mL聚丙烯离心管中,加入5 ng内标,6 mL氢氧化钠溶液(0.4 mol·L-1),涡旋后置于冰箱过夜。依次加入4 mL TBAHS (0.5 mol·L-1)、8 mL碳酸钠-碳酸氢钠缓冲液(0.25 mol·L-1)涡旋,而后加入10 mL MTBE,700 r·min-1震动5 min,超声10 min,3 000 r·min-1离心10 min,转移上清液,用5 mL MTBE重复以上步骤2次,收集合并上清液,高纯氮气吹至1 mL。用10 mL的甲醇、10 mL的MTBE冲洗Florisil SPE柱。加入样品,并用甲醇冲洗聚丙烯管,用10 mL的MTBE冲洗Florisil SPE柱,用10 mL的甲醇MTBE溶液(30:70,V:V)洗脱小柱,收集到的溶液氮吹至1 mL。最后经过ENVI-Carb净化,样液经过由1 mL甲醇冲洗3次的ENVI-Carb,用1 mL甲醇冲洗聚丙烯管3次,用甲醇冲洗小柱3次,速度始终控制在1滴每秒,收集样液用高纯氮气吹至1 mL,用0.2 μm的尼龙滤膜过滤,收集待上机[20]。
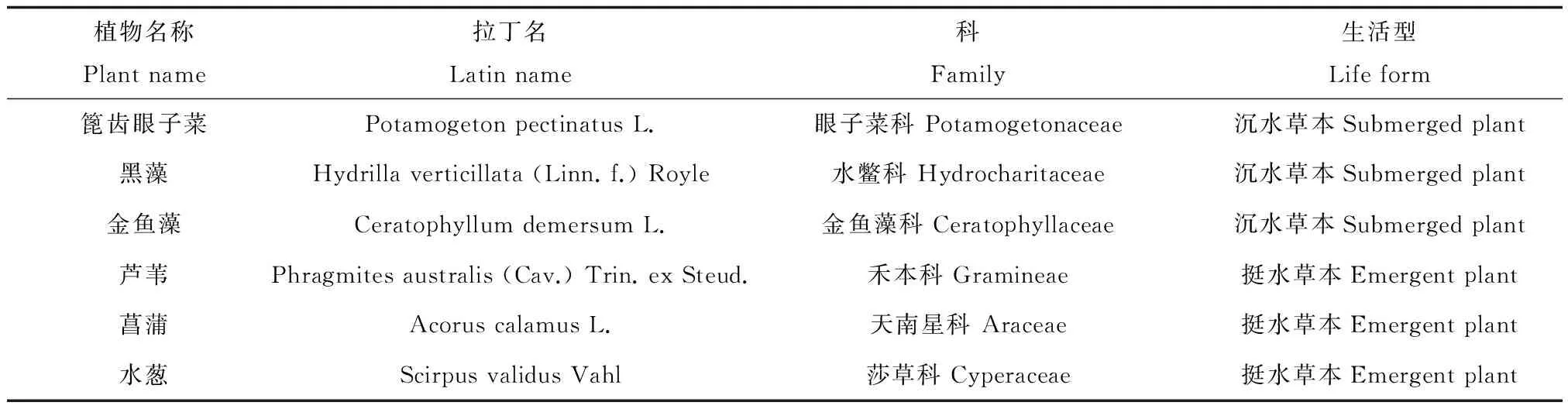
表1 清河河道主要植物样品种类Table 1 Aquatic plant samples collected from the Qing River
1.4 样品检测
液相系统所用色谱柱为Agilent ZORBAX Eclipse Plus C18, 2.1 mm×100 mm, 3.5 μm,前接3 μm在线过滤器,柱温40 ℃,进样量5 μL。流动相为2 mmol·L-1乙酸铵(A)和乙腈(B),流速0.3 mLmin-1,初始比例为80% A和20% B,保持0.5 min,经8 min变为10% A和90% B,保持2 min后,回到初始状态保持5 min。质谱条件为电喷雾电离负源(ESI-),雾化温度350 ℃,雾化器压力40 psi,辅助气( N2)流量9 Lmin-1,毛细管电压为3 500 V。
1.5 质量控制及保证
样品采集与处理过程中所用耗材均采用聚丙烯材质塑料瓶、塑料袋、离心管,分析过程严格控制避免含氟材料的使用。实验容器、仪器及装置在操作前均经超纯水及甲醇多次清洗,降低可能的任何污染。为保证数据可靠,同时设置了程序空白、场地空白及运输空白,空白处理的检测结果均低于检测限。
1.6 数据处理
植物的富集系数(bioaccumulation coefficient, BCF)是比较植物对于物质吸收能力大小的重要描述指标,体现着植物对周围环境中蓄积难降解物质的能力或程度[10,21],富集系数越大,其富集能力越强。转移系数(translocation factor, TF)指植物对物质从地下向地上的运输和富集能力。转移系数越大,则难降解物质从根系向地上器官转运能力越强[22]。
挺水植物富集系数=植物茎叶(或根)PFC浓度/底泥中该化合物浓度
沉水植物富集系数=植物整株PFC浓度/水中该化合物浓度
挺水植物转移系数=植物地上部PFC浓度/根部该化合物浓度[9]
沉水植物由于根部退化甚至消失,不考虑转移系数。
2 结果(Results)
2.1 北京清河水体PFCs的暴露水平
清河表层水及沉积物中12种PFCs同系物均有不同程度地检出(图1)。水样中PFCs含量在中部的7号点位出现最高值(64.45 ng·L-1)。PFOS、PFOA、PFBS及PFBA为主要组成物质,其中PFBS为水体中最主要成分(占PFCs比例最高达70%)。4种化合物含量各点位平均值比较,PFBS(16.55 ng·L-1)>PFBA(9.44 ng·L-1)>PFOA(4.58 ng·L-1)>PFOS(1.98 ng·L-1)。沉积物中的PFCs含量相对较低,最大浓度值(4.05 ng·L-1dw)出现在河流下游的13号点位。沉积物中PFCs组成与水体相比变化较大,短链PFBS、PFBA明显减少(<1.50 ng·L-1dw),但长链的PFOS、PFOA比例增加,特别是PFOA占PFCs总量的比例由水体中的12%增长至沉积物中的53%。
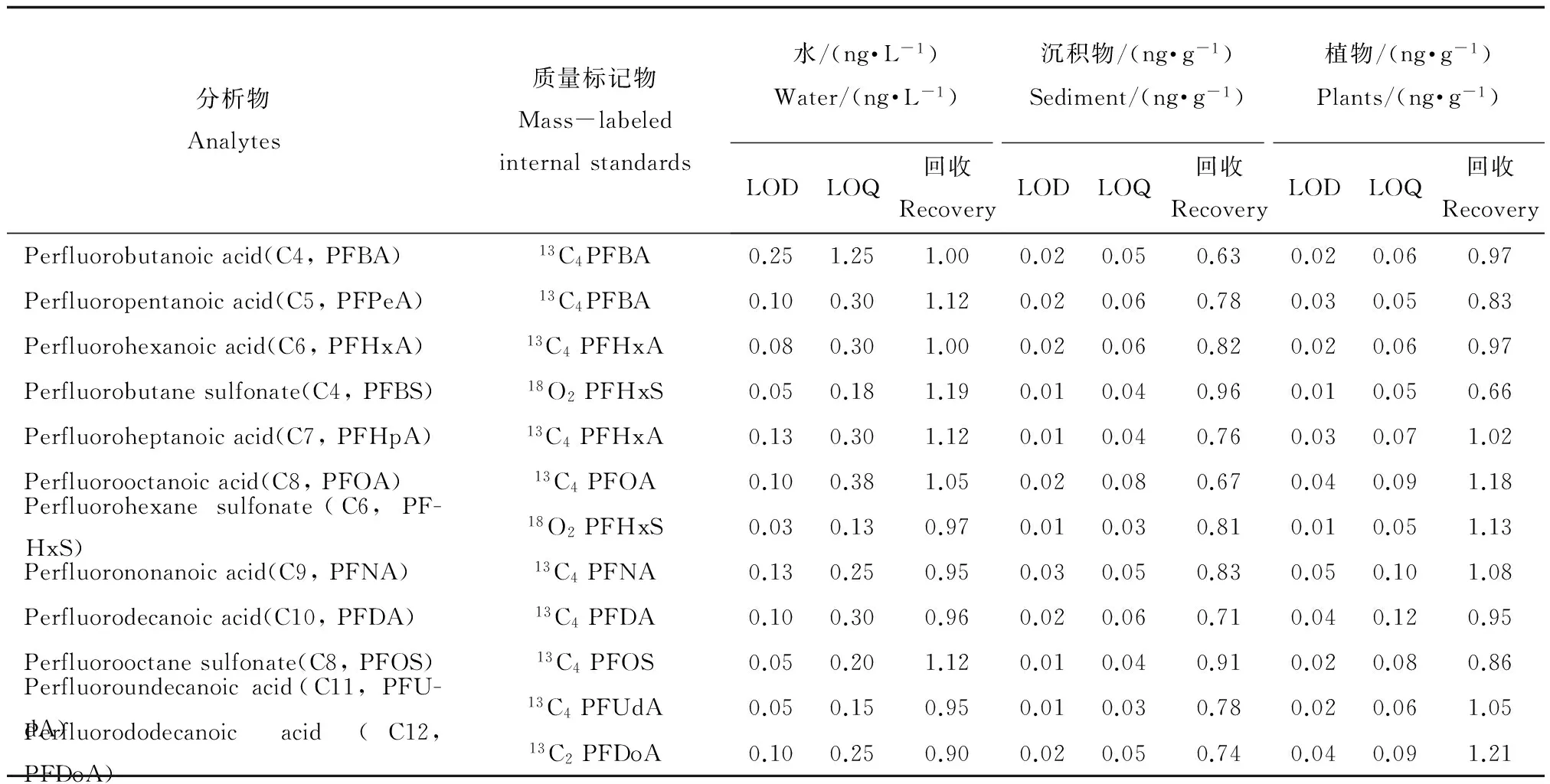
表2 12种全氟化合物(PFCs)检测质量控制表Table 2 Analytes of 12 kinds of PFCs measured in this study with QA/QC information
注:LOD表示检测极限,LOQ表示定量极限。
Note: LOD means limit of detection, LOQ means limit of quantification.
2.2 北京清河水生植物中PFCs的暴露水平
2.2.1 沉水植物
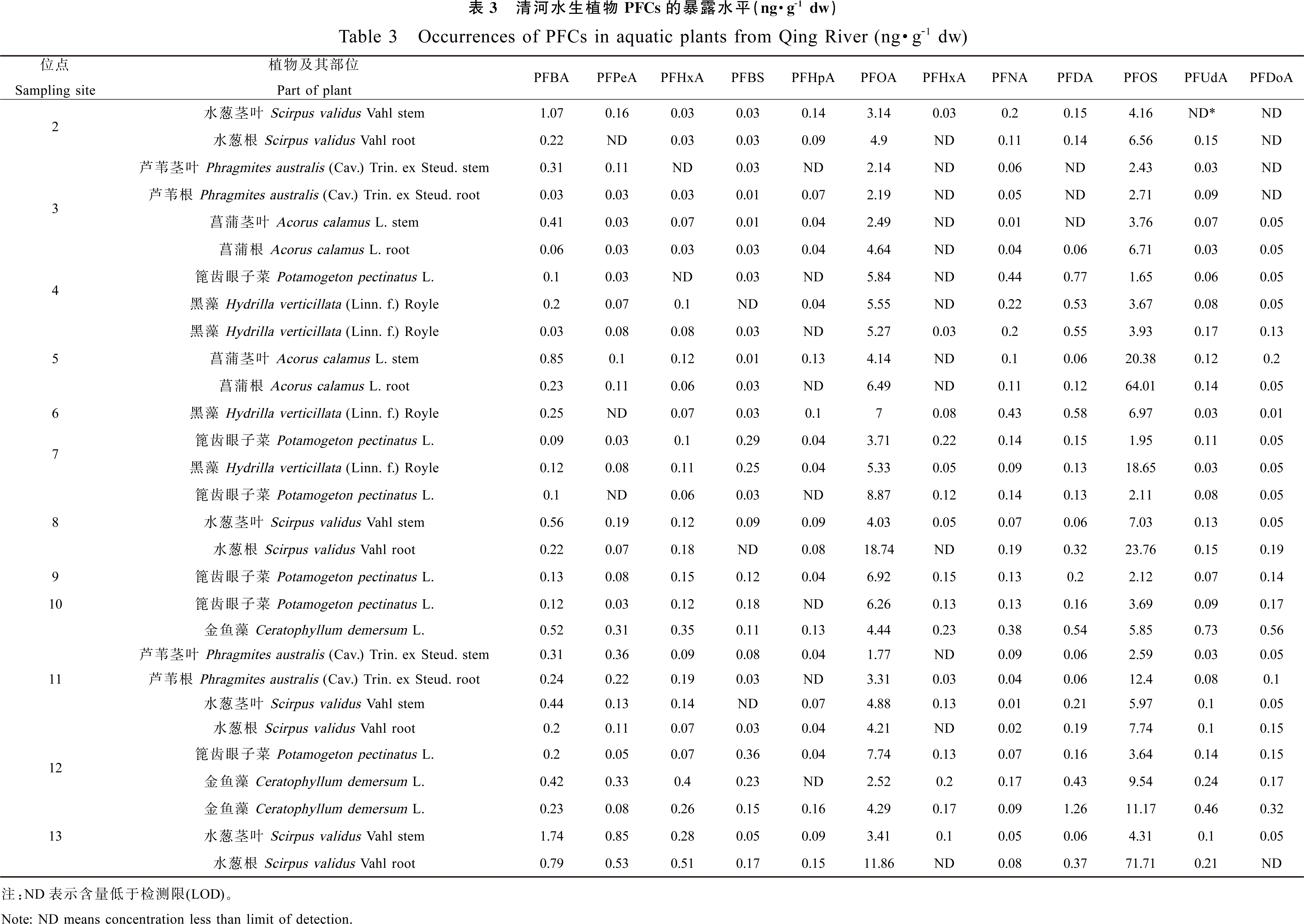
在清河的12个采样点位分别收集到3种沉水植物:篦齿眼子菜、黑藻和金鱼藻,广泛分布于清河上、下游以及温榆河水体,3种沉水植物均有PFCs检出。沉水植物全部生长在水下,虽然清河水体中PFBS含量较高,但在植物内吸收富集量却远低于PFOA与PFOS,PFBS、PFBA含量均低于0.55 ng·g-1dw。篦齿眼子菜中PFOA含量(3.71~8.87 ng·g-1dw,平均值 6.56 ng·g-1dw)明显高于PFOS(1.65~3.89 ng·g-1dw,平均值2.53 ng·g-1dw),黑藻中PFOA(5.33~7.00 ng·g-1dw,平均值5.79 ng·g-1dw)相对稳定,而PFOS含量(3.67~18.69 ng·g-1dw,平均值8.30 ng·g-1dw)则变化较大。其中在清河中段排污口附近的黑藻中PFOS含量达最大值(18.69 ng·g-1dw)。金鱼藻主要存在于河流下游的非硬化河道,检出的PFOS含量(5.85~11.17 ng·g-1dw,平均值8.86 ng·g-1dw)明显高于PFOA(2.52~4.44 ng·g-1dw,平均值3.75 ng·g-1dw)。
2.2.2 挺水植物
挺水植物样品包括芦苇、菖蒲、水葱,不同采样点位植物体内PFCs含量变化明显,植物不同组织的PFCs含量亦有不同,PFOS、PFOA、PFBS根部浓度高于茎叶,PFBA则相反,在茎叶中含量高于根部。PFBS及PFBA含量依然很低,植物吸收以PFOS和PFOA为主,其中PFOS变化较大(2.71~71.71 ng·g-1dw),挺水植物的根部PFCs总量(5.16~36.85 ng·g-1dw)高于茎叶部分(5.30~71.39 ng·g-1dw)。
2.3 水生植物中PFCs的富集与转移
水生植物对于PFBA、PFBS、PFOA及PFOS的富集转移均有不同,PFOS富集系数变化较大,但基本均高于1,表现出较强的生物富集性,4种物质富集系数表现为PFOS>PFOA>PFBA>PFBS。沉水植物中,篦齿眼子菜与黑藻PFOA的富集系数较稳定(多大于1),有富集效果,金鱼藻对PFBA、PFBS富集系数高于黑藻和篦齿眼子菜。整体来看,挺水植物对于PFCs富集能力较高,富集系数多高于20以上,同时转移系数均低于1,PFBA和PFBS含量虽然不高,但PFBA根和茎叶的转移系数大于1。
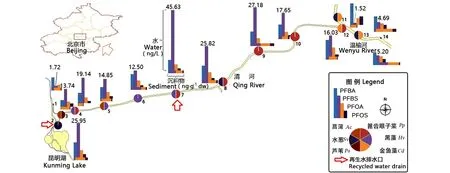
图1 清河水、沉积物中PFCs组成及植物样品类型Fig. 1 Concentrations of PFCs in water and sediment, and type of aquatic plant samples in Qing RiverNote: Ac, Acorus calamus L.; Pp, Potamogeton pectinatus L.; Sv, Scirpus validus Vahl; Hv, Hydrilla verticillata (Linn. f.) Royle; Pa, Phragmites australis (Cav.) Trin. ex Steud; Cd, Ceratophyllum demersum L..
3 讨论(Discussion)
3.1 北京清河水体中PFCs含量
本次实验样品采集处于北京清河的平水期(10-11月),杨永亮等[23]曾就沈阳地区地表水中PFCs季节变化作出研究,结果显示,枯水期与丰水期地表中PFOS及PFOA浓度未见明显不同,Zhao等[24]对天津降水的季节性变化研究表示,PFC的同系物没有明显季节性变化趋势。综合以上结论认为,自然环境变化对北京清河PFCs浓度影响较小。清河水体主要为城市污水处理后中水,整体上水体中PFBS、PFBA高于PFOA、PFOS,在采样点2、7号附近有两个主要的处理后污水排放口(图1),排放量分别为4 ×104m3·d-1和4 ×105m3·d-1(实际处理量为5×105m3·d-1)[25],且污水处理厂主要的处理技术为A2/O工艺。范庆等[26]关于城市污水中PFCs去除的相关研究证明,A2/O工艺处理后污水处理厂的出水中PFBS含量升高,可以认为在以中水为主的城市排污河道中,污水处理厂的排水贡献可能是短链PFCs (如PFBS和PFBA)的主要来源。
清河沉积物中PFBS在6~10,14号点含量较高(图1),这与清河水体中含量趋势基本一致。清河沉积物中PFCs浓度整体上低于国内天津沿海工业区[1,27],高于北京官厅水库沉积物平均值(1.60 ng·L-1dw)[28]。上游浓度较低,可能与沉积物的组成有关,清河上游水源为处理后中水,水质清澈,在5号点下游,万泉河水、小月河分别汇入,可能带入部分泥沙。另外未经处理的生活污水汇入,也影响着沉积物中PFCs的组成以及沉积。
3.2 北京清河水生植物中PFCs含量及富集特征
植物样品采集期处于北京秋季,沉水植物、挺水植物均已进入花果期,植株成熟,对PFCs的富集稳定。3种沉水植物均以PFOS、PFOA为主要富集物质,短链PFBS、PFBA含量极低,这与其较低的生物富集性相符。清河中上游为人工硬化河道,水生植物种群分布受人工干预较大。其中篦齿眼子菜体内PFCs含量基本稳定,黑藻6、7号点PFOS含量升高,可能与处理后污水排水口的位置有关。河道下游及温榆河水道附近为自然河道,属于北京郊区少有的湿地环境,水生植物以金鱼藻为主。PFOS含量占金鱼藻吸收的PFCs总量的55%左右,在富集系数上,金鱼藻对主要受限物质PFOS富集效果相对较高。结合金鱼藻作为自然河道广泛存在的水生优势物种这一特性,有必要开展室内模拟和实地调研的对比研究,分析其生物指示特征和生态修复功效。
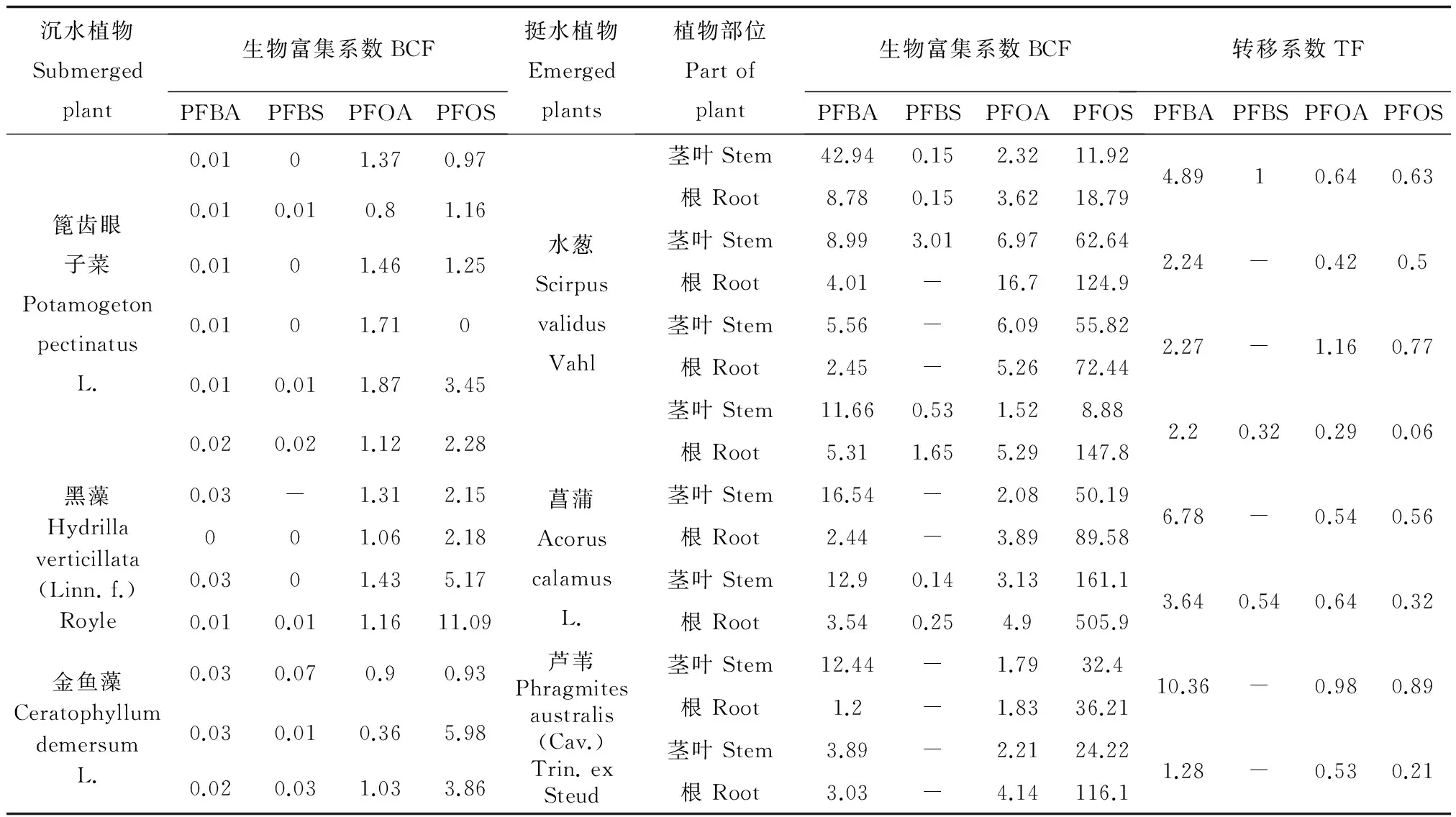
表4 清河植物样品PFCs的富集系数及转移系数Table 4 Factors of bioaccumulation and translocation of PFCs in aquatic plants from Qing River
注:“-” 表示基础数据低于检测限,不计算富集系数或转移系数。
Note: “-” means the raw data less than limit of detection, excluding for calculation of bioaccumulation and transportation factors.
3种挺水植物中PFBA茎部含量高于根部,转移系数大于1,PFOS、PFOA转移系数小于1,这与关月等[17]对于小麦的研究结论相一致。PFBA的饱和蒸汽压为1.33 Kpa (25 ℃),碳链较短,受蒸腾作用影响随营养物质运移,更易出现向上运输的累积效应。对3种挺水植物根部和沉积物中PFCs含量进行Spearman的rho单侧检验,在置信度(单侧)为0.01时,相关性均达显著水平,表明挺水植物能在一定程度上反应PFCs环境浓度的变化并产生生理响应。超富集植物是能超量吸收污染物质并将其运移到地上部的植物。通常超富集植物应达到两个标准:①植物地上部富集的物质应达到一定量;②植物地上部的物质含量应高于根部[29]。本研究可以看出,3种挺水植物虽然有较高的PFCs富集量,但尚未达到超富集效果。芦苇、菖蒲、水葱的污水治理效果已被多次验证[10,30〗[31],考虑到挺水植物PFOS及PFOA浓度较高且植株体型较大,对环境中PFCs有一定去除和改善水质的效果。但植株整体对PFOS的吸收表现为根部明显高茎部,且3种挺水植物均为多年生植物,根部不易清理,造成PFCs物质可以被固定但难以被清除的状况。
综合以上结果,可以发现:1)清河水体中PFBS含量高于其他PFCs同系物,其中7号点位含量最高,水体中PFCs应主要来源于沿河道处理后生活污水和非集中生活污水的排放;2)不同于水体,河道分布的沉水植物未能检测出较高浓度的PFBS,基本验证作为PFOS替代物的PFBS的低生物蓄积和生物安全特性;3)沉水植物均以蓄积PFOS及PFOA为主,金鱼藻较黑藻、篦齿眼子菜对PFOS的吸收富集效果更好,可作为水体中PFOS生物有效性以及生态风险评价研究的模式生物;4)3种挺水植物虽然对沉积物中PFOS和PFOA均有较好地吸收富集效果,但富集部位主要是挺水植物根系,且转移系数低于1。结合实际种植目的及采集情况,挺水植物在水环境调控过程中发挥景观和治污的同时,对PFCs类物质也有一定的生态修复功效。
[1] Wang T Y, Wang P, Meng J, et al. A review of sources, multimedia distribution and health risks of perfluoroalkyl acids (PFAAs) in China [J]. Chemosphere, 2015, 129(6): 87-99
[2] Muller C E, De Silva A O, Small J, et al. Biomagnification of perfluorinated compounds in a remote terrestrial food chain: Lichen-Caribou-wolf [J]. Environmental Science & Technology, 2011, 45(20): 8665-8673
[3] Zhu Z Y, Wang T Y, Wang P, et al. Perfluoroalkyl and polyfluoroalkyl substances in sediments from South Bohai coastal watersheds, China [J]. Marine Pollution Bulletin, 2014, 85(2): 619-627
[4] Chen C L, Lu Y L, Zhang X, et al. A review of spatial and temporal assessment of PFOS and PFOA contamination in China [J]. Chemistry and Ecology, 2009, 25(3): 163-177
[5] Yan H, Zhang C J, Zhou Q, et al. Short- and long-chain perfluorinated acids in sewage sludge from Shanghai, China [J]. Chemosphere, 2012, 88(11): 1300-1305
[6] Xie S W, Lu Y L, Wang T Y ,et al. Estimation of PFOS emission from domestic sources in the eastern coastal region of China [J]. Environment International, 2013, 59: 336-343
[7] 张晖, 史江红, 东口朋宽, 等. 倒置A2O污水处理厂PFOS和PFOA的浓度分布特征及其总量分析[J]. 环境科学学报, 2014, 34(4): 872-880
Zhang H, Shi J H, Higashiguchi T, et al. Quantitative determination and mass flow analysis of perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) during reversed A2O wastewater treatment process [J]. Acta Scientiae Circumstantiae, 2014, 34(4): 872-880 (in Chinese)
[8] 朱琳, 张远, 渠晓东, 等. 北京清河水体及水生生物体内抗生素污染特征[J]. 环境科学研究, 2014, 27(2): 139-146
Zhu L, Zhang Y, Qu X D, et al. Occurrence of antibiotics in aquatic plants and organisms from Qing River, Beijing [J]. Research of Environmental Sciences, 2014, 27(2): 139-146 (in Chinese)
[9] 李冬林, 王磊, 丁晶晶, 等. 水生植物的生态功能和资源应用[J]. 湿地科学, 2011, 93: 290-296
Li D L, Wang L, Ding J, et al. Ecological functions and resource utilization of aquatic plantsecological plants [J]. Wetland Science, 2011, 9(3): 290-296 (in Chinese)
[10] 潘义宏, 王宏镔, 谷兆萍, 等. 大型水生植物对重金属的富集与转移[J]. 生态学报, 2010, 30(23): 6430-6441
Pan Y, Wang H, Gu Z P, et al. Accumulation and translocation of heavy metals by macrophytes [J]. Acta Ecologica Sinica, 2010, 30(23): 6430-6441 (in Chinese)
[11] 赵良元. 水生植物水葱对沉积物中十溴联苯醚的修复机制研究[D]. 武汉: 华中师范大学, 2012: 81-114
Zhao L Y. Mechanisms of the phytoremediation of decabromodiphenyl ether in sediment by aquatic macrophyte Scirpus validus Vahl [D]. Wuhan: Central China Normal University, 2012: 81-114 (in Chinese)
[12] 兰策介, 王备新, 陈开宁, 等. 金鱼藻、环棱螺及其组合处理对水生附着生物含量和氮、磷浓度的影响[J]. 生态学杂志, 2009, 28(10): 2042-2047
Lan C J, Wang B X, Chen K N, et al. Effects of Ceratophyllum demersum, Bellamya purificata, and their combination on water body’s periphyton content and N and P concentrations [J]. Chinese Journal of Ecology, 2009, 28(10): 2042-2047 (in Chinese)
[13] 刘丽霞, 冯国锋. 水生植物景观的营造[J]. 北方园艺, 2008(7): 188-190
Liu L X, Feng G F. Aquatic plant landscape construction [J]. Northern Horticulture, 2008(7): 188-190 (in Chinese)
[14] 张鸿, 陈清武, 姚丹. 用典型植物监测环境中有机氟污染物的可行性[J]. 深圳大学学报: 理工版, 2013, 30(27): 36-41
Zhang H, Chen Q W, Yao D, et al. Feasibility to monitor environmental organofluorine pollutants using typical plants [J]. Journal of Shenzhen University: Science and Engineering, 2013, 30(27): 36-41 (in Chinese)
[15] Garcia-Valcarcel A I, Molero E, Escorial M C, et al. Uptake of perfluorinated compounds by plants grown in nutrient solution [J]. Science of the Total Environment, 2014, 472: 20-26
[16] Wen B, Li L, Zhang H, et al. Field study on the uptake and translocation of perfluoroalkyl acids (PFAAs) by wheat (Triticum aestivum L.) grown in biosolids-amended soils [J]. Environmental Pollution, 2013, 184C: 547-554
[17] 关月. 小麦对全氟化合物的吸收研究[D]. 大连: 大连理工大学, 2012: 16-29
Guang Y. Uptake of perfluorinated compounds (PFCs) by wheat (Triticum aestivum L.) [D]. Dalian: Dalian University of Technology, 2012: 16-29 (in Chinese)
[18] Wang P, Lu Y L, Wang T Y, et al. Occurrence and transport of 17 perfluoroalkyl acids in 12 coastal rivers in south Bohai coastal region of China with concentrated fluoropolymer facilities [J]. Environmental Pollution, 2014, 190: 115-122
[19] Loi E I, Yeung L W, Mabury S A, et al. Detections of commercial fluorosurfactants in Hong Kong marine environment and human blood: A pilot study [J]. Environmental Science & Technology, 2013, 47(9): 4677-4685
[20] Felizeter S, McLachlan M S, de Voogt P, et al. Uptake of perfluorinated alkyl acids by hydroponically grown lettuce (Lactuca sativa) [J]. Environmental Science & Technology, 2012, 46(21): 11735-11743
[21] 弓晓峰, 黄志中, 张静, 等. 鄱阳湖湿地重金属形态分布及植物富集研究[J]. 环境科学研究, 2006, 19(3): 34-40
Gong X F, Huang Z Z, Zhang J, et al. Study on the speciation distributing and the plants enrichment of heavy metals in the wetland of Poyang Lake [J]. Research of Environmental Sciences, 2006, 19(3): 34-40 (in Chinese)
[22] 魏敏, 刘新, 陈朝琼, 等. 攀钢冶炼渣堆土壤与优势植物的重金属含量[J]. 生态学报, 2008, 28(6): 2931-2936
Wei M,Liu X,Chen C Q, et al. The concentration of heavy metals in soil and dominant plants growing on spoiled heap from steel refinery [J]. Acta Ecologica Sinica, 2008, 28(6): 2931-2936 (in Chinese)
[23] 杨永亮, 路国慧, 杨伟贤, 等. 沈阳地区水环境和生物样品中全氟化合物的污染分布特征[J]. 环境科学学报, 2010, 30(10): 2097-2107
Yang Y L, Lu G H, Yeung L W Y, et al. Levels and distribution of perfluorinated compounds in water and biological samples from the Shenyang Area, China [J]. Acta Scientiae Circumstantiae, 2010, 30(10): 2097-2107 (in Chinese)
[24] Zhao L, Zhou M, Zhang T, et al. Polyfluorinated and perfluorinated chemicals in precipitation and runoff from cities across eastern and central China.[J]. Archives of Environmental Contamination and Toxicology, 2013, 64(2): 198-207
[25] 杨勇, 魏源送, 郑祥, 等. 北京温榆河流域微生物污染调查研究[J]. 环境科学学报, 2012, 32(1): 9-18
Yang Y, Wei Y S, Zhen X, et al. Investigation of microbial contamination in Wenyu River of Beijing [J]. Journal of Environmental Sciences, 2012, 32(1): 9-18 (in Chinese)
[26] 范庆, 邓述波, 周琴, 等. 城市污水处理厂中全氟化合物的存在及去除效果研究[J]. 环境污染与防治, 2011(1): 30-35
[27] Wang T Y, Khim J S, Chen C, et al. Perfluorinated compounds in surface waters from Northern China: Comparison to level of industrialization [J]. Environmental International, 2012, 42: 37-46
[28] Wang T Y, Chen C, Naile J E, et al. Perfluorinated compounds in water, sediment and soil from Guanting Reservoir, China [J]. Bulletin of Environmental Contamination and Toxicology, 2011, 87(1): 74-79
[29] 韦朝阳, 陈同斌. 重金属超富集植物及植物修复技术研究进展[J]. 生态学报, 2001, 21(7): 1196-1203
Wei C Y, Chen T B. Hyperaccumulators and phytoremediation of heavy metal contaminated soil: A review of studies in China and abroad [J]. Acta Ecologica Sinica, 2001, 21(7): 1196-1203 (in Chinese)
[30] 杨倩. 三种湿地植物对污染水体中重金属离子的积累能力研究[D]. 兰州: 兰州交通大学, 2009: 34-37.
Yang Q. Accumulation of heavy metals by three wetland plant species in pollution water [D]. Lanzhou: Lanzhou Jiaotong University, 2009: 34-37. (in Chinese)
[31] Mudumbi J B N, Ntwampe S K O, Muganza M, et al. Susceptibility of riparian wetland plants to perfluorooctanoic acid (PFOA) accumulation [J]. International Journal of Phytoremediation, 2014, 16(9): 926-936
◆
Ecological Effects on Aquatic Plants Induced by Perfluorinated Compounds I—Occurrences and Bioaccumulation of Perfluorinated Compounds in Typical Urban River
Jiang Zhaoze1,2, Wang Tieyu2,*, Zhang Xiaojun1,#, Kong Xiaoxiao1,2, Li Qifeng2,3, Meng Jing2,3, Zhu Zhaoyun2,3
1. College of Life Sciences and Technology, Mudanjiang Normal University, Mudanjiang 157012, China 2. State Key Lab of Urban and Regional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China 3. Graduate University of Chinese Academy of Sciences, Beijing 100049, China
16 January 2015 accepted 28 January 2015
Perfluorinated compounds (PFCs)
extensive attentions and were reported to be widespread in environment in recent years. The existing studies mainly focused on environmental exposure, source identification, and ecological effects related to animal, however, few studies were designed to pay more attention to bioaccumulation of aquatic plants growth in urban river which polluted by domestic discharge. The present study selected the Qing River, which is a typical urban river flowing from west to east of north part of Beijing city. All 12 target PFCs compounds were detected in water with the highest concentration up to 65.45 ng·L-1, and PFBS was the dominant compound(up to 45.63 ng·L-1). As for 6 species of aquatic plants, PFOS and PFOA were predominantly in Potamogeton pectinatus L., Hydrilla verticillata (Linn. f.) Royle, Ceratophyllum demersum L., Phragmites australis (Cav.) Trin. ex Steud., Scirpus validus Vahl and Acorus calamus L. Among three kinds of submerged plants, Ceratophyllum demersum L. had more bioaccumulation of PFOS. Among emergent aquatic plants, generally PFCs levels in root tissues were higher than those in stems and leaves; therein PFOA and PFOS concentrations in roots were higher than those of stems and leaves as well, while PFBA with exact contrary. In general, three kinds of emergent aquatic plants couldn’t be served as hyper-accumulation plant, but the root tissue has significant absorption effect of PFOS. Ceratophyllum demersum L. has significant effect of bioaccumulation of PFOS, and it is also the dominant species widely spread in natural river in north China, thus it could been concerned as a biological indicator and explain its ecological remediation function in the further studies.
perfluorinated compounds; aquatic flora; bioaccumulation; ecological effects; urban river
国家自然科学基金项目(41171394);科技基础性工作专项(2013FY11110);中国科学院重点部署项目(KZZD-EW-TZ-12)
蒋曌泽(1989-),女,硕士,研究方向为环境植物学,E-mail: jzeze@163.com;
*通讯作者(Corresponding author), E-mail: wangty@rcees.ac.cn
10.7524/AJE.1673-5897.20150116003
2015-01-16 录用日期:2015-01-28
1673-5897(2015)2-435-10
X171.5
A
王铁宇(1973-),男,博士,研究员,主要研究方向为区域污染生态过程与风险管理。近几年重点关注新型污染物的环境行为、生态效应及其风险管理,已在国内外核心刊物发表论文100余篇(其中SCI收录70余篇)。
# 共同通讯作者(Co-corresponding author), E-mail: swxzxj@126.com
蒋曌泽, 王铁宇, 张晓军, 等. 全氟化合物对水生植物的生态效应研究Ⅰ-典型城市河道全氟化合物的暴露水平及植物富集特征[J]. 生态毒理学报, 2015, 10(2): 435-444
Jiang Z Z, Wang T Y, Zhang X J, et al. Ecological effects on aquatic plants induced by perfluorinated compounds I-Occurrences and bioaccumulation of perfluorinated compounds in typical urban river [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 435-444 (in Chinese)
——以武汉紫阳湖为例

