乐果对秀丽隐杆线虫生活史特征的影响
王春花,李朝品,何梅
1. 安徽理工大学地球与环境学院,淮南 232001 2. 淮南师范学院生命科学系,淮南 232001
乐果对秀丽隐杆线虫生活史特征的影响
王春花1,2,李朝品1,*,何梅2
1. 安徽理工大学地球与环境学院,淮南 232001 2. 淮南师范学院生命科学系,淮南 232001
采用一种半流体培养基“挂滴法”对线虫进行培养和生命表实验,研究了低剂量暴露下乐果对秀丽隐杆线虫生活史特征的影响。在半致死浓度1/10 LC50、1/100 LC50、1/1000 LC50暴露剂量下(分别为7、0.7、0.07 mmol·L-1)染毒4 h。结果表明,0.7和7 mmol·L-1暴露组线虫的总繁殖率(TFR)分别为260.60、203.80,明显低于对照组(299.23,P<0.05);净增殖率(R0)分别为240.29、147.67,明显低于对照组(298.67,P<0.05);内禀增长率(rm)分别为1.342 d-1、1.233 d-1,明显低于对照组(1.387 d-1,P<0.05);而0.07 mmol·L-1暴露组线虫的总繁殖率为293.84,净增殖率为286.60,与对照组比差异都没有统计学意义(P>0.05)。在上述浓度范围,线虫的总繁殖率(TFR)、净增殖率(R0)和内禀增长率(rm)都随乐果浓度的升高而降低,并存在剂量效应关系。研究同时发现0.07 mmol·L-1暴露组线虫的内禀增长率为1.405 d-1,明显高于对照组(P<0.05)。研究结论认为一定剂量的乐果使线虫的繁殖力降低;而低剂量暴露则对内禀增长率具有毒物兴奋效应。本文选择的3个指标TFR、R0、rm对低剂量下乐果暴露的响应敏感。
乐果;秀丽隐杆线虫;内禀增长率;总繁殖率;净增殖率
线虫是土壤生态系统中最丰富的动物,在水和沉积物环境也有大量发现,它们对生态系统的养分循环和在维护环境质量方面有许多重要作用,这些特性支持它们应用于生态毒理的监测和评估,从20世纪70年代后期,各种线虫物种被开发并用来研究环境问题,在20世纪90年代末,秀丽隐杆线虫(Caenorhabditis elegans)开始成为科学家们青睐的模式生物,现在秀丽隐杆线虫是世界各地许多实验室都在使用的模式生物,已经成功地应用于土壤与水环境中毒物毒性检测与环境评估[1-3]。
乐果一种应用非常广泛的有机磷杀虫剂。Mauricio等[4]研究发现乐果能使小鼠的眨眼运动消失,小鼠的运动机能破坏,并影响小鼠的学习和记忆。Abdallah等[5]研究了乐果对雄性小鼠生殖系统的影响,结果表明乐果能引起雄鼠体重下降,睾丸和附睾及脏器系数极显著增加,影响激素代谢,说明乐果还是一种环境激素类药物,会干扰动物的生长发育、繁殖或激素的合成代谢。陈建秋等[6]研究了乐果对轮虫生殖毒性,结果表明乐果对轮虫有一定的生殖干扰作用,影响个体发育与性成熟时间、产卵量和后代量。Wilczeka等[7]研究表明乐果能使狼蛛肠腺体细胞凋亡或坏死程度增加。Cole等[8]检测了乐果等10种有机磷农药对秀丽隐杆线虫染毒4 h的半致死浓度(LC50)和对乙酰胆碱酯酶(AChE)活性的影响,发现线虫的LC50与小鼠的半数致死量(LD50)具有明显的相关性,提出有机磷农药对秀丽隐杆线虫的影响可以用于指示它们对哺乳动物的神经毒性。
目前乐果对线虫的毒性安全评价研究较少,对生活史特征的影响更是鲜有报道。本文将以模式生物秀丽隐杆线虫为受试生物,检测乐果的急性毒性,并在亚致死浓度下染毒线虫,采用半流体培养基“挂滴法”进行生命表实验,监测乐果对秀丽隐杆线虫生活史特征的影响,以评价乐果对非靶生物的生态毒性,为利用秀丽隐杆线虫监测环境污染提供参考。
1 材料与方法(Materials and methods)
1.1 材料
野生型秀丽隐杆线虫N2由国际线虫遗传中心(Caenorhabditis Genetics Center,CGC)提供,乐果(C5H12NO3PS2,CAS: 60-51-5) Sigma公司产品,其他试剂均为生工生物工程股份有限公司产品。
1.2 线虫的同步化处理
用M9(3.0 g·L-1KH2PO4,15.12 g·L-1Na2HPO4·12H2O)将发育至成虫的线虫从涂有大肠杆菌(E. coli OP50)NGM培养基(2.5 g·L-1Peptone,2.0 g·L-1Yeast extract,17 g·L-1Agar,3 g·L-1NaCl,5 mg·L-1胆固醇,25 mmol·L-1PBS,1 mmol·L-1MgSO4,1 mmol·L-1CaCl2)上洗下,加入到5 mL离心管中,使总体积达到2.8 mL,然后按顺序加入0.8 mL次氯酸钠溶液,0.4 mL 5 mol·L-1NaOH溶液,混匀,直至约2/3的虫体裂解,以5 500 r·min-1离心,弃上清液,再以M9洗涤2遍,即可获得发育中的受精卵,将制备的卵置于4 mL M9中过夜孵化,由于没有添加食物,线虫全部停留在L1期,将L1幼虫接种于NGM上,即获得同步化生长的个体。
1.3 急性毒性试验
乐果分别溶解于含E. coli OP50的Km (53 mmol·L-1NaCl,32 mmol·L-1KCl)溶液中,使乐果最终浓度分别为:40、60、80、100 mmol·L-1,另外Km溶液作为对照组。线虫放在24孔板中培养,每孔分别放置10条同步化的L4期线虫,每组设3个平行孔,所有处理温度均为20 ℃,处理后4 h,在解剖镜下观察,用铂金丝针轻触虫体,没有任何反应的即视为死亡个体,记录死亡个体数目,实验重复3次。根据概率单位法计算半致死浓度(LC50)。
1.4 生命表实验
依据半致死浓度设定乐果的暴露剂量为1/10 LC50、1/100 LC50、1/1000 LC50(分别对应于7、0.7、0.07 mmol·L-1),另设1组对照。不同浓度乐果染毒L4期线虫4 h,Km洗3次,线虫采用半流体培养基“挂滴法”进行培养,每个浓度3个12孔板(n0=36)。每12小时将亲本线虫转到新的培养基上,每12小时观察1次,每次观察线虫存活个体数,每条亲本线虫孵化出的幼体数,实验至亲本线虫个体全部死亡后结束。所有的实验操作都是在室温下进行,室温为(20±1) ℃,实验重复3次。“挂滴法”由Daniel Muschiol在2009年首次提出应用在秀丽隐杆线虫的生命表实验中,此法采用一种半流体培养基[9],在2011年,Brinke等[10]对其进行了改进,2种方法的培养基基本一致,只是Brinke等将这个配方分解分别配成3种溶液保存在冰箱内,现用现配,使用起来更加经济方便。利用半流体培养基“挂滴法”进行培养的具体操作如下[10](略作修改):第1步,半流体培养基的配制(用1.5 g·L-1结冷胶(Gellan gum)取代NGM中的琼脂(Agar),其他与NGM相同,灭菌后用磁力搅拌器边冷却边搅拌,无菌操作),E. coli OP50每2天准备1次,在线虫换新鲜食物培养基时用重新悬浮。第2步,线虫是放在培养板盖子上培养的,新鲜食物悬液8 μL于12孔板盖上,每滴1条线虫,在12孔板每孔中放置1 cm左右吸足无菌水的疏松脱脂棉(使食物挂滴保持湿润),改好盖子,用封口膜密封好放在20 ℃培养箱中培养。第3步,每12 h将亲本线虫转到新的培养液滴中,之前的培养板放在培养箱中继续培养过夜,待所有受精卵孵化后,将新孵化出的L1期幼虫放在80 ℃热蒸汽上热处理1 min,然后用玫瑰红染色液染色,盖上盖玻片,在体式显微镜下计数之前12小时亲本所产的后代数量。
应用Microsoft Excel 2010根据公式对各生命表实验所得数据对参数进行计算,计算公式如下:
x(age):年龄,年龄时期(h)的分段;
lx(age-specific survival rate):特定年龄存活率,lx= nx/n0;
mx(age-specific fecundity):每一期每一存活个体生产的后代数,通过每天的实验统计所得;
R0(net reproductive rate):净增殖率,表示种群在整个生命表中增长或下降的程度,R0=∑lxmx;
TFR(total fertility rate):总繁殖率,TFR=∑mx;
T0/T1/T(alternative measures of generation time):由于在年龄结构种群中世代时间的定义被认为武断和不稳定,因此几种不同的措施被Charlesworth等提出[11],采用如下3个公式对世代时间进行对比。
T0=∑xlxmx/∑lxmx, T1=(lnR0)/rm, T=∑xe-rmxlxmx
rm(intrinsic rate of natural increase):内禀增长率,根据Lotka方程,用代入法求得,方程如下:
1.5 数据处理分析
应用SPSS 17. 0软件中的概率分析(Probit analysis)计算线虫的半致死浓度LC50和95%可信限。采用单因素方差分析( one-way ANOVA)和Duncan检验法分析不同浓度乐果暴露对线虫种群参数的影响,所有数据均表示为平均值±标准误,以P<0.05为差异有统计学意义。
2 结果(Results)
2.1 急性毒性实验
急性毒性实验结果显示,乐果对秀丽隐杆线虫的4 h半致死浓度LC50为(68.75±0.02) mmol·L-1(95%置信限度为60.17~78.48 mmol·L-1)
2.2 生命表参数
在不同浓度环境激素类农药乐果中暴露4 h后,线虫的生命表主要参数值如表1所示。对照组线虫的总繁殖率(TFR)为299.23,而乐果暴露组线虫的总繁殖率随乐果浓度的增加而下降,呈现剂量效应关系,0.07 mmol·L-1暴露组(293.84)与对照组显著不差异(P>0.05),0.7 mmol·L-1暴露组(260.60)和7 mmol·L-1暴露组(203.80)与对照组差异显著(P<0.05)。对照组的净增殖率(R0)为298.67,而乐果暴露组的净增殖率下降,随浓度的增加依次为286.60、240.29和147,也呈现出明显的剂量效应关系。世代时间各参数(T0/T1/T)的变化较复杂,没有明显的剂量效应关系。对照组线虫的内禀增长率(rm)为1.387 d-1,乐果最低浓度暴露组(0.07 mmol·L-1)为1.405 d-1,明显高于对照组;中浓度暴露组(0.7 mmol·L-1)为1.342 d-1,明显低于对照组;而高浓度暴露组(7 mmol·L-1)为1.233 d-1,明显低于中浓度处理组;乐果暴露组线虫的内禀增长率同样表现出明显的剂量效应关系。

表1 在不同浓度乐果中暴露后线虫生命表主要参数值Table 1 Demographic parameters of C. elegans after exposure to different concentrations of dimethoate
注: *表示与对照差异显著(P<0.05);TFR为总繁殖率,R0为净增殖率,T0、T1、T为世代时间的替代措施,rm为内禀增长率。
Note: *represented there was a significant difference in comparing with control group. TFR is the total fertility rate, R0is the net reproductive rate, T0/T1/T is the alternative measures of generation time, rmis the intrinsic rate of natural increase.

图1 不同浓度乐果暴露后线虫的繁殖Fig. 1 Fecundity of C. elegans after exposure to different concetrations of dimethoate
2.3 乐果对线虫繁殖率的影响
在不同浓度乐果中暴露后线虫繁殖率的变化如图1所示。从图中可以看出,线虫的总繁殖率(TFR)的最高值:对照组为309,0.07 mmol·L-1暴露组为296,0.7 mmol·L-1暴露组为272,7 mmol·L-1暴露组为212,总繁殖率的最高值暴露组明显低于对照组。线虫每天繁殖率的峰值:对照组为113,0.07 mmol·L-1暴露组为109,0.7 mmol·L-1暴露组为104,7 mmol·L-1暴露组为88,对照组的每天繁殖率的峰值明显高于乐果暴露组。在实验过程中发现乐果暴露组线虫的排卵时间比对照组延迟2~4 h,而且整个排卵期缩短;还发现在乐果暴露组的线虫出现了较多的卵在线虫体内孵化的现象(如图2所示),而对照组很少发现。

图2 线虫卵在母体内孵化(10x20)Fig. 2 Juveniles of C. elegans hatched inside the body of their mother (10x20)
2.4 乐果对线虫存活曲线的影响
线虫的存活曲线(包括对照组和乐果暴露组)如图3所示。急性中毒后,秀丽隐杆线虫的每天存活率均明显降低,对照组线虫寿命最长的个体为33.5 d,0.07 mmol·L-1暴露组线虫存活时间最长的个体为25 d,0.7 mmol·L-1暴露组线虫存活时间最长的个体为19 d,而7 mmol·L-1暴露组线虫寿命最长的个体为13.5 d。
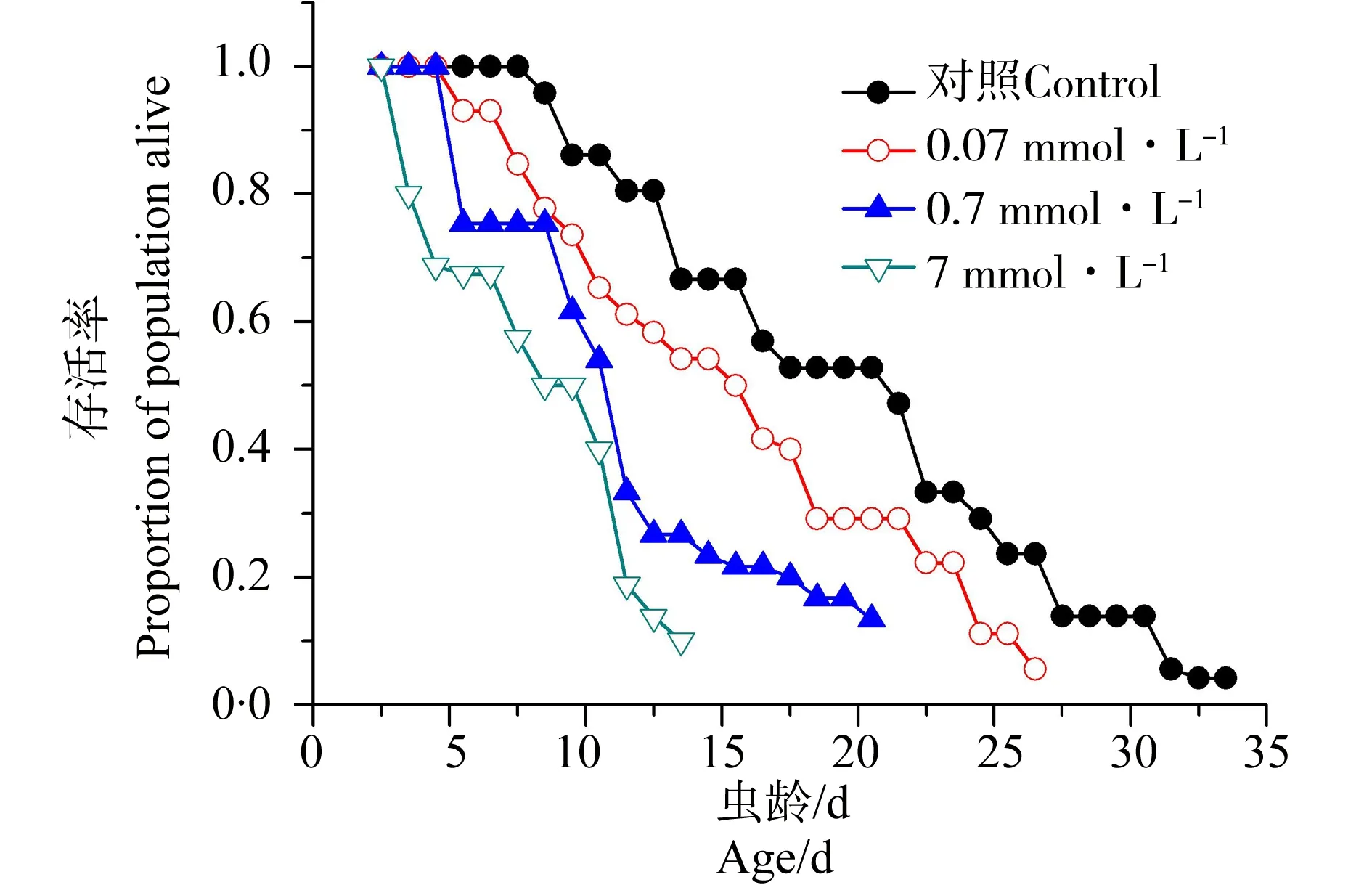
图3 不同浓度乐果暴露后线虫存活曲线Fig. 3 Survivorship curves of C. elegans after exposure to different concetrations of dimethoate
3 讨论(Discussion)
目前国内外有许多学者对秀丽隐杆线虫进行了毒理学研究,但是研究指标主要在个体水平(死亡率,繁殖)、生理生化水平(体长、酶活、运动、摄食等)和基因水平(各种与胁迫有关基因的表达等)。种群水平毒理学研究却鲜有报道,2009年Daniel Muschiol等[9]采用半流体培养基“hanging-drop”/“挂滴法”进行了生命周期(life cycle)实验,对比了2种秀丽隐杆线虫(N2,MY6)的净增殖率(R0)、总繁殖率(TFR)、世代时间各参数(T0/T1/T)和内禀增长率(rm)。这种半流体食物培养基结合了液体和固体培养基的优点,完全适合生命表实验,因为其粘度允许线虫自由行动,同时又阻止细菌细胞积累在挂滴底部。这种方法允许单个个体在悬滴中进行培养,可以允许在任何所需的时间准确度上调查各种生活史特征,而且这种方法每次使用的培养基的量很少,在保证了精准度的同时节约了实验资源,是一种经济、简单、快速而精确的方法。本研究中,在20 ℃下培养秀丽隐杆线虫,56 h左右长到L4期,在第4次蜕皮后,大约65 h开始产卵,大约130 h(整个生活史的第5.5天左右)产卵高峰期结束,本研究对照组线虫的生活史与1976年Byerly等[12]研究的秀丽线虫生活史基本类似。1991年Hodgkin等[13]研究得出线虫的总繁殖率TFR为327,2009年Muschiol等[9]研究得出的为295,本研究中对照组为299,介于两者之间。本研究进一步肯定了该方法的可重复性和便利性。2011年Brinke等[10]利用这种半流体培养基检测了伊佛霉素(ivermectin)、涕灭威(aldicarb)和镉(cadmium)对Caenorhabditis elegans和Panagrolaimus cf. thienemanni两种线虫生长和繁殖的影响,同时与传统液体染毒方法对比,证实半流体培养基非常适合亚致死浓度下线虫的毒性检测,并提出这种半流体培养基也适用于难溶或者不溶于水的物质(如纳米材料)的毒性检测。
生命表实验是对污染物评估很有价值的实验,根据线虫的lx和mx2个指标可以估算出线虫种群的内禀增长率(rm)是与生态有关的指标,可以反映出污染物对种群的影响。陈建秋等[6]提出萼花臂尾轮虫与生命周期有关的各参数(如繁殖率、净增殖率、世代时间等)可以用于检测和评估污染物的毒性。2013年Brinke等[14]检测了伊佛霉素(ivermectin)对秀丽隐杆线虫生命周期特征的影响,证实线虫的总繁殖率(TFR),净增殖率(R0)和种群内禀增长率(rm)可以用于污染物的毒性安全评价。在本研究中,乐果暴露组线虫的内禀增长率(rm)、总繁殖率(TFR)和净增殖率(R0),随着乐果浓度的增加,数值减小,且差异显著,呈现剂量效应关系,表明这3个指标对低剂量下乐果暴露的响应敏感,可以利用秀丽隐杆线虫对乐果的毒性进行检测和评估。世代时间各参数(T0/T1/T)与前3个指标不同,没有出现随乐果浓度增加而规律性的变化,说明它不适用于乐果的毒性检测和评估,Brinke等[10]研究同样表明秀丽隐杆线虫的参数T0/T1/T对伊佛霉素不敏感。陈晓雪等[15]在研究镍对不同生命阶段秀丽隐杆线虫体长和运动的影响中,发现L3期线虫的体长在低浓度受到刺激,在高浓度受到抑制,表现为毒物兴奋效应。本研究发现,低浓度组内禀增长率(rm)为1.405 d-1,显著大于对照组(1.387 d-1),中浓度组和高浓度组(1.342 d-1,1.233 d-1)明显低于对照组,表明乐果低剂量暴露对秀丽隐杆线虫内禀增长率具有毒物兴奋效应。同时本研究还表明较高剂量乐果即使短时暴露都会使线虫种群的内禀增长率受到抑制,因此虽然乐果是易降解农药,但是农药喷洒后,迁移到土壤中的乐果对土壤系统中非靶生物的影响也是不能忽视。
[1] Leung M C K, Williams P L, Benedetto A, et al. Caenorhabditis elegans: An emerging model in biomedical and environmental toxicology [J]. Toxicological Sciences, 2008, 106(1): 5-28
[2] 王云彪, 李润琴, 邓茗芩, 等. 砷与农药草甘膦、敌敌畏对秀丽隐杆线虫的联合毒性[J]. 生态毒理学报, 2013, 8(2): 262-267
Wang Y B, Li R Q, Deng M Q, et al. Joint toxicity of arsenic, glyphosate and dichlorvos to C. elegans [J]. Asian Journal of Ecotoxicology, 2013, 8(2): 262-267 (in Chinese)
[3] 张燕芬, 王大勇. 利用模式动物秀丽线虫建立环境毒物毒性的评估研究体系[J]. 生态毒理学报, 2008, 3(4): 313-322
Zhang Y F, Wang D Y. Establishment of toxicity evaluation system using model organism of Caenorhabditis elegans [J]. Asian Journal of Ecotoxicology, 2008, 3(4): 313-322 (in Chinese)
[4] Mauricio V H, Irene C, Corín D, et al. Dimethoate accelerates the extinction of eyeblink conditioning in mice [J]. NeuroToxicology, 2012, 33(1): 105-110
[5] Abdallah F B, Slima A B, Dammak I, et al. Comparative effects of dimethoate and deltamethrin on reproductive system in male mice [J]. Andrologia, 2010, 42: 182-186
[6] 陈建秋, 王志良, 李国平, 等. 有机磷农药乐果对萼花臂尾轮虫生殖的影响[J]. 生态环境学, 2012, 21(10): 1731-1736
Chen J Q, Wang Z L, Li G P, et al. The effect of dimethoate on the reproduction of freshwater rotifer [J]. Ecology and Environmental Sciences, 2012, 21(10): 1731-1736 (in Chinese)
[7] Wilczeka G, Rost-Roszkowska M, Wilczekc P, et al. Apoptotic and necrotic changes in the midgut glands of the wolf spider Xerolycosa nemoralis (Lycosidae) in response to starvation and dimethoate exposure [J]. Ecotoxicology and Environmental Safety, 2014, 101: 157-167
[8] Cole R D, Anderson G L, Williams P L. The nematode Caenorhabditis elegans as a model of organophosphate-induced mammalian neurotoxicity [J]. Toxicology and Applied Pharmacology, 2004, 194: 248-256
[9] Muschiol D, Schroeder F, Traunspurger W. Life cycle and population growth rate of Caenorhabditis elegans studied by a new method [J]. BMC Ecology, 2009, 9: 14-27
[10] Brinke M, Heininger P, Traunspurger W. A semi-fluid gellan gum medium improves nematode toxicity testing [J]. Ecotoxicology and Environment Safety, 2011, 74: 1824-1831
[11] Charlesworth B. Evolution in Age-structured Populations (2nd ed.) [M]. Cambridge: Cambridge University Press, 1994: 361
[12] Byerly L, Cassada R C, Russell R L. The life cycle of the nematode Caenorhabditis elegans I. Wild-type growth and reproduction [J]. Developmental Biology, 1976, 51: 23-33
[13] Hodgkin J, Barnes T M. More is not better: Brood size and population growth in a self-fertilizing nematode [J]. Proceedings of the Royal Society of London Series B,1991, 246(1315): 19-24
[14] Brinke M, Heininger P, Traunspurger W. Effects of a bioassay-derived ivermectin lowest observed effect concentration on life-cycle traits of the nematode Caenorhabditis elegans [J]. Ecotoxicology, 2013, 22: 148-155
[15] 陈晓雪, 于振洋, 尹大强. 环境浓度水平的镍对不同生命阶段秀丽线虫(Caenorhabditis elegans)体长与运动的刺激效应[J]. 生态毒理学报, 2014, 9(2): 299-305
Chen X X, Yu Z Y, Yin D Q. Stimulations of nickel at environmental concentrations on locomotion and growth of Caenorhabditis elegans at different life stages [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 299-305 (in Chinese)
◆
Effects of Dimethoate on Life-cycle Traits ofCaenorhabditiselegans
Wang Chunhua1,2, Li Chaopin1,*, He Mei2
1. College of Earth and Environmental Science, Anhui University of Science &Technology, Huainan 232001, China 2. Department of Life Science, Huainan Normal University, Huainan 232001, China
27 September 2014 accepted 19 November 2014
A hanging-drop method with a semi-fluid culture medium was used to carry out life table experiments in order to test the toxic effects of dimethoate on life-cycle traits of Caenorhabditis elegans, after the nematodes were exposed to three groups of dimethoate (0.07, 0.7 and 7 mmol·L-1, which were 1/1000 LC50, 1/100 LC50and 1/10 LC50respectively) for 4 h. The results showed that in 0.7 and 7 mmol·L-1groups, the total fertility rates (TFR) of nematodes were 260.60 and 203.80 respectively, both of which decreased significantly compared with control (299.23, P<0.05); the net reproductive rates (R0) were 240.29 and 147.67, which dropped significantly compared with control (298.67, P<0.05); the intrinsic rates of natural increase (rm) were 1.342 d-1and 1.233 d-1, which were much lower than control (1.387 d-1, P<0.05); while in 0.07 mmol·L-1group, TFR was 293.84, and R0was 286.60,the differences of which were not statistically significant (P>0.05). In the scope of the above dimethoate concentration, the values of TFR, R0and rmall decreased evidently as the concentration of dimethoate increased. The study also found that the rmin 0.07 mmol·L-1group was 1.405 d-1, which was evidently higher than control (P<0.05). From the present study, it was concluded that the fertility of C. elegans decreased when exposed to the dimethoate in a specific amount, while low doses of dimethoate had a hormesis effect on intrinsic rate of natural increase (rm) of nematode population, and the three parameters of TFR, R0and rmdetected in this paper were sensitive to dimethoate exposure in low dosage.
dimethoate; Caenorhabditis elegans; intrinsic rate of natural increase;total fertility rate; net reproductive rate
安徽高校省级自然科学研究项目(KJ2012Z380)
王春花(1979-),女,博士,研究方向为环境与健康,E-mail: ch_wang03@aliyun.com;
*通讯作者(Corresponding author), E-mail: 13805536665@126.com
10.7524/AJE.1673-5897.20140927001
2014-09-27 录用日期:2014-11-19
1673-5897(2015)2-332-06
X171.5
A
李朝品(1956-),男,博士,教授,博士生导师,主要从事环境与健康的研究。
王春花, 李朝品, 何梅. 乐果对秀丽隐杆线虫生活史特征的影响[J]. 生态毒理学报, 2015, 10(2): 332-337
Wang C H, Li C P, He M. Effects of dimethoate on life-cycle traits of Caenorhabditis elegans [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 332-337 (in Chinese)

