两种有机酸存在下铜对中华圆田螺肝脏的氧化应激效应
刘慧,王群,王为木,*,谈建康
1. 河海大学南方地区高效灌排与农业水土环境教育部重点实验室,南京 210098 2. 河海大学水利水电学院,南京 210098 3. 南京市溧水区环境监测站,南京 211200
两种有机酸存在下铜对中华圆田螺肝脏的氧化应激效应
刘慧1,2,王群2,王为木1,2,*,谈建康3
1. 河海大学南方地区高效灌排与农业水土环境教育部重点实验室,南京 210098 2. 河海大学水利水电学院,南京 210098 3. 南京市溧水区环境监测站,南京 211200
为探讨不同水平EDTA和柠檬酸(CA)作用下沉积物中铜对底栖无脊椎动物生态毒理学效应,以中华圆田螺为受试生物,研究了肝脏中活性氧(ROS)、丙二醛(MDA)含量、超氧化物歧化酶(SOD)以及过氧化氢酶(CAT)活性的变化规律。研究结果表明:有机酸存在下,铜污染底泥可诱导中华圆田螺肝脏产生ROS。电子顺磁共振(EPR)技术得出的3组双重峰分裂谱线为典型的α-苯基-N-叔丁基甲亚胺-N-氧化物(PBN)捕获羟自由基(·OH)形成PBN/·OH的EPR波谱。有机酸存在下,低剂量铜(≤100 mg·kg-1)对MDA产量影响不显著。较高剂量铜暴露下,EDTA的存在抑制MDA产生,CA的添加则均使MDA含量增加。EDTA存在下铜可显著抑制中华圆田螺肝脏中SOD和CAT活性。相对而言,CA的加入可减缓高剂量铜暴露下中华圆田螺肝脏SOD与CAT酶活性的剧烈变化。
铜;有机酸;中华圆田螺;氧化应激;自由基;抗氧化系统
铜是水生动物的营养元素, 对生长发育相关的生物酶的组成和功能有着重要作用,但是过量的铜又会对生物体产生毒害。研究表明,螯合剂的加入可能改变金属的生物可利用性,从而降低了其对水生生物的毒性。螯合剂包括:人工合成螯合剂,如乙二胺四乙酸(EDTA);天然螯合剂,主要是低分子有机酸,来源于动植物残体分解,植物根系分泌和微生物合成,如柠檬酸(CA)[1-4]。
当环境发生变化时,生物体能够产生大量自由基,抗氧化酶活性也会发生相应的改变[5],很多环境毒理实验都将其作为研究和评价污染物效应的重要标志物。中华圆田螺(Cipangopaludina cahayensis)具有高度灵敏度、分布广泛、可控养性和底泥耐受性四大优点,是理想的环境监测生物[6]。
有机酸改善重金属污染的研究大多集中于土壤[7],而对沉积物中重金属的研究则较少,也有学者选用腐殖酸对沉积物中重金属进行研究[8]。而本文通过EDTA和CA对铜污染沉积物中中华圆田螺的毒性实验,更进一步了解人工和天然有机酸对沉积物中铜污染环境下底栖生物的生态毒性效应。
1 材料与方法(Materials and methods)
1.1 材料
α-苯基-N-叔丁基甲亚胺-N-氧化物(PBN)购自Sigma公司,其余药品均为国产分析纯。
实验沉积物取自河海大学江宁校区西湖沉积物。
中华圆田螺购自南京市水产养殖基地,平均质量为(31.35±3.56) g,长度为(53.82±3.01) mm,宽度为(35.91±5.57) mm。
1.2 方法
1.2.1 实验设计
沉积物取自河海大学江宁校区西湖,风干后过150 μm孔径尼龙筛,按土液质量比为1:1放入体积为36 L的鱼缸(长×宽×高,45 cm×27 cm×30 cm),土层厚度约20 cm。外源添加不同浓度的CuSO4·5H2O溶液,使沉积物铜污染程度分别达到国家土壤环境质量三级标准(Cu: 400 mg·kg-1)的0、0.125、0.25、0.5和1.0倍,即含铜量为0、50、100、200和400 mg·kg-1,各平行设置2个实验组,以便添加不同有机酸。参照冯效毅等[9]和马陶武等[10]的方法,培养铜污染底泥,间歇搅拌,至自然风干。分别在上述2个实验组中按土液质量比1:1添加与Cu2+物质量比为1:1的EDTA、CA溶液,自然风干。添加除氯自来水,沉积物与上覆水的体积比为1:4,放入中华圆田螺,每天更新鱼缸溶液50%。12 d后每个装置取5只中华圆田螺,解剖,取出肝脏,测定活性氧(ROS)和生化指标。
1.2.2 自由基的捕获和测定
自由基的捕获与测定采用Davies改良方法。具体步骤为:活体解剖中华圆田螺,迅速称取0.1 g肝脏,在N2氛围中,置于已经加入1 mL以二甲基亚砜(DMSO)为溶剂,浓度为100 mmol·L-1的PBN溶液的玻璃匀浆器内,冰浴下匀浆,静置,待匀浆液分层后,取上清液注入一端封口的毛细管中,迅速放入液氮中,待电子顺磁共振(EPR)测定。
EPR(德国Bruker公司,Bruker EMX 10/12型EPR谱仪)操作参数:测试温度130 K,微波功率20 mW,微波频率9.751 GHz,调制频率100 KHz,调制幅度0.5 G,中心磁场3 470 G,扫场时间84 s,时间常数41 ms,扫场宽度200 G,信号为5次叠加。
1.2.3 丙二醛(MDA)和蛋白含量,超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的测定
MDA含量的测定:采用TBA比色法[11]。
蛋白含量的测定:用Bradford[12]的方法。
SOD活性的测定:采用改进后的邻苯三酚法[13]。
CAT活性的测定:采用徐镜波等[14]的方法。
1.2.4 数据处理与分析
实验数据采用Origin 7.5和SPSS 17.0对数据进行统计分析,运用单因素方差分析方法,采用S-N-K检验法进行多重比较。差异显著性水平为0.05,结果以标记字母法表示。
2 结果与分析(Results and analysis)
2.1 有机酸存在下铜对中华圆田螺肝脏自由基的影响
DMSO在无氧情况下与羟自由基(·OH)生成甲基(·CH3),有氧情况下生成甲氧基(·OCH3),再被PBN捕获形成稳定的加合物。中华圆田螺肝脏捕获的自由基超精细分裂常数PBN/·CH3为aN=14.3 G;aH=2.7 G;g=2.0059,PBN /·OCH3为aN=15.5 G;aH=3.3 G;g=2.0059,与文献报道的PBN捕获·CH3和·OCH3的特征参数基本一致[15]。因此,
可初步认定EDTA和CA存在下,沉积物铜污染可诱导中华圆田螺肝脏产生·OH。EPR自旋捕集技术直接证明了在有机酸存在的条件下,铜暴露诱导中华圆田螺肝脏产生ROS,其中CA存在下,暴露浓度为100 mg·kg-1时,中华圆田螺肝脏自由基图谱如图1所示。产生的自由基谱线为3组具有双重超精细分裂谱线的6个峰,以第1组双重峰的第1个超精细分裂峰的峰高的差值代表所产生的自由基信号强度,该浓度下信号强度为17 444.51。
中华圆田螺肝脏产生的羟自由基信号强度如图2所示。EDTA和CA各处理组羟自由基信号强度均高于对照组。EDTA存在下,铜暴露浓度为50 mg·kg-1时,自由基信号强度与对照组无明显差异,当浓度达到100 mg·kg-1以上时,可诱导羟自由基信号显著增强,且随浓度增高,自由基强度有降低趋势。CA存在时,自由基信号强度均表现为显著诱导,且随暴露浓度的增大,自由基信号强度表现为先增大,再降低。
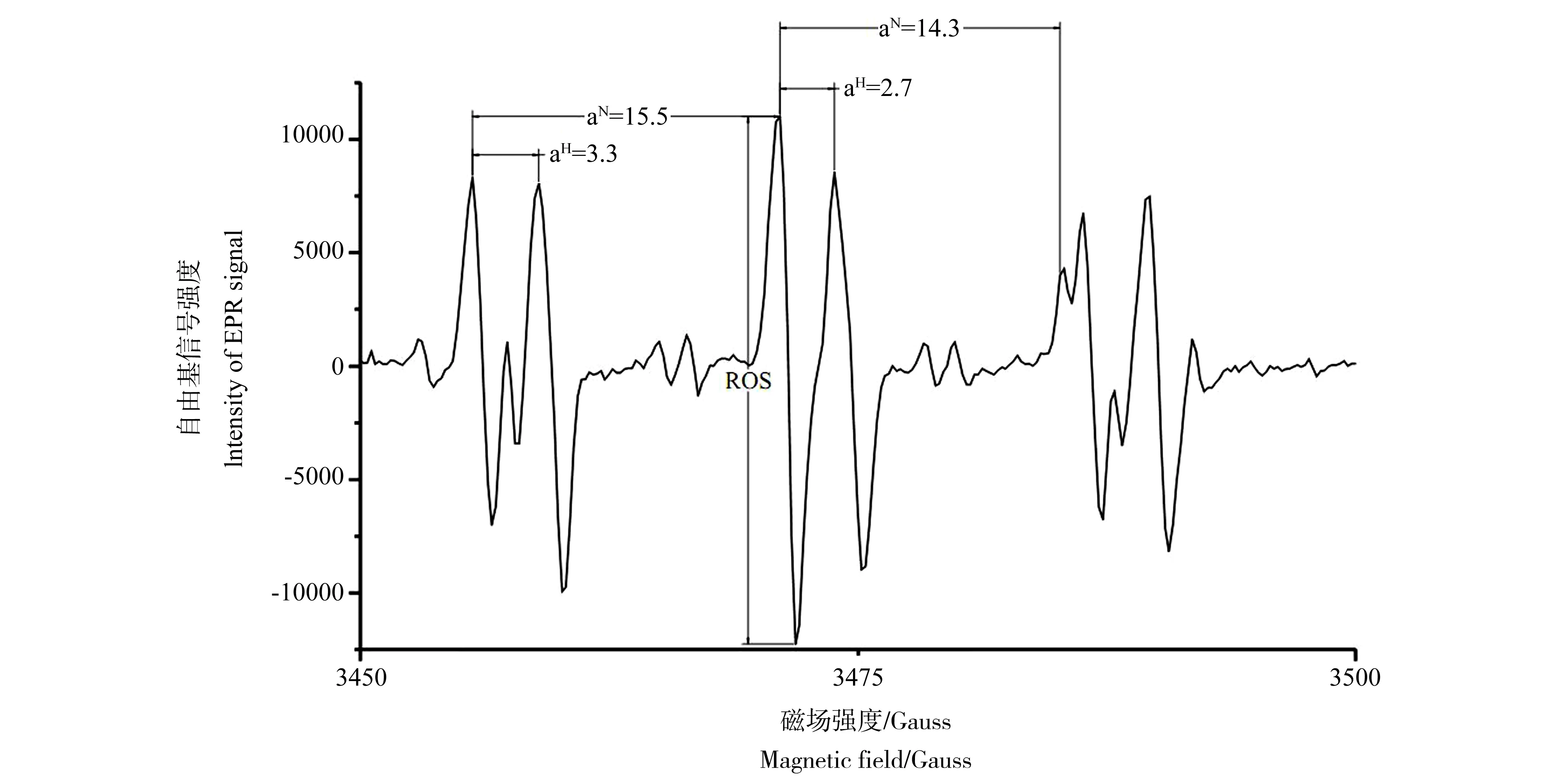
图1 自由基图谱Fig. 1 The EPR spectrum of free radical
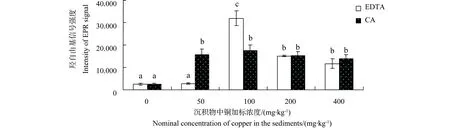
图2 有机酸存在下铜对中华圆田螺肝脏自由基信号强度的影响Fig. 2 Effects of copper on intensity of hydroxyl radicals signal in liver of C. cahayensis with the different levels of organic acids
2.2 有机酸存在下铜对中华圆田螺肝脏MDA含量的影响
MDA含量变化如图3所示。有机酸存在时,较低浓度铜暴露均未引起MDA含量的显著变化。400 mg·kg-1EDTA处理组显著抑制了MDA含量;相反地,铜暴露浓度为200 mg·kg-1与400 mg·kg-1柠檬酸处理组,MDA含量显著增加。
2.3 有机酸存在下铜对中华圆田螺肝脏SOD活性的影响
SOD活性变化情况如图4所示。EDTA存在时,随着铜暴露浓度的增大,SOD活性被显著抑制,且随暴露浓度升高抑制程度逐渐加大,暴露浓度为400 mg·kg-1时,SOD活性仅为对照组的3.39%。CA存在时,低浓度铜暴露会显著抑制SOD活性,当铜暴露达到最高时,SOD活性反而出现被激活的趋势。
2.4 有机酸存在下铜对中华圆田螺肝脏CAT活性的影响
CAT活性变化情况如图5所示。EDTA存在时,各处理组CAT活性均表现为显著抑制,铜暴露浓度达到400 mg·kg-1时,CAT活性达到最小值,为对照组的38.73%。CA存在下,铜抑制各处理组CAT活性。当铜暴露达到最高时,CAT活性有所增大。
3 讨论(Discussion)
该实验中,铜暴露情况下,有机酸的存在可诱导中华圆田螺肝脏产生·OH。其中低浓度EDTA处理组,中华圆田螺肝脏羟自由基未被显著诱导。这表明EDTA对低浓度的铜污染具有解毒效应。有人研究了EDTA存在下铜对生物的毒性效应,得出EDTA可以降低铜的毒性[16-17],这与本实验得到的结果一致。魏克强等[18]研究Cu2+对克氏原螯虾肝胰腺组织进行氧化损伤时,认为随Cu2+浓度升高,ROS含量表现为先增大再降低;最大ROS含量显著高于对照组。曹慧等[19]也认为镉污染也会诱导黑斑蛙精巢产生ROS。这些结果说明,肝脏作为水生生物蓄积铜的主要组织,会诱导机体产生ROS,而ROS的产生可能就是铜污染致毒原因之一。暴露在重金属环境下的生物会产生的ROS,当产生的ROS量大于清除能力时,机体就可能发生氧化应激[20]。
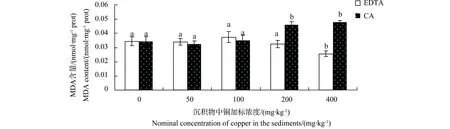
图3 有机酸存在下铜对中华圆田螺肝脏MDA含量的影响Fig. 3 Effects of copper on malonaldehyde content in liver of C. cahayensis with the different levels of organic acids
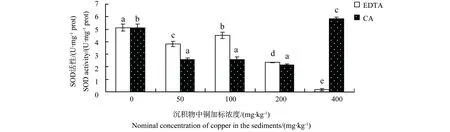
图4 有机酸存在下铜对中华圆田螺肝脏SOD活性的影响Fig. 4 Effects of copper on SOD activity in liver of C. cahayensis with the different levels of organic acids
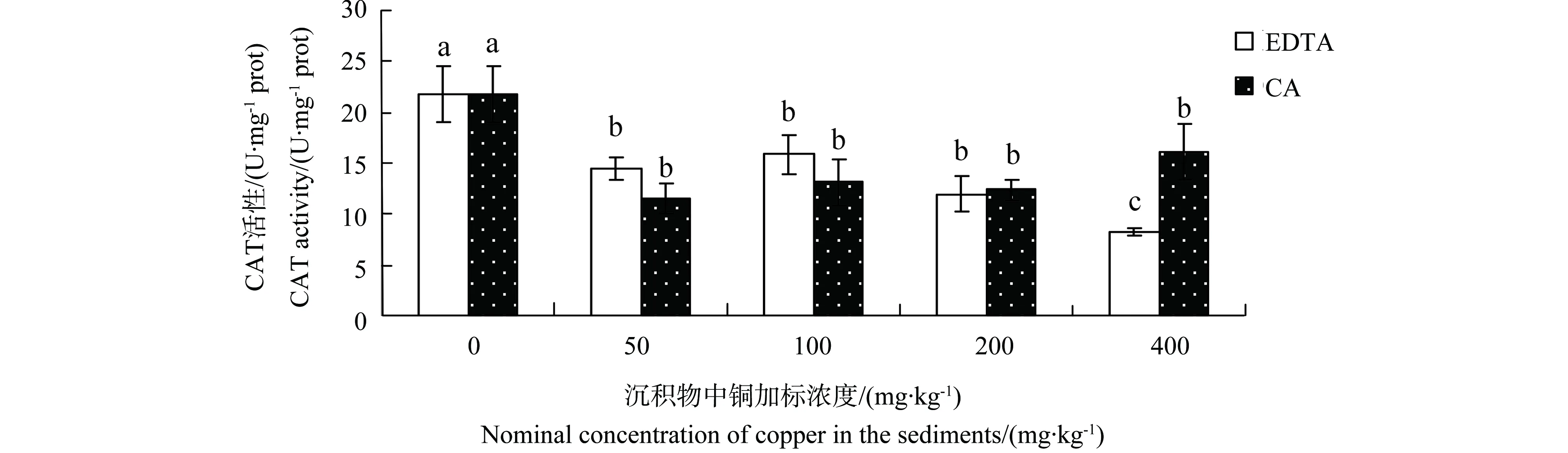
图5 有机酸存在下铜对中华圆田螺肝脏CAT活性的影响Fig. 5 Effects of copper on CAT activity in liver of C. Cahayensis with the different levels of organic acids
本实验中,EDTA存在下,MDA含量随铜暴露浓度的变化呈现出低剂量组增大、高剂量组降低的趋势,与ROS变化规律一致。CA存在时,MDA含量在较高暴露浓度(>200 mg·kg-1)时被显著诱导。罗义等[11]认为MDA含量的增加表明机体被污染物诱导,处于氧化应激状态。纪靓靓等[21]研究2, 4, 6-TCP对鲫鱼肝脏的氧化应激时得出·OH是引发脂质过氧化的主要自由基的结论,因此二者具有一致的变化趋势。刘慧等[22]研究纳米ZnO对鲫鱼肝脏毒性时,也得出相同结果。
重金属污染暴露下,SOD和CAT可共同起作用,清除生物体内因污染胁迫产生的活性氧自由基,导致水生生物SOD和CAT均被显著抑制[20]。这与本实验中EDTA存在下,铜对生物肝脏SOD和CAT活性效应一致。在CA存在下,高浓度铜暴露中华圆田螺肝脏CAT活性表现为诱导。这可能是由于CA的存在降低了铜的毒性效应,缓解了中华圆田螺肝脏抗氧化系统的剧烈变化。
综上所述,铜污染沉积物中有机酸的存在均可诱导中华圆田螺肝脏产生ROS,ROS可能是铜污染致毒的原因之一,进而引起抗氧化系统组分变化的连锁反应。相对而言,EDTA对低浓度的铜污染具有一定程度的解毒效应;而CA可有效地缓解高浓度铜污染下抗氧化系统的剧烈变化。因此,自然水体中存在的人工与天然有机酸均可影响重金属污染对水生生物的生态毒性效应,但具体研究中还应考虑其他相关环境因素。
致谢:感谢南京大学现代分析测试中心眭云霞老师提供EPR测试以及有关EPR谱图解析指导。
[1] Najeeb U, Jilani G, Ali S, et al. Insights into cadmium induced physiological and ultra-structural disorders in Juncus effusus L. and its remediation through exogenous citric acid [J]. Journal of Hazardous Materials, 2010, 186(1): 565-574
[2] Liu H, Wang W M, Zhang J F, et al. Effects of copper and its ethylenediaminetetraacetate complex on the antioxidant defenses of the goldfish, Carassius auratus [J]. Ecotoxicology and Environmental Safety, 2006, 65(3): 350-354
[3] 沈骅, 王晓蓉, 张景飞, 等. Cu2+和Cu-EDTA对鲫鱼脑组织应激蛋白HSP70诱导的影响[J]. 环境科学, 2004, 25(3): 94-97
Shen H, Wang X R, Zhang J F, et al. Effects of copper (Cu2+) and Cu-EDTA complex on the induction of HSP70 in the fish brain [J]. Environmental Science, 2004, 25(3): 94-97 (in Chinese)
[4] 薛明, 柯才焕, 周时强, 等. 重金属对波部东风螺早期发育的毒性及EDTA的解毒效果[J]. 热带海洋学报, 2004, 23(1): 44-50
Xue M, Ke C H, Zhou S Q, et al. Toxic effects of heavy metals on early development of Babylonia formosae habei and detoxification effects of EDTA [J]. Journal of Tropical Oceanography, 2004, 23(1): 44-50 (in Chinese)
[5] 许超, 夏北城, 林颖. EDTA柠檬酸对污染土壤中重金属的解吸动力学及其形态的影响[J]. 水土保持学报, 2009, 23(4): 146-151
Xu C, Xia B C, Lin Y. Kinetics of heavy mental desorption by EDTA and citric acid in contaminated soil and their redistribution of fractions [J]. Journal of Soil and Water Conservation, 2009, 23(4): 146-151 (in Chinese)
[6] 王萌, 马陶武, 龙奕, 等. 腐殖酸作用下沉积物中纳米氧化铜对铜锈环棱螺生态毒性的影响[J]. 生态毒理学报, 2014, 9(4): 803-808
Wang M, Ma T W, Long Y, et al. Impacts of humic acid on ecotoxicity of CuO nanoparticle in Bellamya aeruginosa under the sediment scenario [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 803-808 (in Chinese)
[7] Pytharopoulou S, Grintzalis K, Sazakli E, et al. Translational responses and oxidative stress of mussels experimentally exposed to Hg, Cu and Cd: One pattern does not fit at all [J]. Aquatic Toxicology, 2011, 105(1): 157-165
[8] 郭明新, 林玉环. 用中华圆田螺作为底泥重金属毒性和生物可给性的指示生物[J]. 环境与开发, 1997, 12(2): 8-11
Guo M X, Lin Y H. River snail Cipangopaludina cathayensis as an indicator for toxicity and bioavailability of heavy metals in sediment [J]. Environment and Exploitation, 1997, 12(2): 8-11 (in Chinese)
[9] 冯效毅, 张宇峰, 刘春阳. 柠檬酸对长江三角洲地区不同母质土壤铜解吸的影响[J]. 土壤通报, 2008, 39(1): 203-205
Feng X Y, Zhang Y F, Liu C Y. Desorption of copper by citric acid from the different soils of Yangtze River delta [J]. Chinese Journal of Soils Science, 2008, 39(1): 203-205 (in Chinese)
[10] 马陶武, 朱程, 周科, 等. 铜锈环棱螺对铅污染沉积物慢性胁迫的繁殖响应和氧化应激反应敏感性[J]. 生态学报, 2009, 29(10): 5350-5357
Ma T W, Zhu C, Zhou K, et al. The reproductive reaction and oxidative stress responses sensitivity of Bellamya aeruginosa to the chronic exposure of lead-contaminated sediments [J]. Acta Ecologica Sinica, 2009, 29(10): 5350-5357 (in Chinese)
[11] 罗义, 施华宏, 王晓蓉, 等. 2, 4-二氯苯酚诱导鲫鱼肝脏自由基的产生和脂质过氧化[J]. 环境科学学报, 2005, 26(3): 29-32
Luo Y, Shi H H, Wang X R, et al. Reactive oxygen species generation and the molecular toxic mechanism induced by 2, 4-dichlorophenol in Carassius auratus [J]. Acta Scientiae Circumstantiae, 2005, 26(3): 29-32 (in Chinese)
[12] Brandford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding [J]. Analytical Biochemistry, 1972, 72(1-2): 248-254
[13] 邹国林, 桂兴芬, 钟晓凌, 等. 一种SOD的测活方法-邻苯三酚自氧化法的改进[J]. 生物化学与生物物理进展, 1986, 4: 71-73
[14] 徐镜波, 袁小凡, 郎佩贞. 过氧化氢酶活性及活性抑制的紫外分光光度测定[J]. 环境化学,1997, 16(1): 73-76
Xu J B, Yuan X F, Lang P Z. The determination of enzymic activity and its inhibition on catalase by ultraviolet spectrophotometry [J]. Environmental Chemistry, 1997, 16(1): 73-76 (in Chinese)
[15] Takeshita K, Fujii K, Anzai K, et al. In vivo monitoring of hydroxyl radical generation caused by X-ray irradiation of rats using the spin trapping/EPR technique [J]. Free Radical Biology & Medicine, 2004, 36(9): 1134-1143
[16] 储昭升, 金相灿, 阎峰, 等. EDTA和铁对铜铝微囊藻和四尾栅藻生长和竞争的影响[J]. 环境科学, 2007, 28(11): 2457-2461
Chu Z S, Jin X C, Yan F, et al. Effects of EDTA and iron on growth and competition of Microcystis aeruginosa and Scenedesmus quadricauda [J]. Environmental Science, 2007, 28(11): 2457-2461 (in Chinese)
[17] 黄苏珍, 原海燕, 孙延东, 等. 有机酸对黄菖蒲镉、铜积累及生理特性的影响[J]. 生态学杂志, 2008, 27(7): 1181-1186
Huang S Z, Yuan H Y, Sun Y D, et al. Effects of applying organic acids on Cd and Cu accumulation and physiological characteristics of Iris preudacorus L [J]. Chinese Journal of Ecology, 2008, 27(7): 1181-1186 (in Chinese)
[18] 魏克强, 庞胜喜, 赵辉, 等. Cu2+对克氏原螯虾(Procambarus clarkii)肝胰腺的蛋白质氧化损伤效应[J]. 农业环境科学学报, 2014, 33(7): 1310-1315
Wei K Q, Pang S X, Zhao H, et al. Oxidative damages of proteins in hepatopancreas of Procambarus clarkii exposed to Cu2+[J]. Journal of Agro-Environment Science, 2014, 33(7): 1310-1315 (in Chinese)
[19] 曹慧, 施蔡雷, 贾秀英. 镉暴露对黑斑蛙精巢ROS的诱导及其蛋白质氧化损伤作用机理[J]. 生态学报, 2012, 32(13): 4199-4206
Cao H, Shi C L, Jia X Y. Toxicity mechanism of cadmium-induced reactive oxygen species and protein oxidation in tests of the frog Rana nigromaculata [J]. Acta Ecologica Sinica, 2012, 32(13): 4199-4206 (in Chinese)
[20] 于庆云, 王悠, 徐彦, 等. 镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J]. 生态毒理学报, 2010, 8(4): 504-512
Yu Q Y, Wang Y, Xu Y, et al. Effects of cadmium and lead on the lipid peroxidation and levels of antioxidant enzymes in Ruditapes philippinarum [J]. Asian Journal of Ecotoxicology, 2010, 8(4): 504-512 (in Chinese)
[21] 纪靓靓, 李法云, 罗义, 等. 2, 4, 6-三氯苯酚诱导鲫鱼肝脏自由基的产生及其氧化应激[J]. 应用生态学报, 2007, 18(1): 129-132
Ji L L, Li F Y, Luo Y, et al. Free radicals in Carassius auratus liver: Their generation and oxidative stress induced by 2, 4, 6-trichlorophenol [J]. Chinese Journal of Applied Ecology, 2007, 18(1): 129-132 (in Chinese)
[22] 刘慧, 朱方伟, 尹颖, 等. 纳米ZnO对鲫鱼肝脏的毒性[J]. 生态毒理学报, 2010, 5(5): 698-703
Liu H, Zhu F W, Yin Y, et al. Toxicity of nano-ZnO on liver of goldfish (Carassius auratus) [J]. Asian Journal of Ecotoxicology, 2010, 5(5): 698-703 (in Chinese)
◆
The Oxidative Stress of Copper on Liver of River SnailCipangopaludinacahayensisin the Presence of Two Kinds of Organic Acids
Liu Hui1,2, Wang Qun2, Wang Weimu1,2,*, Tan Jiankang3
1. Key Laboratory of High-Efficient Irrigation and Drainage and Agricultural Water and Soil Environment in Southern China, MOE, Nanjing 210098, China 2. College of Water Conservancy and Hydropower, Hohai University, Nanjing 210098, China 3. Lishui Environmental Monitoring Station, Nanjing 211200, China
16 August 2014 accepted 12 November 2014
The effects of EDTA or citric acid (CA) and copper in sediments on reactive oxygen species (ROS), malonaldehyde (MDA) content, superoxide dismutase (SOD) and catalase (CAT) activities in liver of river snail, Cipangopaludina cahayensis were investigated to get insight into the ecotoxicological effects of copper in sediments with various gradient of EDTA or CA on benthic invertebrates. The results indicated that there was an obvious increase of ROS generation in liver of Cipangopaludina cahayensis treated with organic acids and copper compared with that of the control. The six-line composed of three groups with two hyperfine splitting peaks in each showed a typical hydroxyl free radicals (·OH) spectrum, using electron paramagnetic resonance (EPR) spin trapping technique, captured by α-phenyl-N-tert-butylnitron (PBN). At copper concentration of 100 mg·kg-1and below, the content of EDTA and CA had no significant effect on MDA. EDTA inhibited the generation of MDA at higher concentration of copper. On the contrary, CA induced the generation of MDA at higher concentration of copper. EDTA could suppress the SOD and CAT activities in liver of Cipangopaludina cahayensis after copper exposure. In contrast, the addition of CA could avoid the severe changes of SOD and CAT activities at the highest copper exposure.
copper; organic acid; Cipangopaludina cahayensis; oxidative stress; free radicals; antioxidant system
国家自然科学基金资助项目(51109060);江苏省环保科研资助项目(2013057)
刘慧(1972-),女,博士,研究方向为农业水土环境,E-mail: liuhui@hhu.edu.cn
*通讯作者(Corresponding author), E-mail: wangwm@hhu.edu.cn
10.7524/AJE.1673-5897.20140816001
2014-08-16 录用日期:2014-11-12
1673-5897(2015)2-306-07
X171.5
A
王为木(1972-),男,农业水土工程博士,副教授,主要从事土壤及水污染控制研究。
刘慧, 王群, 王为木, 等. 两种有机酸存在下铜对中华圆田螺肝脏的氧化应激效应[J]. 生态毒理学报, 2015, 10(2): 306-312
Liu H, Wang Q, Wang W M, et al. The oxidative stress of copper on liver of river snail Cipangopaludina cahayensis in the presence of two kinds of organic acids [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 306-312 (in Chinese)

