药品与个人护理品在鱼体中的累积及代谢研究进展
胡君剑,胡霞林,尹大强
同济大学环境科学与工程学院 污染控制与资源化研究国家重点实验室, 上海 200092
药品与个人护理品在鱼体中的累积及代谢研究进展
胡君剑,胡霞林*,尹大强
同济大学环境科学与工程学院 污染控制与资源化研究国家重点实验室, 上海 200092
药品与个人护理品(pharmaceuticals and personal care products, PPCPs)作为一类广泛使用和具有特殊物理化学特性的新型环境污染物,能够在水环境中持续低浓度的存在,对水生生态系统具有潜在风险,已经引起了广泛的关注。鱼体内PPCPs的累积与代谢过程研究在PPCPs的生态风险评价中占据极其重要的地位。概述了PPCPs在鱼体内的分布,分析了影响PPCPs在鱼体内累积的因素如PPCPs的性质、组织差异、鱼的种类、不同的描述方法等,讨论了PPCPs的代谢机制,重点介绍了PPCPs在胆汁内的解毒机制和代谢产物,强调了胆汁应用的重要意义。最后,展望了PPCPs 在鱼体内的累积和代谢这一研究领域的发展方向。
PPCPs;鱼;生物累积;代谢;胆汁
药品与个人护理品(pharmaceuticals and personal care products, PPCPs)作为一类大量使用和具有潜在生态毒理效应的新型环境污染物,近年来备受科学界和社会的普遍关注。PPCPs涵盖了所有人用和兽用医药品、诊断试剂、麝香、化妆品、遮光剂、消毒剂和其他在PPCPs生产制造中添加的组分(如环境激素)等。环境中的PPCPs主要来源于污水处理厂[1]以及兽用药物的直接排放。尽管PPCPs在环境中的半衰期相对较短,但是由于污水处理厂和流水一直连续不断地往环境中释放PPCPs,使得PPCPs在水环境中具有一定的持久性。水环境中的PPCPs已被广泛研究,抗生素、非甾类化合物的消炎药、β阻滞剂和口服避孕药是水环境中检出率最高的几种PPCPs,常见浓度范围为ng·L-1~μg·L-1水平[2]。
长期低浓度的PPCPs暴露对鱼类及其他水生生物的潜在毒性效应已经引起人们的广泛关注。废水中富含的抗生素、耐抗生素细菌和抗生素抗性基因,可以促进生物对抗生素的耐药性[3]。消炎药双氯芬酸对鱼的肾脏、代谢过程的基因表达,前列腺素合成[2]和酰基辅酶A(FAO)的活性[4]产生了影响。雌激素能诱导雄性鱼出现卵黄蛋白原的生理反应[5]。
鱼作为1种典型的脊椎水生生物,在PPCPs的生态风险评价中占据极其重要的地位:鱼体血浆中PPCPs的预测浓度可望与人体治疗时PPCPs的效应浓度相关联[6],而鱼体胆汁中PPCPs及其代谢产物的检测可望成为PPCPs经水暴露的暴露性生物标志物[2, 7]。Huggett等[6]提出了“鱼血浆”模型(fish plasma model, FPM),将已有的PPCPs对人体和动物潜在影响的数据利用起来,进行PPCPs对鱼的潜在风险评价。PPCPs对鱼的毒性效应机制与其在鱼体内的生物累积和代谢过程密切相关。多种PPCPs在鱼体中已有检出,其生物累计因子(bioaccumulation factor, BAF)从几倍到几千倍[5]。目前关于PPCPs在鱼体内的累积和代谢研究还很少,数据还很不完善。因此亟需对PPCPs在鱼体内的分布累积和代谢进行广泛而深入的研究。
1 鱼体内PPCPs的分布
研究野生鱼体内PPCPs的种类和含量有着重要的意义,这是因为水生生态系统是1个复杂的体系,其中的生物不仅受到目标污染物的影响,同时也暴露在其他相关的化学物质下,并且受气候、地理条件、光照等因素的影响。对野生鱼的研究,能够更好的了解实际水环境中PPCPs的潜在风险。
目前关于PPCPs在野生鱼体内分布的研究还很少,仅有的几篇文献[8-16]表明(表1),在野生鱼体内分布研究较多的物质有卡马西平,浓度水平为0.1~693 ng·g-1;其次是氟西汀及其代谢产物诺氟西汀,浓度水平为1.34~130 ng·g-1;然后是舍曲林及其代谢产物去甲基舍曲林,浓度为0.48~1 065 ng·g-1;此外,还有苯海拉明、安定和咖啡因等。目前主要研究的是消炎药和抗抑郁药,研究国家涵盖了美国,加拿大和德国等西方国家。其中美国的研究最多,主要是针对南加州湾海域、丹顿河流、格兰德河、芝加哥、德克萨斯州等河流中的野生鱼。中国仅有1篇研究[15],在珠海鲤鱼的胆汁中检测到了双酚A、雌酮和雌炔醇,浓度分别为70~1 020 ng·L-1、nd~30 ng·g-1、1.20~10.97 ng·g-1。PPCPs在野生鱼体内的分布具有明显的空间差异。同一种药物在不同国家和同一国家的不同地方浓度相差很大,如卡马西平在加拿大和美国不同水域鱼样品中的浓度相差1到100倍。此外,同一物质在同一鱼体内不同组织中的浓度也有明显差异;PPCPs主要分布在肌肉、肝脏、血浆和脑组织中,而血浆和肝脏中的浓度普遍高于肌肉中的浓度。
实际水环境中的暴露很复杂,不同的鱼同时暴露于含有不同浓度的化学物质、胶体、悬浮固体以及表面活性剂的水环境中。另外,由于从实际水环境中捕获野生鱼存在很多问题,如样本的可获得性、种类和数量、季节限制等,很难归一化鱼的种类和身体特征来进行生物监测和生态风险评价。鉴于此,一些研究将经过实验室驯化的、特定的鱼直接暴露于污水处理厂出水口的河流或者出水中,以研究实际水环境中PPCPs在鱼体内的分布。Lahti等[19]将鱼暴露于污水处理厂出水口的河流中,在鱼的肌肉,血浆,胆汁中检测到了双氯芬酸,萘普生和布洛芬。Wang等[12]采用污水处理厂出水对彩虹鱼进行实验室暴露,在鱼体内检测到吉非罗齐、双酚A和布洛芬。Fick等[20]检测出鱼血浆中含有16种PPCPs,其中左炔诺孕酮的浓度为8.5~12 ng·mL-1,超过了治疗性血浆水平。Rostkowski等[21]将鲑鱼暴露于污水处理厂出水中10 d,用生物测定法检测到胆汁中含有氯二甲苯酚、双氯酚等7种抗雄性激素,第一次证明了污水处理厂出水中的一类抗雄性激素对鱼类具有生物可利用性。由于经过污水处理厂处理过的水一般直接排入河流等,用污水处理厂出水来进行暴露试验,检测PPCPs在鱼体内各组织的含量,可以更好地反映鱼类对地表水中PPCPs的摄取、吸收和生物利用情况。
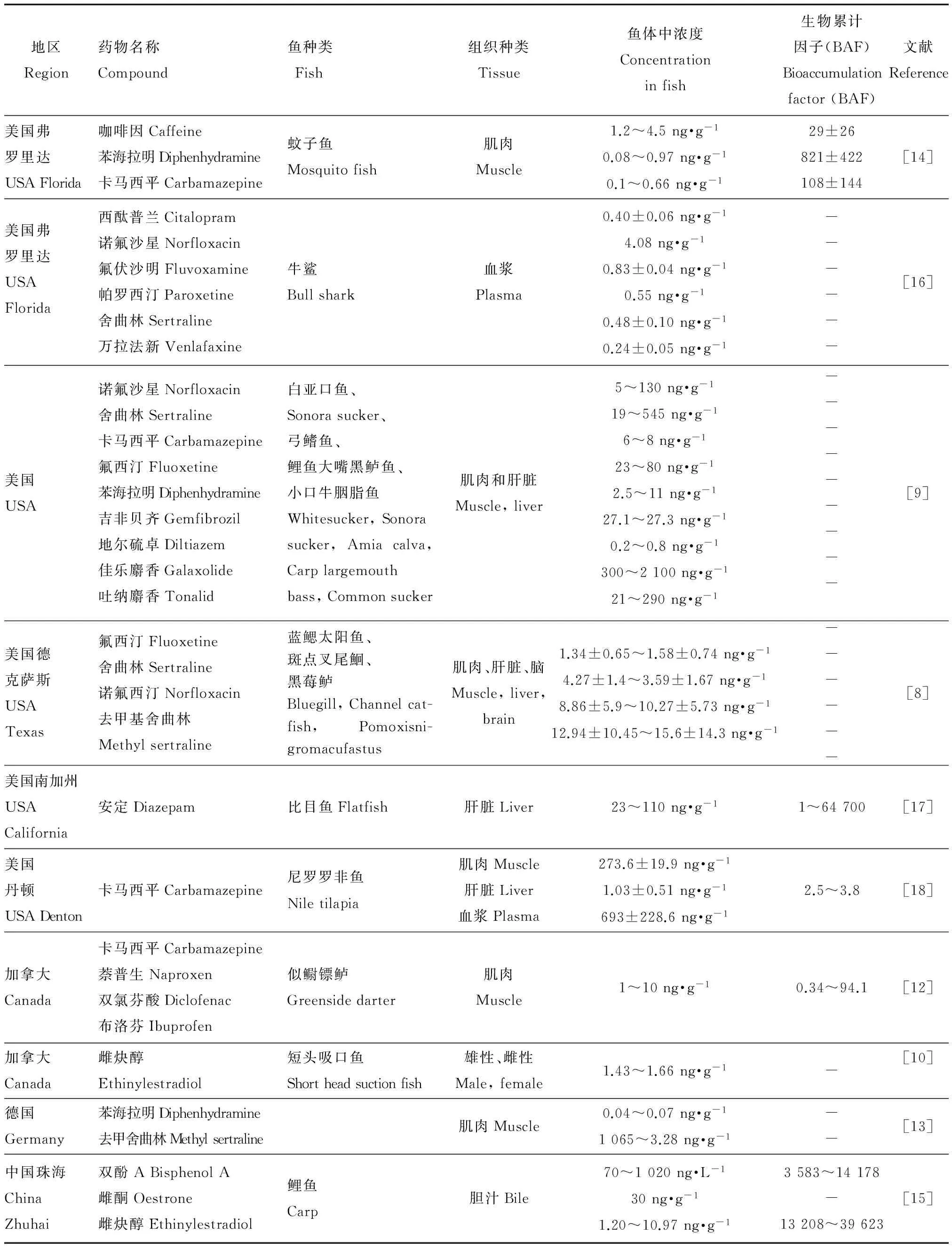
表1 野生鱼体内PPCPs的分布Table 1 The occurrence of PPCPs in the wild fish
2 PPCPs在鱼体内的生物累积
生物富集(bioconcentration)指水生生物仅通过呼吸道或者皮肤表面从水中(通常是在实验室条件下)吸收化学物质,导致化学物质在水生生物体内的浓度大于水环境中浓度的过程。生物累积(bioaccumulation)指水生生物通过所有途径(包括食物吸收,呼吸道和表面皮肤的转运)摄取化学物质,导致化学物质水生生物体内浓度高于水环境中浓度的过程。生物累积过程包含了生物富集和食物摄取过程[22]。生物累积(生物富集)可以由生物累积因子BAF(生物富集因子, bioconcentration factor, BCF)描述,是指化学物质在水生生物体内的浓度与水中的浓度之比:BAF(BCF)=生物体内浓度/水中浓度。(本文全篇用生物累积因子BAF)
BAF的大小可以用来表征物质在鱼体内累积能力的大小。Brooks等[8]第一次报道了抗抑郁药氟西汀和舍曲林及它们的代谢产物诺氟沙星和去甲基舍曲林在蓝鳃太阳鱼、点叉尾鮰和鲤鱼的肌肉、脑组织和肝脏内累积,浓度高达0.1 ng·g-1。Valdés等[23]将食蚊鱼暴露在100~1 000 g·L-1的阿替洛尔和卡马西平下96 h,得到卡马西平的BAF为0.7~0.9 L·kg-1,阿替洛尔的BAF为0.13~0.08 L·kg-1。这两种物质的BAF都<1,说明卡马西平和阿替洛
尔在鱼体内的累积能力很小。Nallani等[24]发现布洛芬在黑头呆鱼和鲶鱼体内的BAF为0.08~1.4,表明布洛芬在这两种鱼体内的累积潜能很小。
目前在野生鱼样品(表1)以及实验室暴露鱼体(表2)的不同组织(包括肌肉,肝脏,血浆,胆汁等)中均检测到了PPCPs的累积,BAF的范围为0.01~49 000,数量级相差很大。而且PPCPs在不同组织中的BAF具有差异性,BAF一般在脑、肝脏和胆汁中较高,而在肌肉和血浆中相对较低。此外,不同种类的PPCPs在同一鱼和组织中的BAF不同,如消炎药的BAF通常低于抗抑郁药的BAF,卡马西平的BAF<10,而氟西汀的BAF>100。PPCPs在不同鱼体内的BAF不同,如卡马西平在罗非鱼中的BAF为2.5~3.8,在钝头鱼中的BAF为1.5~7.1[18]。这说明有多种因素影响PPCPs在鱼体内的累积,如PPCPs的性质,PPCPs在组织内的分配过程,鱼的摄食行为,自然条件(温度、光照),水体条件(胶体、DOM)等。
2.1 PPCPs的性质对累积的影响
PPCPs的物理化学性质会影响其在鱼体内的累积。PPCPs通常具有类似的物理化学性质,如亲脂性(可以通过生物膜)和持续性(可以避免活性成分在起作用前失去活性)[40]。大多数PPCPs的logKow为3~5,具有足够的水溶性,能够溶解于水中,同时又有足够的亲脂性,能够在鱼体内累积。

表2 PPCPs在鱼体内的富集Table 2 The bioaccumulation of PPCPs in fish
续表2
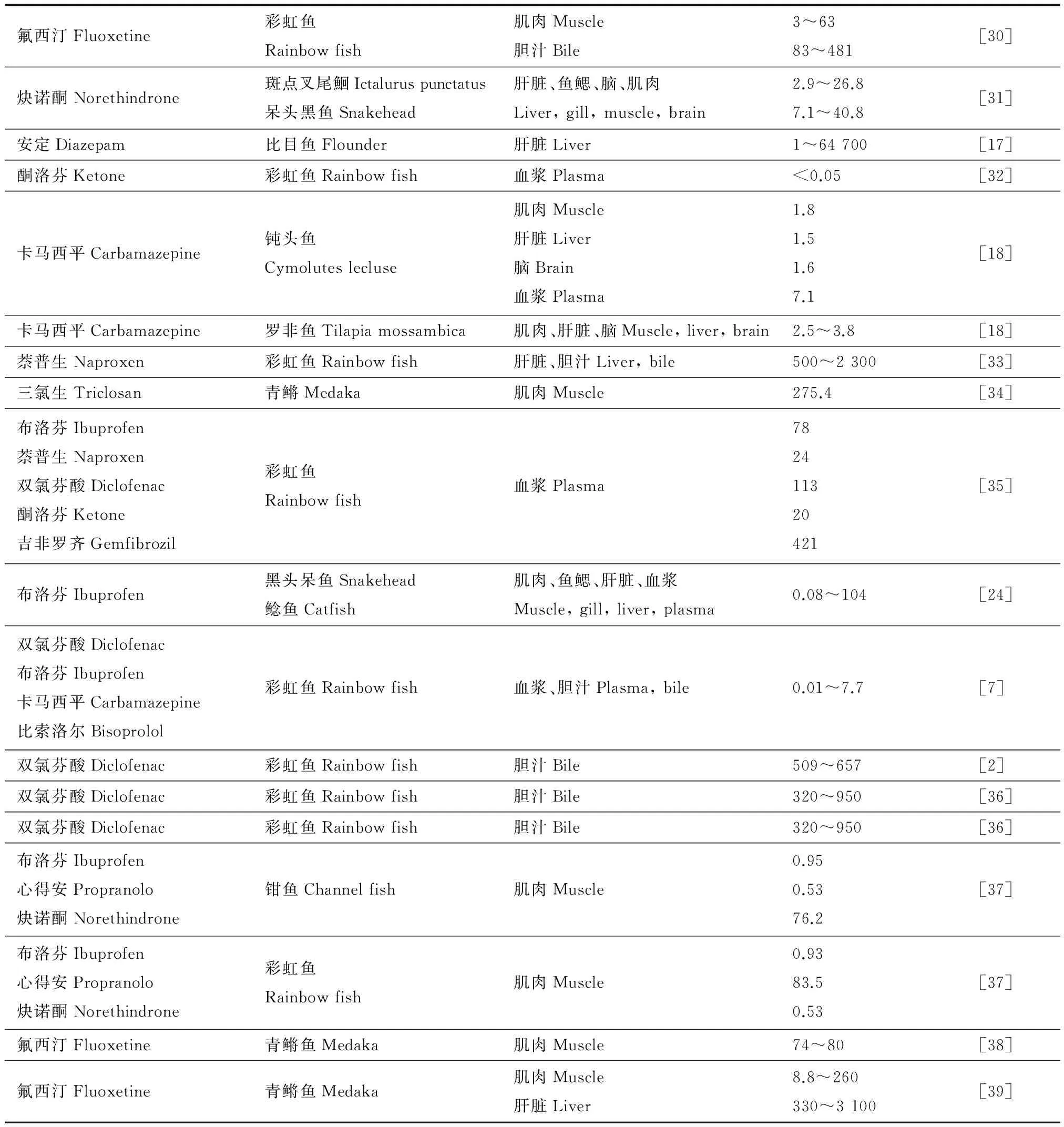
氟西汀Fluoxetine彩虹鱼Rainbowfish肌肉Muscle胆汁Bile3~6383~481[30]炔诺酮Norethindrone斑点叉尾鮰Ictaluruspunctatus呆头黑鱼Snakehead肝脏、鱼鳃、脑、肌肉Liver,gill,muscle,brain2.9~26.87.1~40.8[31]安定Diazepam比目鱼Flounder肝脏Liver1~64700[17]酮洛芬Ketone彩虹鱼Rainbowfish血浆Plasma<0.05[32]卡马西平Carbamazepine钝头鱼Cymoluteslecluse肌肉Muscle肝脏Liver脑Brain血浆Plasma1.81.51.67.1[18]卡马西平Carbamazepine罗非鱼Tilapiamossambica肌肉、肝脏、脑Muscle,liver,brain2.5~3.8[18]萘普生Naproxen彩虹鱼Rainbowfish肝脏、胆汁Liver,bile500~2300[33]三氯生Triclosan青鳉Medaka肌肉Muscle275.4[34]布洛芬Ibuprofen萘普生Naproxen双氯芬酸Diclofenac酮洛芬Ketone吉非罗齐Gemfibrozil彩虹鱼Rainbowfish血浆Plasma782411320421[35]布洛芬Ibuprofen黑头呆鱼Snakehead鲶鱼Catfish肌肉、鱼鳃、肝脏、血浆Muscle,gill,liver,plasma0.08~104[24]双氯芬酸Diclofenac布洛芬Ibuprofen卡马西平Carbamazepine比索洛尔Bisoprolol彩虹鱼Rainbowfish血浆、胆汁Plasma,bile0.01~7.7[7]双氯芬酸Diclofenac彩虹鱼Rainbowfish胆汁Bile509~657[2]双氯芬酸Diclofenac彩虹鱼Rainbowfish胆汁Bile320~950[36]双氯芬酸Diclofenac彩虹鱼Rainbowfish胆汁Bile320~950[36]布洛芬Ibuprofen心得安Propranolo炔诺酮Norethindrone钳鱼Channelfish肌肉Muscle0.950.5376.2[37]布洛芬Ibuprofen心得安Propranolo炔诺酮Norethindrone彩虹鱼Rainbowfish肌肉Muscle0.9383.50.53[37]氟西汀Fluoxetine青鳉鱼Medaka肌肉Muscle74~80[38]氟西汀Fluoxetine青鳉鱼Medaka肌肉Muscle肝脏Liver8.8~260330~3100[39]
一般情况下,PPCPs的logKow值越大,则相应的BAF值越高。双氯芬酸是1种亲脂化合物(lgKow=4.02;USEPA,2009)在鱼体内的累积能力很强,而布洛芬(logKow=3.79;USEPA,2009)是1种在自然环境中容易电离的弱酸性物质,不容易被生物体吸收,BAF值较小。Valdes等[23]将鱼分别暴露在100~1 000 μg·L-1的阿替洛尔和卡马西平下96 h,得到卡马西平的BAF为0.7~0.9 L·kg-1,阿替洛尔的BAF为0.13~0.08 L·kg-1。由于卡马西平的logKow为2.45,比阿替洛尔的logKow(0.16)要高,所以卡马西平的BAF要更大,累积能力也较强。
PPCPs中有相当一部分是可电离的,PPCPs的pKa值越高,则相应的BAF值越高。Wang等[12]将彩虹鱼暴露在7种PPCPs(卡马西平、萘普生、双氯芬酸、吉非罗齐、双酚A、氟西汀)下,控制暴露水体pH,使碱性物质主要以非离子形式存在,而酸性物质以离子形式存在,结果发现,pKa值较高的氟西汀、双酚A和卡马西平,相应的BAF值较高。而且同一浓度下,鱼对碱性化合物(卡马西平,氟西汀和双酚A)的生物可利用性比酸性化合物的高。此外,Ramirez等[9]检测到鱼体内的7种PPCPs,有6种是易电离的。
不同的PPCPs物理化学性质也有区别,直接影响PPCPs的生物有效性。Brown等[35]发现,在暴露于污水处理厂出水的鱼体内检测到双氯芬酸、吉布罗齐、酮洛芬和萘普生的BAFs具有显著差异。可能是因为这几种药物在水中的存在形式和功能团不同。
2.2 不同组织对累积的影响
PPCPs在鱼体内的累积浓度一般是胆汁>肝脏(脑)>鱼片。Brooks等[8]发现,氟西汀和舍曲林及其代谢产物在野生鱼体内的浓度分布为脑>肝脏>肌肉。Ramirez等[9]总结PPCPs在野生鱼肝脏中的浓度大于肌肉中的浓度。Liu等[25]测得罗红霉素在鱼体内BAF值为肝脏>胆汁>鱼鳃>肌肉。Steele等[28]得出甲羟孕酮在肌肉中的BAF为4.3,血浆BAF为8.9,脑组织BAF为10.7,肝脏BAF为32。
通常,疏水性污染物在脂肪含量较高的组织中更容易累积。大多数PPCPs具有亲脂性,肝脏脂肪含量比鱼片高,所以导致肝脏中的PPCPs比鱼片中的累积浓度高。Nallani等[24]测得炔诺酮在黑头呆鱼的肌肉、肝脏和胆汁中的累积含量分别为47~167 ng·g-1、75~411 ng·g-1和576~1 445 ng·g-1。他们认为,炔诺酮是亲脂性物质,使得它穿过内皮细胞层衬里的毛细血管,因此在肝脏和肾脏中的含量较高。
PPCPs在不同组织中的代谢差异也会影响其在组织中的累积。肝脏和胆汁是鱼对外源物质的重要代谢场所,所以PPCPs在肝脏和胆汁内累积较多。Statham等[41]认为,外源物质以及其代谢产物被分泌到胆汁内,使得胆汁内的PPCPs浓度比周围环境高几个数量级。Ramirez等[9]将鱼暴露于污水处理厂出水中,结果发现,与鱼片相比,PPCPs在肝脏中的浓度更高,检出率更大,种类更多。可能是因为肝脏是鱼对外源物质的主要代谢场所,而且肝脏中的脂肪含量比鱼片高。Gomez等[37]发现,心得安和布洛芬在鱼体内总的BAF小于肝脏中的BAF。而由于鱼鳃的清洁作用,左炔诺酮的BAF却没有这个差异。鱼体内肝脏的比重高于鱼鳃的比重,肝脏的重量增加了药物的代谢转移率,减小了药物在肝脏中的BAF。同时,肝脏中的蛋白质水平也比较高,增加了药物的代谢转移率。
2.3 鱼种类对PPCPs累积的影响
由于不同种类鱼的生理状态不同,因此PPCPs在鱼体内的累积与鱼的种类有关。疏水性物质的毒性与鱼体内的脂质含量有关。具有较高logKow的疏水性物质在富含脂质鱼体内的累积浓度较高。鱼体内含有各种阴离子、阳离子和中性粒子,使得外来极性PPCPs被吸收[36]。肌肉质地柔软的鱼比肌肉质地坚实的鱼具有更高的pH,因此,同一种PPCPs在不同种类鱼的肌肉中的累积能力有差异[42-43]。Wang等[12]发现PPCPs在彩虹鱼和似鳚镖鲈体内的BAF不同。极性易电离PPCPs在组织的分配和累积会随着鱼的pH和生理状态而不同[44]。Gomez等[37]发现心得安在彩虹鱼和鲶鱼体内的BAF有差异,但是差异<0.1,从生物学和生态学上看来,这差异与鱼的种类可能没有太大联系。
此外,年龄和性成熟,吸收和净化动力学,代谢和扩散速率,以及PPCPs的亲属关系都可能影响BAF值。Maruya等[17]发现安定在雄性双斑美大菱鲆鱼肝脏中的浓度高于雌性肝脏中的浓度,这说明鱼的性别影响PPCPs在鱼体内的累积。
2.4 不同的描述方法对累积的影响
虽然一直用logKow来描述物质的亲水性,预测PPCPs的累积潜能,但是同一种药物的logKow值随药物的浓度和pH变化而不同。这意味着用logKow来评估极性离子PPCPs的累积潜能具有局限性。Nakamura等[39]提出脂质体/水分配系数(Dlip-wat),能够比logKow更好地描述药物的生物累积性和毒性。Paterson等[38]研究了日本青鳉鱼对氟西汀的累积作用,测定的氟西汀BAF为74~80,其代谢产物诺氟沙星的BAF为117。他们也认为用Dlip-wat预测氟西汀在鱼体内的累积能力比单独用logKow预测的累积能力更强。
还有研究用参数PB:W(血浆中的浓度:水中的浓度)来预测药物在水生生物血浆中的累积能力[6]。Garcia等[18]发现卡马西平在鲶鱼和野生罗非鱼中的PB:W分别为1.4和2.5,表明卡马西平在鱼血浆中的浓度与水中的浓度相近。这与Fick等[20]的研究类似,他发现野生鱼的PB:W为0.8~4.2。Nallani等[24]也尝试用PB:W来表征布洛芬在鱼血浆中的累积,但是由于鱼的血浆量不足0.5~1 mL,无法得出PB:W。
有文献用两种方法来计算鱼对PPCPs的累积,1种是一级代谢动力学模型,BAFK是摄取速率k1和净化速率k2的比值;另一种是BAFS,指在鱼组织中测得的PPCPs浓度与暴露水体中的浓度之比。这2种方法从不同的角度出发,采用不同的计算方式,所得出的生物累积因子的数值大小不同。Garcia等[18]得出暴露于含有卡马西平的水体中鱼的BAFK为1.5~7.1,野生鱼BAFS为2.5~3.8。Al-Ansari等[45]研究了17-α-雌炔醇(EE2)在雄性金鱼体内的动态代谢与净化,发现EE2的BAFK为377,BAFS为0.011。Steele等[28]发现甲羟孕酮在鲤鱼体内的BAFk为10.9~37.8,BAFS为4.3~32.0。Nallani等[31]指出,炔诺酮在野生鱼体内的BAFK为2.6~40.8,BAFS为4.5~24.5。
3 PPCPs在鱼体内的代谢
尽管已经证明PPCPs能够被鱼吸收累积,并且对鱼产生潜在的毒性影响,但是这些研究的重点大多是PPCPs母体化合物的风险评价,而很少关注其代谢产物的潜在毒性。随着分析技术灵敏度的提高,有越来越多关于PPCPs代谢产物的研究。PPCPs的代谢产物是水环境污染的1个重要来源,在人体风险评价中也有重要的作用。目前对PPCPs代谢产物的确定和毒性研究还有很多不足。因此应该加强研究生物体内PPCPs的代谢及其代谢产物,尤其是PPCPs在鱼体内的代谢。
3.1 PPCPs的代谢机制
同其他进入环境中的污染物一样,PPCPs被一系列的氧化酶和共轭酶降解从而使环境不受其影响。与人体类似,PPCPs在鱼体内通常转换成极性和水溶性形式的产物来促进代谢和排出。这个过程一般包括两个阶段:第一阶段,其中涉及氧化,还原,或水解;第二阶段,是结合反应,可以使有毒化合物某些功能基团失活,水溶性增加,很快由肾脏排除,是1种解毒反应。细胞色素P450(CYP450酶调制)在这个阶段起着重要的作用。P450酶系是1个庞大的超家族(superfamily),种类众多,是微粒体混合功能氧化酶系中最重要的药物代谢酶,能参与许多生物异源物质的生物转化,并能被诱导。P450酶类在生物体内主要起2作用,一些P450酶类在固醇类、脂肪酸及前列腺素等内源性物质的生物合成及生物降解中起作用,另一些P450酶类则在生物转化以消除外源性物质中起关键性作用。
抗生素的代谢转化取决于其化学性质,功能基团,原子结构反应。因此,各种类型的抗生素在机体中发生不同的代谢反应,产生不同类型的代谢产物[46]。最近的1项研究报告[47]具体鉴定了磺胺类药物的代谢产物,在尿液样本确定了10种不同的化合物,包括5-羟基磺胺嘧啶,4-羟基磺胺嘧啶,5-羟基磺胺嘧啶葡萄糖醛酸和5-羟基磺胺嘧啶硫酸盐。研究结果表明,磺胺类药物在人类内代谢主要包括酰胺的羟基化,葡糖醛酸共轭化,乙酰化作用。
3.2 鱼对PPCPs的代谢动力学研究
许多PPCPs在鱼体内的代谢途径和代谢产物是未知的,而在人体和哺乳动物的代谢研究比较透彻,因此可以将这些数据用于预测PPCPs在鱼体内的代谢产物[19]。与哺乳动物相比,药物代谢动力学描述水生生物对PPCPs的摄取和净化的研究非常有限。药物代谢动力学涉及很多模型。Paterson等[38]用青鳉鱼暴露在0.64 μg·L-1的氟西汀水环境中,用药物代谢动力学分析了氟西汀在鱼体内的代谢和净化。样品的平均浓度(μg·L-1,湿重)通常用来确定目标物质氟西汀的净化速率常数。此率的一般计算常数和相应的半衰期(T1/2)遵循一级反应动力学。其方程式如下[48]:
In[Cf(t)]=a(t)+b
(1)
k2=∣a∣
(2)
T1/2=In(2)/k2
(3)
a, b为常数,Cf(t)指在t时刻测得鱼体内氟西汀的浓度,k2是指氟西汀的净化速率。Paterson等[38]实验得出氟西汀的半衰期为9.4 d,并且在肝脏和脑组织中均检测出氟西汀的代谢产物诺氟西汀。Wang等[29]也用一级代谢模型研究了蚊子鱼对PPCPs的摄取与净化。结果表明,苯海拉明可在鱼体内达到82 ng·g-1的累积,而咖啡因会平衡周围的水域,在鱼体内持续几天时间。双氯芬酸和吉非罗齐没有在鱼体内累积,暗示可能有其他机制起作用。
鱼鳃和肝脏的体外代谢转化可以用累积模型来描述[49]。Gomez等[37]用一级动力学来假定每个反应,从而测定母体化合物的损失。用测得的残余母化合物浓度和时间来作图,得出以下对数方程:μmols损失=截距×e-kt。K是一级损失常数,t是时间。结果发现高代谢转化率的鱼片组织具有更高的固有清除率。
3.3 胆汁对PPCPs的解毒模式
目前用胆汁来研究水环境中PPCPs代谢情况的文章较多[2, 7, 19, 30, 36]。用胆汁来代替肌肉或者其他器官更合适测定易于代谢和排除的PPCPs。Statham等[41]认为,外源物质及其代谢产物被分泌到胆汁内,使得胆汁内的PPCPs浓度比周围环境高几个数量级,可以进行生物转化的分析和比较。由于胆汁排泄是环境污染物的1个重要去除机制,而且可以对污染物进行累积,从而胆汁有助于研究水环境中外来污染物对水生生物尤其是鱼类的暴露和摄取情况。水溶性污染物的生物消除主要是通过羟基化或者代谢成更多水溶性分子的方式促进排泄。葡萄糖醛酸化是共轭过程中导致环境污染物在胆汁中浓缩的重要原因。辅助酶水解可以破坏共轭化合物,使胆汁中的母体PPCPs更容易被检测。因此,检测胆汁中PPCPs的代谢产物可以作为研究鱼对PPCPs的摄取和代谢的生物标志物[30]。
已有研究将胆汁作为生物标志物来研究易代谢的PPCPs,如雌激素[15, 50]。Lahti等[19]发现双氯芬酸、萘普生和布洛芬及其经过第一阶段的代谢产物,在胆汁进行第二阶段的结合反应,被酶促水解。在未暴露的虹鳟鱼胆汁中掺入1-b-O-acyl葡萄糖醛酸形态的双氯芬酸、萘普生、布洛芬,然后用β-葡萄糖醛酸酶和芳基硫酸酯酶进行处理。进行色谱分析,只检测到萘普生(40~1 900 ng·mL-1),双氯芬酸(10~4 000 ng·mL-1)和布洛芬(33~450 ng·mL-1),以及羟基双氯芬酸(210~4 300 ng·mL-1)。Lahti等[19]还指出,胆汁的多少及其含有的物质取决于鱼的营养状态,代谢过程中产生的生理差异与个体的排除能力对PPCPs的解毒很重要。
Kallio等[36]将彩虹鱼暴露在1.9 μg·L-1的水中,在胆汁中检测到双氯芬酸及其代谢产物4-羟基双氯芬酸和5-羟基双氯芬酸,第一阶段中的羟基酰基葡萄糖醛酸双氯芬酸是双氯芬酸的主要代谢产物。双氯芬酸及其代谢物的总浓度为570~1 670 μg·L-1。Togunde等[30]发现氟西汀可能经过第一阶段和第二阶段代谢成为诺氟西汀。Brozinski等[33]将萘普生暴露于彩虹鱼,发现主要代谢产物是酰基葡糖苷酸萘普生和6-O-二甲基萘普生。Schebb等[34]发现三氯生在青鳉体内主要被氧化产生羟基化代谢产物,然后经过第二阶段产生硫酸盐和葡萄糖醛酸结合物。Mehinto等[2]用彩虹鱼进行双氯芬酸的暴露实验,检测到胆汁中含有羟基双氯芬酸(0.5 μg·L-1)、双氯酚酸甲酯和羟基双氯芬酸葡糖苷酸。
在鱼体内,外源物质可以经过第一阶段反应后再进行第二阶段结合反应,也可以直接进行第二阶段的共轭反应[51]。有研究表明,消炎药主要在彩虹鱼的第二阶段进行结合反应[7, 33, 36, 52]。Lahti等[7]研究彩虹鱼对消炎药的吸收与摄取,在胆汁内检测到了双氯芬酸的2种一阶段代谢产物和7种第二阶段代谢产物:酰基葡糖苷酸4-羟基双氯芬酸、5-羟基双氯芬酸、葡糖苷酸酰基的双氯芬酸、硫酸共轭4-羟基双氯芬酸等;检测到萘普生的代谢产物有萘普生杂质A(第一阶段)和酰基葡萄糖酸酐萘普生;布洛芬的代谢产物有第一阶段羟基布洛芬和羰基布洛芬,第二阶段产物有几种酰基葡萄糖酸酐。这与一般认为葡糖酸酐是双氯芬酸的解毒,但是酰基葡糖酸酐是潜在的蛋白质反应性代谢物的观点相吻合[53]。 Brozinski等[26]研究了布洛芬的胆汁代谢与剂量的关系,在彩虹鱼的胆汁中检测到了第一阶段的代谢产物2-羟基布洛芬和3-羟基布洛芬,而且发现暴露浓度越低,胆汁的BAF越大,可能是因为高浓度的布洛芬暴露,影响了肝胆分泌胆汁的能力。在鱼体内,硫磺酸结合反应是布洛芬代谢的1个重要途径,而在鲑鱼中,羟基布洛芬和葡萄糖醛酸布洛芬进一步与牛磺酸结合,实现布洛芬的代谢。Liu等[25]在胆汁中检测到了17种罗红霉素的代谢产物,总结了罗红霉素在胆汁中可能的4种代谢途径:脱甲基、O-烷基化、红霉支糖降解和异构化作用。证明了环境中μg·L-1的罗红霉素可以被鱼类摄取并且代谢。
PPCPs主要在肝脏进行生物转化反应,然后将代谢产物经过胆汁排泄到小肠,但是代谢产物可以在肠道被重吸收,延长母体化合物的半衰期。Hoeger等[54]证明双氯芬酸及其在肝脏中形成的代谢物被排泄到鱼的胆汁中,这些化合物可以通过重新进入肝肠导致肠道损坏,这可能是由双氯芬酸的活性代谢物引起的,特别是葡萄糖醛酸结合物。
4 展望
尽管已有少量研究考察了PPCPs在鱼体内的吸收和分布,但是鱼对PPCPs的摄取机制以及影响因素还不明确。PPCPs在鱼体内的累积受到多种因素的影响,包括环境因素(如水体pH),鱼的自身生理状态,PPCPs的性质等,然而目前研究还相当贫乏。PPCPs的代谢途径,尤其是在胆汁内代谢的数据还很缺乏。因此,今后的研究应在以下几个方面进行更多深层次探讨。首先,加强研究单一生物体对PPCPs的摄取途径和具有不同特点的食物网的摄取途。其次,需要进一步讨论PPCPs在鱼体内累积的影响因素。再次,需加强研究PPCPs的代谢机制和代谢产物,尤其是胆汁的应用。
[1] Daughton C G, Ternes T A. Pharmaceuticals and personal care products in the environment: Agents of subtle change? [J]. Environmental Health Perspectives, 1999, 107: 907-938
[2] Mehinto A C, Hill E M, Tyler C R. Uptake and biological effects of environmentally relevant concentrations of the nonsteroidal anti-inflammatory pharmaceutical diclofenac in rainbow trout (Oncorhynchus mykiss) [J]. Environmental Science & Technology, 2010, 44(6): 2176-2182
[3] Pruden A. Balancing water sustainability and public health goals in the face of growing concerns about antibiotic resistance [J]. Environmental Science & Technology, 2014, 48(1): 5-14
[4] Anna W, Daniel C. Effects of lipid-lowering pharmaceuticals bezafibrate and clofibric acid on lipid metabolism in fathead minnow (Pimephales promelas) [J]. Environmental Toxicology and Chemistry, 2009, 28(12): 2648-2656
[5] Barber L B, Brown G K, Nettesheim T G, et al. Effects of biologically-active chemical mixtures on fish in a wastewater-impacted urban stream [J]. Science of the Total Environment, 2011, 409(22): 4720-4728
[6] Huggett D B, Cook J C, Ericson J F, et al. A theoretical model for utilizing mammalian pharmacology and safety data to prioritize potential impacts of human pharmaceuticals to fish [J]. Human and Ecological Risk Assessment, 2003, 9(7): 1789-1799
[7] Lahti M, Brozinski J M, Jylha A, et al. Uptake from water, biotransformation, and biliary excretion of pharmaceuticals by rainbow trout [J]. Environmental Toxicology and Chemistry, 2011, 30(6): 1403-1411
[8] Brooks B W, Chambliss C K, Stanley J K, et al. Determination of select antidepressants in fish from an effluent-dominated stream [J]. Environmental Toxicology and Chemistry, 2005, 24(2): 464-469
[9] Ramirez A J, Brain R A, Usenko S, et al. Occurrence of pharmaceuticals and personal care products in fish: Results of a national pilot study in the United States [J]. Environmental Toxicology and Chemistry, 2009, 28(12): 2587-2597
[10] Al-Ansari A M, Saleem A, Kimpe L E, et al. Bioaccumulation of the pharmaceutical 17alpha-ethinylestradiol in shorthead redhorse suckers (Moxostoma macrolepidotum) from the St. Clair River, Canada [J]. Environmental Pollution, 2010, 158(8): 2566-2571
[11] Schultz M M, Furlong E T, Kolpin D W, et al. Antidepressant pharmaceuticals in two US effluent-impacted streams: Occurrence and fate in water and sediment, and selective uptake in fish neural tissue [J]. Environmental Science & Technology, 2010, 44(6): 1918-1925
[12] Wang S, Oakes K D, Bragg L M, et al. Validation and use of in vivo solid phase micro-extraction (SPME) for the detection of emerging contaminants in fish [J]. Chemosphere, 2011, 85(9): 1472-1480
[13] Subedi B, Du B, Chambliss C K, et al. Occurrence of pharmaceuticals and personal care products in German fish tissue: A national study [J]. Environmental Science & Technology, 2012, 46(16): 9047-9054
[14] Wang J, Gardinali P R. Analysis of selected pharmaceuticals in fish and the fresh water bodies directly affected by reclaimed water using liquid chromatography-tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2012, 404(9): 2711-2720
[15] Yang J, Li H, Ran Y, et al. Distribution and bioconcentration of endocrine disrupting chemicals in surface water and fish bile of the Pearl River Delta, South China [J]. Chemosphere, 2014, 107: 439-446
[16] Gelsleichter J, Szabo N J. Uptake of human pharmaceuticals in bull sharks (Carcharhinus leucas) inhabiting a wastewater-impacted river [J]. Science of the Total Environment, 2013, 456-457: 196-201
[17] Maruya K A, Vidal-Dorsch D E, Bay S M, et al. Organic contaminants of emerging concern in sediments and flatfish collected near outfalls discharging treated wastewater effluent to the Southern California Bight [J]. Environmental Toxicology and Chemistry, 2012, 31(12): 2683-2691
[18] Garcia S N, Foster M, Constantine L A, et al. Field and laboratory fish tissue accumulation of the anti-convulsant drug carbamazepine [J]. Ecotoxicology and Environmental Safety, 2012, 84: 207-211
[19] Lahti M, Brozinski J M, Segner H, et al. Bioavailability of pharmaceuticals in waters close to wastewater treatment plants: Use of fish bile for exposure assessment [J]. Environmental Toxicology and Chemistry, 2012, 31(8): 1831-1837
[20] Fick J, Lindberg R H, Parkkonen J, et al. Therapeutic levels of levonorgestrel detected in blood plasma of fish: Results from screening rainbow trout exposed to treated sewage effluents [J]. Environmental Science & Technology, 2010, 44(7): 2661-2666
[21] Rostkowski P, Horwood J, Shears J A, et al. Bioassay-directed identification of novel antiandrogenic compounds in bile of fish exposed to wastewater effluents [J]. Environmental Science & Technology, 2011, 45(24): 10660-10667
[22] Mackay D F A. Bioaccumulation of persistent organic chemicals: Mechanisms and models [J]. Environmental Pollution, 2000, 110: 375-391
[23] Valdes M E, Ame M V, Bistoni Mde L, et al. Occurrence and bioaccumulation of pharmaceuticals in a fish species inhabiting the Suquia River basin (Cordoba, Argentina) [J]. Science of the Total Environment, 2014, 472: 389-396
[24] Nallani G C, Paulos P M, Constantine L A, et al. Bioconcentration of ibuprofen in fathead minnow (Pimephales promelas) and channel catfish (Ictalurus punctatus) [J]. Chemosphere, 2011, 84(10): 1371-1377
[25] Liu J, Lu G, Wang Y, et al. Bioconcentration, metabolism, and biomarker responses in freshwater fish Carassius auratus exposed to roxithromycin [J]. Chemosphere, 2014, 99: 102-108
[26] Brozinski J M, Lahti M, Oikari A, et al. Identification and dose dependency of ibuprofen biliary metabolites in rainbow trout [J]. Chemosphere, 2013, 93(9): 1789-1795
[27] Steinbach C, Fedorova G, Prokes M, et al. Toxic effects, bioconcentration and depuration of verapamil in the early life stages of common carp (Cyprinus carpio L.) [J]. Science of the Total Environment, 2013, 461-462: 198-206
[28] Steele W B, Garcia S N, Huggett D B, et al. Tissue-specific bioconcentration of the synthetic steroid hormone medroxyprogesterone acetate in the common carp (Cyprinus carpio) [J]. Environmental Toxicology and Pharmacology, 2013, 36(3): 1120-1126
[29] Wang J, Gardinali P R. Uptake and depuration of pharmaceuticals in reclaimed water by mosquito fish (Gambusia holbrooki): A worst-case, multiple-exposure scenario [J]. Environmental Toxicology and Chemistry, 2013, 32(8): 1752-1758
[30] Togunde O P, Oakes K D, Servos M R, et al. Determination of pharmaceutical residues in fish bile by solid-phase microextraction couple with liquid chromatography-tandem mass spectrometry (LC/MS/MS) [J]. Environmental Science & Technology, 2012, 46(10): 5302-5309
[31] Nallani G C, Paulos P M, Venables B J, et al. Tissue-specific uptake and bioconcentration of the oral contraceptive norethindrone in two freshwater fishes [J]. Archives of Environmental Contamination and Toxicology, 2012, 62(2): 306-313
[32] Cuklev F, Fick J, Cvijovic M, et al. Does ketoprofen or diclofenac pose the lowest risk to fish? [J]. Journal of Hazardous Materials, 2012, 229-230: 100-106
[33] Brozinski J M, Lahti M, Oikari A, et al. Detection of naproxen and its metabolites in fish bile following intraperitoneal and aqueous exposure [J]. Environmental Science and Pollution Research International, 2011, 18(5): 811-818
[34] Schebb N H, Flores I, Kurobe T, et al. Bioconcentration, metabolism and excretion of triclocarban in larval Qurt medaka (Oryzias latipes) [J]. Aquatic Toxicology, 2011, 105(3-4): 448-454
[35] Brown J N, Paxeus N, Forlin L, et al. Variations in bioconcentration of human pharmaceuticals from sewage effluents into fish blood plasma [J]. Environmental Toxicology and Pharmacology, 2007, 24(3): 267-274
[36] Kallio J M, Lahti M, Oikari A, et al. Metabolites of the aquatic pollutant diclofenac infish bile [J]. Environmental Science & Technology, 2010, 44(19): 7213-7219
[37] Gomez C F, Constantine L, Huggett D B. The influence of gill and liver metabolism on the predicted bioconcentration of three pharmaceuticals in fish [J]. Chemosphere, 2010, 81(10): 1189-1195
[38] Paterson G, Metcalfe C D. Uptake and depuration of the anti-depressant fluoxetine by the Japanese medaka (Oryzias latipes) [J]. Chemosphere, 2008, 74(1): 125-130
[39] Nakamura Y, Yamamoto H, Sekizawa J, et al. The effects of pH on fluoxetine in Japanese medaka (Oryzias latipes): Acute toxicity in fish larvae and bioaccumulation in juvenile fish [J]. Chemosphere, 2008, 70(5): 865-873
[40] Halling-Sorensen B, Nielsen S N, Lanzky P F, et al. Occurrence, fate and effects of pharmaceutical substances in the environment-A review [J]. Chemosphere, 1998, 36(2): 357-394
[41] Statham C N. Bioconcentration of xenobiotics in trout bile: A proposed monitoring aid for some water borne chemicals [J]. Science, 1976, 193: 1
[42] Jahnke A, Mayer P, Broman D, et al. Possibilities and limitations of equilibrium sampling using polydimethylsiloxane in fish tissue [J]. Chemosphere, 2009, 77(6): 764-770
[43] Zhang X, Oakes K D, Cui S F, et al. Tissue-Specific in vivo bioconcentration of pharmaceuticals in rainbow trout (Oncorhynchus mykiss) using space-resolved solid-phase microextraction [J]. Environmental Science & Technology, 2010, 44(9): 3417-3422
[44] Valenti T W, Perez-Hurtado P, Chambliss C K, et al. Aquatic toxicity of sertraline to Pimephales promelas at environmentally relevant surface water pH [J]. Environmental Toxicology and Chemistry, 2009, 28(12): 2685-2694
[45] Al-Ansari A M, Atkinson S K, Doyle J R, et al. Dynamics of uptake and elimination of 17alpha-ethinylestradiol in male goldfish (Carassius auratus) [J]. Aquatic Toxicology, 2013, 132-133: 134-140
[46] Manzetti S, Ghisi R. The environmental release and fate of antibiotics [J]. Marine Pollution Bulletin, 2014, 79(1-2): 7-15
[47] Garcia-Galan M J, Diaz-Cruz M S, Barcelo D. Identification and determination of metabolites and degradation products of sulfonamide antibiotics [J]. Trac-Trends in Analytical Chemistry, 2008, 27(11): 1008-1022
[48] Barron M G, Stehly G R, Hayton W L. Pharmacokinetic modeling in aquatic animals I. models and concepts [J]. Aquatic Toxicology, 1990, 18(2): 61-85
[49] Cowan-Ellsberry C E, Dyer S D, Erhardt S, et al. Approach for extrapolating in vitro metabolism data to refine bioconcentration factor estimates [J]. Chemosphere, 2008, 70(10): 1804-1817
[50] Vermeirssen E L M, Korner O, Schonenberger R, et al. Characterization of environmental estrogens in river water using a three pronged approach: Active and passive water sampling and the analysis of accumulated estrogens in the bile of caged fish [J]. Environmental Science & Technology, 2005, 39(21): 8191-8198
[51] Celiz M D, Tso J, Aga D S. Pharmaceutical metabolites in the environment: Analytical challenges and ecological risks [J]. Environmental Toxicology and Chemistry, 2009, 28(12): 2473-2484
[52] Oikari A. Caging techniques for field exposures of fish to chemical contaminants [J]. Aquatic Toxicology, 2006, 78(4): 370-381
[53] Boelsterli U A. Diclofenac-induced liver injury: A paradigm of idiosyncratic drug toxicity [J]. Toxicology and Applied Pharmacology, 2003, 192(3): 307-322
[54] Hoeger B, Dietrich D R, Schmid D, et al. Distribution of intraperitoneally injected diclofenac in brown trout (Salmo trutta f. fario) [J]. Ecotoxicology and Environmental Safety, 2008, 71(2): 412-418
◆
The Bioaccumulation and Metabolism of Pharmaceuticals and Personal Care Products in Fish
Hu Junjian, Hu Xialin*, Yin Daqiang
State Key Laboratory of Pollution Control and Resources Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China
26 October 2014 accepted 21 November 2014
Pharmaceuticals and personal care products (PPCPs) are a class of emerging contaminants, and occured widely in aquatic environment at constant and low concentrations. PPCPs show a potential risk to the aquatic ecosystem and have attracted extensive concerns. Bioaccumulation and metabolism of PPCPs in fish play an important role in hazard and ecological risk assessment of PPCPs. In this paper, we summarized bioaccumulation of PPCPs in fish, and factors that influence the bioaccumulation, such as chemico-physical properties, tissue-specific differences, species of fish, as well as methods to derive bioconcentration factor. The mechanisms in bioaccumulation for PPCPs in fish were overviewed with focus on the introduction of the detoxification and occurrences of metabolic intermediate products of PPCPs in fish bile. Also, the importance of using fish bile for assessing bioaccumulation and their metaboliam were discussed since it is vital on the study of PPCPs in fish. At the end, we prospect for the future research challenges in the field.
PPCPs; fish; bioaccumulation; metabolism; bile
国家自然科学基金(21277100;21437004)
胡君剑(1992-),女,硕士,研究方向为PPCPs的水生生态毒理学,E-mail: 916526691@qq.com;
*通讯作者(Corresponding author), E-mail: xlhu@tongji.edu.cn
10.7524/AJE.1673-5897.20141026001
2014-10-26 录用日期:2014-11-21
1673-5897(2015)2-89-11
X171.5
A
胡霞林(1979-),女,副教授,硕士生导师,主要研究方向为环境有机污染物的生物有效性。
胡君剑, 胡霞林, 尹大强. 药品与个人护理品在鱼体中的累积及代谢研究进展[J]. 生态毒理学报, 2015, 10(2): 89-99
Hu J J, Hu X L, Yin D Q. The bioaccumulation and metabolism of pharmaceuticals and personal care products in fish [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 89-99 (in Chinese)

