黄连中阿魏酸对小檗碱在HepG2细胞中降糖活性的影响
陈红英,李学刚,叶小利,徐建蓉
(1.西南科技大学生命科学与工程学院,四川绵阳 621010;2. 西南大学药学院黄连研究开发中心,重庆 400715)
黄连中阿魏酸对小檗碱在HepG2细胞中降糖活性的影响
陈红英1,李学刚2,叶小利2,徐建蓉1
(1.西南科技大学生命科学与工程学院,四川绵阳 621010;2. 西南大学药学院黄连研究开发中心,重庆 400715)
为了考察黄连中酸性成分对小檗碱降糖作用的影响,用柱层析法分离鉴定酸性成分,以HepG2细胞建立高糖细胞模型,用MTT法测定细胞的生长,细胞消耗的葡萄糖用试剂盒检测。结果从酸性组分中分离出阿魏酸,其结构经光谱与色谱确证。阿魏酸在高效液相色谱图中有明显的信号,与小檗碱在黄连浸膏中的质量比约为32∶1。细胞实验中,含小檗碱的培养液中加入阿魏酸后,细胞存活率和细胞消耗的葡萄糖明显增加;在含36mg/L小檗碱的培养液中加入64mg/L阿魏酸,可使细胞的存活率上升到69%,细胞消耗的葡萄糖增加29.4%。此结果说明黄连中酸性成分阿魏酸能促进小檗碱处理的HepG2细胞对葡萄糖的吸收生长,并降低小檗碱对HepG2细胞的毒性,显示一定的协同增效作用。
黄连,阿魏酸,小檗碱,HepG2细胞,协同增效
黄连(CoptischinensisFranch.)为中国常见的一种中药材,其化学成分有异喹啉生物碱小檗碱、黄连碱、巴马汀、药根碱及部分酸性成分阿魏酸、绿原酸等,其中小檗碱为主要化学成分,含量约10%[1]。黄连有降糖作用,在古今很多中药降糖方剂均含有黄连[2-3]。普遍认为,黄连降糖活性成分为小檗碱[4]。但有报道黄连浸膏或水煎液的降糖活性高于同等剂量的小檗碱[5]。事实上,黄连降糖方剂在临床上也多以煎煮的方式用药。在此过程中,除小檗碱外,其它成分也会溶出,其中部分酸性成分阿魏酸和绿原酸也有降糖作用的报道[6]。在临床中药的配伍中,对药是中医经常使用的药物,有很多酸碱对药的配伍案例如大黄与附子、附子与甘草,甘草皂苷配伍小檗碱,麻黄和甘草,黄芩和黄连等[7]。为初步考察黄连中酸性组分对小檗碱降糖作用的影响,特别是其中高含量酸性成分的影响,酸性组分通过层析法被进一步分离纯化,酸性成分与小檗碱之间的相互作用用体外细胞实验来进行。
1 材料与方法
1.1 材料与仪器
人肝癌胚胎瘤细胞HepG2 购自中国典型培养物保藏中心;黄连 重庆石柱黄连GAP种植基地,由西南大学药学院袁吕江教授鉴定,样品保存在西南大学黄连研究开发中心标本馆,样品编号:20130317。
胎牛血清和RPMI 1640培养基 购自Gibco公司;四甲基偶氮唑盐(MTT)和胰蛋白酶 购自Sigma公司;葡萄糖酶法测定试剂盒 购自南京建成生物工程研究所;盐酸小檗碱、黄连碱、巴马汀、表小檗碱、药根碱、木兰碱和反式阿魏酸对照品 购自成都曼斯特公司,纯度均为98%;格兰地新 自制,结构已经NMR、MS、IR确证;盐酸二甲双胍(纯度98%) 购自南京泽朗植提;色谱甲醇、乙腈;其它试剂均为分析纯。
LC-20A液相色谱仪、二极管阵列检测器(DAD) 日本岛津公司;Hypersil BDS C18色谱柱(5μm,4.6mm×250mm) 大连依利特科学仪器有限公司;Elix/Rios纯水系统仪 Millipore公司;JJ-CJ-2F洁净工作台 苏州市金净净化设备公司;ZEISSAxiovert40 CFL倒置显微镜 深圳九天实业;AM-300M超导核磁共振仪 Bruker公司;Thermo 6500二氧化碳培养箱 上海旦鼎国际贸易公司;Eos BravoW全自动生化分析仪 上海安泰分析仪器厂;BioTek ELX800酶标仪 上海天呈科技有限公司;超声波清洗器 江苏昆山。
1.2 实验方法
1.2.1 酚酸性成分的分离与结构鉴定 黄连药材5公斤粉粹后过20目筛,用3倍量70%乙醇浸泡三次,浸泡液合并浓缩至干得浸膏。浸膏用甲醇溶解后,用活性炭进行吸附脱色。脱色液用聚酰胺柱层析,pH=4的冰醋酸水洗脱,分部收集洗脱液,TLC检测。
1.2.2 HPLC分析
1.2.2.1 定性分析 流动相:乙腈-50mmol/L磷酸二氢钾溶液(50∶50),其中含15mmol/L十二烷基磺酸钠,磷酸调节pH为4.0;流速:1.0mL/min;柱温:30℃;进样量:20μL;检测波长:254nm;标准溶液:表小檗碱,巴马汀,药根碱,黄连碱,木兰碱,格兰地新,分别配制成5mg/L的甲醇溶液;小檗碱,配成10mg/L的甲醇溶液;阿魏酸,配成100mg/L的甲醇溶液。
1.2.2.2 定量分析 酸性成分阿魏酸的含量测定:对照溶液的制备:称取阿魏酸对照品20mg,精密称定,用甲醇∶甲酸(5∶95)溶解并制成0.5mg/mL的储备溶液。用时用70%甲醇稀释成相应的倍数。临用前用0.45μm滤膜过滤。
样品溶液的制备:取黄连药材5g,粉碎后过20目筛,精密称取0.2g,加入甲醇∶甲酸(5∶95)50mL,超声加热(70℃)提取30min,放冷,补足损失的甲醇,摇匀,取上清液过0.45μm滤膜,取续滤液2mL,用甲醇∶甲酸(5∶95)稀释至10mL。
流动相由甲醇∶2%冰醋酸(20∶80)组成;流速为1mL/min;柱温为30℃;检测波长为322nm;HPLC-DAD在线收集紫外光谱的范围为200~400nm;进样量为10μL。
黄连中小檗碱的含量测定:小檗碱对照溶液的制备:取盐酸小檗碱对照品10mg,精密称定,用甲醇溶解并定容至100mL,制成100mg/L的储备溶液。临用前用0.45μm滤膜过滤,取续滤液作为供试溶液。
小檗碱的含量测定方法按照中国药典2010版第一部中黄连的含量测定方法进行。
1.2.3 细胞实验
1.2.3.1 细胞培养 用含10%胎牛血清的RPMI 1640培养液培养HepG2细胞,CO2浓度为5%,并保持饱和湿度。用0.25%的胰酶消化增殖状况良好的细胞并进行传代。
1.2.3.2 样品溶液制备 小檗碱、阿魏酸、MTT均用pH7的磷酸缓冲液配制,滤过除菌。使用时与不含血清的培养基按1∶9混溶。阿魏酸最终质量浓度为2、4、8、16、32、64mg/L溶液。小檗碱浓度参考实验的半数抑制浓度,最终质量浓度为1,36,72mg/L溶液。二甲双胍最终质量浓度为1mg/L溶液。
1.2.3.3 细胞降糖实验 将消化并稀释好的HepG2细胞加入到96孔板中,按照文献方法[8]建立高糖细胞模型,进行体外降糖实验。待细胞铺满率达80%,每孔换用250μL含药或不含药的培养液。二甲双胍作为阳性对照。对照组和实验组均重复三次。24h后利用酶法在505nm处用生化分析仪检测培养液中葡萄糖剩余量。
1.2.3.4 MTT实验 细胞降糖实验完成后,按照文献方法[9],在HepG2细胞葡萄糖消耗实验结束时将待测培养液移出,换上含5mg/mL MTT的培养基,继续孵育4h,然后将培养液倒尽,吸干,每孔再加入200μL二甲亚砜,混匀后置酶标仪上于490nm处测吸光度。吸光度值A与活细胞数成正比关系。细胞存活率计算公式为:
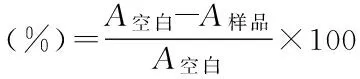
2 结果与讨论
2.1 酚酸性成分的分离与鉴定
浸膏用活性炭脱色后,生物碱被吸附,得到酸性组分。酸性组分用聚酰胺柱层析后得到两个化合物1(147mg),2(7mg)。它们的结构鉴定分别为:
1,白色针晶,1HNMR(300Hz,CD3OD)δ:6.32(d,J=15.9Hz,H-2),7.52(d,J=15.9Hz,H-3),6.78(d,J=8.1Hz,H-3′),7.02(d,J=8.1Hz,H-4′),7.13(H-6′),3.81(s,-OCH3,);13CNMR(75MHz,CD3OD)δ:168.1(-COOH),149.2(C-2′),148.1(C-1′),144.6(C-3),125.9(C-5′),122.9(C-6′),115.8(C-2),115.7(C-3′),111.3(C-6′),55.8(-OCH3)。1HNMR与13CNMR数据与文献[10]中反式阿魏酸的一致。
2,白色粉末,1HNMR(300Hz,CD3OD)δ:6.74(1H,d,J=7.5Hz,H-9),6.59(2H,s,H-8,H-3),4.10(1H,brd,J=12.9Hz,H-6a),3.83(3H,s,10-OCH3),3.81(3H,s,2-OCH3),3.59(1H,m,H-5),3.47(1H,m,H-5),3.32(3H,m,N-CH3),3.24(1H,m,H-4),3.08(1H,brd,J=11.7Hz,H-7),2.92(s,3H,N-CH3),2.78(1H,m,H-4),2.64(1H,brt,J=12.9Hz,H-7);13CNMR(CD3OD,75Hz):24.7(C-4),31.8(C-7),43.4(N-CH3),53.8(N-CH3),56.0(10-OCH3),56.3(2-OCH3),62.5(C-5),71.3(C-6a),109.4(C-3),110.5(C-9),115.8(C-3a),117.0(C-8),121.0(C-6b),123.5(C-11a),123.6(C-11b),126.0(C-7a),149.8(C-11),150.8(C-1),151.8(C-10),153.2(C-2)。1HNMR与13CNMR数据与木兰碱[11]一致。
从酸性组分中得到大量阿魏酸,说明它在黄连中的含量较高。而木兰碱从酸性组分中分离出,一方面其本身是多羟基生物碱,极性较大的原因,另一方面,可能活性炭对这种极性相对较强的阿朴菲型生物碱吸附力较弱。
2.2 HPLC分析与讨论
2.2.1 定性分析 黄连的HPLC色谱图见图1,为了进一步了解阿魏酸在黄连中的含量,在查阅文献及实验前期分离工作的基础上,对黄连中主要生物碱及阿魏酸的混合标准溶液进行色谱分析,结果见图1A。图1B为样品色谱图。根据加样回收实验及每个信号的色谱行为,5个主要色谱峰分别判定为5个异喹啉型生物碱小檗碱、表小檗碱、药根碱、黄连碱、巴马汀(图1中1~5号峰);6、7号峰为酚性生物碱格兰地新和木兰碱。8号峰与标准反式阿魏酸的紫外及保留时间一致,加样实验的色谱行为也一致,判定为阿魏酸。色谱图中的8个色谱峰基本上得到了指认。其中7个生物碱的色谱峰及紫外吸收均较强,而阿魏酸的相关信号在样品色谱图中则相对弱得多。虽然文献报道黄连中还含有绿原酸,但与标准绿原酸色谱图比对,发现在相应的位置并无信号,可能原因与绿原酸含量少或在相应色谱条件下保留时间短有关。

图1 对照溶液(A)和黄连浸膏(B)的HPLCFig.1 HPLC of contrast solution and Coptis chinensis Franch.extracts注:1:小檗碱;2:巴马汀;3:黄连碱;4:表小檗碱; 5:药根碱;6:格兰地新;7:木兰碱;8:阿魏酸。
2.2.2 定量分析 为考虑阿魏酸对小檗碱细胞降糖的影响,分别测定了黄连中阿魏酸及小檗碱的含量。阿魏酸HPLC分析结果见图2。在实验条件下,阿魏酸峰形对称,塔板数为3750,分离度较好。外标法测得黄连中阿魏酸的含量为0.25±0.033mg/g;以峰面积对进样浓度进行线性回归,线性方程为y=3750 x+174500(R2=0.9764),在2.2~13.1mg/L内具有良好线性关系。样品的平均回收率为97%±2.35%。保留时间RSD均小于0.5%,色谱峰的峰面积RSD均小于1.5%。样品溶液在12h内稳定。目前尚无黄连中阿魏酸含量的相关文献报道。
因阿魏酸溶液易氧化,随着光照时间及存放时间的延长,反式阿魏酸变为顺式阿魏酸的几率增高。样品溶液的色谱图(图2)中1号峰后的小峰经二级阵列管检测器检测,与顺式阿魏酸的紫外图谱一致,两峰的峰面积之比约为16∶1。进行阿魏酸含量测定时,样品和标准溶液须现配现用。另一方面,阿魏酸在极性太小和太大的溶剂中均不易溶出。实验中发现原料用甲醇∶甲酸(5∶95)超声加热(70℃)提取30min后,残渣中几乎检测不出阿魏酸。在色谱分离条件下,黄连中存在的生物碱基本上不被洗脱,而保留在色谱柱上,因此,它们对阿魏酸的测定影响较小。

图2 阿魏酸含量测定的HPLC图Fig.2 HPLC of ferulic acid reference standard(C) and extracts of Coptis chinensis Franch(D)注:C:样品溶液;D:对照溶液;1:反式阿魏酸的色谱峰。
小檗碱HPLC图见图3。按照2010版中国药典标准测定,石柱黄连中小檗碱的含量为7.91±0.022mg/g,与文献报道[12]一致。上述实验结果测得黄连中阿魏酸的含量为0.25±0.033mg/g,由此说明黄连浸膏中小檗碱与阿魏酸的质量比约为32∶1。

图3 小檗碱含量测定的HPLC图Fig.3 HPLC of berberine reference standard(E) and extracts of Coptis chinensis Franch.(F)注:E:样品溶液;F:对照溶液;2:小檗碱的色谱峰。
2.3 细胞实验
2.3.1 阿魏酸对小檗碱处理的肝细胞增殖作用的影响 MTT实验结果见图4。结果表明,在一定浓度下,阿魏酸本身有微弱的促进HepG2细胞增殖作用,而小檗碱有一定的细胞毒性。这与文献报道[13-14]一致。在实验中,用不同浓度小檗碱处理HepG2细胞后,计算其半数抑制率为36mg/L。在36mg/L的小檗碱溶液中混合加入0 ~64mg/L的低浓度阿魏酸后,HepG2细胞的存活率明显上升,效果非常显著。当含64mg/L阿魏酸后,存活率上升到69%。
小檗碱引起肝细胞凋亡的机理可能与其能引起细胞信号分子ASK1,AKT,MAPKs变化,从而导致活性氧的产生有关[15]。虽有报道高剂量的阿魏酸对HepG2细胞的生长有一定的抑制作用,其凋亡机理可能与此细胞中NADPH氧化酶系统激活产生的ROS有紧密联系[16],但低剂量0 ~64mg/L的阿魏酸对HepG2细胞的影响很小。Sudheer等[17]发现10 ~300μmol/L(相当于1.94 ~60mg/L)阿魏酸对3μmol/L尼古丁所诱导的大鼠外周血淋巴细胞DNA损伤及细胞改变有显著的保护效应。该研究认为尼古丁引起内源性抗氧化因子,如SOD、CAT、GSH-Px等的减少,而加入阿魏酸治疗后这种趋势得到抑制。小檗碱处理的HepG2细胞中加入阿魏酸后,细胞存活率提高是否也与抗氧化因子有关还有待进一步验证。

图4 阿魏酸与小檗碱混合对HepG2细胞增值作用的影响Fig.4 cytotoxity effect of berberine in combination with ferulic acid on HepG2 cells注±s,n=4;小檗碱同一浓度下 a-g表示组内差异显著,p<0.05。
2.3.2 阿魏酸对小檗碱处理的细胞吸收葡萄糖的影响 小檗碱能促进细胞吸收葡萄糖,但阿魏酸对其降糖作用的影响鲜有报道。本实验选用阿魏酸来考察此影响,一方面中药配伍中有酸碱药对配伍的模式,另一方面阿魏酸有一定降糖效果[18],常有与它药联用用于糖尿病并发症治疗的报道[19-20]。近年来也发现它对某些降糖药物有协同增效的作用[21]。从图5中可看出,在同一浓度下,阿魏酸促进肝细胞吸收葡萄糖的效果不如二甲双胍和小檗碱。在小檗碱的三个不同浓度中加入阿魏酸后,细胞吸收葡萄糖的前后效果有显著差异(p<0.05),呈现显著正相关。36mg/L的小檗碱与阿魏酸的组合明显优于另两个浓度1mg/L和72mg/L。当在含有36mg/L小檗碱的培养液中加入64mg/L阿魏酸后,葡萄糖消耗量增加29.4%。随着阿魏酸加入量的增加,葡萄糖消耗增加量先快后慢。结果表明,二者合用后,能明显促进HepG2细胞增殖,并能促进细胞吸收葡萄糖,体现了一定的协同增效。
小檗碱能促进肝细胞吸收葡萄糖可能与其抑制细胞线粒体功能,导致肝中糖原异生和脂肪积累受阻有关[22]。闫忠卿等认为小檗碱可使HepG2细胞的葡萄糖消耗量增加69.11%,小檗碱能通过肝细胞发挥显著的降糖作用可能与其调节肝细胞核因子4的表达进而调节GK活性有关。也有报道认为小檗碱降糖与下调HepG2细胞HNFs mRNA表达,调节肝脏葡萄糖代谢相关激酶活性有关[23]。阿魏酸这种行为机理目前不是很明确。阿魏酸为药用植物当归、川芎及很多中药方剂中单一的主要药效成份,临床研究证实其具有十分广泛的治疗作用(如抗炎、抗糖尿病、抗癌、抗衰老、抗细胞凋亡)和众多的靶器官保护作用(如肝、肺、神经及抗辐射保护)。阿魏酸的降糖作用与其能改善胰岛素抵抗有关[24]。目前,相关合成药物阿魏酸钠片、阿魏酸哌嗪片早已用于临床心脑血管疾病治疗。高利臣等发现一定浓度范围内阿魏酸显著增加了药物代谢酶及转运体活性CYP3A4、2C9、2B6、MDR及MRP2-ER-8启动子活性,显示了对药物代谢酶及转运体体外诱导活性[25]。文献报道[26]阿魏酸、小檗碱在肌小管细胞中有不同的降糖机制。

图5 阿魏酸与小檗碱混合 对促进HepG2细胞葡萄糖消耗作用的影响Fig.5 Glucose-lowering effect of berberine in combination with ferulic acid on HepG2 cells注±s,n=4;小檗碱同一浓度下 a-g表示组内差异显著,p<0.05。
3 结论
用柱层析法从黄连的酸性组分中分离出阿魏酸。酸性成分阿魏酸与黄连主要降糖活性成分小檗碱都有不同程度的促进HepG2细胞吸收葡萄糖的作用。二者按照不同比例混合后,显示一定的协同增效作用,阿魏酸能促进小檗碱的细胞降糖作用,并在一定程度上减弱小檗碱的细胞毒性。当在含36mg/L小檗碱的培养液中下加入64mg/L阿魏酸后,可使HepG2细胞的存活率上升到69%,细胞消耗的葡萄糖增加29.4%。
HPLC结果表明,阿魏酸与小檗碱在黄连中的近似质量比约为32∶1。由此推测,黄连中酸性成分阿魏酸一方面能减弱小檗碱对肝细胞的细胞毒性,另一方面也能在一定程度上促进含小檗碱的培养液中肝细胞对葡萄糖的吸收,二者对肝细胞的葡萄糖消耗呈现一定的协同增效作用。黄连中阿魏酸对小檗碱降糖作用的影响还需动物实验及进一步的分子机制研究,同时,黄连中其它酸性成分是否对小檗碱降糖作用产生影响也需进一步的探讨。
[1] 匡艳辉,朱晶晶,王智民,等. 一测多评法测定黄连中小檗碱,巴马汀,黄连碱,表小檗碱,药根碱含量[J]. 中国药学杂志,2009(5):390-394.
[2]刘继林,孟宪丽,刘咏松. 古代中医用黄连治疗消渴的方药探讨[J]. 四川中医,2010,28(4):41-43.
[3]马燕,袁月新,张俊梅,等. 黄连相关中药复方治疗糖尿病及其并发症的研究概况[J]. 中国实验方剂学杂志,2011,17(12):272-275.
[4] 李彩虹,周克元. 黄连活性成分的作用及机制研究进展[J]. 时珍国医国药,2010,21(2):466-468.
[5]乔琳琳,黄飞,闫小光,等. 黄连煎剂对代谢综合征大鼠模型骨骼肌 AMPK 表达的影响[J]. 中华中医药杂志,2010(1):145-148.
[6]吴卫华,康桢,欧阳冬生,等. 绿原酸的药理学研究进展[J]. 天然产物研究与开发,2006,18(4):691-694.
[7]裴妙荣,段秀俊,裴香萍,等. 中医方剂中酸碱对药的配伍化学研究[J]. 中国中药杂志,2009(15):1989-1993.
[8]殷峻,胡仁明,唐金凤,等.小檗碱的体外降糖作用[J].上海第二医科大学学报,2001,21(5):425-427
[9]殷峻,胡仁明. 小檗碱,齐墩果酸和大蒜新素对糖代谢作用的体外研究[J]. 北京中医药大学学报,2003,26(2):36-38
[10]Jiang W,Wang C H,Wang Z T. Water-soluble chemical constituents of Angelica Sinensis(Oliv.) Diels[J]. Chin Pharm J,2010,45(2):101-103.
[11]Jung H A,Yoon N Y,Bae H J,etal. Inhibitory activities of the alkaloids from Coptidis Rhizoma against aldose reductase[J]. Archives of pharmacal research,2008,31(11):1405-1412.
[12]黄小平,张毅,钟国跃. 不同产地和生长年限黄连的总生
物碱含量测定[J]. 现代中药研究与实践,2004,18(1):42-43.
[13]Chen H Y,Ye X L,Cui X L,etal. Cytotoxicity and antihyperglycemic effect of minor constituents from Rhizoma Coptis in HepG2 cells[J]. Fitoterapia,2012,83(1):67-73.
[14]Ma B L,Ma Y M,Shi R,etal. Identification of the toxic constituents in Rhizoma Coptidis [J]. Journal of ethnopharmacology,2010,128(2):357-364.
[15]Hyun M S,Hur J M,Mun Y J,etal. BBR induces apoptosis in HepG2 cell through an Akt‐ASK1‐ROS‐p38MAPKs‐linked cascade[J]. Journal of cellular biochemistry,2010,109(2):329-338.
[16]Lee YS. Role of NADPH oxidase-mediated generation of reactive oxygen species in them echanism of apoptosis induced by phenolic acids inHepG2 human hepatoma cells[J]. Arch Ph arm R es,2005,28(10):1183 - 1189.
[17]Sudheer A R,Muthukumaran S,Kalpana C,etal. Protective effect of ferulic acid on nicotine-induced DNA damage and cellular changes in cultured rat peripheral blood lymphocytes:A comparison with N-acetylcysteine[J]. Toxicology in vitro,2007,21(4):576-585.
[18]Choi R,Kim B H,Naowaboot J,etal. Effects of ferulic acid on diabetic nephropathy in a rat model of type 2 diabetes[J]. Experimental & molecular medicine,2011,43(12):676-683.
[19]庞彩云. 前列地尔联合阿魏酸钠治疗糖尿病肾病的临床观察[J]. 中国实用医刊,2011,38(3):27-28.
[20]蔺枢勇,吴瑞格,周蕾. 阿魏酸钠联合低分子肝素钙治疗糖尿病肾病蛋白尿 20 例[J]. 中国药业,2012,21(Z1):144-145.
[21]Prabhakar P K,Prasad R,Ali S,etal. Synergistic interaction of ferulic acid with commercial hypoglycemic drugs in streptozotocin induced diabetic rats[J]. Phytomedicine,2013,20(6):488-494.
[22]Xia X,Yan J,Shen Y,etal. Berberine improves glucose metabolism in diabetic rats by inhibition of hepatic gluconeogenesis[J]. PLoS one,2011,6(2):e16556.
[23]刘锋,冷三华,陆付耳,等. 小檗碱对 HepG2 细胞肝细胞核因子基因表达的影响[J]. 中国中西医结合消化杂志,2007,15(3):141-144.
[24]刘志霞,韩淑英,李继安. 人肝癌细胞胰岛素抵抗模型建立及有效中药成分的筛选[J]. 中国组织工程研究与临床康复,2011,15(28):5241-5244.
[25]高利臣. 阿魏酸对药物代谢酶,转运体基因的影响及其与 CYP2B6,POR 和 PXR 基因多态性关系[D]. 长沙:中南大学,2012.
[26]Prabhakar P K,Doble M. Synergistic effect of phytochemicals in combination with hypoglycemic drugs on glucose uptake in myotubes[J]. Phytomedicine,2009,16(12):1119-1126.
Effect of ferulic acid fromCoptischinensisFranch on hypoglycemic acitivity of berberine in HepG2 cells
CHEN Hong-ying1,LI Xue-gang2,YE Xiao-li2,XU Jian-rong1
(1. College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China;2. College of Pharmaceutical Sciences,Southwest University,Chongqing 400715,China)
In order to study impact of acidic component fromCoptidisRhizomaon glucose-lowering effect of berberine in HepG2 cells,acidic constituents were separated fromCoptidisRhizomaextracts by column chromatography,and cell assay was performed by MTT and Kit methods in high glucose model. From acidic constituents,ferulic acid was separated and identified by chromatography and spectrum methods. It had obvious peak signal in HPLC. Quantitative determination of ferulic and berberine was finished by HPCL-DAD. Their weight ratio inCoptidisRhizomaextracts was approximately 32∶1. Cell experiment showed that berberine 36mg·L-1in combination with ferulic acid 64mg·L-1could make glucose consumption increase by 29.4% and elevate cell livability up to 69% in HepG2 cells,compared with same dose of berberine. The result suggested that ferulic acid,had some synergistic effect on improving glucose-lowering effect of berberine and decreasing cytotoxicity of berberine in HepG2 cells.
CoptischinensisFranch;ferulic acid;berberine;HepG2 cells;synergistic effect
2014-04-08
陈红英(1973-),女,博士,主要从事药品食品检测及天然产物化学方向的教学及科研工作。
西南科技大学实验室开放基金(13xnkf10);西南科技大学博士基金(13zx7118)。
TS201
A
1002-0306(2015)01-0361-05
10.13386/j.issn1002-0306.2015.01.068

