Fe3O4磁性纳米颗粒外包腐植酸用于有效去除水中重金属
Liu Jingfu, Zhao Zongshan, Jiang Guibin 著 任翠领 译
(1 中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室 北京 100085 2 兰州大学化学化工学院 兰州 730000)
水体中有毒重金属污染是全球性问题。严格控制重金属排放的环保法规以及对重金属含量极低的清洁水源的极大需求,使开发高效去除水体中各种重金属技术显得极为重要。最近研究侧重于开发具有良好吸附率、吸附容量及能选择吸附目标金属离子的新型吸收剂。现已研制了多种去除重金属的吸附剂,如介孔二氧化硅、沸石、生物质以及生物聚合物。纳米吸附剂独特的性能为开发高效、低成本的去除金属离子的方法提供了前所未有的机会,已有多种纳米粒子及枝状大分子用于处理水体中的重金属离子。
虽然磁铁矿纳米粒子有广泛的生物医学应用,但它在环境领域的应用报道很少,尽管磁铁矿和磁赤铁矿纳米粒子可除去水体中Cr(VI),壳聚糖包裹的Fe3O4磁性纳米粒子可去除Cu(II)离子。Ngomsik等人综述了磁性纳米颗粒及其微粒在去除废水中金属离子的应用进展。最近报道了单分散的Fe3O4纳米晶体在低磁场中通过磁分离去除水中的砷,当Fe3O4纳米晶体直径从300 nm减到12 nm时,对砷(III)和砷(V)的去除率提高了一个数量级。自组装的三维花状氧化铁纳米材料能够去除水体中的砷(V)、Cr(VI)和橙黄II。最近有研究利用表面修饰二巯基丁二酸的超顺磁性Fe3O4纳米粒子去除有毒的金属离子,如汞、银、铅、镉和铊。
单纯的磁铁矿纳米粒子很容易被空气氧化,并易在水中团聚。最近的研究表明,腐植酸(HA)和Fe3O4纳米粒子具有很高的亲和力,腐植酸在Fe3O4纳米粒子表面的吸附能够防止磁性纳米材料聚集,增强磁性材料分散体的稳定性。腐植酸在天然水中含量丰富,其化学结构包括连有羧基、酚羟基和醌基的烷基及芳香基。这些功能团与重金属离子有很强的络合能力,所以能用于去除水中重金属离子。腐植酸与金属氧化物的结合会影响其及金属氧化物的吸附。这是因腐植酸在金属氧化物表面的吸附使其表面形成聚阴离子有机涂层,从而彻底改变颗粒的表面性质。腐植酸和金属氧化物粒子复合体系对重金属离子的吸附过程复杂,自第一篇论文发表以来,有大量实验和模拟工作致力于这方面的研究。据报道,腐植酸与铁氧化物组成的复合物对金属离子的吸附能力大于它们各自的吸附能力,虽然对某些金属离子的吸附不符合加和规则。
本研究中,通过在Fe3O4磁性纳米粒子表面包裹腐植酸制备了一种可去除水中重金属离子的新型吸附剂材料,并且该方法新颖、成本低。研究了所合成的腐植酸涂层的Fe3O4纳米粒子(Fe3O4/HA)的物理化学特性,通过吸附动力学和容量、水基质、材料的稳定性考察了Fe3O4/HA对去除重金属离子的适用性。
1 试验部分
1.1 磁性纳米材料的制备与表征
按之前文献报道方法稍加改进,合成了裸露Fe3O4磁性纳米粒子和腐植酸涂层Fe3O4磁性纳米粒子。简单地说,将6.1 g FeCl3·6H2O和4.2 g FeSO4·7H2O溶解于100 mL水并加热至90 ℃,10 mL氢氧化铵(25%)和0.5 g腐植酸钠盐溶解于50 mL水中,然后依次迅速加入两种溶液。混合物在90 ℃搅拌30 min后冷却至室温。收集黑色沉淀物,过滤并用水洗涤至中性。所得到黑色沉淀物即Fe3O4/HA纳米颗粒,备用。用于制备Fe3O4/HA的商用腐植酸钠盐购自Acros Organics(新泽西州)和Aldrich(德国),以用来比较腐植酸来源的影响,但无特殊说明使用的是Acros Organics的腐植酸制备的Fe3O4/HA。除不加入腐植酸,制备裸露的Fe3O4磁性纳米粒子的方式类似。
1.2 重金属离子吸附过程
典型吸附过程是向100 mL 0.1 mg/L或1 mg/L的各重金属离子溶液中,加入10 m g所制备的Fe3O4/HA(取1 mL 10 mg/mL Fe3O4/HA的水分散液),然后用HCl和NaOH将混合液pH调至6.0,并搅拌30 min。为除去实际水样中重金属离子,向100 mL实际水样中加入50 mg所制备的Fe3O4/HA(1 mL 50 mg/mL的Fe3O4/HA的水性分散液)。然后,用手持式永久磁铁将吸附重金属离子的Fe3O4/HA从混合物中分离。用ICP-MS(美国安捷伦的7500ce)确定溶液中剩余重金属离子的浓度。为确定重金属离子吸附等温线,按上述相同方法在20 ℃下处理不同初始浓度的各金属离子的溶液。
2 结果与讨论
2.1 Fe3O4/HA和Fe3O4的表征
Fe3O4和Fe3O4/HA的红外光谱显示腐植酸已成功涂覆在Fe3O4纳米颗粒表面。由图1a可知,约1569 cm-1处的红外吸收峰为Fe3O4/HA中C=O的伸缩振动峰,说明羧酸根阴离子与FeO表面发生相互作用,因为自由羧酸中C=O的伸缩振动峰位于1700 cm-1以上。1396 cm-1位置的峰最有可能源于亚甲基的剪切振动。但Fe3O4的红外光谱没有观察到C=O的伸缩振动。和腐植酸相比,Fe3O4/HA紫外可见光谱的最大吸收峰红移,证明腐植酸与Fe3O4已结合。人们普遍认为腐植酸主要是通过配体交换结合到Fe3O4颗粒表面。
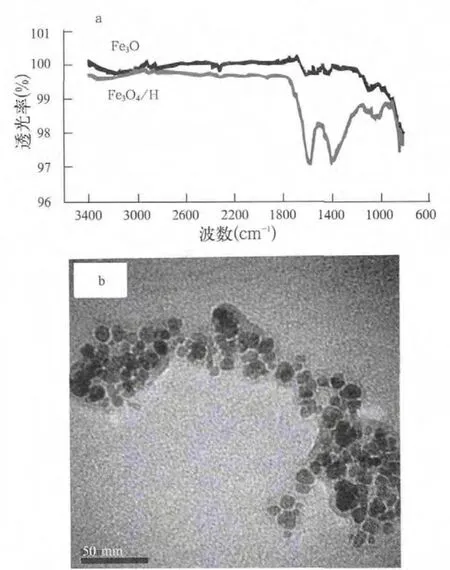
图1 所制备Fe3O4/HA磁性纳米颗粒的红外谱(a)和透射电镜(b)Fig.1 IR Spectrum (a) and TEM Image (b) of the prepared Fe3O4/HA magnetic nanoparticles
根据测得的Fe3O4/HA(5.15%)和腐植酸原料(45.0%)中总有机碳(TOC)的含量,计算得到所制备的Fe3O4/HA中含有11.4%(W/W)的腐植酸,因为HA在吸附到Fe3O4表面的过程会分解,所以这是个近似值。X射线光电子能谱(XPS)分析显示腐植酸原料的表面组成为19.3%的O,0.554%的N,79.7%的C和0.505%的S(w/w),而Fe3O4/HA的表面组成为49.43%的O,2.12%的N,33.5%的C和14.9%的Fe。根据Fe的含量计算出Fe3O4/HA表面含有79.4%的腐植酸,Fe3O4/HA中的腐植酸含有62.1%的O,2.67%的N和42.2%的C。显然,Fe3O4吸附的腐植酸中O和N的含量均显著高于腐植酸原料,表明在合成Fe3O4/HA的过程中,腐植酸中含O和N丰富的基团选择性地涂覆在Fe3O4表面。同样,腐植酸中尺寸更小的、富含酸性官能团的组分也优先吸附在Fe3O4表面。考虑合成温度(90 ℃)较高,也有可能是腐植酸某些组分降解形成具有较高O-和N-含量的官能团的产物,它们优先吸附在Fe3O4表面。然而,因为本工作的目的不是研究腐植酸与金属的络合性质,而是开发一种去除重金属离子的新型材料,因此没必要抑制腐植酸的降解。
在多种p H条件下测定了所制备的F e3O4和F e3O4/H A各自的ζ-电位。F e3O4的等电点(pHPZC)为pH=6.0,与文献报道的结果基本一致。Fe3O4/HA表面包覆的腐植酸中丰富的羧基使其pHPZC约下降到2.3。在pH为0.5~9.0的范围内发现灰色腐植酸的ζ-电位也带负电荷。低的pHPZC表明Fe3O4/HA在环境相关的全部酸性(pH为3~9)范围内表面都带负电荷,这可以防止Fe3O4/HA颗粒聚集,有利于带正电荷的金属离子的吸附。
F e3O4/H A和F e3O4的饱和磁化强度分别为68.1 e m u/g和79.6 e m u/g,表明腐植酸在F e3O4/H A中的含量约为14.5%(w/w),接近TOC分析的结果(11.4%,w/w)。用手持式永久磁铁在几分钟内即可将Fe3O4/HA从它的水分散体系中分离。裸Fe3O4纳米颗粒的黑色水悬浮液很易被氧化成无磁性的褐色悬浮液,而Fe3O4/HA在水中储存30天后,其饱和磁化强度和颜色无明显变化,表明腐植酸涂层能够防止Fe3O4/HA纳米粒子氧化,从而保持其饱和磁化强度。
BET分析显示Fe3O4(62 m2/g)和Fe3O4/HA(64 m2/g)的表面积几乎相同。这可能是由于腐植酸的微孔高度狭窄,在77 K时不吸附N2。据报道,273 K时利用二氧化碳测得的腐植酸类物质(瑞士Fluka公司)的比表面积为42.5 m2/g,但77 K时用N2检测的结果小于1 m2/g。值得注意的是,Fe3O4和Fe3O4/HA相似的表面积说明这两种材料的尺寸大致相同。
图1b是所制备Fe3O4/HA的TEM图像。Fe3O4磁性核的平均尺寸约为10 nm,但整个Fe3O4/HA包含颗粒聚集体,没有统一的大小和不规则碎片形特征。激光粒度分析结果表明Fe3O4/HA颗粒的平均动力学尺寸约为140 nm,也证明了制备的材料在溶胶溶液中的聚集。Illes等也观察到初始尺寸约为10 nm的Fe3O4颗粒在含腐植酸的溶胶溶液中聚集成平均尺寸约为120 nm、大小和形貌不均一的聚集体。尽管这两种材料的总体尺寸几乎相同,但所制备的Fe3O4颗粒水悬浮液比Fe3O4/HA(140 nm,104~189 nm)具有更大的平均尺寸(250 nm)和更宽的流体动力学尺寸(160~366 nm)。这些结果清楚地表明,Fe3O4表面包裹的腐植酸能够有效地降低它们的聚集。
2.2 吸附动力学
为了评价这些Fe3O4/HA对重金属离子的吸附动力学,室温下,向100 mL含有0.1 mg/mL金属离子(pH=6.0)的溶液中加入0.01 g制备的Fe3O4/HA。结果表明,大约在15 min内达到吸附平衡,比单分散的壳聚糖和二巯基丁二酸修饰的Fe3O4纳米的时间长(约1 min)。动力学慢的原因可能是由于Fe3O4/HA颗粒表面的结合位点达到饱和以及外层腐植酸的无序结构使重金属离子点对点交换速度变慢。
2.3 环境参数的影响
影响重金属离子与腐植酸结合的主要参数是腐植酸的来源和浓度、金属离子浓度、pH和其他参数。因此,在环境相关范围内改变这些参数,研究它们对Fe3O4/HA去除重金属离子的影响很重要。
2.3.1 天然有机物质
据报道,在腐植酸存在时,水合金属氧化物对重金属的吸附是多种作用的综合结果。如果氧化物对腐植酸和金属离子的结合位点相同,腐植酸直接在金属氧化物表面结合会堵塞、竞争表面的结合位点,可能会降低对金属离子的吸附。另一方面,因腐植酸和金属离子之间的络合作用,金属氧化物结合腐植酸可能会有利于金属的吸附,但是溶液中的腐植酸会妨碍一小部分金属离子在氧化物表面的吸附。图2给出了以Aldrich腐植酸作为模型,水溶液中腐植酸对所制备的Fe3O4和Fe3O4/HA去除金属的影响。加入溶解有机碳(DOC)浓度为0~50 mg/L的腐植酸,Fe3O4/HA去除重金属离子没有显著变化,Fe3O4对重金属离子的去除则发生了明显改变。在DOC浓度为0~1.1 mg/L的范围内增加腐植酸浓度能够增强对金属离子的去除,特别是对Hg(II),其去除率几乎从42%直线上升到90%。进一步加入腐植酸对金属离子的去除效果却减弱了,这是因为部分金属离子与溶液中腐植酸结合,从而减弱了Fe3O4对它们的吸附。当加入的腐植酸增加至9 mg/L DOC时,Cu(II)的去除率明显下降至55%。试验表明,进一步提高腐植酸浓度至高达50 mg/L DOC时,对Fe3O4/HA和Fe3O4去除金属离子都没有显著影响。上述结果表明,Fe3O4纳米粒子去除天然水中的金属离子取决于天然水中有机物的含量,这与相关文献的报道一致。由于天然水中含有0.5~50 mg/L的DOC,其中有50%~70%的腐殖质,用Fe3O4磁性纳米粒子去除天然水中重金属离子的效率难免会受到其中含有的天然有机物的影响。而所制备的Fe3O4/HA纳米颗粒则能克服这个缺点,在腐植酸的整个研究范围(0~100 mg/L)内,它们对重金属离子具有高的、近乎恒定的去除效率(93%~98%)。
2.3.2 pH值
当pH值从2增加到9时,Fe3O4/HA(图3a)对Cu(II)、Hg(II)和Pb(II)的去除率从96%~97%降为90%~94%,略有降低。清除效率的轻微降低可能是因为pH的增加会导致腐植酸从Fe3O4/HA上轻微解吸,解吸的腐植酸可与金属离子在溶液中竞争络合,从而降低金属离子在Fe3O4/HA表面吸附。但是,pH<6.0(Fe3O4的pHPZC)时,Fe3O4(图3b)对Cu(II)、Hg(II)和Pb(II)的去除能力非常低。这可归结为Fe3O4表面的正电荷减少了带正电的金属离子的吸附。值得注意的是,当溶液pH值大于Fe3O4的pHPZC时,其对Cu(II)和Pb(II)的去除效率达到90%以上,但对Hg(II)的去除率只有65%。由于腐植酸和Cd(II)会形成弱的络合物,Cd(II)主要吸附到金属氧化物而不是腐植酸涂层。因此,对于Fe3O4/HA和Fe3O4而言,它们对Cd(II)的去除效率随pH值增加而增加,这与文献报道的金属离子在赤铁矿/腐植酸上的吸附随pH值增加而增加的结果一致。从图3可以断定腐植酸对Pb(II)和Cu(II)的去除是与pH相关的,并且pH=3时可高达70%~80%。
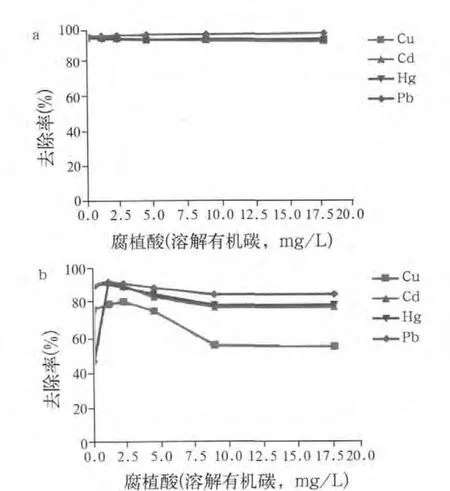
图2 水溶液中的腐植酸对所制备的Fe3O4/HA(a)和Fe3O4(b)去除重金属的影响Fig.2 In fluence of humic acid in aqueous solutions on the removal of heavy metals by the as-prepared Fe3O4/HA (a)and Fe3O4 (b)
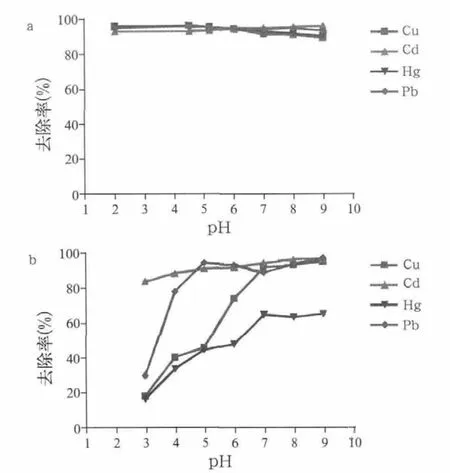
图3 pH对所制备Fe3O4/HA(a)和Fe3O4(b)去除重金属的影响Fig.3 In fluence of pH on the removal of heavy metals by the as-prepared Fe3O4/HA (a) and Fe3O4 (b)
2.3.3 盐度
当含盐量从NaCl浓度(海水盐度)为0%增加到3.5%时,对Fe3O4/HA去除金属离子没有显著影响。这是因为盐度对腐植酸和铁氧化物之间的吸附/脱附没有重大影响,而且目标金属离子与氯离子之间的络合远弱于与腐植酸。
2.3.4 共存离子
分别以Ca2+和PO43-为模型阳离子和阴离子研究了常见共存离子对重金属离子去除的影响。Ca2+(0~100 mg/L)和PO43-(0~10 mmol/L)的存在对所研究的重金属离子的去除均无显著影响。腐植酸与重金属离子的结合比与Ca2+的强,腐植酸对重金属离子的吸附远强于PO43-。因此,存在的Ca2+和PO43-对Fe3O4/HA吸附重金属离子没有影响。
2.4 实际水体的影响
为进一步评价不同体系对重金属离子去除率的影响,向实际水样中加入1 mg/L各目标金属离子溶液。表1给出了Ca、Mg、Cu(II)、Cd(II)、Hg(II)和Pb(II)的初始浓度以及所制备的Fe3O4/HA对它们的去除效率。在研究的全部水样中,Hg(II)和Pb(II)的去除率都在99%以上,TOC、Ca和Mg浓度的影响可以忽略不计。这是因为腐植酸对这两种金属离子的强络合能力。pH值是影响Cu(II)和Cd(II)去除的主要因素(图3)。地下水的pH值最低,Cu(II)的去除率最高,而自来水的pH值最高,Cd(II)的去除率最高。进一步的实验表明分别调整这些水的pH值为6.0和8.0,Cu(II)和Cd(II)去除率提高到95%以上。表1中Ca(0~16%)和Mg(0~10%)的去除率非常低,表明它们和腐植酸的结合弱,这是溶液中分别存在124和288倍于目标重金属离子的Ca和Mg时没有影响重金属离子去除率的原因。经Fe3O4/HA处理后,在这些水样中没有观察到水垢或结垢,表明Fe3O4/HA选择性吸附重金属离子。
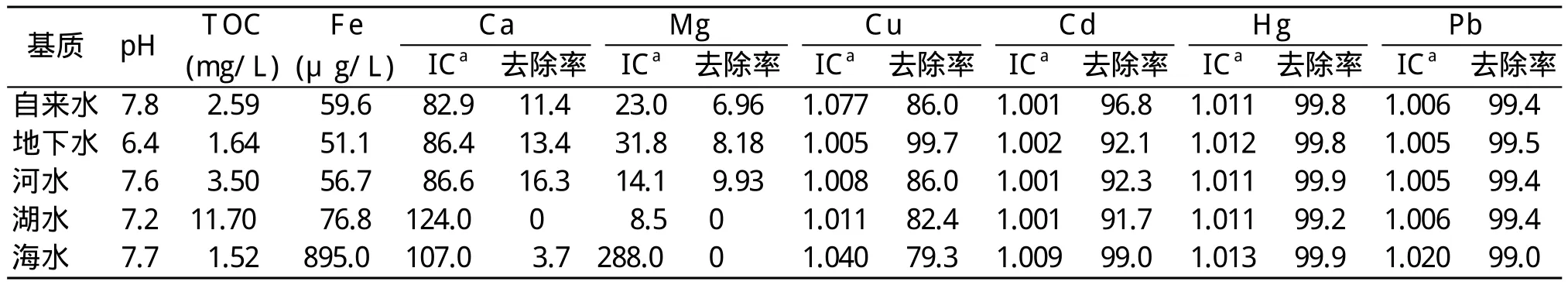
表1 用50 mg Fe3O4/HA处理100 mL水后水溶液的pH值、TOC、Fe和重金属离子的浓度以及水中重金属离子的去除率Tab.1 The pH, concentration of TOC, Fe and heavy metals in water and the removal(%)after treating 100 mL of water with 50 mg Fe3O4/HA
2.5 吸附容量
在pH=6.0,Fe3O4/HA浓度为10 mg/L时,通过改变各金属离子浓度(0.01~5 mg/L)测定所制备的Fe3O4/HA对各金属阳离子的吸附容量,平衡状态下重金属离子的吸附量(qe,mg/g)和金属离子的平衡浓度Ce(mg/L)符合Langmuir吸附模型qe=qmbCe/(1+bCe)。其中,qm是完全单层覆盖对应的最大吸附容量,b是平衡常数(L/mg)。数据拟合模型的相关系数(r2)为0.98~0.99,Cu(II)、Cd(II)、Pb(II)和Hg(II)的最大吸附量分别为46.3 mg/g、50.4 mg/g、92.4 mg/g和97.7 mg/g。通过b值(L/mg)得出各金属离子与Fe3O4/HA的亲和力按递减顺序排序如下:Cu(II)(22.4)>Cd(II)(18.3)>Pb(II)(14.8)≈Hg(II)(14.6)。值得注意的是,pH和离子强度会影响金属离子与腐植酸络合物的稳定常数,因此不同水体中金属离子的最大吸附容量的值可能会不同。作为比较,用与Fe3O4/HA相同的方式,测定通用的吸附剂-活性炭对Pb(II)的吸附等温线,测得的qm(3.3 mg/g)值低得多。Fe3O4/HA吸附Cu(II)的qm也高于壳聚糖键合的Fe3O4磁性纳米粒子(21.5 mg/g)。
2.6 材料的稳定性
吸附组分在处理后的水中浸出不利于材料的应用。虽然低pH值对腐植酸在氧化铁表面的吸附有利,但在碱性条件下合成的Fe3O4/HA抗浸出性更高。与低pH下的球状结构不同,腐植酸在高pH值时以直链或拉伸的结构存在,有利于与Fe3O4的多位点结合,从而降低了Fe和腐植酸的浸出。实验表明,在平衡状态下,Fe3O4/HA的水性分散液(100 mg/L,pH值6.0)中游离铁离子和DOC的浓度分别为0.025 mg/L和0.16 mg/L,而Fe3O4纳米颗粒的水性分散液(100 mg/L,pH值6.0)中游离铁离子的浓度为0.24 mg/L,是Fe3O4/HA的近10倍,表明腐植酸的包覆明显提高了Fe3O4磁性纳米粒子的稳定性。Fe3O4/HA分散体系中腐植酸的浓度低,这与文献报道的吸附在氧化铁上的天然有机物在给定条件下很难脱附的结果一致。
表2给出了Fe3O4/HA分散到不同溶液中后腐植酸和Fe的浸出情况。在天然水和自来水中,Fe3O4/HA浸出到溶液中的Fe和腐植酸的量分别低于0.03%和5.3%,而在0.1 M盐酸和2 M氢氧化钠的酸性/碱性溶液中,Fe和腐植酸的浸出量分别低于3.7%和1.1%。根据使用量(500 mg/L)以及TOC(5.15%)和Fe(64%)在Fe3O4/HA中的含量,腐植酸(5.3%)和Fe(3.7%)的浸出量最高时水中DOC和Fe的浓度分别为1.4 mg/L和12 mg/L。DOC增加量低有望使水中重金属离子的量几乎可以忽略,图2a表明Fe3O4/HA适用于处理大多数天然水和废水。由于Fe3O4/HA在碱性溶液中制备,在2 M氢氧化钠中没有观察到腐植酸浸出,而腐植酸在5 M HCl中完全浸出。值得注意的是,腐植酸在天然水中与在0.5 M盐酸的浸出行为相似,说明天然水体也有助于腐植酸从Fe3O4/HA上释放。总体而言,Fe3O4/HA在天然水、自来水和浓度在0.1 M盐酸和2 M的氢氧化钠酸性/碱性溶液中比较稳定,没有观察到纳米簇分解和细粉的形成。
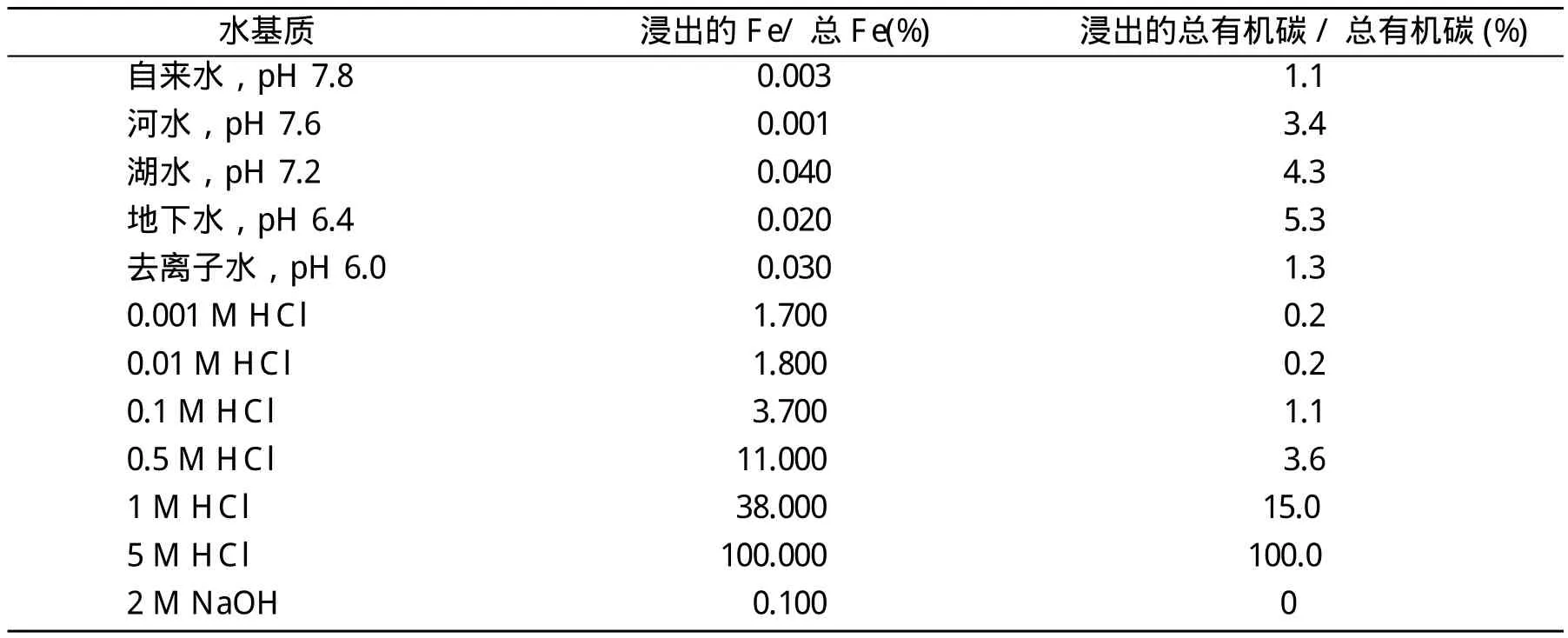
表2 50mg Fe3O4/HA分散到100 mL不同溶液中6 h后腐植酸和Fe的浸出情况Tab.2 Leaching of Fe and HA after suspending 50 mg Fe3O4/HA in 100 mL of different fluids for 6 h
为测定时间对Fe3O4/HA浸出组分和所吸附重金属离子的影响,将载满重金属离子的Fe3O4/HA重新分散到去离子水中,并在不同时间段检测上清液中Fe、TOC及重金属离子浓度。结果表明所吸附的重金属离子和材料组分的浸出可忽略不计。负载的重金属离子浸出量与时间无关且都在0.05%以下,而Fe的溶出量则随溶出时间(0.5~12天)延长从0.07%略增到0.21%。在时间间隔(0.5~12天)内,HA浸出量从3.5%降为0.33%。HA在溶液中的浸出量下降可能是由于Fe3O4/HA随时间延长发生团聚,使之前解吸的HA重新吸附到Fe3O4/HA的聚集体上。文献报道了在63天内从氧化铁上解吸的天然有机物的量可以忽略不计,HA的浸出量低与文献报道的结果一致。
2.7 处理重金属污染的意义
本研究发现,和纳米Fe3O4相比,所制备的Fe3O4/HA的稳定性和对重金属的去除率均显著提高。尤其是HA包裹层有效地降低了Fe3O4/HA在水悬浮液中的聚集使其磁性保持稳定,显著增强了Fe3O4/HA在低pH下对Hg(II)和Cu(II)的去除率。所制备的Fe3O4/HA纳米颗粒价格低廉、对环境友好。因为其主要成分是在自然界中含量丰富,对环境无不利影响,且合成过程简单、成本低的Fe3O4和HA。此外,通过简单的磁分离就可以将吸附重金属离子后的Fe3O4/HA从水中回收,有望降低水处理费用。预计所制备的Fe3O4/HA去除各种水体中的重金属具有广泛的适用性。
致谢和参考文献(略)

