Ni-Mn共掺杂高电压钴酸锂锂离子电池正极材料
胡 国 荣卢苇 梁龙伟 曹雁冰 彭忠东 杜柯
(中南大学冶金与环境学院,长沙410083)
Ni-Mn共掺杂高电压钴酸锂锂离子电池正极材料
胡 国 荣卢苇 梁龙伟 曹雁冰 彭忠东 杜柯*
(中南大学冶金与环境学院,长沙410083)
以金属硫酸盐为原料,NaOH和NH3·H2O为沉淀剂,用共沉淀法合成了Co0.9Ni0.05Mn0.05(OH)前驱体,再进行配锂并通过高温固相法合成了Ni-Mn共掺杂高电压钴酸锂锂离子电池正极材料Li(Co0.9Ni0.05Mn0.05)O2。用X射线衍射(XRD)、扫描电镜(SEM)、循环伏安(C-V)、交流阻抗(EIS)和充放电测试研究样品的晶体结构、形貌和电化学性能。结果表明Ni-Mn共掺杂正极材料Li (Co0.9Ni0.05Mn0.05)O2有优秀的电化学性能:在3.0~4.4 V和3.0~4.5 V区间,0.5C倍率下首次放电比容量分别为162.5 mAh·g-1和185 mAh·g-1,循环100次后容量保持率分别为94.4%和93.7%。
高电压钴酸锂;共掺杂;共沉淀法;电化学性能
锂离子电池的应用已快速扩展到新的领域如智能移动设备、(混合)电车和储能系统,在这些领域高能量密度和高功率密度是至关重要的先决条件,所以迫切需要能够提供较高的可逆容量的正极材料[1-2]。层状钴酸锂凭借生产工艺简单、放电平稳、电压高等优点占据着锂离子电池正极材料市场的重要地位,但是实际上钴酸锂在2.7~4.2 V电压区间只能释放理论容量274 mAh·g-1的大约一半电量[3-5]。理论上提高钴酸锂的充电截止电压就会有更多的锂离子可逆的嵌入和脱出,从而获得较高的能量密度[6]。然而高电压将导致材料不可逆的相变和Co4+的溶解,从而使其热稳定性尤其是循环性能变[7]。一般通过掺杂和包覆改善高电压钴酸锂的性能[8-9]。大批研究工作者通过共掺杂Ni-Mn来改善高电压下钴酸锂的结构特性,深入研究了LiCo1-2xNixMnxO2系列如LiCo0.96Ni0.02Mn0.02O2[10]、LiCo0.8Ni0.1Mn0.1O2[11]、LiCo0.6Ni0.2Mn0.2O2[12]、LiCo0.5Ni0.25Mn0.25O2[13]。在LiCo1-2xNixMnxO2(0.05<x<0.5)系列中,镍、钴、锰分别呈现+2、+3、+4氧化数[14]。Mn4+能够提高结构和热稳定性,然而充放电过程中锰无电化学活性,导致了初始放电容量的降低[15];尽管Ni2+/Ni4+的氧化还原反应提高了充放电容量,但是Ni2+(r=0.069 nm)和Li+(r=0.076 nm)有相近的粒子半径会导致阳离子混排,导致电化学性能变差[3]。Saadoune等[11]合成的材料充电至4.4 V,0.1C倍率下初始放电容量接近180 mAh·g-1,然而极化严重,循环稳定性较差;Myung等[16]指出LiCo1-x(Ni0.5Mn0.5)xO2系列随着钴含量的增加,锂镍混排程度降低,电化学性能变好。因此,在该系列产品中,一方面是要使用镍锰来替代有毒且昂贵的钴元素,另一方面又要保证材料有较好的电化学性能,根据前人的研究成果和实验室前期的探索,我们选择Li(Co0.9Ni0.05Mn0.05)O2为研究对象。
本工作采用氢氧化物共沉淀法制备球形度较好的Co0.9Ni0.05Mn0.05(OH)2前驱体,再与Li2CO3混合,通过高温固相法合成了Li(Co0.9Ni0.05Mn0.05)O2。考察了不同电压下的首次放电容量和循环性能,并用XRD、EIS、C-V表征了循环前后结构方面的变化以及导致电化学性能变化的原因。
1 实验部分
1.1 前驱体制备及材料合成
按nCo∶nNi∶nMn=0.9∶0.05∶0.05将CoSO4·7H2O(浙江华友钴业有限公司,工业级)、NiSO4·6H2O(金川集团镍业有限公司,工业级)、MnSO4·H2O(长沙博鑫化工有限公司,工业级)配制成总金属离子浓度为2 mol· L-1的混合溶液,将该混合溶液与4 mol·L-1NaOH (长沙明瑞化工有限公司,工业级)溶液、2 mol·L-1NH3·H2O(长沙信美材料科技有限公司,工业级)溶液按2∶2∶1的流量比以并流方式同时泵入10 L反应釜中,严格控制反应体系的pH、反应温度、搅拌速度、进料液体的流量。反应一段时间后,用去离子水洗涤沉淀物至滤液为中性,过滤后在60℃下烘干24 h,得到Ni-Mn共掺杂前驱体Co0.9Ni0.05Mn0.05(OH)2,命名为Ⅰ。用同样浓度的CoSO4·7H2O及上述同样的实验条件得到前驱体Co(OH)2,命名为Ⅱ。采用ICP-AES(美国利曼-徕伯斯)对Ni,Mn含量进行分析表明Ⅰ的nCo∶nNi∶nMn=0.902∶0.052∶0.049,Ⅱ的wCo= 62.4%,与实验设计的理论比值很接近。将前驱体Ⅰ和Ⅱ分别与Li2CO3(青海盐湖佛照蓝科锂业股份有限公司,99.5%)按金属离子与Li的物质的量的比1.00∶1.01混合均匀后,置于马弗炉中以2℃·min-1的升温速度升温至900℃,保温10 h,自然冷却后即得到正极材料Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2。
1.2 材料结构表征
采用日本Rigaku公司生产的Minflex型X射线自动衍射仪进行物相和晶体结构分析,实验条件为Cu靶Kα辐射源(λ=0.154 18 nm),靶压40 kV,靶流300 mA,扫描速度为10°·min-1,扫描角度2θ为10°~80°;步长为0.02°;采用日本JEOL公司JSM-6360 LV型扫描电子显微镜观察样品的形貌;采用美国利曼-徕伯斯真空型电感耦合等离子体原子发射光谱仪进行电感耦合等离子体(ICP)分析,确定材料的化学成分;采用美国EDAX公司EDXGENESIS 60S型X-射线能谱面扫描观察元素分布;用PerkinElmer生产的Model 273A电化学工作站,采用0.1 mV·s-1的速率扫描,测试电压范围为2.8~4.6 V进行循环伏安测试;用PerkinElmer生产的Model 273A恒电位仪及Model 5210锁相放大器,设置频率范围为10 mHz~100 kHz,交流幅值为5 mV进行交流阻抗测试。其中未循环的交流阻抗图谱待电池组装静置2 h后进行交流阻抗测试,循环100次后的交流阻抗图谱测试方法为将电池在0.5C下循环100次后再充电至4.5 V,静置2 h后进行交流阻抗测试。循环伏安和交流阻抗测试结果均采用Zview软件进行拟合。
1.3 电化学性能测试
按质量比8∶1∶1将活性物质、聚偏氟乙烯(日本吴羽,AR)和乙炔黑(河南焦作和兴化工有限公司,AR)在溶剂N-甲基吡咯烷酮(日本三菱,AR)中混匀,涂覆在20 μm厚的铝箔(上海天重,99.7%)上,在120℃烘箱中烘干4 h,以8 MPa压力轧制成直径为11 mm正极片(约含2.8 mg活性物质)。以金属锂片(天津中能锂业,99.9%)为负极,Celgard 2400膜(美国CELGARD)为隔膜、1 mol·L-1LiPF6/EC+DMC+ EMC(体积比1∶1∶1,江苏国泰,电池级)为电解液,在氩气气氛手套箱中组装CR2025型扣式电池。用BTI-10电池测试系统(武汉市金诺电子有限公司)进行电化学性能测试,在电压为3.0~4.4 V和3.0~4.5V,0.5C下进行循环性能测试,在3.0~4.4 V和3.0~4.5 V下以0.2C、0.5C、1C、2C 4个倍率连续各循环5次下进行倍率性能测试。
2 结果与讨论
2.1 前驱体的合成
在合成氢氧化物前驱体时,若直接采用氢氧化物与金属盐反应,反应速度很快,产物形貌难以控制,另外在Co-Ni-Mn体系中还会因氢氧化锰溶度积相比氢氧化镍和氢氧化钴高2个数量级而难于实现复合沉淀。为了解决这些问题,可以通过外加氨水,调控溶液中游离镍、钴、锰离子浓度。在C[NH3]T为0.1~1.0 mol·L-1,pH值为10.0~12.0时,氨对Ni2+、Co2+、Mn2+离子的配位作用适宜,可以对沉淀反应速度进行有效控制,从而能够合成复合沉淀化合物并控制产物形貌[17]。经实验探索得最佳合成前驱体条件pH=11.0,C[NH3]T=0.5 mol·L-1,制备的前驱体颜色呈粉红色,前驱体中nCo∶nNi∶nMn=0.902∶0.052∶0.049与理论值接近。
2.2 材料的物理性能
Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的XRD图见图1。
从图1可看出采用共沉淀法制备的Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2均具有明显的(003),(101)和(104)衍射峰,表明他们都具有典型的六方相层状结构,其XRD图与标准LiCoO2的XRD衍射图基本一致,均没有出现杂质峰,样品Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的XRD图相比,峰位与强度都没有明显的变化,说明掺杂的Ni2+和Mn4+离子完全进入LiCoO2晶格内部,并不会改变晶体的结构。
从图1的数据,通过JADE5软件计算的样品Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的晶胞参数见表1。
从表1可知,掺杂Ni-Mn后样品的晶胞参数a,c,c/a均有所增大,证明Ni2+和Mn4+已掺入到晶格内部。c/a比值大说明Li(Co0.9Ni0.05Mn0.05)O2层间距增大,容纳锂离子的空间也相应增大,其扩散速度加快,有利于锂离子在整个晶体中的有效嵌入和脱出。
Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的SEM图见图2。

图1 Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的XRD图Fig.1 XRD patterns of Li(Co0.9Ni0.05Mn0.05)O2and LiCoO2

图2 Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的SEM图Fig.2 SEM images of Li(Co0.9Ni0.05Mn0.05)O2and LiCoO2
从图2(a),(b),(c),(d)可知,制备的2个样品呈类球形,由二次颗粒堆积而形成。相对于无规则颗粒,由球形或类球形颗粒组成的材料具有更大的堆积密度,从而有利于提高锂离子电池的比能量。比较Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的微观形貌,两者没有明显差异,说明该掺杂对粒子表面形貌影响不大。
2.3 电化学性能
Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2在不同电压下的首次充放电曲线见图3。
从图3可知,在4.4 V和4.5 V下,Li(Co0.9Ni0.05Mn0.05)O2、LiCoO2的首次放电比容量分别为162.5 mAh·g-1、163.3 mAh·g-1和186.6 mAh·g-1、185.0mAh·g-1,首次充放电效率分别为94.6%、94.1%,92.7%、90.0%,两者首次放电比容量相差不多,首次充放电效率Li(Co0.9Ni0.05Mn0.05)O2略高。在不同高电压下,掺杂后样品的充放电曲线均比较平整,曲线之间的间距缩短,说明掺杂提高了充放电效率和可逆性。

表1 Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的晶胞参数Table1 Lattice parameters of Li(Co0.9Ni0.05Mn0.05)O2and LiCoO2

图3 不同电压下的Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2首次充放电曲线Fig.3 Initial charge-discharge curves of Li(Co0.9Ni0.05Mn0.05)O2and LiCoO2at different voltages
样品Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2在不同电压下的循环及倍率性能见图4。
从图4(a)和(b)可知,在4.4 V下,Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2的首次放电比容量分别为162.5 mAh·g-1,163.3 mAh·g-1,循环100次后,容量保持率分别为94.4%和90.1%,在4.5 V下,Li (Co0.9Ni0.05Mn0.05)O2、LiCoO2的首次放电比容量分别为185.0 mAh·g-1、186.6 mAh·g-1,循环100次后,容量保持率分别为93.7%和89.7%。将Li(Co0.9Ni0.05Mn0.05) O2和LiCoO2材料在3.0~4.4,4.5 V下分别在0.2C、0.5C、1C、2C下各循环5次进行倍率性能测试,见图4(c)和(d)。由图可知,在0.2C、0.5C较小倍率下,掺杂样品和纯相样品放电比容量相差并不明显,但在1C和2C倍率下掺杂样品和纯相样品的放电比容量相差就很明显,Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2在4.4 V,1C和2C的放电比容量分别为164.5mAh·g-1,159.4 mAh·g-1;在4.5 V,1C和2C的放电比容量分别为180.8 mAh·g-1,172.2 mAh·g-1。Li(Co0.9Ni0.05Mn0.05)O2材料较好的循环及倍率性能归因于Ni和Mn元素共掺杂从而使材料的结构更加稳定,晶胞体积增大,有助于提高材料的可逆嵌锂容量,这与XRD测试的结果相符合。
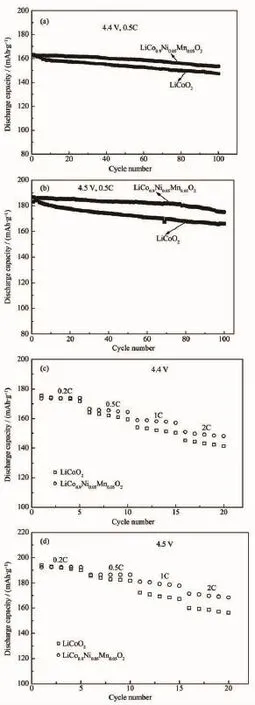
图4 不同电压下的Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2循环及倍率性能Fig.4 Cycle performance and rate capability of Li(Co0.9Ni0.05Mn0.05)O2and LiCoO2at different voltages
结合图3和图4可知,Ni-Mn共掺杂对样品的首次放电容量并没有太大影响,但是样品的循环稳定性以及倍率性能明显提高。在LiCo1-2xNixMnxO2(0≤x≤0.5)中,包含Ni2+,Co3+和Mn4+,电化学反应为Ni2+/Ni3+和Co3+/Co4+,Mn4+无电化学活性,它的作用是在电化学反应过程中稳定层状结构[18]。
为了进一步考察样品Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2在循环过程中结构的稳定性,我们将在3.0~4.5 V,0.5C下循环100次后的电池拆开,将正极片用DMC洗涤后烘干,将铝箔上的粉料刮下,进行XRD测试。
Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2在3.0~4.5 V,0.5C下循环100次后的XRD图见图5。

图5 Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2在3.0~4.5 V,0.5C下循环100次后的XRD图Fig.5 XRD patterns of Li(Co0.9Ni0.05Mn0.05)O2and LiCoO2after 100 cycles in the voltage of 3.0~4.5 V at 0.5C rate
从图5可知,Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2在3.0~4.5 V,0.5C下循环100次后,Li(Co0.9Ni0.05Mn0.05) O2材料的XRD图在峰位上和理论给出的层状晶体结构的XRD衍射峰符合的依然很好,只是峰强度降低,表明其晶体结构没有遭到破坏,还可以保持较好的循环稳定性。(018)和(110)处以及(006)和(102)处峰的分离能证明材料保持了良好的层状结构[19],而LiCoO2循环100次后的XRD图不但主峰强度降低较多且(006)、(102)和(018)、(110)峰几乎消失,说明了其层状结构遭到破坏,从而导致了其电化学性能变的较差。该XRD图进一步说明了Li(Co0.9Ni0.05Mn0.05) O2电化学性能优于LiCoO2的结构原因。
样品Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2未循环及循环100次后的交流阻抗谱图见图6。

图6 Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2不同循环下的交流阻抗谱图Fig.6 Nyquist plots of:as-assembled(a)and after 100 cycles(b)of Li(Co0.9Ni0.05Mn0.05)O2and LiCoO2
从图6可知,未循环的交流阻抗图谱均仅有一个大的半圆弧,该半圆的实轴数值即为电荷转移电阻R2;循环100次后交流阻抗图谱均由高频区的小半圆及中频区的大半圆和低频区的直线组成,高频区小半圆表示锂离子在电池材料表面膜通过时产生的阻抗(R1)。中频区半圆则对应电极与电解液界面上的电荷转移阻抗(R2)。低频区的斜线则是表示锂离子在电极中扩散时所引起Warburg阻抗[20]。循环100次后,两种材料的膜阻抗几乎相同,但是界面电荷转移阻抗R2显著不同,可知循环100次后掺杂样品Li(Co0.9Ni0.05Mn0.05)O2的电荷转移电阻比未掺杂样品LiCoO2的小很多。

图7 交流阻抗图谱的拟合等效电路图Fig.7 Equivalent circuit used for fitting the experimental AC impedance data

表2 通过等效电路拟合实验数据所得的电极动力学参数数据Table2 Electrode kinetic parameters obtained from equivalent circuit fitting of experimental data
图7为用来拟合交流阻抗图谱的等效电路图,其中Rs代表电解液、接线端口等的阻抗,R1和CPE1代表表面层阻抗和相应的恒相角元,R2和CPE2代表电荷转移阻抗和相应的恒相角元[21]。其电路图中各元件参数如表2所示。从表2可以看出,循环前后,两种材料的Rs和R1数值变化不大,然而两种材料的R2数值有明显的增加,Li(Co0.9Ni0.05Mn0.05)O2的R2数值由29.3 Ω cm2增大到51.81 Ω·cm2,LiCoO2的R2数值由36.83 Ω·cm2增大到181.6 Ω·cm2,说明掺杂后的材料的极化差和电荷转移电阻较小,这与掺杂后材料的电化学性能提高的结果相吻合。
图8为Li(Co0.9Ni0.05Mn0.05)O2和LiCoO2第1次、2次,100次的循环伏安曲线。

图8 (a)Li(Co0.9Ni0.05Mn0.05)O2和(b)LiCoO2不同次数下的循环伏安曲线Fig.8 Cyclic voltammograms of Li(Co0.9Ni0.05Mn0.05)O2(a)和LiCoO2(b)after different cycles
从图8(a)可以看出,在3 V附近没有出现Mn3+/ Mn4+的氧化还原峰,说明Li(Co0.9Ni0.05Mn0.05)O2化合物中Mn不是活性成分,Mn以Mn4+形式存在[22]。在氧化脱锂过程中在4 V左右出现一个明显的氧化峰,这个氧化峰是不对称的,在高于4 V处还有一个氧化过程存在,这个氧化过程的存在使得高于4 V区的氧化峰宽化。从还原嵌锂过程中,可观到3.8 V处的还原峰,因此,我们认为在C-V曲线中氧化还原过程分别对应高电位区的Co3+/Co4+和低电位区的Ni2+/Ni3+的氧化还原反应[23]。图8(a)中Li(Co0.9Ni0.05Mn0.05)O2氧化还原主峰之间的电势差从第一次循环的178 mV下降到第二次循环的164 mV,图8(b) LiCoO2中氧化还原主峰之间的电势差从第一次循环的228 mV下降到第二次循环的219 mV,说明材料在首次循环时生成不可逆的SEI膜后在充放电过程中的氧化还原反应具有较好的可逆性,极化现象减小。但是循环100次后,Li(Co0.9Ni0.05Mn0.05)O2电势差为由第二次的164 mV升为184 mV,而LiCoO2电势差为由第二次的219 mV升为327 mV,变化较前者大,说明LiCoO2循环100次后极化较Li(Co0.9Ni0.05Mn0.05)O2严重,在C-V曲线上,氧化峰面积等于还原峰面积,这表明充放电电量基本相等[24],反映出该材料在此电压范围内有良好的可逆性,图8(a)的氧化还原峰都较尖锐,氧化还原峰面积相差较小。以上结果与Li(Co0.9Ni0.05Mn0.05)O2电化学性能优于LiCoO2的结果相符。
3 结论
Ni-Mn共掺杂Li(Co0.9Ni0.05Mn0.05)O2材料相比LiCoO2材料在不降低材料初始放电容量的前提下能显著提高材料的循环稳定性。Li(Co0.9Ni0.05Mn0.05)O2材料在3.0~4.4和4.5 V,0.5C下首次放电比容量分别为162.5 mAh·g-1和185 mAh·g-1,在0.5C下循环100次后容量保持率分别为94.4%和93.7%,相比LiCoO2有了较大的提高。材料循环100次后的XRD测试结果表明共掺杂Ni-Mn后材料的晶体结构比未掺杂的纯LiCoO2相对稳定,层状结构明显,有利于锂离子的脱嵌,从而材料的循环稳定性大幅度提高。材料的C-V及EIS测试结果表明了共掺杂Ni-Mn后材料的极化和交流阻抗均较小,材料动力学性能优异,锂离子脱嵌容易,这都与共掺杂后材料的循环稳定性提高相符合。
[1]Li H,Wang Z X,Chen L Q,et al.Adv.Mater.,2009,21(45): 4593-4607
[2]Goodenough J B,Kim Y.Chem.Mater.,2010,22(3):587-603
[3]Shaju K M,Rao G V S,Chowdari B V R.Electrochim.Acta, 2002,48(2):145-151
[4]Fan J,Fedkiw P S.J.Power Sources,1998,72(2):165-173
[5]Manthiram A,Kim J.Chem.Mater.,1998,10(10):2895-2909
[6]Chen Z H,Dahn J R.Electrochem.Solid-State Lett.,2003,6: A221-A224
[7]Kim G H,Myung S T,Bang H J,et al.Electrochem.Solid-State Lett.,2004,7(12):A477-A480
[8]Cho J,Kim G.Electrochem.Solid-State Lett.,1999,2:253-255
[9]Jung H G,Gopal N V,Prakash J,Kim D W,et al.Electrochim. Acta,2012,68:153-157
[10]Zeng D L,Cabana J,breger J,Yoon W S,et al.Chem. Mater.,2007,19:6277-6289
[11]Saadoune I,Labrini M,Yahya M,et al.Electrochim.Acta, 2010,55:5180-5185
[12]Bentaleb Y,Saadoune I,Maher K,et al.J.Power Sources, 2010,195:1510-1515
[13]Ben Kamel K,Amdouni N,Abdel-Ghany A,et al.Ionics, 2008,14:89-97
[14]Hwang B J,Tsai Y W,Carlier D,et al.Chem.Mater.,2003, 15:3676-3682
[15]Yoon W S,Grey C P,Balasubramanian M,et al.Electrochem.Solid-State Lett.,2004,7:A53-A55
[16]Myung S T,Ogata A,Lee K S,et al.Electrochem.Soc., 2008,155:A374
[17]YANG Ping(杨平).Thesis for the Doctorate of Central South University(中南大学博士论文).2009.
[18]Thackeray M M,Johnson C S,Vaughey J T,et al.J.Mater. Chem.,2005,15(23):2257-2267
[19]Xia H,Lu L,Ceder G.J.Alloys Compd.,2006,417(1):304-310
[20]Du K,Huang J L,Cao Y B,et al.J.Alloys Compd.,2013, 574:377-382
[21]Levi M D,Gamolsky K,Aurbach D,et al.Electrochim. Acta,2000,45:1781-1789
[22]Li L J,Li X H,Wang Z X,et al.Powder Technol.,2011, 206:353-357
[23]Shi S J,Tu J P,Tang Y Y,et al.J.Power Sources,2013, 225:338-341
[24]SHI Xiu-Juan(施秀娟).Thesis for the Doctorate of Central South University(中南大学博论文).2006.
Ni,Mn-Codoped High-Voltage LiCoO2Cathode Material for Lithium Ion Batteries
HU Guo-RongLU WeiLIANG Long-WeiCAO Yan-BingPENG Zhong-DongDU Ke*
(School of Metallurgy and Environment,Central South University,Changsha,Hunan 410083,China)
The precursor Co0.9Ni0.05Mn0.05(OH)2of the high-voltage cathode material for lithium ion batteries was synthesized by hydroxide co-precipitation method using the transition metal sulphate as the raw material,NaOH and NH3·H2O as the precipitate agents.Then the corresponding Li(Co0.9Ni0.05Mn0.05)O2was obtained when mixing the precursor with Li2CO3by high solid method.Crystal structure,morphology and electrochemical performance of the sample were investigated by XRD,SEM,Cyclic voltammetry(C-V)method,electrochemical impedance spectroscopy(EIS)test and charge-discharge test.Mixed doping Ni-Mn material Li(Co0.9Ni0.05Mn0.05)O2shows better electrochemical performance compared to LiCoO2as confirmed by the results of C-V,XRD and EIS.When the co-doped product Li(Co0.9Ni0.05Mn0.05)O2was charged to 4.4 and 4.5 V,the initial discharge capacity is 162.5 mAh·g-1and 185 mAh·g-1at 0.5C rate,respectively.After cycling for 100 times,the retention of discharge capacity was 94.4%and 93.7%,respectively.
high-voltage LiCoO2;codoped;co-precipitation;electrochemical performance
TM912.9
A
1001-4861(2015)01-0159-07
10.11862/CJIC.2015.020
2014-08-29。收修改稿日期:2014-10-23。
国家自然科学基金(No.)资助项目。
*通讯联系人。E-mail:dukeben76@yahoo.com.cn

