Fe2O3/TiO2纳米管阵列的制备及其光催化性能
黄益操 赵浙菲 李世雄 邸 婧 郑华均
(浙江工业大学化学工程学院,杭州310032)
Fe2O3/TiO2纳米管阵列的制备及其光催化性能
黄益操 赵浙菲 李世雄 邸 婧 郑华均*
(浙江工业大学化学工程学院,杭州310032)
在钛基体上采用阳极氧化法制备了TiO2纳米管阵列,采用化学浴方法在TiO2纳米管阵列上修饰了Fe2O3纳米颗粒。利用扫描电镜、X射线衍射和紫外可见漫反射光谱等手段对材料进行了表征,同时测试了材料的光电化学性能及其光催化降解亚甲基蓝染料废水的性能。结果表明,Fe2O3纳米颗粒的修饰将TiO2纳米管阵列的光响应拓宽至可见光区域,提高了光电流,Fe2O3/ TiO2纳米管阵列的光电流是未修饰的TiO2纳米管阵列的9倍。而在光催化反应中,亚甲基蓝最高降解率可达80%,比未修饰的TiO2纳米管阵列高出30%。
三氧化铁;二氧化钛纳米管阵列;光催化降解;亚甲基蓝
0 引言
自从Fujishima等[1]于1972年报道了二氧化钛在紫外光辐射下分解水产生氢气以来,利用二氧化钛作为光催化剂,在过去的40余年里引起了人们的广泛关注。Gong等[2]在2001年首次报道了阳极氧化法合成TiO2纳米管阵列。因其具有独特的管阵列结构、优异的光学和电学性能、低成本和高稳定性等特点,在过去的十几年中,二氧化钛纳米管阵列在传感器[3-4]、光解水[5-6]、光催化[7-8]、染料敏化太阳能电池[9-11]等方面得到广泛应用。而与二氧化钛薄膜电极相比,通过阳极氧化法制备的TiO2纳米管阵列,垂直于导电的钛基体上,不仅具有较大的比表面积[12],而且入射光经过散射后提高了光吸收[13],同时其管状结构使电子沿管壁传导,可以有效抑制光激发的电子/空穴对的复合[14-16],使其光催化性能和光电化学性质有明显的增强。
然而,由于二氧化钛的禁带宽度较宽(达到3.0~3.2 eV),其光响应只在紫外区域,而紫外光只占太阳光谱的很小一部分能量(4%)。为了充分利用太阳能,通过二氧化钛与其他窄带隙的光催化材料复合被认为是一种很有前途的方法。Fe2O3具有较低的带隙能(2.1~2.2 eV),且其成本低、无毒、稳定性相对较高。但Fe2O3本身导电性差、电子空穴对容易复合[17-20]。采用Fe2O3与TiO2纳米管阵列的复合,可以使纳米管阵列的吸光性能向可见光区域扩展,从而提高光的利用率,充分利用二氧化钛纳米管阵列优异的光电化学性质。
在本论文中,我们采用热化学浴沉积的方法制备了Fe2O3/TiO2纳米管阵列复合材料。这是合成Fe2O3纳米颗粒复合TiO2纳米管的一个简单而有效的方法。通过控制相关的工艺参数,使得Fe2O3纳米颗粒填充在TiO2纳米管间。这种保留着完整管口的纳米管阵列结构,兼具了Fe2O3与TiO2两种半导体的性能,一方面拓展了复合材料的光响应范围,另一方面提高电子转移能力,使光生电子/空穴的有效分离,从而提高其光催化性能。
1 实验部分
1.1 材料制备
TiO2纳米管阵列制备:采用电化学阳极氧化法制备TiO2纳米管。在阳极氧化前,钛片(纯度99.6%,厚度0.2 mm,宝鸡鹏盛鑫有色金属有限公司)分别在异丙醇、去离子水和乙醇中超声清洗,然后再用氮气吹干。以经前处理的Ti片为阳极,泡沫镍为阴极,电解液为含NH4F质量分数为0.5%,丙三醇和水体积比为4∶1的溶液。在40 V恒定电压下阳极氧化2 h,制得TiO2纳米管阵列。将制得的样品用无水乙醇和去离子水冲洗、风干,在管式炉中以2℃· min-1升温到450℃后,恒温退火处理2 h即得到晶化的TiO2纳米管。
Fe2O3/TiO2纳米管阵列复合材料制备:采用热化学浴的方法,将制备好的TiO2纳米管阵列浸入浓度分别为10、20、40、80 mmol·L-1的FeCl3溶液中,在80℃条件下水浴4 h,然后用去离子水仔细清洗钛片表面并在烘箱中干燥。最后在管式炉中以2℃·min-1升温至450℃恒温退火处理2 h,即得到结晶的Fe2O3/TiO2复合半导体材料。
1.2 材料的表征
材料的表面形貌采用Hitachi S-4700型SEM测定,加速电压15 kV;同时运用VANTAGE ESI X射线能谱仪(EDX;美国Thermo NORAN)分析确定复合材料对应金属氧化物的含量。复合材料表面物相采用X′Pert PRO型高分辨多晶X射线衍射仪(荷兰PNAlytical公司)测定,以Cu靶产生X射线,扫描范围2θ=20°~80°。材料的UV-Vis DRS谱采用紫外-可见漫反射仪(岛津UV-2550型)进行扫描测定。
1.3 材料的光电流及光催化降解亚甲基蓝性能测试
材料的光电流性能测试在传统的三电极体系中进行。以复合材料制备得到的电极(1 cm×1 cm)为工作电极,Pt片电极为对电极,饱和甘汞电极为参比电极,Na2SO4溶液(0.1 mol·L-1)为支持电解液。采用Ivium Vertex电化学工作站进行线性伏安曲线扫描,以氙灯为外照光源模拟太阳光(AM 1.5)。测试均在室温下进行。
材料的光催化性能测试是在一个自制的反应器中进行的。将复合材料样品浸入10 mg·L-1的亚甲基蓝溶液中,先在暗室下搅拌30 min以达到吸附平衡,然后将模拟太阳光垂直照射在钛片表面,每隔30 min取一次样,用紫外-可见分光光度计(岛津UV-1800)测定亚甲基蓝溶液的浓度变化。
2 结果与讨论
2.1 复合材料的表面形貌
图1为TiO2纳米管阵列和Fe2O3/TiO2复合纳米管阵列的扫描电镜图像。从图1(a)TiO2纳米管阵列的表面形貌可以看到,采用阳极氧化法在钛片表面制备得到分布较整齐的TiO2纳米管阵列,管的内径约90~120 nm,管壁厚约10 nm,且管与管之间是相互分离的。图1(b)~(e)为TiO2纳米管阵列在不同浓度FeCl3溶液化学浴后得到的复合材料的表面形貌。可以看到Fe2O3纳米颗粒修饰均匀分布在二氧化钛纳米管表面上,而且随着FeCl3溶液浓度的提高,在TiO2纳米管阵列上的Fe2O3颗粒越来越多。FeCl3溶液为10和20 mmol·L-1化学浴得到的复合材料,Fe2O3颗粒主要沉积在TiO2纳米管阵列中管与管之间的缝隙,且分布均匀,没有覆盖TiO2纳米管管口。随着FeCl3溶液浓度提高到40 mmol·L-1时,有较多的Fe2O3纳米颗粒沉积在TiO2纳米管阵列的管口和管间,当浓度为80 mmol·L-1时纳米管几乎全部被Fe2O3纳米颗粒覆盖。这说明低浓度的掺杂改性有利于Fe2O3纳米颗粒均匀的分布在纳米管阵列的管间,制备得到的Fe2O3/TiO2纳米管阵列复合材料仍然保留着完整的管结构。在FeCl3浓度为20 mmol·L-1溶液化学浴得到的Fe2O3/TiO2纳米管阵列复合材料的EDX谱图见图1(f)所示,可以看到,复合材料表面上存在Ti、O和Fe 3种元素(图中所见的Pt元素,来自于测试前所喷镀的铂层),其中铁元素的含量为2.66%。

图1 TiO2纳米管阵列和Fe2O3/TiO2复合纳米管阵列的扫描电镜SEM图像Fig.1 SEM images of the TiO2nanotube arrays,Fe2O3/TiO2nanotube arrays and EDX spectra
2.2 复合材料的晶体结构
图2为TiO2纳米管阵列和Fe2O3/TiO2纳米管阵列复合材料的XRD图。从图可以看出,经450℃焙烧处理后,TiO2纳米管阵列在2θ=26.2°处出现锐钛矿型TiO2的特征衍射峰,这表明得到TiO2具有很好的结晶性。而对于不同浓度FeCl3溶液化学浴得到的Fe2O3/TiO2纳米管阵列复合材料来说,其XRD图分别为曲线c和d,可以看出复合材料在2θ=26.2°处有TiO2的衍射峰,但衍射峰有所减弱。这表明得到的复合材料中的TiO2具有很好的结晶性,且Fe2O3颗粒的修饰只是使TiO2的衍射峰有所减弱,并没有破坏TiO2纳米管的晶型。说明Fe2O3纳米颗粒修饰在TiO2纳米管阵列上,并不改变TiO2纳米管阵列的晶体结构。曲线c为TiO2纳米管阵列在20 mmol·L-1浓度的FeCl3溶液中化学浴得到复合材料的XRD图,仅表现出TiO2锐钛矿结构的特征峰,并没有出现Fe2O3对应的峰,这是因为复合材料中Fe2O3含量较低,在XRD图上没有表现。曲线d是在FeCl3为40 mmol·L-1浓度溶液化学浴得到复合材料的XRD图,可以发现除有TiO2的衍射峰外,还存在较明显的Fe2O3的衍射峰,表明在高浓度FeCl3溶液化学浴得到复合材料中,有Fe2O3纳米颗粒较多地沉积在TiO2纳米管上,且结晶度较好。

图2 TiO2纳米管阵列和Fe2O3/TiO2纳米管阵列复合材料的XRD衍射图Fig.2 XRD patterns of TiO2nanotube arrays and Fe2O3/ TiO2nanotube array composites
2.3 复合材料的紫外可见吸收光谱
图3为TiO2纳米管和Fe2O3/TiO2纳米管阵列复合材料的紫外可见吸收光谱图(UV-Vis DRS)。曲线a是TiO2纳米管阵列的紫外可见吸收光谱图,从图中可以看出,TiO2纳米管阵列在紫外波段(200~420 nm)有明显吸收,这主要归因于锐钛矿相的TiO2的带隙吸收。从曲线b、c和d可以看到,当TiO2纳米管阵列上修饰Fe2O3纳米颗粒后,其吸收带向红外区域扩展,且在可见光(420~600 nm)范围内的光吸收强度明显增加,而且在高浓度FeCl3溶液下修饰得到的复合材料,其在红外区域的吸收强度越大,吸收光谱的范围拓展得越宽。这主要是由于窄禁带宽度的Fe2O3纳米颗粒在受到光辐射后,光生电子由价带跃迁到导带所需的能量较低,有效地利用可见光。

图3 TiO2纳米管阵列和Fe2O3/TiO2纳米管阵列复合材料的紫外可见吸收光谱Fig.3 UV-Vis DRS of TiO2nanotube arrays and Fe2O3/ TiO2nanotube array composites
2.4 复合材料的光电流响应性能
图4为TiO2纳米管阵列和Fe2O3/TiO2纳米管阵列复合材料的光生电流响应结果。从图4可以看到,在偏压为0.5 V时,在AM 1.5的模拟太阳光照射下,未修饰Fe2O3的TiO2纳米管阵列和Fe2O3/TiO2纳米管阵列复合材料都能产生光电流,修饰了Fe2O3的TiO2纳米管阵列的电流值明显大于未修饰的TiO2纳米管阵列的光电流值。且光电流值随着Fe含量的提高先上升后下降,这可能是因为随着FeCl3溶液浓度的提高Fe2O3在TiO2纳米管阵列表面沉积的量越来越多,多余的Fe2O3纳米颗粒成为光生电子和空穴对的复合中心,而且更多的Fe2O3纳米颗粒覆盖了TiO2纳米管,使得TiO2材料无法正常接受光的辐射,从而降低了复合材料的光响应能力。在用20 mmol·L-1的FeCl3溶液修饰所得的复合材料光电流值最大,是未修饰TiO2纳米管阵列所得到光电流的9倍。可能是因为偏压的加入,能够使复合材料的光生电子-空穴的分离效果更好,使得光电流有明显提高。

图4TiO2纳米管阵列和Fe2O3/TiO2纳米管阵列复合材料的光电流响应图Fig.4 Photocurrent response of TiO2nanotube arrays and Fe2O3/TiO2nanotube arrays
图5 为20 mmol·L-1FeCl3溶液中的Fe2O3/TiO2纳米管阵列复合材料在经过不同温度煅烧后的光生电流响应结果。从图5可以看到,在偏压为0.5 V时,在AM 1.5的模拟太阳光照射下,不同温度处理后的Fe2O3/TiO2纳米管阵列复合材料光电流响应的结果不同,当处理温度为350℃时,光电流最小,450℃时,光电流最大,随着煅烧温度的升高,在550和650℃时光电流都有所下降,但都要比350℃时要高。这可能是因为在较低温度时,材料结晶度低,光生电子-空穴容易复合,故光电流较低。随着温度的升高,材料结晶度提高,光电流也有较明显的提高。
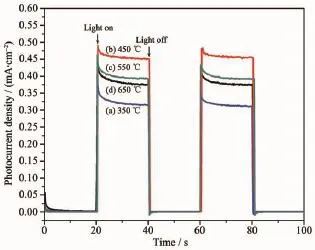
图5 Fe2O3/TiO2纳米管阵列复合材料在不同温度煅烧后的光电流响应图Fig.5 Photocurrent response of Fe2O3/TiO2nanotube arrays at different temperature
2.5 复合材料的光催化性能
图6为TiO2纳米管阵列和Fe2O3/TiO2纳米管阵列复合材料的光催化降解亚甲基蓝性能。由图6可见,当光照时间为2 h时,在浓度为20 mmol·L-1的FeCl3溶液中修饰得到的Fe2O3/TiO2纳米管阵列复合材料的光催化降解效果最佳,与光电流响应性能结果一致。此时,亚甲基蓝的降解率达到80%,比未修饰的TiO2纳米管阵列高出30%。当修饰的浓度达到40和80 mmol·L-1时,降解的效率随着浓度的增高而降低,这可能是由于Fe2O3修饰量增多,成为光生电子和空穴对的复合中心,导致光催化性能的降低;还可能由于FeCl3溶液浓度太大,造成Fe2O3纳米颗粒覆盖了TiO2纳米管,使得TiO2材料无法正常接受光的辐射,从而降低了复合材料的光催化活性。

图6TiO2纳米管阵列和Fe2O3/TiO2纳米管阵列复合材料的光催化降解亚甲基蓝性能Fig.6 Photocatalytic degradation of methylene blue performance
图7 为20 mmol·L-1FeCl3溶液中的Fe2O3/TiO2纳米管阵列复合材料在经过不同温度煅烧后的光催化降解亚甲基蓝性能。由图7可见,当光照时间为2 h的时候,在450℃下处理的Fe2O3/TiO2纳米管阵列复合材料的光催化降解效果最佳,350℃处理的材料降解效率最低。而当温度继续升高时,在550和650℃中处理的材料降解效果都下降了。可能是因为处理温度较低时材料结晶度差,光生电子-空穴对已复合,而表面也可能包覆着一些未被烧去的杂质,使光催化性能受到影响。随着煅烧温度升高,材料结晶度提高,材料光催化性能得到提高。但随着温度继续升高,降解效果下降了,可能是由于随着温度升高,TiO2晶粒变大,表面活性位点减少,使得光催化活性有所下降。

图7Fe2O3/TiO2纳米管阵列复合材料在不同温度煅烧后的光催化降解亚甲基蓝性能Fig.7 Photocatalytic degradation of methylene blue performance at different temperature
图8 为20 mmol·L-1FeCl3溶液中的Fe2O3/TiO2纳米管阵列复合材料的光催化循环试验。经过4次循环后亚甲基蓝的降解率仍能保持在75%以上。这一结果表明所制备的Fe2O3/TiO2纳米管阵列复合材料具有较好的光催化稳定性,具有潜在的使用价值。
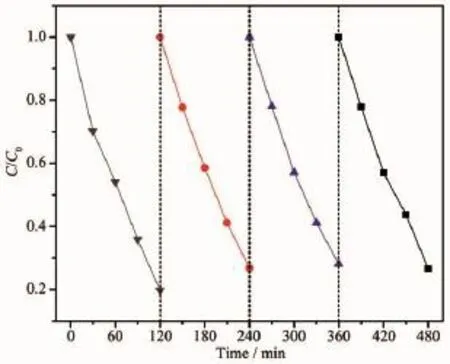
图820 mmol·L-1FeCl3溶液中的Fe2O3/TiO2纳米管阵列复合材料的光催化循环曲线Fig.8 Recycling photocatalytic curves on Fe2O3/TiO2nanotube composite fabricated in 20 mmol·L-1FeCl3solution
通过以上光电流响应和光催化结果分析可知,Fe2O3/TiO2纳米管阵列复合材料在模拟太阳光照射下具有较好的电化学特性和光催化性能。主要是因为,将Fe2O3纳米颗粒沉积到TiO2纳米管阵列的管间,形成Fe2O3/TiO2纳米管阵列复合材料,保留了纳米管较大的比表面积,使其与溶液接触的面积更大。又由于Fe2O3带隙较窄,能够吸收可见光,可以提高材料的对光的吸收。而且Fe2O3的导带比TiO2的导带更正,电子很容易从Fe2O3的导带传输到TiO2的导带,累积在Fe2O3的导带上的电子会和吸附在材料表面的氧分子结合,生成超氧自由基,而留在TiO2价带上的空穴则与水反应生成羟基自由基和氢离子,其机理如图9所示。这些生成的自由基会将溶液中的亚甲基蓝分解成小分子的水和二氧化碳。

图9 Fe2O3/TiO2纳米管阵列复合材料的光催化原理示意图Fig.9 Scheme for photocatalytic mechanism of Fe2O3/TiO2nanotube composite
3 结论
采用阳极氧化法和化学浴沉积的方法制备了Fe2O3/TiO2纳米管阵列复合材料。通过Fe2O3纳米颗粒的修饰该材料提高了TiO2纳米管阵列在可见光区域的吸收强度,材料的光电流也得到了很大提升。通过测试可得,在浓度20 mmol·L-1的FeCl3溶液中修饰的Fe2O3/TiO2纳米管阵列,经过450℃煅烧后,光电流是未修饰的TiO2纳米管阵列的9倍,其光催化降解亚甲基蓝最高降解率可达80%,比未修饰的TiO2纳米管阵列高出30%。
[1]Fujishima A,Honda K.Nature,1972,238(5358):37-38
[2]Gong D,Grimes C A,Varghese O K,et al.J.Mater.Res., 2001,16(12):3331-3334
[3]Varghese O K,Gong D,Paulose M,et al.Adv.Mater.,2003, 15(7-8):624-627
[4]Peng X,Cao G Z,Zhou M,et al.Electrochim.Acta,2012, 76:512-517
[5]Mor G K,Shankar K,Paulose M,et al.Nano Lett.,2005,5 (1):191-195
[6]Gong J Y,Pu W H,Yang C Z,et al.Catal.Commun.,2013, 36:89-93
[7]Albu S P,Ghicov A,Macak J M,et al.Nano Lett.,2007,7 (5):1286-1289
[8]Niraula M,Adhikari S,Lee D Y,et al.Chem.Phys.Lett., 2014,593:193-197
[9]Gao X F,Sun W T,Hu Z D,et al.J.Phys.Chem.C,2009, 113(47):20481-20485
[10]Yodyingyong S,Zhou X Y,Zhang Q F,et al.J.Phys.Chem. C,2010,114(49):21851-21855
[11]Yip C T,Guo M,Huang H T,et al.Nanoscale,2012,4(2): 448-450
[12]Xiong F Q,Wei X M,Li C,et al.J.Mater.Chem.A,2014, 2(13):4510-4513
[13]Ong K G,Varghese O K,Mor G K,et al.Sol.Energ Mater. Sol.Cells,2007,91(4):250-257
[14]Yu J G,Wang B.Appl.Catal.B:Environ.,2010,94(3/4):295 -302
[15]Xie K P,Sun L,Wang C L,et al.Electrochim.Acta,2010, 55(24):7211-7218
[16]Shankar K,Bandara J,Paulose M,et al.Nano Lett.,2008,8 (6):1654-1659
[17]Kay A,Cesar I,Gratzel M.J.Am.Chem.Soc.,2006,128(49): 15714-15721
[18]Han W Q,Wen W,Yi D,et al.J.Phys.Chem.C,2007,111 (39):14339-14342
[19]Beranek R,Macak J M,Gartner M,et al.Electrochim.Acta, 2009,54(9):2640-2646
[20]Tahir A A,Wijayantha K G U,Yarahmadi S S,et al.Chem. Mater.,2009,21(16):3763-3772
Preparation and Photocatalytic Properties of Fe2O3/TiO2Nanotube Arrays
HUANG Yi-CaoZHAO Zhe-FeiLI Shi-XiongDI JingZHENG Hua-Jun*
(College of Chemical Engineering,Zhejiang University of Techonogy,Hangzhou 310032,China)
TiO2nanotube array was prepared by anodic oxidation method on the titanium substrate,and Fe2O3nanoparticles was successfully deposited on TiO2nanotube array by a chemical bath method.Scanning electron microscopy(SEM),X-ray diffraction(XRD)and UV-Vis diffuse reflectance spectroscopy was applied to characterize their properties and the photoelectrochemical properties and the performance of photocatalytic degradation of methylene blue was investigated.The results indicated that the Fe2O3modification not only broadened the absorption spectrum of TiO2nanotube arrays to the visible light region,but also increased the photocurrent.The photocurrent response of Fe2O3modified TiO2nanotube arrays was 9 times higher than undecorated TiO2nanotube arrays.In the photocatalytic reaction,the highest methylene blue degradation rate can reach 80%,which was 30%higher than the bare TiO2nanotube arrays.
iron oxide;TiO2nanotubes array;photocatalytic degradation;methylene blue
O614.41+1;O614.81+1
A
1001-4861(2015)01-0133-07
10.11862/CJIC.2015.037
2014-07-31。收修改稿日期:2014-10-20。
浙江省科技计划(No.2009R50002-20)资助项目。
*通讯联系人。E-mail:zhenghj@zjut.edu.cn

