子宫内膜癌中NF-κB、MCP-1蛋白的表达及意义*
李彩霞,江 玲△,邓 伟,黄江生
(南京中医药大学附属昆山市中医医院:1.妇产科;2.病理科,江苏昆山 215300)
论著·临床研究
子宫内膜癌中NF-κB、MCP-1蛋白的表达及意义*
李彩霞1,江 玲1△,邓 伟2,黄江生2
(南京中医药大学附属昆山市中医医院:1.妇产科;2.病理科,江苏昆山 215300)
目的 检测子宫内膜癌组织中核转录因子-κB(NF-κB)、单核细胞超化蛋白-1(MCP-1)的表达并探讨其意义。方法 选取该院及江苏省苏北人民医院2003年1月至2013年12月子宫内膜癌标本52例,采用免疫组织化学SP法检测52例子宫内膜癌、16例子宫内膜不典型增生、19例增生期子宫内膜中NF-κB、MCP-1蛋白的表达,及子宫内膜癌中两者与临床病理特征的关系和两者间的相关性。结果 子宫内膜癌组织中NF-κB、MCP-1蛋白的表达明显高于子宫内膜不典型增生、增生期子宫内膜(P<0.05),NF-κB和MCP-1的表达与组织学分级、肌层浸润深度有关(P<0.05),与临床分期、淋巴结转移无关(P>0.05),二者之间的表达呈正相关(r=0.895,P<0.05)。结论 NF-κB、MCP-1蛋白参与子宫内膜癌的发生发展过程。
子宫内膜肿瘤;NF-κB;MCP-1;免疫组织化学
核转录因子-κB(NF-κB)是一个重要转录调控因子,参与许多靶基因的转录调控。研究报道称,凡启动子或增强子中含有NF-κB结合位点的基因均可接受核因子κB的调节[1]。单核细胞趋化蛋白-1(MCP-1)作为CC趋化因子家族的主要成员,具有趋化及活化单核巨噬细胞的功能,其基因启动子部位存在NF-κB的结合位点[2]。因此,NF-κB通过调控MCP-1,参与多种疾病的发生、发展过程。本文通过对子宫内膜癌中NF-κB、MCP-1的检测,探讨他们在子宫内膜癌中的表达及与临床病理特征的联系,以及NF-κB与MCP-1两者间的相关性,以期为子宫内膜癌中两者间的调控机制的研究及探讨子宫内膜癌的诊断治疗新策略奠定研究基础。
1 资料与方法
1.1 一般资料 选取本院及江苏省苏北人民医院2003年1月至2013年12月子宫内膜癌标本52例,平均年龄(52.6±6.4)岁,所有子宫内膜癌患者术前均未行放、化疗及激素治疗。按2000年国际妇产科联盟(FIGO)标准进行临床病理分期及组织学分级:I期39例,Ⅱ期7例,Ⅲ期5例,Ⅳ期1例;G1级20例,G2级13例,G3级19例;病灶局限于黏膜层及浸润小于1/2肌层16例,浸润大于 1/2肌层36例;有淋巴结转移6例,无淋巴结转移46例。另有子宫内膜不典型增生标本16例,因子宫肌瘤行手术切除子宫的增生期子宫内膜19例。
1.2 方法 兔抗人多克隆NF-κ Bp65抗体浓缩液,购于Immunoway公司,工作浓度1∶200;兔抗人多克隆MCP-1抗体浓缩液,购于北京博奥森公司,工作浓度1∶200。免疫组织化学SP试剂盒、DAB显色试剂购于福州迈新生物技术有限公司。所有标本均为石蜡包埋的存档标本,连续切片4 张,厚5 μm。采用免疫组织化学SP二步法,取已知切片作为阳性对照,以PBS缓冲液代替一抗作为阴性对照。
1.3 结果判定 NF-κB p65亚基免疫组化阳性产物呈棕黄色细颗粒状,主要定位于肿瘤细胞细胞质中。MCP-1免疫组织化学阳性产物呈棕黄色细颗粒状,主要定位于肿瘤细胞细胞质中。参照Ozdemir方法按切片中阳性物质的量及表达强度分为4级:高倍镜下随机观察记数10个高倍视野(×200),不少于1 500个细胞中阳性细胞所占百分数,根据阳性细胞数和显色强度分为,(-):阳性细胞数小于5%或无阳性物质的表达;(+):阳性细胞数5%~<25%或显色浅;(++):阳性细胞数25%~<50%或显色深;(+++):阳性细胞数大于或等于50%及显色深。
1.4 统计学处理 采用SPSS12.0统计软件,有序分类变量资料采用秩和检验,计数资料以率表示,采用χ2检验,两者之间的相关性运用Spearman相关分析检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 3组中NF-κB蛋白的表达 NF-κB在增生期子宫内膜、子宫内膜不典型增生、子宫内膜癌中阳性表达率分别为15.79%、18.75%、82.69%。三者间的差异有统计学意义(χ2=36.57,P<0.05)。其中增生期子宫内膜与子宫内膜不典型增生两者的表达率差异无统计学意义(χ2=0.00,P>0.05),增生期子宫内膜与子宫内膜癌两者的表达率差异有统计学意义(χ2=27.30,P<0.05),子宫内膜不典型增生与子宫内膜癌两者的表达率差异有统计学意义(χ2= 22.86,P<0.05)。NF-κB在增生期子宫内膜、子宫内膜不典型增生、子宫内膜癌中表达强度有统计学意义(P<0.05),3组两者之间表达强度均有统计学意义(P<0.05),见表1,图1。

表1 NF-κB在3组中的表达(n)
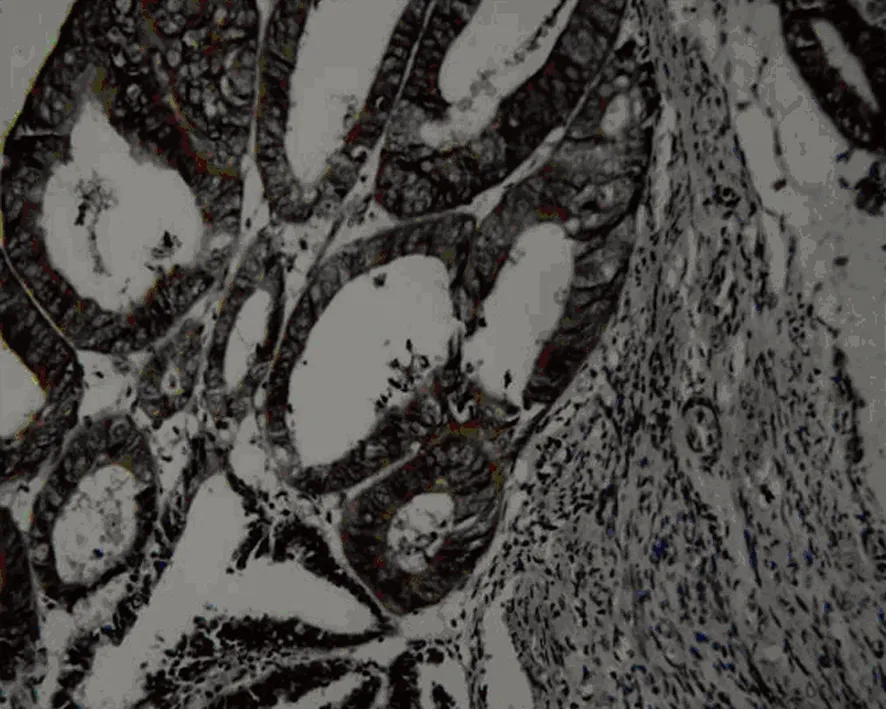
图1 NF-κB在子宫内膜癌中的表达 (SP×200)
NF-κB在子宫内膜癌Ⅰ期、Ⅱ-IV期中阳性表达率分别为79.49%、92.31%,两者的阳性表达率差异无统计学意义(P>0.05),两者的表达强度有统计学意义(P<0.05)。NF-κB在子宫内膜癌高分化、中低分化中阳性表达率分别为65.00%、93.75%,两者的阳性表达率差异有统计学意义(P<0.05),两者的表达强度有统计学意义(P<0.05)。NF-κB在子宫内膜癌肌层浸润深度小于1/2、大于1/2中阳性表达率分别为62.50%、91.67%,两者的阳性表达率差异有统计学意义(P<0.05),两者的表达强度差异有统计学意义(P<0.05)。NF-κB在子宫内膜癌无淋巴结转移、有淋巴结转移中阳性表达率分别为82.61%、83.33%,两者的阳性表达率差异无统计学意义(P>0.05),两者的表达强度有统计学意义(P<0.05),见表2。

表2 NF-κB与子宫内膜癌临床病理关系(n)
2.2 3组中MCP-1蛋白的表达 MCP-1在增生期子宫内膜、子宫内膜不典型增生、子宫内膜癌中阳性表达率分别为10.53%、12.50%、76.92%。三者间的差异有统计学意义(χ2=35.91,P<0.05)。其中增生期子宫内膜与子宫内膜不典型增生两者的表达率差异无统计学意义(χ2=0.00,P>0.05),增生期子宫内膜与子宫内膜癌两者的表达率差异有统计学意义(χ2=25.39,P<0.05),子宫内膜不典型增生与子宫内膜癌两者的表达率差异有统计学意义(χ2=21.50,P<0.05)。MCP-1在增生期子宫内膜、子宫内膜不典型增生、子宫内膜癌中表达强度差异有统计学意义(P<0.05),增生期子宫内膜与子宫内膜不典型增生两者的表达强度差异有统计学意义(P<0.05),增生期子宫内膜与子宫内膜癌两者的表达强度有统计学意义(P<0.05),子宫内膜不典型增生与子宫内膜癌两者的表达强度无统计学意义(P>0.05)。见表3,见图2。

表3 MCP-1在3组中的表达(n)
MCP-1在子宫内膜癌Ⅰ期、Ⅱ-Ⅳ期中阳性表达率分别为76.92%、76.92%,两者的阳性表达率差异无统计学意义(χ2=0.00,P>0.05),两者的表达强度有统计学意义(P<0.05)。MCP-1在子宫内膜癌高分化、中低分化中阳性表达率分别为55.00%、90.63%,两者的阳性表达率差异有统计学意义(χ2=6.91,P<0.05),两者的表达强度有统计学意义(P<0.05)。MCP-1在子宫内膜癌肌层浸润深度小于1/2、大于1/2中阳性表达率分别为50.00%、88.89%,两者的阳性表达率差异有统计学意义(χ2=7.37,P<0.05),两者的表达强度差异有统计学意义(P<0.05)。MCP-1在子宫内膜癌无淋巴结转移、有淋巴结转移中阳性表达率分别为76.09%、83.33%,两者的阳性表达率差异无统计学意义(χ2=0.00,P>0.05),两者的表达强度差异有统计学意义(P<0.05),见表4。
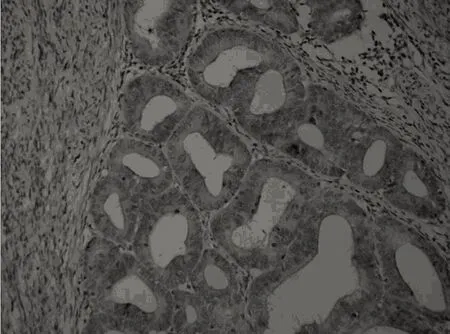
图2 MCP-1在子宫内膜癌中的表达 (SP×200)

表4 MCP-1与子宫内膜癌临床病理关系(n)
2.3 NF-κB、MCP-1在子宫内膜癌组织中的相关性分析 NF-κB和MCP-1在子宫内膜癌组织中的表达呈显著正相关(r=0.895,P<0.05),见表5。

表5 NF-κB和MCP-1蛋白在子宫内膜癌组织中的相关性(n)
3 讨 论
NF-κB是重要转录调控因子,它广泛存在于细胞中,参与机体的多种调节功能,如免疫应答[3]、细胞增殖[4]、生长分化[5]、细胞周期、凋亡[6],而且与肿瘤的发生发展浸润转移密切相关[7]。Pallares等[8]的研究发现,NF-κB可能通过调控细胞增殖和凋亡在子宫内膜癌的发生、发展过程中发挥举足轻重的作用。王琰等[9]研究发现NF-κB在子宫内膜癌组织中的表达明显高于正常子宫内膜组织,并且NF-κB的阳性表达与子宫内膜癌中淋巴结转移、病理分期、浸润深度及组织学分级有关。本研究显示NF-κB在子宫内膜癌组织中的阳性表达率明显高于增生期子宫内膜和子宫内膜不典型增生,且NF-κB在子宫内膜癌中低分化组阳性表达率明显高于高分化者,肌层浸润深度大于1/2者中阳性表达率明显高于肌层浸润深度小于1/2者,可见NF-κB参与了子宫内膜癌发生、发展、浸润、转移的生物学过程。
MCP-1是CC趋化因子家族成员之一。MCP-1主要由单核细胞、淋巴细胞、成纤维细胞、内皮细胞及人和鼠的肿瘤细胞分泌。MCP-1参与多种疾病的发生、发展,包括动脉粥样硬化[10]、炎性反应[11]、肿瘤[12]等。郑晓霞等[13]的研究发现,子宫内膜癌组织中单核细胞趋化蛋白在mRNA和蛋白水平均表达明显增强,单核细胞趋化蛋白对子宫内膜癌的发病及进展均有一定的促进作用。本研究显示MCP-1在子宫内膜癌组织中的阳性表达率明显高于增生期子宫内膜和子宫内膜不典型增生,且MCP-1在子宫内膜癌中低分化者阳性表达率明显高于高分化者、肌层浸润深度大于1/2者中阳性表达率明显高于肌层浸润深度小于1/2组,可见MCP-1参与了子宫内膜癌发生、发展、浸润、转移的生物学过程。
MCP-1基因是一种小的可诱导基因家族成员之一,其基因启动子部位存在NF-κB的结合位点。Deng等[14]的研究发现MCP-1通过NF-κB信号通路调控低氧新生大鼠脑室周白质中神经胶质细胞的迁移。Panicker等[15]的研究发现,高血糖通过NF-κB引起内皮细胞中MCP-1的合成。Ning等[16]的研究发现人成骨细胞中的金黄色葡萄球菌通过激活NF-κB信号通路调节MCP-1的分泌。Lee等[17]的研究发现,在聚氨酯诱导的肺癌模型中CC趋化因子受体5的缺乏通过灭活NF-κB、抑制MCP-1抑制肿瘤的发展。本研究显示NF-κB和MCP-1在子宫内膜癌组织中的表达呈显著正相关,提示NF-κB可能通过调节MCP-1基因的表达在子宫内膜癌发生发展过程中发挥举足轻重的作用。
本研究显示NF-κB、MCP-1参与了子宫内膜癌发生、发展、浸润、转移的生物学过程,且两者在子宫内膜癌组织中的表达呈显著正相关,这有利于进一步解析子宫内膜癌的发病机制,并发现更多的治疗靶点,以利于在不同层面阻断子宫内膜癌发生、发展的信号传导通路,从而为其防治策略探索新思路。
[1]Smale ST.Dimer-specific regulatory mechanisms within the NF-kappa B family of transcription factors[J].Immunol Rev,2012,246(1):193-204.
[2]李彩霞,孔祥.单核细胞趋化蛋白1与妇科肿瘤[J].医学综述,2008,14(16):2444-2447.
[3]刘彬果,杨本明,高骥.NF-κB在肠道炎症和免疫应答中的作用[J].胃肠病学和肝病学杂志,2009,18(10):886-888.
[4]何晓鹏,毕研文,刘相燕,等.NF-κB信号通路阻断对内皮细胞增殖的抑制作用观察[J].山东医药,2011,51(38):25-27.
[5]阎潇,李菲菲,刘丽娟,等.核转录因子κB信号通路在应力调控成肌细胞分化中的作用[J].中国组织工程研究,2012,16(24):4441-4446.
[6]张瑞,王选.大鼠急性胰腺炎中核因子NF-κB抗凋亡机制的研究[J].中国现代医学杂志,2005,15(24):3740-3742.
[7]Mayo MW,Baldwin AS.The transcription factor NF-KB:control of oncogenesis and cancer therapy resistance[J].Biochim Biophys Acta,2000,1470(2):M55-62.
[8]Pallares J,Martinez-Guitarte JL,Dolcet X,et al.Abnormalities in the NF-kappa B family and related proteins in endometrial carcinoma[J].J Pathol,2004,204(5):569-577.
[9]王琰,赵学锋,杨华英,等.P-P38和NF-κB蛋白在子宫内膜癌中的表达及临床意义[J].大连医科大学学报,2012,34(6):550-553.
[10]Tan CH,Liu Y,Li WN,et al.Associations of matrix metalloproteinase-9 and monocyte chemoattractant protein-1 concentrations with carotid atherosclerosis,based on measurements of plaque and intima-media thickness[J].Atherosclerosis,2014,232(1):199-203.
[11]Strecker JK,Minnerup J,Schuette-Nuetgen K,et al.Monocyte chemoattractant protein-1-Deficiency results in altered Blood-Brain barrier breakdown after experimental stroke[J].Stroke,2013,44(9):2536-2544.
[12]Nikolic Nielsen L,Kjelgaard-Hansen M,Kristensen AT.Monocyte chemotactic protein-1 and other inflammatory parameters in Bernese Mountain dogs with disseminated histiocytic sarcoma[J].Vet J,2013,198(2):424-428.
[13]郑晓霞.单核细胞趋化蛋白在子宫内膜癌的表达和临床意义[J].中国妇幼保健,2012,27(26):4116-4117.
[14]Deng YY,Lu J,Ling EA,et al.Monocyte chemoattractant protein-1 (MCP-1) produced via NF-kappa B signaling pathway mediates migration of amoeboid microglia in the periventricular white matter in hypoxic neonatal rats[J].Glia,2009,57(6):604-621.
[15]Panicker SR,Kartha CC.Curcumin attenuates Glucose-Induced monocyte chemoattractant protein-1 synthesis in aortic endothelial cells by modulating the nuclear factor-kappa B pathway[J].Pharmacology,2010,85(1):18-26.
[16]Ning R,Zhang X,Guo X,et al.Staphylococcus aureus regulates secretion of interleukin-6 and monocyte chemoattractant protein-1 through activation of nuclear factor kappaB signaling pathway in human osteoblasts[J].Braz J Infect Dis,2011,15(3):189-194.
[17]Lee NJ,Choi DY,Song JK,et al.Deficiency of C-C chemokine receptor 5 suppresses tumor development via inactivation of NF-kappa B and inhibition of monocyte chemoattractant protein-1 in urethane-induced lung tumor model[J].Carcinogenesis,2012,33(12):2520-2528.
Expression and significance of NF-κB and MCP-1 in endometrial carcinoma*
LiCaixia1,JiangLing1△,DengWei2,HuangJiangsheng2
(1.DepartmentofGynecologyandObstetrics,AffiliatedKunshanHospitalofofNanjingChineseMedicineUniversity,Kunshan,Jiangsu215300,China;2.DepartmentofPathology,AffiliatedKunshanHospitalofofNanjingChineseMedicineUniversity,Kunshan,Jiangsu215300,China)
Objective To detect the expression of NF-κB,MCP-1 in the endometrial carcinoma and their significance.Methods The expression of NF-κB,MCP-1 in 52 cases of patients with endometrial carcinoma selected from January 2003 to December 2013,and in 16 cases of endometrial atypical hyperplasia and 19 cases of proliferative endometrial were detected by immunohistochemistry assay.The relationship and correlation between clinical pathological characteristics was analyzed.Results The expressions of NF-κB,MCP-1 proteins were significantly higher in the endometrial carcinoma than those of the endometrial atypical hyperplasia and proliferative endometrial (P<0.05).The expressions of NF-κB and MCP-1 were related with histological grade and myometrial invasion (P<0.05),but independent of clinical stage and lymph node metastasis (P>0.05).The expressions of these two proteins were positively correlated(r=0.895,P<0.05).Conclusion NF-κB,MCP-1 may participate in the progress of endometrial carcinoma.
endometrial neoplasms;NF-κB;MCP-1;immunohistochemistry
10.3969/j.issn.1671-8348.2015.01.012
昆山科技发展项目(KS1253)。 作者简介:李彩霞(1981-),主治医师,硕士,主要从事妇科肿瘤方向研究。△
,Tel:15950921628;E-mail:lilianglcx@sit.edu.cn。
R711
A
1671-8348(2015)01-0036-04
2014-08-12
2014-10-25)

