声学密度定量技术在胸部放疗致心脏损害评价中的应用
侯海燕
山东省妇幼保健院,山东 济南 250014
声学密度定量技术在胸部放疗致心脏损害评价中的应用
侯海燕
山东省妇幼保健院,山东 济南 250014
目的 探讨常规超声心动图及声学密度定量技术评价胸部放疗致心脏损害的临床应用价值。方法 测定并比较120例胸部肿瘤患者放疗前和放疗后6个月的常规超声心动图参数及声学密度定量参数;以29例健康志愿者作为平行对照组,记录其在相同时间间隔内的上述参数变化。结果 与放疗前相比,15例患者(12.5%)出现常规超声心动图检查异常;声学密度定量显示部分患者心肌平均背向散射积分(IBS)、IBS%升高,心肌背向散射积分周期变化幅度(CVIB)、CVIB%降低。其中,放疗联合蒽环类化疗组上述参数的变化比单纯放疗组和放疗联合其他化疗剂组更为明显;放疗联合其他化疗剂组的心脏损害较单纯放疗组显著。平行对照组在首次检查6个月后再查未出现上述参数异常。结论 常规超声心动图及声学密度定量技术可用于评价放疗所致的心脏结构、功能和血流动力学异常。与常规超声心动图检查相比,声学密度定量技术能更早、更敏感地评价放疗致心脏微观结构改变和功能受损。放疗联合化疗尤其是蒽环类化疗剂可加重心脏损害。
声学密度定量技术;超声心动图;放射治疗;心脏损害
大量动物和临床实验证实[1-3],胸部放射治疗在杀伤肿瘤细胞的同时,也可导致心脏损害,严重影响患者的预后与生活质量。声学密度定量技术(Acoustic Densitometry,AD)基于心肌病理与超声特征之间的因果关系,可通过对心肌物理状态变化即声学特性改变的检出和量化,检测心肌细微组织的病理变化从而达到评价心肌的组织病理学特征性改变的目的[4]。已有许多研究表明,声学密度定量的量化参数——心肌背向散射积分(Integrated Backscatter,IBS)的测定可以检测心肌超微结构的变化,进而评价心肌组织病理学特性的改变[5-6],但在评价胸部放疗致心脏损害方面的报道较少。本研究通过对120例胸部肿瘤患者行放疗前和放疗后6个月的常规超声心动图参数及声学密度定量参数测定,探讨声学密度定量技术评价胸部放疗致心脏损害的临床应用价值。
1 资料与方法
1.1 研究对象
选取2013年6月~2014年6月于本院接受胸部放疗的患者120例,其中男67例,女53例;年龄33~77岁,平均(48.70±9.23)岁;左肺癌45例,左侧乳腺癌28例,食管癌20例,纵隔淋巴瘤17例,胸腺瘤10例,均经手术或穿刺病理证实。所有患者在放疗前经临床和相关辅助检查排除冠心病、高血压、心肌病、瓣膜病、肺心病及心肌炎和糖尿病等器质性疾病。
上述患者依据是否同时应用化疗剂及化疗剂种类分为单纯放疗组(Ⅰ组)27例,放疗联合蒽环类化疗组(Ⅱ组)36例,放疗联合其他化疗剂组(Ⅲ组)57例。放疗均采用常规分割照射,每次2 Gy,每周5次,连续6~8周,累积剂量40~76 Gy(平均63.5 Gy)。
对照组(Ⅳ组)29例,均为健康志愿者,年龄31~69岁,平均(46.90±10.31)岁。
1.2 仪器与方法
1.2.1 仪器
采用Philips Sonos-7500型彩色多普勒超声诊断仪,探头频率为2~4 MHz,该机配有AD联机分析软件及光盘存储功能。
1.2.2 心肌背向散射积分参数测定
受检者左侧卧位,取标准胸骨旁左室长轴切面,启动AD-IBS程序。
(1)仪器设置:采样深度固定为14 cm,增益固定为60 dB,调整时间增益补偿,得到良好的背向散射积分二维图像,使室间隔和左室后壁信号强度相近,在实验过程中各项仪器设置保持不变。
(2)心肌背向散射积分二维图像的采集:联接心电监测电极以确定心脏运动时相,嘱受检者呼气末屏住呼吸,将连续2.48 s内的62帧图像以Loop形式储存于内存中或转录到磁光盘中,待脱机后进行分析测定。
(3)心肌背向散射积分的分析测定:感兴趣区(ROI)取样框形态采用新月形,凹面朝向左室腔,长轴与室壁运动方向垂直,大小为21 Pixel×21 Pixel,置于室间隔及左室后壁中间段的心肌层内,随心动周期运动,注意避开心内膜与心外膜及强回声信号的干扰。分别测量以下参数:①IBS,单位:dB;②心肌背向散射积分周期变化幅度(Cyclic Variation of IBS,CVIB),单位:dB;③背向散射积分的标化值(IBS%):心肌IBS值和同一声束扫描线上心包IBS值的比值;④背向散射积分周期变异率(CVIB%)=CVIB/IBS×100%,即用同一采样部位的心肌IBS值校正CVIB。上述所测数据均取3次测量的平均值。
1.3 统计学分析
应用SPSS 12.0统计软件进行数据分析,计量资料以均值加减标准差(x-±s)表示,行自身对照t检验;组间比较采用方差分析Q检验(Student-Newman-Keuls法),以P<0.05为差异有统计学意义,以P<0.01为差异有高度统计学意义。
2 结果
2.1 放疗组与平行对照组临床资料比较分析
两组间年龄、身高、体重和心率差异无统计学意义(P>0.05),具有可比性。
2.2 放疗前后心脏结构指标比较分析
120例胸部放疗患者中,15例常规超声心动图表现异常(12.5%),其中心包积液7例,为少或中量;瓣膜形态改变及反流6例,其中主动脉瓣反流3例,二尖瓣反流2例,主动脉瓣及二、三尖瓣均有反流1例,为轻、中度反流;心包壁增厚2例。上述15例患者中,9例采用放疗联合蒽环类化疗,4例采用放疗联合其他化疗剂,2例采用单纯放疗。放疗前后3组间比较,左房室内径、室间隔和左室后壁厚度无统计学意义。
2.3 放疗前后心功能指标比较分析
34例患者(28.3%)放疗后出现一项或多项左室舒张功能指标异常(E/A<1、DT或IVRT延长)。肺动脉高压2例,均为轻度。但上述患者左室射血分数及短轴缩短率无明显变化。
2.4 声学密度定量指标比较分析
(1)放疗前各组声学密度定量指标比较:与Ⅰ组、Ⅲ组相比,Ⅱ组心肌IBS增高(P<0.05),IBS%增高(P<0.05);而CVIB降低(P<0.05),CVIB%亦降低(P<0.05)。Ⅰ组、Ⅲ组间各参数无明显差异,具体结果见表1。
(2)各组放疗前后声学密度定量指标比较:与放疗前相比,各组放疗后心肌IBS和IBS%均增高(其中IBS和IBS%在Ⅰ组和Ⅲ组为P<0.05,在Ⅱ组为P<0.01)。CVIB和CVIB%降低(3组均为P<0.01),具体结果见表1以及图1。
(3)放疗后各组声学密度定量指标差值比较:Ⅱ组AD各项参数其治疗前后差值大于Ⅰ组和Ⅲ组,差异具有统计学意义;Ⅲ组各项参数治疗前后的差值大于Ⅰ组,差异亦具有统计学意义,具体结果见表2。
(4)平行对照组在首次检查6月后未出现常规超声心动图检查异常,声学密度定量参数也无明显改变。
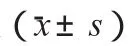
表2 各组放疗前后声学密度定量参数差值比较
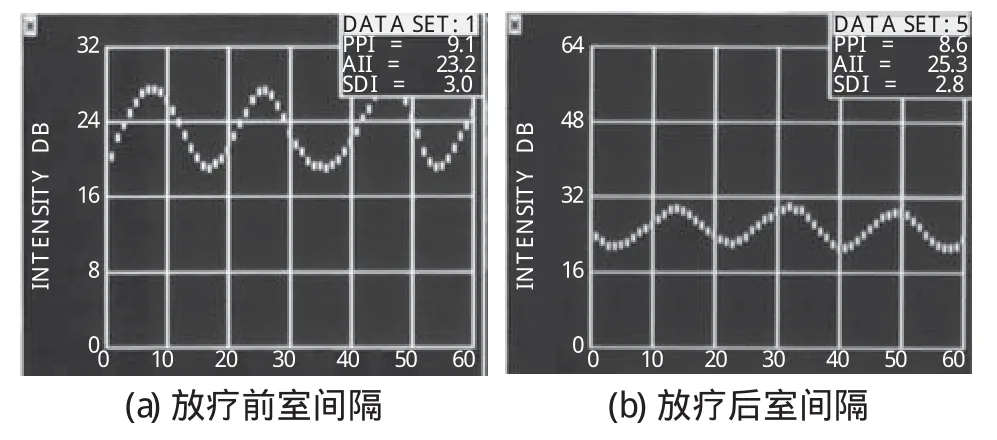
图1 同一患者背向散射积分曲线
3 讨论
胸部放疗可以引起心脏损害已众所周知,在电力辐射作用下,心包、心肌、心瓣膜、传导系统及冠状动脉均可受累。放疗可以导致细胞损伤,进而引起心肌细胞空泡样变,进一步则可发展为不可逆性心肌病变,导致患者出现心肌细胞肌原纤维裂解丢失、胶原含量增加甚至心肌纤维化,组织病理学检查可见心肌胶原含量显著增加[7-8],此即放疗后的迟发性心脏损害。严重者可发展成扩张型心肌病甚至充血性心力衰竭,且一旦发生则呈进行性加重,目前尚无有效的治疗办法。而当患者心功能出现异常或出现临床心力衰竭症状时再采取治疗措施则往往为时已晚,因此早期监测胸部放疗致心脏损害尤为重要[9-11]。
在众多检测胸部放疗致心脏损害的方法中,超声心动图仍是最常用的方法。不过,近年来,反映心肌组织特性的指标——IBS参数已经应用于冠心病、高血压性心脏病、原发性心肌病、心脏移植排斥反应等的研究[12-15]。由于胸部放疗可以导致肌原纤维裂解丢失、胶原含量增加甚至心肌纤维化。而心肌的病理变化可引起心肌声学特性改变,通过测定IBS参数可定量评价心肌内在超微组织病理改变。因此,该技术有望成为评价放疗致心脏损害的有效手段。
笔者应用声学密度定量技术监测了120例接受胸部放疗的肿瘤患者及29例正常对照组的心肌背向散射积分参数。研究结果显示,放疗后患者IBS%明显比放疗前增高,而IBS周期性变化幅度(CVIB和CVIB%)则比放疗前减低。这可能是由于放疗导致心肌细胞受损发生空泡样变、细胞水肿、心肌间质胶原蛋白沉积、血管周围结缔组织增多,造成散射元增多,散射元排列紊乱,感兴趣区散射元密度增加从而引起IBS%增高、CVIB和CVIB%降低。大量理论和动物实验证据显示,胶原纤维是心肌组织超声背向散射的一种主要决定因素,并且胶原含量与IBS强度之间存在线性相关。因此,这一结果提示,放疗患者在心功能正常的情况下心肌已经出现了细微的组织病理学变化,从而说明放疗患者较早出现的IBS参数变化能够敏感地反映其心肌组织声学特性的改变。
许多研究表明,CVIB与心肌局部收缩性相关[12]。他们认为,CVIB不仅能够反映心肌收缩力,而且能够反映心肌收缩功能储备。因此,CVIB可以反映与间质胶原沉积或其他潜在心肌病变相关的心肌的早期改变,也可以间接反映心肌病变的程度,故心肌细胞的动力学特性及功能状态均影响CVIB。鉴于此,笔者认为CVIB亦可在无症状且心功能正常的情况下敏感定量评价放疗患者的心肌收缩功能储备,IBS参数的异常理论上反应了亚临床期或潜在的早期细微的心肌病变。

表1 各组放疗前后声学密度定量参数比较
本研究还发现,放疗联合化疗剂组各项AD参数比单纯放疗组改变更为明显;且放疗联合蒽环类化疗组改变最为显著。放疗前,放疗联合蒽环类化疗组与单纯放疗组之间各项AD参数已有差异,这在笔者过去的研究中已经得到证实,分析可能的原因有:①化疗剂与放疗对正常组织损伤具有协同作用;②蒽环类化疗剂如阿霉素(ADM)、表阿霉素(EPI-ADM)可以引起自由基介导的心肌细胞受损,导致心肌细胞空泡形成、水肿等,从而使得各项AD参数改变更为显著;而蒽环类抗肿瘤药可以引起迟发性心脏毒性也众所周知;③通过药物本身毒性或与放疗结合的相加作用能够抑制亚致死性损伤修复。动物实验亦发现[15],与单纯放疗组相比,放疗联合化疗组心脏胶原纤维含量百分比升高,空泡样变加重,润盘变直,纤维化更加明显,凋亡细胞增多。
此外,笔者还应用常规超声心动图技术监测了120例接受胸部放疗的肿瘤患者,结果显示所有患者均无临床心功能不全的症状,左心室收缩功能指标也都在正常范围内。但是,本研究发现有34例患者放疗后出现一项或多项舒张功能指标异常,表现为二尖瓣舒张早期血流速度峰值(E)减低,心房收缩期峰值(A)升高,E/A比值减小,EDT、IVRT延长等,表明左心室主动松弛功能可能受损,这可能是由于心肌组织及心内膜在放射线作用下出现细胞萎缩、纤维化、脂肪样变甚至不同程度坏死而导致心肌顺应性下降所致。本研究还发现,有2例患者在放疗后出现肺动脉高压,其发生原因可能为:①三尖瓣反流加重右室前负荷;②肺动脉各级分支在放疗作用下发生血管壁增厚、纤维化;③继发血管活性物质如前列环素、血栓素A2、内皮素-1、一氧化氮及血管内皮生长因子等释放异常。此外,还有15例出现常规超声心动图检查结构异常,其中9例出现心包病变表现为心包积液和心包壁增厚,积液量多为少至中量,心包壁增厚以右室前壁最为明显,心包渗出及纤维化的机制考虑为电离辐射直接作用于心包微血管的内皮细胞,导致血管壁损伤,通透性增加,纤维素渗出;同时,心包组织缺血致纤维母细胞增生,胶原纤维形成;还有5例患者出现不同程度、不同部位的瓣膜形态、功能改变,以二尖瓣或(和)主动脉瓣受累为主,与国内外文献报道一致,但未见重度反流者,考虑为复查时间距首次放疗较短有关。值得指出的是,常规超声心动图表现异常的15例患者中,放疗联合蒽环类或其他化疗剂者占13例(87%),远较单纯放疗组显著。这一结果进一步说明了化疗剂尤其是蒽环类化疗剂与放疗联合对正常组织损伤具有协同作用。
综合国外[7-9]和本研究结果,笔者认为,常规超声心动图在监测放疗致早期心脏功能损害方面的敏感度并不高,只有当患者心肌严重受损或心脏整体功能受损时,才会出现左室收缩功能指标——左心射血分数的异常改变,而胸部放疗后心脏舒张功能比收缩功能更易受到影响。相对于心脏功能改变,常规超声心动图对心内膜及心包病变更为敏感。
综上所述,IBS参数是量化检测心肌组织学变化的敏感指标,可以通过研究心肌组织声学的改变来揭示心肌早期细微的组织病理学的变化,进而识别心肌易受损的高危人群,对该人群进行心功能监测可能有助于我们判别哪些患者在放化疗后更易发生迟发性心脏毒性。与其他检测心脏毒性的方法相比,IBS参数测定技术无创、便于操作、价格较低、可重复检查,而且对于心肌细微病变更为敏感,结合常规超声心动图可以达到优势互补,在早期检测胸部放疗及联合化疗对心脏毒性的损害方面极有发展潜力,值得临床进一步研究应用。
[1]Strender L.Incidence of heart disease and functional significance of change in the electrocardiogram 10 year after radiotherapy for breast cancer[J].Cancer,1986,57(5):929.
[2]M itrael A.Cardiovascular sepuelae of therapeutic thoracic radiation[J].Prog Cardiovasc Dis,1991,33(5):299.
[3]陶功福,张枫.导管室放射防护评价[J].中国医疗设备,2014,29 (10):115-116.
[4]Tam irisa PK,Holland MR,M iller JG,et al.U ltrsonic tissue characterization:Review of an approach to assess hypertrophic myocardium[J].Echocardiography,2001,18:593-597.
[5]Schecter SO,Teichholz LF,K lig V,et al.U ltrsonic tissue characterization:Review of noninvasive technique for assessing myocardial viability[J].Echocardiography,1996,13(4):415-430.
[6]Zuber M,Gerber K,Erne P,et al.M yocardial tissue characterization in heart failure by real-time integrated backscatter[J].Eur J Ultra, 1999,9(2):135-143.
[7]Wagdi P,Rouvinez G,Fluri M,et al.Cardioprotection in chemo and radiotherapy for malignant diseases:An echocardiographic pilot study[J].Schweiz Rundsch Med prax,1995,84(43):1220-1223.
[8]Andresen H,Kaag N,M einhardt A,et al.Radiation-induced cardiac disease[J].Z Kardiol,2003,92(11):957-961.
[9]M imbs JW,O’Donnell M,M iller JG,et a l.Detection o f cardiom yopathic changes induced by doxo rubin base on quantitative analysis of ultrasonic backscatter[J].Am J Cardiol, 1981,47:1056-1060.
[10]Muro T,O ta T,W atanabe H,et al.Prediction of contractile reserve by cyclic variation o f in tegrated backscatter o f the m yocardium in patients w ith chronic left ventricular dysfunction[J].Heart,2001,85:165-170.
[11]W akasugi S.D rug-induced m yocardial disease-adriam ycin cardiotoxicity[J].Nippon Rinsho,2000,58:204-211.
[12]Tokume T,M izushige K,Noma T,et al.Prevention of doxotubicin induced cardiomyopathy by simultaneous adm inistration of angiotension convertin t enzym e inhibitor assessedby acoustic densitometry[J].J Cardiovasc Pharmaco l,2000, 36:361-368.
[13]Robert JS.Radiation injury to the heart[J].In J Radiat Oncology Biolphys,1995,37:2813.
[14]Schultz SH.Fractionation response and repair of radiationinduced heart failure in the rat[J].Radiotherapy and oncology, 1992,23:33.
[15]崔亚利,胡玉林,高永军.5-Fu和DDP联合放疗对心脏损伤的观察[J].实用肿瘤学杂志,2000,14(1):23-25.
Assessment of Heart Damage Induced by Chest Radiotherapy w ith Acoustic Densitometry
HOU Hai-yan
Shandong Provincial Maternal and Child Health Care Hospital, Jinan Shandong 250014, China
Objective To explore the clinical application of acoustic densitometry (AD)in assessing heart damage induced by chest radiotherapy in patients w ith thoracic tumors. Methods A ltogether 120 patients received chest radiotherapy were exam ined by echocardiography and acoustic densitometry before radiotherapy and six months later. Additionally, 29 healthy volunteers were enrolled as control group. Results Some abnormal echocardiography characters appeared in 15 patients after chest radiotherapy (12.5%). AD showed that integrated back-scatter (IBS)and IBS% was signi fi cantly higher;while cyclic variation of IBS (CVIB)and CVIB% were signi fi cantly lower than those obtained before irradiation. Among patients received combination of radiotherapy and anthracyclines treatment, the changes of parameters acquired from AD differed signi fi cantly from those patients treated by simplex irradiation or combination of radiotherapy and other chemotherapeutic drugs. A t the same time, those data in patients received combination of radiotherapy and other chemotherapeutic drugs differed signi fi cantly from those patients treated by simplex irradiation. As to the control group, all of the parameters changed insigni fi cantly six month later. Conclusion Echocardiography and AD can be used in assessing early heart damages induced by chest radiotherapy. Compared w ith echocardiography, AD was more sensitive in detecting m icrocosm ic changes and abnormalities of heart functions. Combination of radiotherapy and anthracyclines or other chemotherapeutic drugs can aggravate the heart damage.
acoustic densitometry;echocardiography;radiotherapy;heart damage
R445.1
B
10.3969/j.issn.1674-1633.2015.09.033
1674-1633(2015)09-0108-04
2015-03-25
作者邮箱:hou_hyan@126.com

