羊毛羊绒红外光谱特征及鉴别方法探讨
庄琳 徐燕红 宋小娇

摘 要:采用傅立叶变换红外光谱(FTIR)法测定了羊毛与羊绒红外光谱,结果表明,通过各自的特征峰的比较可以区别两者,通过傅立叶自去卷积技术对羊毛与羊绒红外光谱进行解析,也可以有效鉴别两者。红外光谱在羊毛与羊绒司法鉴定领域有较好的应用前景,此技术有望成为司法鉴定体系中的有效方法之一。
关键词:傅立叶变换红外光谱(FTIR);羊毛;羊绒
中图分类号 TS101.8文献标识码 A 文章编号 1007-7731(2015)13-111-04
The Identification Method of Wool and Cashmere Infrared Absorption Spectrum
Zhuang Lin et al.
(Nanjing Forest Police College,Nanjing 210046,China)
Abstract:Using Fourier transform infrared spectroscopy(FTIR)method to determine the fields of wool and cashmere infrared absorption spectrum. The results show that they can be distinguished between wool and cashmere through their respective characteristic peak. They also can be identified through the Fourier self deconvolution technique. There is a good application prospect in the field of wool and cashmere identification by using the infrared spectra. This technology is expected to become one of the effective ways of judicial authentication system.
Key words:FTIR;Wool;Cashmere
纯净的羊毛和羊绒纤维主要由蛋白质组成,其中角朊约占82%,非角朊约占17%,另外0.8%~1%为非蛋白质组分,主要由类脂物及少量多糖类物质构成[1]。羊毛与羊绒的鉴别有多种方法,例如可以利用显微镜技术观察羊毛与羊绒的细度及鳞片结构特征[2],采用计算机图像分析技术[3]、采用激光显微拉曼光谱技术热力学鉴别[4-5]。本研究应用傅立叶变换红外光谱仪的衰减全反射法检验羊毛与羊绒的红外光谱,探讨了羊毛和羊绒红外吸收峰的归属问题,对两者之间的鉴别进行了初步尝试,以期对羊毛与羊绒微量或无损鉴别探索一条简捷有效的方法。该分析方法的特点是需要样本量极少,检验速度快,适用于微量物证的定性分析。
1 材料与方法
1.1 材料 本研究选择的羊毛为澳州羊毛,羊绒为内蒙古羊绒。
1.2 方法 测试仪器:Nicolet iN10 MX型FT-IR傅立叶红外光谱仪,ATR附件,金刚石晶体,检测器:DTGS。参数设置:测试波数范围400~4 000cm-1,仪器分辨率4cm-1,扫描采样32次。分析软件为omnic8.2。将羊毛羊绒标本进行采样,抽取样本纤维丝2~3根,3~5mm长。调试仪器后将待测纤维置于金刚石晶体上,用FTIR-OMNI采样器固定钮压紧样品,纤维丝与金刚石晶体之间形成紧密接触,进行扫描,计算机采集样本的衰减全反射红外光谱图谱文本文件和图形文件。每个标本取样6次,重复实验6次,红外光谱图取其平均图谱。
2 结果与分析
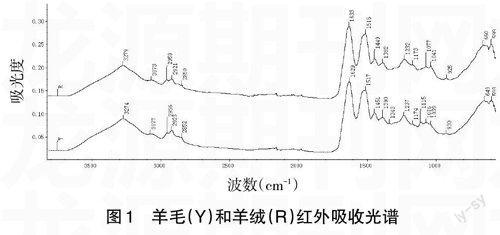
2.1 羊毛和羊绒红外光谱分析 图1为羊毛和羊绒的红外吸收光谱,图谱明显区分出3个谱带区域,3 800~2 800cm-1;2 800~1 700cm-1;1 700~600cm-1。2 800~1 700cm-1区域几乎为一平滑曲线,有一些弱小凸峰为金刚石晶体形成,所以不予讨论。
图1 羊毛(Y)和羊绒(R)红外吸收光谱
从图1可以发现,羊毛与羊绒的红外光谱极为相像,吸收峰的峰位与峰强几乎一致,但由于羊毛和羊绒在成分组成和结构上存在一定的差别,反映在光谱的吸收峰上也有所不同。
蛋白质纤维的主要特点是都含有酰胺键(-CO-NH),红外光谱在3 280cm-1附近为酰胺A带,即-NH伸缩振动与酰胺Ⅱ第一倍频伸缩振动的偶合,与分子链间氢键断裂产生的作用力变化有关联;在本实验中,羊毛吸收峰位3 274cm-1;羊绒吸收峰位3 279cm-1。
3 000~2 800cm-1为C-H振动区,这一吸收带分裂为3个弱吸收峰,显现了氨基酸主链侧基-CH3和-CH2键的吸收情况,其中2 960cm-1附近为-CH3的反对称伸缩振动;2 920cm-1附近为-CH2不对称伸缩振动;2 850cm-1附近为-CH3的对称伸缩振动。羊毛吸收峰分别是2 956cm-1、
2 923cm-1、2 852cm-1;羊绒吸收峰分别是2 959cm-1、
2 921cm-1、2 850cm-1。蛋白质中的二硫键(-CH2-S-S-CH2-)发生了断裂,C-H中C的电子云密度降低,致使C-H的伸缩振动谱带发生漂移,吸收峰位置也因此略有差异。
1 630~1 660cm-1为酰胺Ⅰ带,即C=O伸缩振动。对于酰胺I带,红外谱图中各峰位的归属已经研究的比较清晰,1 630cm-1,1 650cm-1,1 660cm-1附近的特征峰分别对应于β-折叠,无规线团和a-螺旋结构。在本实验中,羊毛吸收峰为1 629cm-1,羊绒吸收峰为1 633cm-1。可以推断本次羊毛、羊绒样品中,二级结构含有一定量的β-折叠。
1 510cm-1附近为酰胺Ⅱ,表征N-H变形振动与C-N伸缩振动的偶合,羊毛吸收峰为1 517cm-1,羊绒吸收峰为1 515cm-1。
1 320~1 220cm-1属于酰胺Ⅲ带,表征N-H弯曲振动与C-N伸缩振动的偶合。其中,1 240~1 230cm-1间的谱带属于β-折叠链结构,1 270~1 240cm-1谱带属于无规结构[6]。本实验羊毛吸收峰为1 237cm-1,羊绒吸收峰为1 232cm-1。印证了上述本次样品羊毛和羊绒二级结构含有一定量的β-折叠,同时表明羊绒β-折叠结构的含量比羊毛的更高。
角朊纤维中的硫主要以胱氨酸二硫键的形式存在,1 200~1 000cm-1表征的是胱氨酸氧化物的红外特征吸收谱带,归属于S-O伸缩振动谱带,它的出现表明胱氨酸二硫键已发生断裂,出现新的产物[7]。
在蛋白质的主要化学键中,S-S键的键能最
小(263.71kJ/mol),C-S(301.38kJ/mol)、S-O(309.75~458.77kJ/mol)、S-H(343.24kJ/mol)键的键能也较小,因此易于变化[8]。二硫键断裂后,巯基被氧化,即-S-S-被破坏生成-SH后又被氧化生成-SO3-中的S-O伸缩振动峰[9]。其中半胱氨酸磺酸盐谱带峰位为1 023cm-1和1 190cm-1,振动类型分别是S-O(ss)和S-O(as);磺基丙氨酸谱带峰位是1 040cm-1和1 170cm-1,振动类型分别是S-O(ss)和S-O(as);胱氨酸一氧化物谱带峰位是1 060cm-1和1 075cm-1,振动类型分别是S-O(ss)(+)和S-O(as)(-)。胱氨酸二氧化物谱带峰位是1 124cm-1,振动类型是S-O(ss)[10]。在本次实验谱带中,羊毛有4个吸收峰,分别是1 174cm-1、1 115cm-1、1 076cm-1和1 039cm-1;羊绒有3个吸收峰,分别是1 173cm-1、1 077cm-1和1 041cm-1[10]。在这一区域,羊毛的振动强度明显高过羊绒,尤其是在1 115cm-1附近羊毛有一中等强度的吸收峰,而羊绒没有。这是因为羊绒的胱氨酸二硫键含量低于羊毛,羊绒平均二硫键含量为313μmol/g,羊毛平均二硫键含量为449μmol/g,羊绒为羊毛的68%[11]。
羊绒在1 041cm-1附近的吸收峰峰强明显高于羊毛,羊绒呈上翘,并且高过1 077cm-1附近的峰强;而羊毛在1 039cm-1附近的吸收峰呈下斜,并且明显低于1 076cm-1附近的吸收峰而成为右肩形态。这表明说明羊绒比羊毛的无规则结构要多。
767~625cm-1表征的是蛋白质酰胺ⅣO-C-N弯曲振动,混有其它振动方式;800~640cm-1表征的是蛋白质酰胺ⅤN-H面外弯曲,606~537cm-1表征的是酰胺ⅥC=O面外弯曲振动。690cm-1附近表征的是C-S的振动。因此这一谱带比较复杂,吸收峰实际上是相互叠加的结果。本实验中,羊毛双峰分别是649cm-1和599cm-1,羊绒分别是660和599cm-1。
2.2 羊毛和羊绒红外光谱自去卷积分析分析 红外光谱图是由多种官能团的振动所形成相互交叉或叠加的吸收峰,一些弱吸收峰或被强吸收峰掩盖。通过傅立叶自去卷积(FSD)技术对红外谱图进行解构,可以将原谱峰分成若干个子峰,避免了峰与峰之间的相互影响,增加了对比分析的准确性和有效性[12]。
图2 羊毛(Y)和羊绒(R)傅立叶自去卷积图谱
图2为羊毛和羊绒傅立叶自去卷积图谱(截取指纹图谱区1 500~900cm-1)。从解构的谱图可以直观地发现,两者之间既有相似的部分,各自也有不同之处。羊毛的特征峰位在1 343cm-1附近有一强峰,而羊绒表现为1 351cm-1和1 337cm-12个小的弱峰;羊毛在1 116cm-1附近有一强峰,羊绒没有吸收峰;羊绒特征峰在1 261cm-1附近,羊绒有一强吸收峰,羊毛仅仅表现为一弱峰。
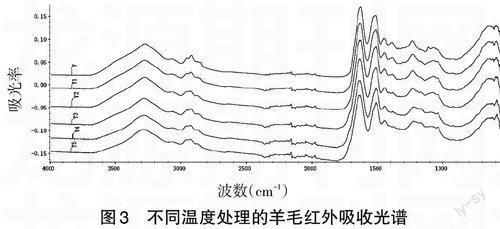
2.3 不同温度处理后羊毛和羊绒红外光谱分析 随着温度的升高,羊毛和羊绒的峰位都出现了漂移,见图2与图3。比较Y和Y6,3 274cm-1漂移到3 283cm-1;3 077cm-1漂移到3 069cm-1。
关于羊毛受热处理后性能的变化,Lu L.等人研究了羊毛纱线经120、140、160、180℃干热空气处理(2~500h)后物理及化学性能的变化[13]。
Mullejans1报道了羊毛纤维经100℃干热空气处理lh后的荧光光谱有变化,这说明在100℃空气中长时间干燥处理,角朊纤维有可能与空气中的氧发生化学反应,纤维结构因而有所变化[14]。
羊毛在1 115cm-1和1 076cm-1附近的峰强逐渐减弱,同时从1 139cm-1附近峰强逐渐增强,并漂移至1 142cm-1;羊绒在1 077cm-1附近的峰强逐渐减弱,同时1 141cm-1附近的峰强逐渐增强,说明酰胺Ⅲ带无规则结构在增加。在不同温度下比较红外光谱峰谷比的数值,可以发现羊毛和羊绒的1 390cm-1峰/1 415cm-1谷的数值是在逐渐减小,如图4所示,峰谷比数值越大,就表明落差较大,峰谷比数值接近1,表明落差不大,曲线变得较平缓。羊毛羊绒在160~180℃下1h,红外光谱变化不大,210℃下1h红外光谱变化加快,两者在210℃下4h的红外光谱基本趋于一致。
图3 不同温度处理的羊毛红外吸收光谱
注:Y为没有进行高温处理的羊毛样本,Y1为160℃下处理1h,Y2为180℃下处理1h,Y3为210℃下处理1h,Y4为210℃下处理2h,Y5为210℃下处理4h。
图4 不同温度处理羊绒红外吸收光谱
注:R为没有进行高温处理的羊绒样本,R1为160℃下处理1h,R2为180℃下处理1h,R3为210℃下处理1h,R4为210℃下处理2h,R5为210℃下处理4h。
图5不同温度处理羊毛、羊绒红外吸收光谱峰谷比
注:1代表没有高温处理,2~6分别代表160℃下处理1h,180℃下处理1h,210℃下处理1h,210℃下处理2h,210℃下处理4h。
3 结论与讨论
羊毛与羊绒的红外光谱极为相像,吸收峰的峰位与峰强几乎一致,但由于羊毛和羊绒在成分组成和结构上存在一定的差别,反映在光谱的吸收峰上也有所不同。
(1)1 200~1 000cm-1表征的是胱氨酸氧化物的红外特征吸收谱带,羊毛有4个吸收峰,分别是1 174cm-1、
1 115cm-1、1 076cm-1和1 039cm-1;羊绒有3个吸收峰,分别是1 173cm-1、1 077cm-1和1 041cm-1。在这一区域,羊毛的振动强度明显高过羊绒,1 115cm-1附近是羊毛的特征峰,羊绒没有此吸收峰。羊绒在1 041cm-1附近的吸收峰峰强明显高于羊毛,羊绒呈上翘,并且高过1 077cm-1附近的峰强;而羊毛在1 039cm-1附近的吸收峰呈下斜,并且明显低于1 076cm-1附近的吸收峰而成为右肩形态。
(2)傅立叶自去卷积图谱可以直观地发现,羊毛的特征峰位在1 343cm-1附近有一强峰,而羊绒表现为
1 351cm-1和1 337cm-12个小的弱峰;羊毛在1 116cm-1附近有一强峰,羊绒没有吸收峰;羊绒特征峰在1 261cm-1附近,羊绒有一强吸收峰,羊毛仅仅表现为一弱峰。
(3)羊毛羊绒在160~180℃下1h,红外光谱变化不大,210℃下1h红外光谱变化加快,两者在210℃下4h的红外光谱基本趋于一致。
本研究结果表明,利用红外谱图技术可以探讨羊毛与羊绒化学结构的不同,此技术也有望成为羊毛与羊绒司法鉴定体系中的有效方法之一。对羊毛与羊绒的红外光谱司法鉴定技术研究还处于探索阶段,需要进一步研究不同地区羊毛与羊绒红外光谱的稳定性和差异性,以及建立各类羊毛与羊绒标准的图谱库,才能应用于实际的司法鉴定。
参考文献
[1]张尚德,张汉武.羊毛学[M].西安:陕西科学技术出版社,1982:11.
[2]王柏华,胡志宇,葛顺顺,等.基于光镜条件下绵羊毛与山羊绒的鉴别[J].毛纺科技,2011(4):42-45.
[3]陶晨.利用图像处理和分析技术测定羊毛/羊绒混纺比[J].毛纺科技,2009(2):47-50.
[4]侯秀良,王善元,采用激光显微拉曼光谱仪研究山羊绒、羊毛纤维的结构[J].毛纺科技,2004,1:38-41.
[5]侯秀良,刘启国,王善元.采用WAXD、DSC技术研究山羊绒、羊毛纤维的结晶结构[J].东华大学学报,2004(3):86-89.
[6]K.Kaiden,T.Matsui,S.Tanaka.A study of the Amide Ⅲ band by FT-IR spectrometry of the structure of Albumin,Myoglobin,and Grobulin[J].Applied Spectroscopy,1982,41(2):180.
[7]Jones D.C.,Carr C. M.,et al.Investigating the Photo-oxidation of wool using FT-Raman and FT-IR spectroscopies[J].T.R.J.,1998,68(10):739-748.
[8]宋时风,陈小立,朱泉,等.羊毛角蛋白粗溶液的制备及其反应动力学研究[J].印染,2003(7):8-10.
(下转117页)
(上接113页)
[9]阿部康次,村手宏隆.硬角蛋白纤维素复合再生物的制备[P].日本专利:2002-167401,2002-06-11.
[10]胡朝明.傅里叶变换红外光谱检测过一硫酸处理羊毛表面的研究[J].现代纺织技术,2001,9(1):1-3.
[11]Kozo Arai,et al.Cross-linking structure of keratin[J].Joumal of applied Polymer science,1993,47:1973-1981.
[12]庄琳,黄群,徐燕红.楠属和润楠属4种木材红外光谱的鉴别方法探讨[J].福建林业科技,2014(4):21-25.
[13]Lu L,Weatherrall I.L.The 9th International wool Textile Reseach Conference,vol I:265-271.
[14]Mullejans I.,Goddinge D.,et al.The 9th International wool Textile Reseach Conference,volⅠ:232-240.
(责编:张宏民)

